基于CAIX分级的癌症治疗的制作方法
本发明涉及一种用于治疗癌症的靶向碳酸酐酶ix的化合物,其中所述用途包括定量caix表达以及基于所述caix表达来确定caix评分。本发明还涉及一种用于诊断、预测和/或分类癌症疾病的方法,所述方法包括定量caix表达和确定caix评分。
背景技术:
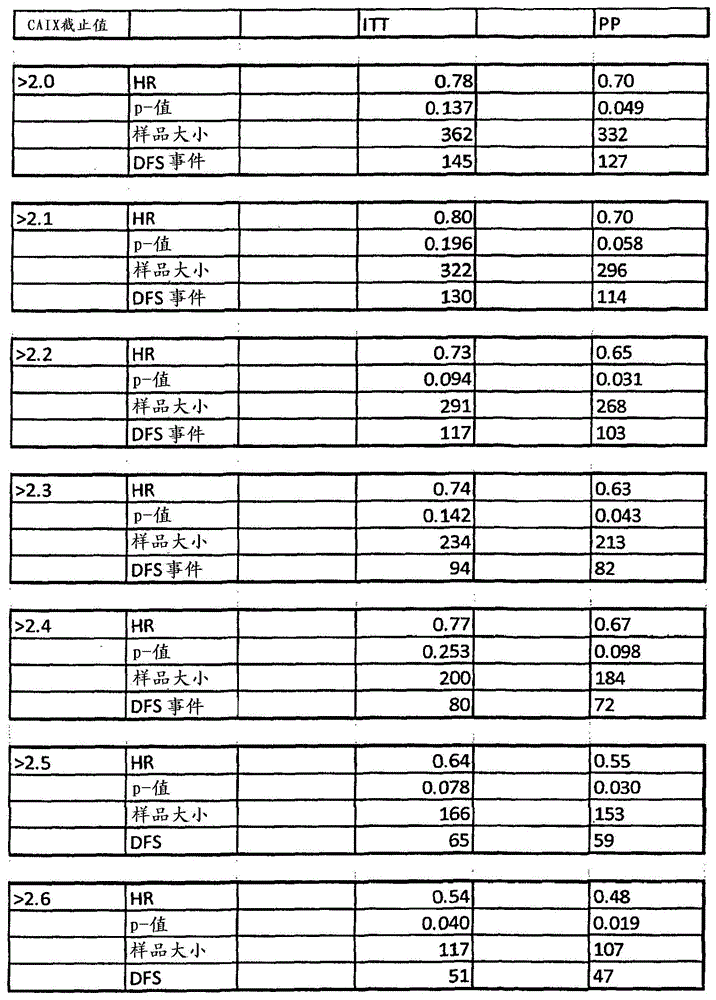
:跨膜蛋白碳酸酐酶ix(caix)是碳酸酐酶大家族的一个成员,所述大家族共有催化二氧化碳向碳酸的可逆水合的能力,从而导致ph的下降(opavskyr,等人,genomics1996,33:480487)。响应于低氧,通过低氧诱导因子-1α(hif-1α)的直接转录活化,发生caix基因表达的上调,并且据信其涉入感知和维持含氧量低的细胞的酸性环境,特别是在肿瘤的含氧量低的区域内(wykoff等人,cancerres2000,60:7075-708;svastova等人,febsletters2004577:439-445)。g250抗原与众多癌诸如肾细胞癌密切相关。g250抗原最初被描述为肾癌相关的抗原(wo88/08854)。以后,发现它与肿瘤相关的抗原mn(一种具有碳酸酐酶活性的细胞表面抗原,也被称作caix)相同。在胃粘膜层、肠粘膜层和胆道粘膜层中发现了正常的caix表达,在所述位置,它的生理学作用在于ph调节。除了它的正常表达谱以外,在多种肿瘤中发现了caix表达,所述肿瘤包括宫颈癌、食管癌、结肠直肠癌、肺癌、胰腺癌、胆道癌和肾细胞透明细胞癌(rcc)。因此,针对caix的抗体可以用于癌症治疗。抗-g250抗体描述在例如ep637336、wo93/18152、wo95/34650、wo00/24913、wo02/063010、wo04/025302、wo05/037083、wo2011/139375和它们的外国相应文件中。此外,wo02/062972描述了产生单克隆抗体g250的杂交瘤细胞系dsmacc2526。所述单克隆抗体g250识别这样的抗原:其优选地在肾细胞癌细胞(rcc)的膜上表达,但是不在正常的近端管上皮中表达。所述g250抗体结合抗原g250,其也称为mn抗原(参见,例如,wo93/18152)或caix(碳酸酐酶ix)。用于确定caix表达的方法是本领域技术人员已知的,且包括、但不限于组织切片的免疫组织化学染色,其例如描述在bui等人,clinicalcancerresearch2003,9:802-811,atkins等人,clin.cancerres2005,11:3714-3721,us5,989,838、us6,004,535、us6,093,548、us7,524,634、us7,851,455中。这样的方法可以用在人肾透明细胞癌预测中。技术实现要素:本发明的目的是提供这样的方法:其使得进一步表征caix-相关的癌症疾病(cancerdisease)和预测使用靶向caix的化合物的治疗如何有效和成功成为可能。根据本发明,通过定义新颖的caix评分和它在癌症的治疗、诊断、预测和分级(classification)中的应用实现了该目的。因而,本发明的第一方面涉及一种用于治疗癌症的靶向碳酸酐酶ix(caix)的化合物,其中所述用途包括:定量从要治疗的受试者提供的至少一个肿瘤样品中的caix表达,基于所述肿瘤样品中的caix表达来确定caix评分,和如果达到预定的(predefined)caix评分,则治疗所述受试者。因而,要治疗的癌症的特征在于预定的caix评分。以本发明的方式,基于通过肿瘤细胞范围和染色强度的组合描述的caix表达,分别优选地确定或计算caix评分。换而言之,在本文使用的caix评分中考虑表达caix抗原的肿瘤细胞的量/百分比以及染色的肿瘤细胞的染色强度二者。可以将caix表达视作抗原密度的量度,优选地为遭受要治疗的癌症的患者的肿瘤组织内的caix多肽密度的量度,优选地其中所述癌症是rcc或ccrcc。caix评分是描述样品中的标志物(诸如caix)的免疫反应性的量的值。所述评分考虑了染色强度和在特定强度范围染色的细胞的百分比。通过累加样品(诸如ccrcc癌症的组织切片)中在给定的染色强度染色的细胞的百分比(0-100)与染色强度(0-3)的乘积,确定所述评分。优选地,可以为特定隔室例如细胞质、膜、细胞核提供所述评分。还可以利用染色强度的0-4的数值量表来确定评分。在使用0-3的染色强度的评分的情况下,所述评分是在0-400的范围内,而不是0-300(mcclelland等人,cancerres.50:3545-3550,1990)。具体地,通过下式确定和/或计算caix评分:caix评分=(0×不具有染色强度的存活肿瘤细胞的百分比)+(1×具有微弱的可觉察的染色强度的存活肿瘤细胞的百分比)+(2×具有中等染色强度的存活肿瘤细胞的百分比)+(3×具有强染色强度的存活肿瘤细胞的百分比)。例如,具有1的10%染色强度、2的20%染色强度和3的20%染色强度和20%的未染色细胞的样品具有(1×10)+(2×20)+(3×20)+(0×50)=110的评分,或者如果计算的话,(1×10/100)+(2×20/100)+(3×20/100)+(0×50/100)=1.1。caix评分可以取0(没有染色)和300(具有3+的强度评分的100%存活肿瘤细胞)之间的任意值,或0和3,优选地在0.0和3.0之间。在本发明的上下文中,通过存活肿瘤细胞的百分率和它们的染色强度的指示,在根据本发明的caix评分公式中考虑“肿瘤细胞范围”或表达caix抗原的肿瘤细胞的量。通过本领域技术人员已知的方法,可以计数或确定存活肿瘤细胞。例如,通过视觉计数或计算机辅助的程序诸如自动成像系统,可以确定细胞的数目和/或各个百分率。将作为caix评分的一部分的肿瘤细胞范围分级进四级(four-tired)换算系数(0、1+、2+和3+)。换算系数0衍生自与对照样品可比较的caix染色,且代表caix表达的缺乏。换算系数1+至3+衍生自表达caix的肿瘤细胞的平均样品,其显示了从几乎不能觉察至强烈的肿瘤细胞染色。经常,具有本领域一般技术的组织学家或病理学家通过用眼进行常规分析可以做出分级(cregger等人,arch.pathol.lab.med.,2006,130:1026-1030)。染色强度的绝对值可以取决于例如施加的染色试剂、要染色的肿瘤组织等。但是,除了别的以外,通过使用以上包含等级+1至+3的评级系统,可以克服该问题。肿瘤细胞中的染色强度几乎成比例地从几乎不能觉察的染色增加至强烈染色。根据染色强度的这种线性增加,将表达caix的肿瘤细胞分成3个具有从1+至3+的标度(scaling)的组,染色强度的各个增加对于每个组而言是相同的。换而言之,将存活的肿瘤细胞分成具有微弱的或几乎不能觉察的染色强度(标度1+)、中等染色强度(2+)和强染色强度(3+)的细胞。一旦已经为特定染色剂和定义参考系的肿瘤细胞的平均样品中的特定肿瘤细胞建立评分系统,它就可以用于肿瘤细胞的其它样品,即当然不必为每个肿瘤细胞样品建立各个caix评分系统。根据本发明的“染色强度”是指在四级换算系数中的每一个内的肿瘤细胞的百分比。所述百分比可以是0%和100%之间的任何值。对于每个组织样品,将染色的强度确定为,显示微弱的或几乎不能觉察的膜染色的肿瘤细胞的百分比为标度+1,显示中等膜染色的肿瘤细胞的百分比为标度+2,显示强烈(moderate)膜染色的肿瘤细胞的百分比为标度+3(表1)。表1:染色强度标度显示微弱的/几乎不能觉察的膜染色的肿瘤细胞的百分比1+显示中等膜染色的肿瘤细胞的百分比2+显示强烈膜染色的肿瘤细胞的百分比3+通过将样品的染色强度与作为caix评分基础的参考肿瘤样品进行对比,可以容易地做出在各个标度组中对表达caix的肿瘤细胞的分级。因而,肿瘤细胞样品可能不包括所有3个标度组。本领域一般技术人员知道用于确定染色强度的方法,无论是用于定义评分系统,还是用于对比不同细胞样品或将细胞分级进评分系统中用于对比染色强度目的(参见cregger等人,1026,arch.pathol.lab.med.,第130卷,2006年7月)。染色强度的确定或分级进评分系统中可以手工地或通过计算机辅助的程序或任意其它合适的方法进行。在一个优选的实施方案中,与提供定量和客观输出的装置组合地使用标准化的对照肿瘤测定,应用所述评分系统。下面将显示一个实施例,其用于计算具有40%中等和60%强染色强度的100%caix抗原范围表达的caix评分。在表2中显示了不同caix表达范围、不同染色强度含量和各个评分的其它实施例。caix评分的计算:具有40%中等和60%强染色强度的100%caix抗原范围表达(1*(0/100))+(2*(40/100))+(3*(60/100))0+0.8+1.8=2.6表2根据本发明,caix评分是基于必须确定的caix表达。在本文中,术语caix表达和caix蛋白表达可以互换使用。优选地,术语caix表达与表达的caix蛋白的量有关。因而,本发明的另一个方面涉及一种用于治疗癌症的靶向caix的化合物,其中所述用途包括:定量从要治疗的受试者提供的至少一个肿瘤样品中的caix蛋白,基于所述肿瘤样品中的caix蛋白来确定caix评分,和如果达到预定的caix评分,则治疗所述受试者。本发明的另一个方面涉及一种用于治疗癌症的靶向碳酸酐酶ix(caix)的化合物,所述治疗包括:如果已经发现患者的癌症具有等于或大于2.0、2.1、2.2、2.3、2.4、2.5或2.6的caix评分,则给所述患者施用治疗有效量的caix拮抗剂。在一个优选的实施方案中,所述caix评分等于或大于200、210、220、230、240、250或260,最优选地所述caix评分等于或大于260。本发明的另一个实施方案涉及一种用于治疗癌症的靶向碳酸酐酶ix(caix)的化合物,其中要治疗的受试者的至少一个肿瘤组织样品的特征在于以下caix评分:至少2.0、2.1、2.2、2.3、2.4、2.5或2.6,更优选地至少200、210、220、230、240、250或260,最优选地至少260。由此定量存在于一个或多个从要治疗的受试者衍生出的样品中的表达的caix(如果有的话)。优选地,从要治疗的受试者衍生出的样品是要治疗的癌症的组织样品。更优选地,要治疗的癌症的组织样品是从肾细胞癌(rcc)、最优选地从肾透明细胞癌(ccrcc)衍生出的组织样品。优选地,通过下述定量表达的caix:肿瘤细胞染色、优选免疫组织化学染色、更优选免疫组织化学染色,其中caix蛋白或caix多肽被单克隆抗体特异性地结合,更优选地被在caix的n-端具有表位结合结构域的单克隆抗体特异性地结合,甚至更优选地被单克隆抗体m75特异性地结合,最优选地被从具有登记号atcchb11128的杂交瘤vu-m75分泌的单克隆抗体特异性地结合。本领域技术人员知道免疫组织化学染色方法的合适方法。用于免疫组织化学染色的试剂盒是商购可得的,且包括但不限于由oncogenescience100acornparkdrive,cambridge,ma02140,usa提供的caixihc试剂盒。用于免疫组织化学染色方法的另一个实施例描述在例如ep1501939b1中。如dako染色系统(dakocorporation,carpenteria,ca)所述,使用过氧化物酶技术,使用热处理进行抗原提取,用抗-caix抗体可以进行组织切片的免疫组织化学染色。在免疫测定和/或免疫组织化学染色中使用的抗体可以是多克隆抗体或单克隆抗体。优选地,使用单克隆抗体。在根据本发明的免疫组织化学染色的方法中,可以使用标记的或未标记的抗体。标记的检测装置包括标记,其可能包含荧光装置、酶、辅酶、放射性核苷酸、化学发光装置、酶底物、颗粒、染料等。各种测定包括酶免疫测定、荧光免疫测定、放射免疫测定、elisas、等。在免疫组织化学染色组织中使用的检测抗体包括单克隆抗体m75、mn9、mn、12、mn7。根据本发明优选地使用的检测抗体是m75。m75抗体进一步描述在us5,981,711中,且是由oncogenescience(参见上文出处)提供的caixihc试剂盒的一部分。特别优选的是这样的染色方法,其提供可测量的和/或可比较的结果诸如染料强度、荧光强度、无线电信号、酶活性等。根据一个优选的实施方案,表达的caix包含caix多肽或caix多肽的片段。根据另一个优选的实施方案,表达的caix包含编码caix多肽或caix多肽片段的mrna。本领域技术人员知道确定细胞样品中的mrna的量的方法,诸如rna印迹、微测定、实时pcr等。根据一个优选的实施方案,如果从受试者(优选地从小于65岁的受试者)提供的肿瘤样品中的caix评分≥2.0,则治疗所述受试者。在一个进一步更优选的实施方案中,所述评分≥2.1,更优选地≥2.2,更优选地≥2.3,甚至更优选地≥2.4,甚至更优选地≥2.5。从0.0至3.0的所有可能的caix评分的分析揭示,caix评分增加越多,治疗效果越显著。当用靶向caix的化合物(特别是抗-g250抗体)治疗时,具有≥2.6的caix评分的患者显示出统计学上显著的治疗效果。因而,≥2.6的caix评分被视作最优选的实施方案。优选地,从受试者提供的肿瘤样品是要治疗的受试者的癌症的至少一个组织样品。更优选地,从受试者提供的肿瘤样品是从要治疗的受试者的肾细胞癌(rcc)、最优选地从肾透明细胞癌(ccrcc)衍生出的至少一个组织样品。根据一个进一步优选的实施方案,caix评分或预定的caix评分等于或大于2.0、2.1、2.2、2.3、2.4、2.5或2.6。在某些实施方案中,所述caix评分等于或大于200、210、220、230、240、250或260。在一个优选的实施方案中,所述caix评分等于或大于260。靶向caix的分子可以是任何化合物,其如下特异性地识别介导它的活性的caix:结合caix或其片段或剪接变体;不可逆地结合在活性位点的入口处,和/或通过在caix的活性位点处与锌离子配位而抑制caix。优选地,靶向caix的化合物与caix多肽特异性地相互作用。与……特异性地相互作用(例如识别或结合)是指,靶向caix的化合物(例如抗体)对caix的亲和力大于其它多肽。在一个实施方案中,所述靶向caix的化合物与caix多肽相互作用(即结合或识别caix多肽)或调节caix多肽的活性和/或介导抗体依赖性的细胞的细胞毒性(adcc)和/或补体介导的细胞毒性(cdc)。因而,根据一个实施方案,所述靶向化合物是caix抑制剂。所述caix抑制剂可以在蛋白水平或核酸水平起作用。caix抑制剂(例如在蛋白水平起作用)的例子包括、但不限于肽和抗-caix抗体以及那些抗体的功能片段或小有机分子,其优选地具有低于500g/mol的分子量。抗-caix抗体或针对caix的抗体的例子描述在ep637336、wo93/18152、wo95/34650、wo00/24913、wo02/063010、wo04/025302、wo05/037083、wo2011/139375、murri-plesko等人,eurjpharmacol2011,657:173-183。小有机分子的例子包括、但不限于磺胺类、杂芳族磺胺类、氨基磺酸盐类、香豆素类和硫代香豆素类和bay-79-4620。在核酸水平起作用的抑制剂的例子是sirna分子、核酶和/或反义分子。根据一个特别优选的实施方案,所述靶向caix的化合物和/或抑制剂是抗-caix抗体和/或这样的抗体的功能片段。根据一个优选的实施方案,抗-caix抗体的片段具有与全长抗-caix抗体基本上相同的caix结合和/或抑制活性,和/或是抗-caix抗体的表位结合片段。在另一个优选的实施方案中,抗体或/和其抗体片段选自多克隆抗体、单克隆抗体、其抗原结合片段诸如f(ab')2、fab'、sfv、dsfv和它们的嵌合的、人源化的和完全人的变体。根据一个进一步优选的实施方案,该抗-caix抗体或其表位结合片段会结合氨基酸序列lstafarv和/或algpgreyral。根据另一个特别优选的实施方案,所述靶向caix的化合物是抗体抗-g250和/或其表位结合片段。抗-g250抗体描述在例如ep-b-0637336中。特别优选的是,所述抗肿瘤抗体是嵌合的或人源化的g250抗体和/或其片段。通过本领域已知的任意合适方法,包括但不限于在pct/ep02/01282和pct/ep02/01283(它们通过引用并入本文)中描述的方法,可以生产用于本发明中的抗体。一种特别优选的抗体是cg250,优选吉瑞昔单抗(inn)。另一个特别优选的实施方案是由杂交瘤细胞系dsmacc2526生产的单克隆抗体g250。抗体cg250是原始鼠单克隆抗体mg250的igg1κ轻链嵌合形式。要治疗的癌症是特征在于表达caix的癌症。具体地,所述癌症的特征在于具有≥2.0的如本文中定义的caix评分,优选地来自小于65岁的受试者,且特别地具有≥2.6的如上所述的caix评分。根据一个特别优选的实施方案,要治疗的受试者是小于65岁的年龄且具有≥2.6的caix评分。优选地,所述癌症或患者的癌症选自宫颈癌、食管癌、胃癌、结肠直肠癌、卵巢癌、肝癌、膀胱癌、肺癌、头颈癌、胆道癌和肾细胞癌。在一个特别优选的实施方案中,所述癌症是肾透明细胞癌(rcc)。在本发明的最优选的实施方案中,通过施用抗体g250和特别是cg250,优选吉瑞昔单抗,治疗肾透明细胞癌。优选的是,要治疗的受试者已经被诊断出非转移型的癌症或非转移性疾病,更优选非转移型的癌症或非转移性疾病或/和将要被诊断为具有复发的高危(highrisk)。根据另一个实施方案,在要治疗的受试者已经经历原发肿瘤切除术(优选肿瘤肾切除术,更优选肿瘤肾切除术和淋巴结切除术)以后,将使用靶向caix的化合物和特别是抗-g250抗体。优选地,该原发肿瘤是表达g250抗原的肿瘤,特别地选自宫颈癌、食管癌、胃癌、结肠直肠癌、肝癌、膀胱癌、肺癌、胆道癌、头颈癌和肾透明细胞癌(ccrcc)。因此,在另一个优选的实施方案中,将靶向caix的化合物和特别是抗-g250抗体用作辅助疗法。以本发明的方式,辅助疗法描述了靶向不可看到的任何剩余癌细胞的方式。经常在初步治疗(诸如外科手术或辐射)以后使用辅助疗法以提防任何癌症复发。辅助疗法的一个例子是经常在外科手术以后施用的另外治疗,其中所有可检测的疾病已经被除去,但是其中由于潜隐的疾病而存在复发的统计学上的风险。辅助疗法的类型包括化学疗法、激素疗法、辐射疗法和/或免疫疗法。例如,放射疗法或全身疗法经常在乳腺癌外科手术以后作为辅助治疗来施用。全身疗法可能由化学疗法、免疫疗法或生物应答调节剂或激素疗法组成。优选地,如果使用根据本发明的靶向caix的化合物,可以将辅助疗法与已知辅助疗法的这些类型中的任一种相组合。本发明的另一个方面涉及一种靶向caix的化合物,其用于治疗表达caix的癌症,其中癌细胞的特征在于≥2.0和特别是≥2.6的caix评分。当然,可以使用如上文具体指定的任何靶向caix的化合物。优选地,所述靶向caix的化合物是抗-g250抗体,特别是cg250抗体,和/或其表位结合片段。根据另一个实施方案,靶向caix的化合物和特别是抗体cg250用于治疗具有≥2.0和特别是≥2.6的caix评分的肾透明细胞癌。根据另一个实施方案,靶向caix的化合物和特别是抗体cg250用于治疗具有≥2.0的caix评分的肾透明细胞癌,且其中要治疗的受试者小于65岁和/或具有≥2.6的caix评分。本发明的另一个方面涉及一种用于诊断、预测和/或分类癌症疾病的方法,其包括(a)通过染色定量癌症样品中caix的表达,和(b)根据染色的癌细胞的范围和染色强度,将所述癌症疾病分类。所述诊断方法可以进一步包括如上所述确定caix评分。要诊断和/或分类的癌症优选地是如上所述的癌症,特别是肾透明细胞癌。优选地,该癌症具有≥2.0且甚至更优选地≥2.6的caix评分。预测实施方案包括caix评分用于预测要治疗的患者是否对使用靶向caix的化合物的治疗(特别是使用抗-g250抗体的治疗)做出应答的用途。它特别地用于预测患者是否对使用cg250抗体(优选地使用吉瑞昔单抗)的治疗做出应答。换而言之,它可以预测哪些患者可能受益于使用靶向caix的化合物的治疗。例如,具有肾透明细胞癌的患者(其中对应的肿瘤细胞样品显示≥2.6的caix评分)最可能受益于使用cg250抗体(优选吉瑞昔单抗)的治疗。与具有高caix评分的患者相比,具有高t-期(t3/t4)、低分级(g1/g2)、无淋巴结涉入(n0/nx)且无转移性疾病(m0)的患者具有更差预后,具有低caix评分。本发明的另一个方面涉及一种用于治疗癌症的方法,所述方法包括(a)通过染色来定义得自要治疗的受试者的癌细胞中的caix的表达,(b)根据所述癌细胞的范围和染色强度确定caix评分,和(c)如果在步骤(b)中已经超过预定的caix阈值,则施用靶向caix的化合物。根据一个优选的实施方案,施用本发明的靶向caix的化合物和特别是抗-g250抗体作为单一疗法方案,优选地作为单一疗法来施用。靶向caix的化合物和特别是抗-g250抗体,优选cg250抗体,更优选吉瑞昔单抗,也可以在联合疗法方案中或作为联合疗法来施用,例如,如上面已经描述的,可以将辅助抗-g250抗体治疗与任意其它类型的辅助疗法相组合。优选地,可以将细胞因子与所述抗体一起共同施用以增加抗体依赖性的细胞的细胞毒性(adcc)和/或活化患者的免疫系统,例如,nk细胞。该细胞因子优选地选自:白介素诸如il-2、-3、-4、-5、-6、-7、-8、-9、-10、-12、-13、-14和-15,干扰素,例如,ifn-α、ifn-β和ifn-γ、tfn-α、tnf-β、神经生长因子、cd40的配体、fas、cd27和cd30、巨噬细胞抑制蛋白、rantes、药学上可接受的类似物和衍生物的活性片段、及其混合物。更优选地,所述细胞因子选自il-2和ifn-α。当然,与其它细胞毒性的工具(例如,多柔比星、顺铂或卡铂和其它肿瘤工具)的组合是可能的。基于例如年龄、重量、状况和疾病的严重程度,普通技术人员可以确定使用的靶向caix的化合物和特别是g250-抗原特异性的抗体的剂量。20mg或50mgcg250抗体的定量施用方案(例如,每位患者在每周循环中)将会递送高于0.5μg/ml、优选1μg/ml的浓度,且因此对于效力而言是足够的。因此,在一个优选的实施方案中,施用5-250mg/周、更优选10-100mg/周和最优选20mg/周至50mg/周的g250-特异性抗体的每周剂量。根据一个优选的实施方案,将g250抗原特异性的抗体和/或其抗体片段在至少2个治疗阶段中施用给有此需要的受试者,在所述治疗阶段中施用不同的、优选地递减量的抗体。更优选地,本发明的方法包括在2个阶段中给有此需要的受试者施用g250-抗原特异性的抗体或/和其抗体片段,其中(a)在第一个治疗阶段中施用的g250-抗原特异性的抗体的剂量为10-250mg/周,优选20-100mg/周,更优选30-100mg/周,甚至更优选30-55mg/周和最优选50mg/周,和(b)在第二个治疗阶段中施用的g250-抗原特异性的抗体的剂量为5-100mg,优选10-50mg,更优选15-25mg,最优选20mg/周。甚至更优选的是,第一个治疗阶段包括施用50mg/周的g250-特异性抗体,且第二个治疗阶段包括施用20mg/周。优选地静脉内地施用抗肿瘤抗体,优选地通过输注或静脉内注射。通过输注施用抗体优选地进行至多约30分钟,更优选地在约15分钟内。当然,还可以腹膜内地或肌肉内地施用靶向caix的化合物。每周输注20或50mgcg250抗体持续至多20周的定量施用方案似乎被良好耐受,且不会导致显著的haca发展。因此优选的是,第一个治疗阶段包括至多12周,优选地至多6周,甚至更优选地至多1周,且第二个治疗阶段包括至多156周,优选地至多104周,更优选地至多52周,甚至更优选地至多12-24周。在最优选的实施方案中,对于肾透明细胞癌的治疗而言,第一个治疗阶段包括至多1周和50mg/周的cg250抗体的单个负荷剂量的施用,且第二个治疗阶段包括至多24周和20mg/周的cg250抗体的施用。在另一个优选的实施方案中,对于肾透明细胞癌的治疗而言,第一个治疗阶段包括至多1周和50mg/周的cg250抗体的单个负荷剂量的静脉内施用,且第二个治疗阶段包括至多24周和20mg/周的cg250抗体的施用,优选地,对于肾透明细胞癌的治疗而言,第二个治疗阶段包括20mg/周的cg250抗体的至少8次连续静脉内施用。当然可以在药物组合物中施用靶向caix的化合物,特别是cg250抗体。该药学上可接受的组合物可以包含可接受的载体、稀释剂和/或佐剂。当在本文中使用时,术语“载体”包括这样的载体、赋形剂和/或稳定剂:其在使用的剂量和浓度对暴露于它的细胞或哺乳动物是无毒的。生理上可接受的载体经常是水性ph缓冲溶液或脂质体。生理上可接受的载体的例子包括:缓冲剂诸如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸、低分子量(小于约10个残基)多肽;蛋白诸如血清白蛋白、明胶或免疫球蛋白;亲水的聚合物诸如聚乙烯吡咯烷酮;氨基酸诸如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖类,二糖类和其它碳水化合物,包括葡萄糖,甘露糖或糊精,胶凝剂诸如edta,糖,醇诸如甘露醇或山梨醇;形成盐的抗衡离子诸如钠;和/或非离子型表面活性剂,诸如tween、聚乙烯或聚乙二醇。在一个特别优选的实施方案中,在生理盐水(在水中的0.9%无菌氯化钠)中施用靶向caix的化合物。根据一个特别优选的实施方案,通过静脉内输注在生理盐水中施用抗体cg250,例如,100ml溶液历时15min。术语“碳酸酐酶ix”和“caix”、“ca9”、“mn”和“g250”在本文中视作是同义的。“cg250”和吉瑞昔单抗可互换地使用。“抗原”表示可以被例如抗体结合的配体。抗原的与抗体接触的部分被命名为“表位”。如果没有另外提及,本文中使用的“染色”表示使得肿瘤细胞可见的任何方法。一种优选的“染色”方法是如上所述的免疫组织化学染色。附图说明图1:对于itt(意向性治疗)和pp群体(按方案群体)而言,增加的caix-评分值的hr(危害比)和p-值图2:对于2.6的caix截止值(cut-off),治疗组(treatmentarm)的dfs(cg250相对于安慰剂)图3:具有≥2.6的caix评分的pp群体的dfs曲线图4:高caix评分(≥2.0)和年龄<65岁(itt群体)具体实施方式以下结果是基于在具有肾透明细胞癌(ccrcc)和复发高危的患者中的随机化双盲iii期研究,以评价相对于安慰剂的辅助cg250治疗。目的:在该研究中的目的是相对于安慰剂评价吉瑞昔单抗治疗的无疾病存活率(dfs)和相对于安慰剂评价吉瑞昔单抗治疗的总存活率(os)。患者:在预见性的、两组的(armed)、随机化的、双盲的、安慰剂对照的研究中招募864位患者(itt)。由独立的放射学综述委员会(radiologicalreviewcommittee)评估无疾病存活率的评价。855位患者接受至少一种研究治疗(cg250或安慰剂),并由独立的数据监测委员会(independentdatamonitoringcommittee)分析安全性。患者的包括标准是:年龄≥18岁,具有记载的透明细胞组织学的原发性肾细胞癌的在先(部分或全部)肾切除术,没有肉眼可见的和显微镜的残留疾病的证据。患者应当具有以下高危组(rg)(称作tnm分级,第6版uicc,2002)之一:οrgi:t3an0/xm0或t3bn0/xm0或t3cn0/xm0或t4n0/xm0οrgii:任何t期和n+疾病和m0οrgiii:t1bn0/xm0或t2n0/xm0,每个具有分级g3(具有至少3个等级的fuhrman或任意其它核分级系统),在肾切除术和随机化的日期之间不超过12周,0-1的ecog。研究药物:在50mg的单个负荷剂量中施加吉瑞昔单抗(cg250;原始鼠单克隆抗体mg250的igg1κ轻链嵌合形式)(第1周),随后每周输注20mg吉瑞昔单抗(第2-24周)。将药物在100ml生理盐水(在水中的0.9%无菌氯化钠)中稀释,并通过静脉内输注历时15分钟施加。安慰剂组接受不含活性成分的、含有聚山梨酯20(20)的磷酸盐缓冲盐水。治疗的持续时间是24周。免疫组织化学:将石蜡包埋的肾切除的组织样本切成3-5μm的切片,并收集在各个粘着载玻片上。用得自ventanamedicalsystems,inc.的ezprep混合物进行脱石蜡和脱水。将组织材料封闭,并用稀释的抗体(caixm75,1:150)的溶液染色。使用生物素化的igg抗-小鼠igg抗体(ventanamedicalsystems,inc.),随后用缀合的抗生蛋白链菌素-辣根过氧化物酶(ventanamedicalsystems,inc.),检测抗体。用二氨基联苯胺和过氧化氢(ventanamedicalsystems,inc.)进行信号检测。包括阳性和阴性组织对照作为参照。统计方法:主要针对由所有864位随机化的患者组成的意向性治疗(itt)群体分析效力评价。另外,对于由766位患者组成的按方案(perprotocol,pp)群体,重复分析。将这样的患者评价为按方案(pp)群体:其接受至少8次研究药物的连续施用(第1-8周),且在去盲性(unblinding)之前不具有在偏差标准中定义的重大方案偏差。使用程序pass2002进行样品大小计算。使用8.1版或更高的软件,产生统计总结。对于效力分析,输入不完全/部分日期;不输入缺失的安全性日期。使用医学管理活动字典(medicaldictionaryforregulatoryactivities)编码不利事件和医疗史;使用世界卫生组织药物词典(worldhealthorganisationdrugdictionary)编码药物。主要效力分析是基于意向性治疗(itt)群体,并使用按方案群体进行重复。使用观察的数目、算术平均值、标准差、最小值、中位数和最大值,描述连续变量。使用观察的数目和百分比呈现类别变量。对于dfs和os应用分级试验以保持二者的总显著性水平≤5%。使用时序检验和kaplan-meier方法,在吉瑞昔单抗组和安慰剂组之间对比dfs和os。对于具有5%的总显著性水平的组连续方法,使用o'brien-fleming方案调节os的显著性水平。使用确切方法(pearson-clopper)计算群体的95%置信区间。使用cox比例危害模型,研究预测因子对dfs和os的潜在影响。使用比例危害模型,与它的有关的95%置信区间和p-值一起估计危害比(吉瑞昔单抗治疗相对于安慰剂)。结果的总结:在数据分析截止值时,根据当地研究人员评估,360位患者(41.7%)已经经历dfs事件,且504位(58.3%)仍然没有疾病。0.6%的dfs患者在当地评估为在基线时具有转移性疾病。总共181位患者已经死亡。irrc中心读出评估以后,可以给389位患者(45%)分配dfs事件,而可以给剩余的475位(55%)患者分配检察日期。在itt群体中发生的dfs事件的数目(293,不包括在基线时具有转移性疾病的患者)在治疗组之间是相当的(cg250:142,32.8%;安慰剂:151,35.0%),在基线时的转移速率也是如此(dfs=0),在11.5%的吉瑞昔单抗患者和10.7%的安慰剂患者中观察到。基于itt群体的irrc评价对dfs的主要分析没有显示治疗组之间的总中位数dfs的统计学上显著的差异(危害比[hr]=0.999,p=0.737)。吉瑞昔单抗的中位数dfs是71.4个月,且安慰剂组的中位数dfs没有达到。在治疗组之间不存在dfs的统计学上显著的差异,不论高危组(rg)分级(rgi:hr=0.934,p=0.596;rgii:hr=1.73,p=0.084;rgiii:hr=0.984,p=0.627)。另外,无论是对于预测,还是对于治疗效果,根据bui等人(bui等人,clinicalcancerresearch2003,9:802-811)使用单独基于caix抗原表达的分级进行的探究分析尚未产生统计学上显著的结果。但是,令人惊讶地,对于治疗效果以及对于预测,caix抗原表达与染色强度的组合(即caix评分,其可以视作抗原密度的量度)显示出显著的结果。从存活树分析衍生出的caix评分截止值(对于itt为1.91,和对于itt安慰剂为1.52)的多变量分析表明,对于dfsitt、ositt和os安慰剂中的预测而言,caix评分是预测性的,但是不是独立因子。结果提示1.52的caix评分截止值(itt安慰剂)可能对于预测而言是有用的。对于具有低caix评分的患者,不同治疗组的kaplan-meier-曲线独立于使用的截止值发生重叠。这清楚地表明,具有低caix评分的患者不会从治疗获益。≥1.91的高caix评分显示出治疗效果的积极趋势(hr=0.879,p-值0.248)。从0.0至3.0的所有caix评分的亚组分析揭示,随着caix评分增加,治疗效果变得更显著(图1)。≥2.6的caix评分导致统计学上显著的治疗效果,中位数dfs从安慰剂组中的51.2个月增加至cg250患者中的73.6个月(整个患者群体的17%,hr=0.568;p=0.022;图2)。具有≥2.6的高caix评分的itt群体中的151位患者在cg250和安慰剂组之间均匀地分布。令人感兴趣的是,在安慰剂组中的患者表现出与具有<2.6的caix评分的患者类似的5年dfs时间(48.4个月相对于51.7个月),不论治疗组。对于具有基线转移的患者或对于具有阳性淋巴结的患者,调节群体不会改变结果。采用具有≥2.6的caix评分的pp群体(n=139)会提高危害比和显著性水平(hr=0.508;p=0.007;图2)。总之,在pp群体中的结果反映了在itt群体中观察到的结果(图3)。另一个亚组分析揭示了统计学上显著的治疗效果,中位数dfs从安慰剂组中的55.2个月增加至具有≥2.0的caix评分和<65岁的cg250患者中的70.9个月(hr=0.60;95%ci0.40-0.89;p-值=0.01;图4)。另外,分析已经证实,与具有高caix评分的患者相比,具有高t-期(t3/t4)、低分级(g1/g2)、无淋巴结涉入(n0/nx)和无转移性疾病的透明细胞rcc患者具有显著更差的预后,具有低caix评分。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1