区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清的间接竞争ELISA方法及试剂盒与流程
本发明属于病毒检测
技术领域:
,具体涉及一种区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清的间接竞争elisa方法及试剂盒。
背景技术:
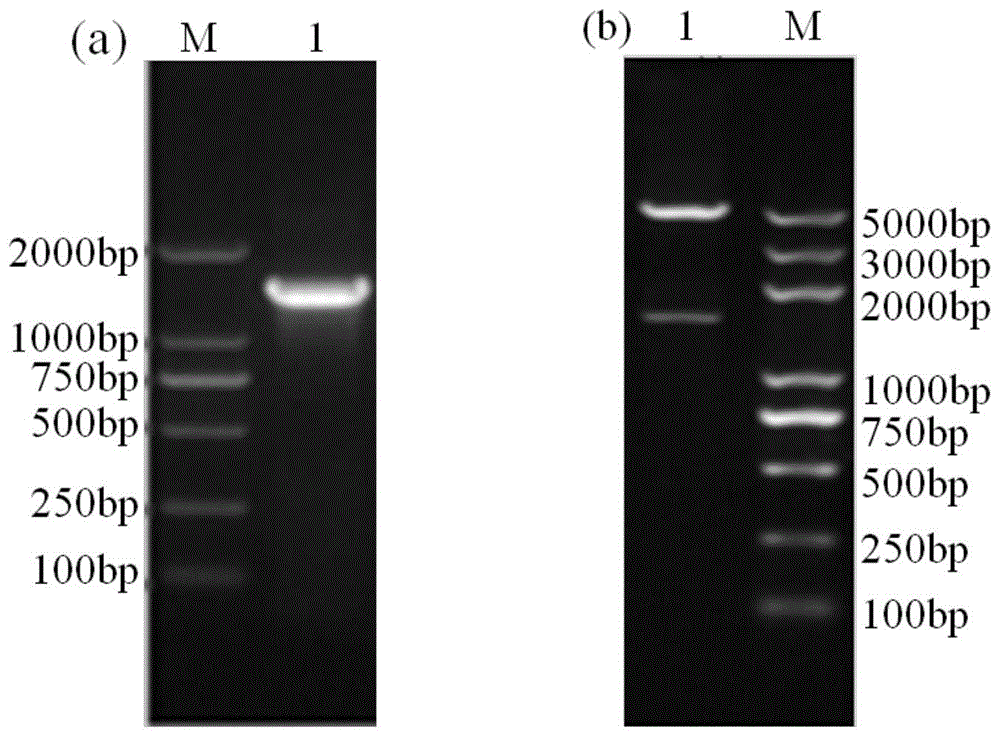
:新城疫(newcastledisease,nd)是由新城疫病毒(newcastlediseasevirus,ndv)引起的一种急性烈性高度接触性传染病,被世界动物卫生组织(oie)列为必报动物疫病,我国农业部将其列为一类动物疫病,同时也是我国中长期规划五大优先防治的动物疫病之一。新城疫在世界范围内经过四次大流行,宿主范围不断扩大,迄今能自然或人工感染的禽类已超过250多种,对养殖业造成重大危害。虽然基因ii型弱毒疫苗lasota株能够有效的预防新城疫,但却无法区分疫苗抗体与野毒抗体,导致新城疫净化困难重重。农业部印发的《国家新城疫防治指导意见(2017-2020年)》中明确提出,到2020年底国家新城疫达到净化标准。因此,研发安全、高效的新型疫苗以及建立相匹配的能有效区分疫苗抗体与野毒抗体的检测方法成为目前的首要任务。新城疫病毒属于副黏病毒科,禽腮腺炎病毒属,单股负链不分节段rna病毒。新城疫共编码6种结构蛋白,依次为核衣壳蛋白(np)、磷蛋白(p)、基质蛋白(m)、融合蛋白(f)、血凝素-神经氨酸酶蛋白(hn)、大分子蛋白(l),而m蛋白是形成病毒样颗粒(virus-likeparticles,vlps)的主要结构,在出芽过程中可自行组装hn蛋白和f蛋白。新城疫病毒样颗粒(newcastlediseasevirus-likeparticles,ndvvlps)是由新城疫病毒的一个或多个结构蛋白自行组装而成的空心结构蛋白颗粒,不含有病毒的核酸,具有良好的安全性,这也是病毒样颗粒疫苗相较于弱毒疫苗的优势。ndvvlps因其适宜的大小可从外周血被引流到次级淋巴器官中,同时ndvvlps抗原表面的重复结构使其能被apcs有效摄取,进而诱导机体产生较高水平的体液免疫、细胞免疫和粘膜免疫,是理想的疫苗候选株。技术实现要素:本发明目的在于建立一种区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清的间接竞争elisa方法及试剂盒,从而快速检测并移除新城疫野毒感染禽群,为新城疫的净化提供理论依据。本发明为解决技术问题所采用的技术方案如下:本发明的区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清的间接竞争elisa方法,包括以下步骤:步骤一、制备免疫抗原(1)将np蛋白基因克隆至t载体中,构建重组克隆质粒t+np,并测序鉴定;(2)对重组克隆质粒t+np和pet28a(+)载体进行双酶切,将回收的目的基因及载体基因进行连接构建重组表达质粒pet28a+np;(3)对重组表达质粒pet28a+np进行诱导表达,经纯化后获得np蛋白,作为免疫抗原;步骤二、制备单克隆抗体(1)将纯化的np蛋白免疫balb/c小鼠,再将免疫小鼠的脾细胞与sp2/0细胞进行融合筛选,制备杂交瘤细胞株;(2)将杂交瘤细胞株腹腔注射balb/c小鼠,取腹水加以纯化,即为单克隆抗体,作为抗体诊断试剂;步骤三、间接竞争elisa方法条件优化抗原包被浓度为0.781μg/ml,单克隆抗体稀释倍数为1:800,单克隆抗体孵育时间为90min,酶标二抗稀释倍数为1:5000,酶标二抗孵育时间为60min,样品血清稀释倍数为1:20;步骤四、确定间接竞争elisa方法的判定标准当待检血清抑制率i%≥35%时,判定为阳性即野毒感染;当待检血清抑制率i%<35%时,判定为阴性即新城疫病毒样颗粒疫苗免疫;步骤五、待检血清检测根据步骤三确定的优化条件,将免疫抗原包被于elisa孔中,将稀释后的样品血清与单克隆抗体混合后进行阻断实验,再与固相抗原结合作用,加入酶标二抗继续孵育,最后用tmb显色液显色,加入2m硫酸溶液终止反应并读数。作为优选的实施方式,步骤一(1)中,所述t载体采用-t1simple克隆载体。作为优选的实施方式,步骤一(1)中,所述np蛋白基因的构建过程如下:以新城疫病毒流行优势强病毒株na-1为模板,采用pcr扩增np基因,引物序列如下:np-nhei-f:5’-cggctagcatgtcgtctgtctttgacgaa-3’,np-noti-r:5’-atttgcggccgcgatcagtatccccaatcagtgtc-3’;pcr反应程序为:94℃预变性5min;94℃变性30秒、65℃退火30s、72℃延伸1min,30个循环;72℃再延伸10分钟;pcr扩增产物经1%(m/v)琼脂糖凝胶电泳检测分析,进行胶回收纯化。作为优选的实施方式,步骤一(2)中,连接体系为:目的片段4μl、载体基因1μl、t4dna连接酶1μl、buffer4μl。作为优选的实施方式,步骤一(2)中,双酶切采用nhei和noti。作为优选的实施方式,所述酶标二抗采用辣根过氧化物酶标记的羊抗小鼠igg。作为优选的实施方式,步骤五的具体检测过程如下:i包被:将纯化的np蛋白稀释至0.781μg/ml,包被于96孔elisa板上,包被量为100μl/孔,4℃过夜;ii洗板:弃掉上清并拍干,加入250μl的1%pbst洗板,清洗3次,每次5min;iii封闭:加入100μl的1%脱脂奶粉,置于37℃封闭60min,洗板同步骤ii;iv竞争:将待检血清与单克隆抗体混合均匀,混合体积为100μl,待检血清稀释倍数为1:20,单克隆抗体稀释倍数为1:800,加入反应孔中,加入量为100μl/孔,置于37℃反应90min,洗板同步骤ii;v加入酶标二抗:每孔加入100μl酶标二抗,酶标二抗的稀释倍数为1:5000,于37℃反应60min,洗板同步骤ii;vi显色及终止:每孔加入100μl可溶型单组分tmb底物溶液,显色10min,每孔加入50μl的2m硫酸终止反应;vii读数:显色前预热酶标仪,od450读取数值。本发明的区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清的试剂盒,包括:np蛋白、单克隆抗体、酶标二抗、可溶型单组分tmb底物溶液、硫酸。作为优选的实施方式,所述np蛋白的浓度为0.781μg/ml,所述单克隆抗体的稀释倍数为1:800,所述单克隆抗体的孵育时间为90min,所述酶标二抗的稀释倍数为1:5000,所述酶标二抗的孵育时间为60min。作为优选的实施方式,所述np蛋白的制备方法如下:(1)将np蛋白基因克隆至t载体中,构建重组克隆质粒t+np,并测序鉴定;(2)对重组克隆质粒t+np和pet28a(+)载体进行双酶切,将回收的目的基因及载体基因进行连接构建重组表达质粒pet28a+np;(3)对重组表达质粒pet28a+np进行诱导表达,经纯化后获得np蛋白,作为免疫抗原。作为优选的实施方式,所述np蛋白基因的构建过程如下:以新城疫病毒流行优势强病毒株na-1为模板,采用pcr扩增np基因,引物序列如下:np-nhei-f:5’-cggctagcatgtcgtctgtctttgacgaa-3’,np-noti-r:5’-atttgcggccgcgatcagtatccccaatcagtgtc-3’;pcr反应程序为:94℃预变性5min;94℃变性30秒、65℃退火30s、72℃延伸1min,30个循环;72℃再延伸10分钟;pcr扩增产物经1%(m/v)琼脂糖凝胶电泳检测分析,进行胶回收纯化。作为优选的实施方式,步骤(1)中,所述t载体采用-t1simple克隆载体。作为优选的实施方式,步骤(2)中,连接体系为:目的片段4μl、载体基因1μl、t4dna连接酶1μl、buffer4μl。作为优选的实施方式,步骤(2)中,双酶切采用nhei和noti。作为优选的实施方式,所述酶标二抗采用辣根过氧化物酶标记的羊抗小鼠igg。本发明的有益效果是:本发明适用于区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清,可有效移除传染源,消灭持久疫源地的存在,为新城疫的净化提供理论依据。本发明具有检测灵敏、准确,操作简便以及特异性强的优点,具体而言,其技术优势主要表现在:1、创新性强:农业部印发的《国家新城疫防治指导意见(2017-2020年)》中明确提出,到2020年底国家新城疫达到净化标准,因此新型、安全、高效的新城疫病毒颗粒疫苗前景广大。目前尚未有区分新城疫病毒样颗粒疫苗抗体与野毒抗体的检测方法,本发明能更好地调补这一空白。2、特异性强:新城疫病毒样颗粒是由m蛋白、f蛋白和hn蛋白构成,不含有病毒的其他结构蛋白(np蛋白、p蛋白、l蛋白),新城疫病毒样颗粒疫苗免疫血清中不含有针对np蛋白的抗体,因此新城疫病毒样颗粒疫苗免疫血清中不含有抗np、p及l三种蛋白血清组份。在三种不参与新城疫病毒样颗粒组装的结构蛋白中,np蛋白保守性较高,含量最大。因此,本发明以np蛋白为研究靶点,只会与野毒感染血清反应,而不会与新城疫病毒样颗粒疫苗免疫血清发生交叉反应,因而本发明的检测方法的特异性较强。3、重复性、敏感度高:本发明经抗原包被浓度和包被时间、封闭液种类和封闭时间、一抗稀释倍数和孵育时间、二抗浓度和孵育时间等条件优化,重复性及敏感性均良好。4、操作性强:本发明操作技术较为成熟和简便,成本较低,适合大规模的样品检测,同时检测较为快速,可在5小时左右完成。附图说明图1为重组表达质粒的构建。其中图1(a)为np特异性引物pcr鉴定(1470bp);图1(b)为重组表达质粒pet28a+np双酶切鉴定(np片段酶切为1470bp,pet28a+载体酶切片段为5304bp)。图2为np蛋白的纯化与鉴定。其中图2(a)为sds-page(约55kda);图2(b)为westernblot鉴定。图3为重组表达质粒pet28a+np构建示意图。具体实施方式本发明的区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清的间接竞争elisa方法,主要包括np蛋白的制备、单克隆抗体的制备、间接竞争elisa法的建立以及对ndvvlps疫苗免疫血清进行检测等步骤。以np蛋白为免疫抗原,以单克隆抗体为抗体诊断试剂,利用棋盘法对包被抗原及单抗浓度进行优化筛选,并对包被时间、一抗工作浓度及孵育时间、二抗工作浓度及孵育时间等条件优化;根据工作浓度将免疫抗原包被于elisa孔中,同时以不同稀释倍数的样本血清与固定稀释倍数的单克隆抗体混合后进行阻断实验,将混合物与固相抗原结合作用,再以辣根过氧化物酶标记的羊抗小鼠igg为二抗继续孵育,最后用tmb显色液显色,加入2m硫酸溶液终止反应,设置空白对照孔、标准品阳性对照孔和样品孔,计算抑制率,确定样本血清最佳稀释倍数、阴阳临界值判定标准,并对临床样品进行检测。下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。在介绍具体实施例前,对下述实施例中所涉及部分实验原理、实验设备情况简要介绍说明如下。生物样品:新城疫病毒流行优势强病毒株na-1strain(genbank:dq659677)、e.colidh5α、bl21(de3)、sp2/0细胞和pet28a(+)由吉林大学预防兽医学传染病实验室冻存;-t1simple克隆载体购自北京全式金生物技术有限公司;6周龄雌性balb/c小鼠购自长春生物制品研究所。实验试剂:t4dna连接酶、hifidna聚合酶、核酸marker购自北京全式金生物技术有限公司;蛋白分子marker购自thermo公司;dna胶回收试剂盒、质粒小提试剂盒购自axygen公司;ecl化学发光检测试剂盒购自武汉博士德生物工程有限公司;anti-histagmab和hrp-goat-anti-mouseigg购自sigma公司;胎牛血清购自gibco公司;限制性内切酶nhei和noti购自neb公司。实施例1免疫抗原np蛋白的制备(1)扩增np蛋白基因序列以新城疫病毒流行优势强病毒株na-1(genbank登录号:dq659677)为模板,采用pcr扩增np基因,引物序列如下:np-nhei-f:5’-cggctagcatgtcgtctgtctttgacgaa-3’,np-noti-r:5’-atttgcggccgcgatcagtatccccaatcagtgtc-3’;pcr反应程序为:94℃预变性5min;94℃变性30秒、65℃退火30s、72℃延伸1min,30个循环;72℃再延伸10分钟;pcr扩增产物经1%(m/v)琼脂糖凝胶电泳检测分析,进行胶回收纯化。(2)构建重组克隆质粒t+np将步骤(1)所得胶回收纯化产物与-t1simple克隆载体室温连接25min后转化至e.colidh5α感受态细胞中,涂板于kan选择性平板中,37℃培养12h,挑取单菌落按照步骤(1)的pcr反应程序进行菌液pcr鉴定,鉴定结果如图1(a)所示,结果与预期条带相符,表明重组克隆质粒构建成功;提取鉴定正确的阳性质粒即为重组克隆质粒t+np。(3)构建重组表达质粒pet28a+np重组表达质粒pet28a+np的构建过程如图3所示,将pet28a(+)质粒及重组克隆质粒t+np经nhei和noti双酶切,回收目的片段及载体基因,采用t4dna连接酶进行连接从而构建重组表达质粒pet28a+np,其连接体系为:目的片段4μl、载体基因1μl、t4dna连接酶1μl、buffer4μl,于室温反应30min;将连接产物转化至e.colidh5α感受态细胞中,涂板于kan选择性平板中,置于37℃培养12h,挑取单菌落按照步骤(1)的pcr反应程序进行菌液pcr鉴定,并利用nhei和noti进行双酶切鉴定,鉴定结果如图1(b)所示,结果显示重组表达质粒pet28a+np构建成功;提取鉴定正确的阳性质粒,转化至bl21(de3)感受态细胞中。(4)np蛋白的表达与纯化将鉴定正确的bl21(de3)阳性菌株进行大体积培养,待od值为0.6时加入0.1%的异丙基硫代半乳糖苷iptg(24mg/ml),置于30℃摇床诱导表达8h,8000×g离心收集菌体沉淀,加入含有6m尿素的蛋白结合液重悬,超声破碎菌体溶解靶蛋白,采用亲和层析纯化np蛋白,利用sds-page及westenblot进行鉴定。结果如图2(a)和图2(b)所示,结果表明np蛋白制备成功且纯化纯度较高。实施例2单克隆抗体的制备(1)免疫balb/c小鼠将实施例1所制备的np蛋白稀释至1mg/ml,取100μl(100μgnp蛋白)与100μl的弗氏完全佐剂乳化,腹腔注射6-8周龄的雌性balb/c小鼠。首次免疫2周后,取100μl(100μgnp蛋白)与100μl的弗氏不完全佐剂进行乳化,进行第二次免疫,第二次免疫2周后以相同方式(取100μl(100μgnp蛋白)与100μl的弗氏不完全佐剂进行乳化)进行第三次免疫,并在取小鼠脾细胞前3天腹腔注射50μg纯化的np蛋白,注射3天后无菌分离小鼠脾细胞。(2)建立抗新城疫病毒np蛋白单克隆抗体杂交瘤细胞株复苏sp2/0细胞,利用含有10%胎牛血清的1640培养液进行传代培养,待细胞处于对数生长期时,然后将小鼠脾细胞与sp2/0细胞按照体积比为5:1的比例进行混合,并利用50%的peg-4000(v/v)进行细胞融合;将融合后的sp2/0细胞铺板于铺有饲养层细胞的96孔板中,置于含有5%co2的37℃培养箱中培养,检测细胞培养上清效价,筛选阳性克隆,无限稀释后再次进行克隆筛选;按照上述方法连续筛选3次获得稳定的杂交瘤细胞株。(3)制备单克隆抗体给balb/c小鼠腹腔注射0.5ml石蜡油制备腹水,一周后打入1×106个步骤(2)获得的杂交瘤细胞,约一周后收集腹水,采用elisa测定其效价,-80℃分装保存。使用时取腹水加以纯化,即为单克隆抗体。实施例3间接竞争elisa方法的建立(1)间接竞争elisa方法条件优化通过棋盘法对实施例(1)制备的np蛋白的包被浓度和实施例(2)制备的单抗的孵育浓度进行优化。具体的操作过程如下:将np蛋白分别按照浓度为50μg/ml、25μg/ml、12.5μg/ml、6.25μg/ml、3.125μg/ml、1.563μg/ml、0.781μg/ml和0.391μg/ml进行包被,单克隆抗体腹水分别按照稀释倍数为1:200、1:400、1:800、1:1600、1:3200、1:6400进行稀释。结果如表1所示:最佳抗原包被浓度为0.781μg/ml,最佳单克隆抗体稀释倍数为1:800。表1抗原包被浓度及单克隆抗体稀释倍数优化以上述最佳条件,对单克隆抗体的工作时间进行优化。将单克隆抗体分别孵育30min、60min、90min和120min,根据p/n值的大小进行判定,结果如表2所示:单克隆抗体最佳孵育时间为90min。表2单克隆抗体孵育时间优化单克隆抗体作用时间p值n值p/n值30min0.8250.1266.54860min1.0190.1099.34990min1.0970.08113.543120min0.9030.07611.882以上述最佳条件,对二抗工作浓度和孵育时间进行优化。将酶标二抗分别按照稀释倍数为1:2500、1:5000、1:7500和1:10000进行稀释以及作用时间为30min、60min和90min进行孵育,根据p/n值的大小进行判定,结果如表3和表4所示:酶标二抗稀释倍数为1:5000,孵育时间为60min。表3酶标二抗工作浓度优化酶标二抗工作浓度p值n值p/n值1:25001.4760.1917.7281:50001.0430.08811.8521:75000.8320.08210.1461:100000.5800.0688.529表4酶标二抗孵育时间优化酶标二抗工作时间p值n值p/n值30min0.6440.1036.25260min0.9300.0969.68890min1.0220.1646.231以上述最佳条件,对样品血清稀释倍数进行优化。将样品血清分别按照稀释倍数为1:5、1:10、1:20和1:30进行稀释,根据抑制率进行判定。抑制率=阴性od值(n)-样本od值(p)/阴性od值(n)。结果如表5所示:最佳样品血清稀释倍数为1:20。表5样品血清稀释倍数优化(2)间接竞争elisa方法判定标准确定利用间接竞争elisa方法的优化条件,对20份新城疫病毒样颗粒疫苗免疫血清进行检测,计算其抑制率(i%),利用统计学方法判定阴阳临界值。阴阳临界值=抑制率平均值(x)+3×抑制率标准方差(sd)。结果如表6所示,新城疫病毒样颗粒疫苗免疫血清的平均抑制率(x)为22.80,标准方差(sd)为3.55,经计算,阴阳临界值为33.45。设定:当待检血清抑制率(i%)≥35%时,判定为阳性即野毒感染;当待检血清抑制率(i%)<35%时,判定为阴性即新城疫病毒样颗粒疫苗免疫。表6间接竞争elisa方法判定标准确定编号i%编号i%编号i%124.933822.3411519.871218.562921.6831620.432327.7521023.2001726.033431.3411124.9011825.632519.5701227.3001923.766620.3131320.9122021.078716.2851420.130--(3)新城疫病毒样颗粒疫苗免疫血清样本和临床阳性血清样本的检测利用上述建立的间接竞争elisa方法对20份新城疫病毒样颗粒疫苗免疫血清和20份临床阳性血清进行检测,具体操作如下:i包被:将实施例1制备的np蛋白稀释至0.781μg/ml,包被于96孔elisa板上(100μl/孔),4℃过夜;ii洗板:弃掉上清并拍干,加入250μl的1%pbst洗板,清洗3次,每次5min;iii封闭:加入100μl的1%脱脂奶粉,置于37℃封闭60min,洗板(同步骤ii);iv竞争:将待检血清与单克隆抗体混合均匀(最终混合体积为100μl,血清最终稀释倍数为1:20,单克隆抗体最终稀释倍数为1:800),加入反应孔中,加入量为100μl/孔,置于37℃反应90min,洗板(同步骤ii);v加入酶标二抗:每孔加入100μl酶标二抗,酶标二抗的稀释倍数为1:5000,置于37℃反应60min,洗板(同步骤ii);vi显色及终止:每孔加入100μl可溶型单组分tmb底物溶液,显色10min,每孔加入50μl的2m硫酸终止反应;vii读数:显色前预热酶标仪,od450读取数值。结果如表7所示:阳性血清抑制率均>35%,阴性血清抑制率均<35%,说明建立的间接竞争elisa方法能够有效区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清或全病原疫苗免疫。表7新城疫病毒样颗粒疫苗免疫血清和临床阳性血清的检测结果本发明公开了一种区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清的间接竞争elisa方法及试剂盒,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的产品已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的产品进行改动或适当变更与组合,来实现和应用本发明技术。序列表<110>吉林大学<120>区分新城疫病毒样颗粒疫苗免疫血清与野毒感染血清的间接竞争elisa方法及试剂盒<160>1<170>siposequencelisting1.0<210>1<211>1470<212>dna<213>新城疫病毒(newcastlediseasevirus)<400>1atgtcgtctgtctttgacgaatacgagcagttcctcgctgctcagacccgccctaacgga60actcatggagggggagagaaagggagcactttaaaagttgaggtcccagtatttgccctt120aacagtgatgacccagaggatagatggaattttgcggtattctgtcttcggattgctgtt180agcgaggatgccaacaaaccactcaggcaaggtgctcttatatccctcttatgctcccat240tctcaggtgatgagaaaccatgttgcccttgcagggaaacagaatgaggccacactggct300gttcttgagatcgatggttttgctaacagtgtgccccagtttaacaataggagtggagtg360tctgaggagagagcacagagattcatggtaatagcaggatctctccctcgggcatgcagt420aacggtactccgtttgtcacagctggggttgaagatgatgcaccagaagatatcactgac480actctggaaagaatcctatctatccaagttcaggtatgggtcacagtagcaaagaccatg540actgcatatgagacagcagatgagtcagaaacaagaagaataaataggtatatgcagcaa600ggtagagttcagaagaagtacatccttcaccctgtatgcaggagcgcaattcaactcaca660atcagacactctctggcagtccgtattttcttagttagtgagctcaagaggggccgcaat720acagcaggtgggagctctacatattacaacttggtcggggatgtagactcatacatcaga780aacaccgggcttactgcatttttcctaacactcaaatatggaatcaataccaagacgtca840gccctcgcactcagcagcctcacaggtgatatccaaaaaatgaaacagctcatgcgttta900tatcggatgaaaggtgaaaacgcaccatacatgacattgttaggtgacagtgaccagatg960agctttgcaccagctgagtatgcacaactttattcttttgccatgggcatggcatcagtc1020ttggataagggaactggcaagtaccaatttgccagggactttatgagcacatcattctgg1080agacttggagtagagtatgcccaggctcagggaagtagcatcaatgaggacatggctgct1140gagctaaaactaaccccggcagcaaggagaggcctggcagctgctgcccaacgagtatct1200gaagaaatcggcagcatggacattcctacccaacaagcgggagtcctcaccgggctcagt1260gacgaaggcccccgaaccccacagggcggatcaaacaagccgcaagggcaaccggatgcc1320ggggatggggagacccaattcttggattttatgagagcagtggcgaacagcatgcgggaa1380gcgccaaatccagcacagagcaccacccatccagagcctcccccaacccctggggcatcc1440caagacaacgacactgattggggatactga1470当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1