基于磁性荧光探针的食品大肠杆菌菌落可视化检测及自动化计数方法与流程
本发明属于微生物检测技术领域,具体涉及一种基于磁性荧光探针的食品大肠杆菌菌落可视化检测及自动化计数方法。
背景技术:
食品可通过不同的途径被大肠杆菌污染,在大肠杆菌的作用下,食品腐败变质,失去应有的营养成分,影响其食用性和安全性。人们在食用了大肠杆菌污染的食品后,可能导致肠道外感染、急性腹泻,引发痢疾、霍乱或者伤寒等疾病甚至是严重的败血症。它严重危害人类的公共卫生安全,是国际上公认的卫生监测指示菌。
现有检测大肠杆菌的技术主要包括传统的生化测定法、免疫分析法、和分子生物学法等。传统的生化测定法根据微生物生长的特性实现大肠杆菌的检测,该方法耗时长,易受生长环境的影响且准确率低。免疫分析法和分子生物学法存在重现性低且成本高等缺点。并且以上方法不能同时实现大肠杆菌的鉴别及计数。
菌落最可能数法和平板计数法是最常用的大肠杆菌计数法,但其操作复杂,耗时长,而且结果随机性比较大,如何实现其快速简易且准确检测大肠杆菌成为当前研究的难点。荧光传感技术因其灵敏度高、成本低,专一性强,受到了研究者的广泛关注;但尚未有应用到此领域的研究。因此,本研究将利用磁性荧光纳米探针结合传统的菌落平板计数法,以期实现大肠杆菌的快速和准确鉴别及计数。
技术实现要素:
为了克服现有技术存在的缺陷,本发明提供了一种操作简单且准确度高的大肠杆菌检测方法,能够缩短检测周期,简化检测步骤,提高检测的精度,实现自动化、可视化检测大肠杆菌的目的。
为了实现以上目的,本发明首先提供一种基于磁性荧光探针的食品大肠杆菌菌落可视化检测及自动化计数方法,具体包括以下步骤:
步骤1、磁性纳米微球Fe3O4@SiO2-cDNA的制备:六水氯化铁、三水合乙酸钠和柠檬酸三钠分别加入乙二醇中,40~60℃下磁力搅拌8~12h,将混合液转入到反应釜中,在180~200℃条件静置8~16h,得到反应的混合液,经去离子水和乙醇各洗涤3次,磁性分离得到的产物在50~70℃下真空干燥6~12h,即可得到Fe3O4纳米颗粒;所述六水氯化铁、三水合乙酸钠、柠檬酸三钠和乙二醇的用量比为100~10g:200~20g:20~2g:1L;
称取Fe3O4纳米颗粒溶解于乙醇和水的混合溶液中,超声震荡15min~60min形成均匀溶液,然后将氨水加入到混合液中,超声震荡30min~120min,最后将正硅酸乙酯加入到混合液中,超声震荡45min~120min,将得到的混合液经去离子水和乙醇各洗涤3次,磁性分离的产物在50~70℃真空干燥箱中干燥6~12h,即可得到Fe3O4@SiO2;所述Fe3O4、氨水、正硅酸乙酯、乙醇和水的用量比为4~20g:0.05~0.2L:0.01~0.1L:1~5L:1~2L;
将Fe3O4@SiO2加入到甲苯和氨丙基三甲氧基硅烷中,在100℃~150℃条件下搅拌20h~30h,将得到的混合液经去离子水和乙醇各洗涤3次,磁性分离的产物在50℃~70℃真空干燥箱中干燥5h~12h,即可得到Fe3O4@SiO2-NH2;所述Fe3O4@SiO2、甲苯和氨丙基三甲氧基硅烷加入的用量比为10~50g:5~15L:1~2L;
将羧基修饰的适配体互补链(cDNA)加入到1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS)混合液中,充分震荡15min~45min;随后将得到的Fe3O4@SiO2-NH2加入混合液中震荡2~8h;得到的产物经过磁性分离并经过多次洗涤,即可得到磁性纳米微球Fe3O4@SiO2-cDNA;
在Fe3O4@SiO2-cDNA中,Fe3O4粒径范围为50~200nm,SiO2厚度为10~50nm;EDC和NHS溶液的浓度为20mg/mL,且用量比为3:1~1;加入的适配体互补链的浓度范围比为15~35μmol/L;Fe3O4@SiO2-NH2和EDC/NHS溶液的用量比为0.5~0.2mg:1mL;羧基修饰的适配体互补链(cDNA)的序列为COOH-TTAGCAAAGT AGCGTGCACT TTTG;
步骤2、荧光碳量子点(aptamer-CQDs)的制备:将柠檬酸、浓硫酸和乙二醇混合搅拌后,置于微波炉中加热1~5min,获得碳量子点溶液(CQDs);碳量子点溶液经离心(8000~15000rpm,10~20min)、透析(透析袋截留分子量为1000KD)去除碳量子点溶液中的杂质,得到表面富含羧基的荧光碳量子点;将EDC/NHS混合液加入到荧光碳量子点溶液中搅拌10~20min,随后加入氨基修饰的大肠杆菌适配体(aptamer)并搅拌2~5h,得到特异性荧光碳量子点(aptamer-CQDs);
所述柠檬酸、浓硫酸、乙二醇的用量比为0.4~0.1g:0.5~0.05mL:1mL;所述EDC和NHC溶液的浓度均为20mg/L,EDC和NHC溶液的体积为(3~1):1;所述碳量子点溶液和EDC/NHC溶液的体积比为1~5:1~2;大肠杆菌适配体的浓度为15~35μmol/L,大肠杆菌适配体的序列为GCAATGGTACGGTACTT CCCCATGAGT GTT GTGAAAT GTT GGGACACTAG GTGGCATAGAGCCGCA AAAG TGCACG CTACTTTGC TAA-NH2;
步骤3、磁性荧光探针的制备:
将步骤1中得到的Fe3O4@SiO2-cDNA和步骤2中得到的aptamer-CQDs常温下混合孵育,磁性分离除去多余的Fe3O4@SiO2-cDNA,获得磁性荧光探针Fe3O4@SiO2-CQDs;
步骤4、食品中菌株菌落的培养:
在无菌条件下,食品样品预处理方法参照国标GB-4789.36-2016《食品安全国家标准食品微生物学检验大肠埃希氏菌O157:H7/NM检验》,得到了样品稀释匀液,并制备十倍递增系列稀释样品匀液,稀释梯度分别为10-(p+1),10-(p+2),10-(p+3),……,10-(p+i)(p为大于或等于零的整数,i为大于零的整数);然后对不同梯度的样品稀释匀液进行涂布平板培养,每个梯度接种n个固体培养基平板,每个平板加入菌液进行涂布,然后将平板倒置于一定环境中进行培养,培养后得到了不同稀释梯度的食品菌株菌落平板;
步骤5、大肠杆菌菌落的快速识别:
将步骤3中的磁性荧光探针加入到步骤4中的不同稀释梯度的食品菌株菌落平板中,静置一段时间;若菌落为大肠杆菌时,则大肠杆菌会与aptamer-CQDs结合,导致磁性荧光探针Fe3O4@SiO2-CQDs中的Fe3O4@SiO2-cDNA和aptamer-CQDs分离;若菌落不是大肠杆菌,Fe3O4@SiO2-cDNA和aptamer-CQDs不会分离,仍然以Fe3O4@SiO2-CQDs的形式存在;
将磁铁置于菌落平板的皿盖上方,可将分离的Fe3O4@SiO2-cDNA和残留的Fe3O4@SiO2-CQDs与菌落分离,此时的磁性纳米微球和磁性荧光探针会粘在培养皿盖内表面;将磁铁以及平板皿盖与平板皿底分离后,平板皿底放入便携式荧光成像仪中,获取稀释梯度为10-(p+1)的n个菌落平板的荧光平板图像P1-1、P1-2、P1-3、……、P1-n(n为大于零的整数);同理获取n个稀释梯度为10-(p+2)的荧光平板图像P2-1、P2-2、P2-3、……、P2-n,获取菌液稀释梯度为10-(p+3)的荧光平板图像P3-1、P3-2、P3-3、……、P3-n,……,获取稀释梯度为10-(p+i)的荧光平板图像Pi-1、Pi-2、Pi-3、……、Pi-n;总共得到了i×n个菌落荧光平板图像;此时,特异性荧光碳量子点(aptamer-CQDs)会吸附在大肠杆菌菌落上,使大肠杆菌的菌落显示荧光;同时aptamer-CQDs不会吸附在非大肠杆菌菌落上,非大肠杆菌菌落不显示荧光;由此,实现了大肠杆菌菌落的快速和可视化识别;
步骤6、食品中大肠杆菌菌落的自动计数:
(1)对步骤5获取的i×n个菌落荧光平板图像进行预处理,利用彩色图像滤波函数imfilter对菌落荧光平板图像进行线性滤波,去除图像中的噪声;
(2)阈值分割:提取预处理图像的蓝(B)通道分量图像,并将分量图像灰度化,获得B分量图像的阈值T;利用阈值T对大肠杆菌菌落进行分割,将高于阈值T的像素点定为1,低于阈值T的像素点定为0,得到了荧光平板菌落分割图像;
(3)荧光平板菌落计数:采用八邻域边缘跟踪法检测荧光平板菌落分割图像的菌落边缘,并利用连通区域计数法对大肠杆菌菌落计数;对得到的i×n个荧光平板菌落分割图像菌落计数(i和n为大于零的整数,i个稀释梯度,每个梯度n个重复),计算每个稀释梯度的大肠杆菌平均菌落数,稀释梯度为10-(p+1)的大肠杆菌平均菌落数记为N1,稀释梯度为10-(p+2)的大肠杆菌平均菌落数记为N2,稀释梯度为10-(p+3)的大肠杆菌平均菌落数为N3,……,稀释梯度为10-(p+i)的大肠杆菌平均菌落数为Ni,其中,p为大于或等于零的整数,i和n为大于零的整数,并根据计算公式进一步自动计算出食品中大肠杆菌菌落总数。
所述计算公式具体分为4种:
A、若只有一个稀释梯度(10-(p+k))平板的大肠杆菌菌落数在20~200CFU之间,则计数该稀释梯度菌落平板上的大肠杆菌菌落数,样品中的菌落数为C(CFU/mL)=Nk/(V×10-(p+k))(C为食品样品中的大肠杆菌菌落数,Nk为大肠杆菌菌落数,10-(p+k)为稀释梯度值,k为大于或等于零小于i的整数)。
B、若所有稀释梯度菌落平板的大肠杆菌菌落数都小于20CFU,即N1,N2,N3,……,Ni<20CFU,则计数最低稀释梯度菌落平板上的大肠杆菌菌落数,样品中的菌落数为C(CFU/mL)=N1/(V×10-(p+1))(C为食品样品中的大肠杆菌菌落数,N1为最低稀释梯度的大肠杆菌菌落数,10-(p+1)为最低稀释梯度值)。
C、若某一稀释梯度(10-(p+k))菌落平板的菌落数大于200CFU,但是下一梯度平板上没有大肠杆菌菌落,或者虽有大肠杆菌菌落但菌落数不在20~200CFU范围内,应计数该稀释梯度培养皿上的大肠杆菌菌落,食品样品中的菌落数为C(CFU/mL)=Nk/(V×10-(p+k))(C为食品样品中的大肠杆菌菌落数,Nk为大肠杆菌菌落数,10-(p+k)为稀释梯度值,k为大于或等于零小于i的整数)。
D、若有2个连续梯度(10-(p+k)和10-(p+k+1))菌落平板的菌落数均在20~200CFU之间,食品样品中的菌落数为C(CFU/mL)=(Nk+Nk+1)/(1.1V×10-(p+k))(C为食品样品中的大肠杆菌菌落数,Nk为低稀释梯度大肠杆菌菌落数,Nk+1为高稀释梯度大肠杆菌菌落数,1.1为计算系数,10-(p+k)为低稀释梯度的稀释梯度值,k为大于或等于零小于i的整数)。
优选的,步骤3所述的孵育时间为12~24h。
优选的,步骤3所述Fe3O4@SiO2-cDNA和aptamer-CQDs的体积比为(2~1):1。
优选的,步骤4所述的每个平板加入菌液的体积为0.1mL~1mL。
优选的,步骤4所述培养的温度为35~37℃,时间为10h~15h。
优选的,步骤5中所述磁性荧光探针的用量为1~5mL。
优选的,步骤5中所述静置的时间为10~20min。
本发明的有益技术效果在于:
(1)与单一的磁性纳米材料或者荧光材料相比,本发明制备了特异性的磁性荧光探针(Fe3O4@SiO2-CQDs),该荧光探针由磁性纳米微球Fe3O4@SiO2和荧光碳量子点复合形成;其中的Fe3O4@SiO2克服了Fe3O4磁性纳米颗粒易发生团聚和沉降以及生物相容性差等缺陷,提高了探针的水溶性和稳定性。其中的碳量子点生物相容性好,能够很好地与大肠杆菌菌落结合,该磁性荧光探针能够准确识别混合菌株平板中大肠杆菌菌落,且附着在大肠杆菌菌落表面使其显示荧光,实现大肠杆菌菌落的识别。
(2)与国标中大肠杆菌最可能数计数法相比,本发明基于荧光平板计数法,对获取的大肠杆菌菌落荧光平板图像进行处理来实现大肠杆菌的自动计数,从而能够实时、直观且准确跟踪了解食品样品中大肠杆菌的含量。
(3)与国标中的大肠杆菌平板计数法相比,该方法仅用最普通最常用的固体培养基,利用特异性的荧光探针定位大肠杆菌菌落,实现了大肠杆菌菌落荧光可视化检测;利用图像处理技术实现了菌落计数的自动化和智能化。另外,本发明可以从大量未知的菌株菌落中准确鉴别出大肠杆菌菌落,可避免使用一些鉴别性培养基,出现假阳性现象,达到更准确、更快速鉴别大肠杆菌的目的,实现自动化、可视化检测大肠杆菌的目的。
附图说明
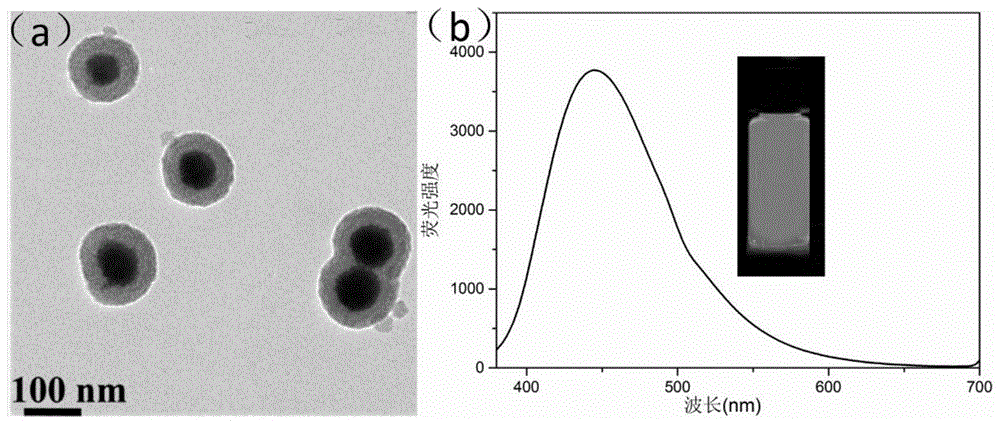
图1中(a)为磁性纳米微球的TEM图;(b)为磁性荧光探针的荧光光谱曲线,插图为磁性荧光探针在365nm激发光下的荧光图片。
图2为自然光下的菌落平板图像,图(a)、(b)、(c)、(d)和(e)的稀释梯度分别是10-1,10-2,10-3,10-4,10-5。
图3为添加磁性荧光探针后获取的菌落荧光平板图像,图(a)、(b)、(c)、(d)和(e)的稀释梯度分别是10-1,10-2,10-3,10-4,10-5。
图4中(a)、(b)、(c)、(d)和(e)分别是稀释梯度为10-1,10-2,10-3,10-4,和10-5的荧光平板菌落分割图像。
具体实施实例
下面结合附图具体实施方式对本发明作进一步详细说明,但本发明的保护范围并不限于此。
实施例1:
本发明首先固态培养牛奶中的菌株,获得菌株菌落平板;随后将制备的特异性磁性荧光探针加入菌落平板中,磁性分离出未与大肠杆菌反应的磁性荧光探针;接着获取大肠杆菌菌落荧光平板图像;最后图像处理实现大肠杆菌菌落自动计数。
步骤1、磁性纳米微球Fe3O4@SiO2-cDNA的制备:
1.08g六水氯化铁、1.8g三水合乙酸钠和0.25g柠檬酸三钠依次加入到50mL乙二醇中,40℃的条件下磁力搅拌9h,形成均匀透明的溶液后转入到反应釜中,在200℃条件静置10h,最后将得到的混合液经去离子水和乙醇各洗涤3次,磁性分离得到黑色的产物,60℃真空干燥10h,即可得到Fe3O4纳米颗粒粉末。称取0.1g Fe3O4加入到乙醇(40mL)和水(10mL)的混合溶液中,超声震荡30min,随后将1.2mL氨水加入到混合液中,超声震荡60min,最后将0.35mL正硅酸乙酯加入到混合液中,超声震荡60min,将得到的混合液经去离子水和乙醇各洗涤3次,磁性分离后得到黑色的产物在60℃下真空干燥8h,即可得到Fe3O4@SiO2。
将0.1g Fe3O4@SiO2加入到甲苯(50mL)和氨丙基三甲氧基硅烷(5mL)混合液中,在120℃条件下搅拌24h,将得到的混合液经去离子水和乙醇各洗涤3次,磁性分离后得到黑色的产物,60℃真空干燥箱中干燥8h,即可得到Fe3O4@SiO2-NH2。将羧基修饰的适配体互补链加入EDC/NHS混合液中(9mL)震荡25min,此时适配体互补链的浓度为20μM;随后将得到的Fe3O4@SiO2-NH2加入混合液中震荡4h。得到的产物经过磁性分离并多次洗涤,即可得到纳米微球Fe3O4@SiO2-cDNA溶液。适配体互补链的碱基序列为COOH-TTAGCAAAGT AGCGTGCACT TTTG。
通过透射电镜图(附图1a)可以看出Fe3O4纳米颗粒的平均直径为95nm,二氧化硅壳层的平均厚度为40nm,Fe3O4@SiO2-NH2-cDNA具有明显的核壳结构。该磁性纳米微球性质较单一磁性纳米颗粒Fe3O4稳定,因为二氧化硅壳层既能够阻止Fe3O4纳米颗粒团聚,而且能保护Fe3O4纳米颗粒在恶劣的环境下不被破坏。
步骤2、荧光碳量子点aptamer-CQDs的制备:
将2g柠檬酸、100μL浓硫酸和10mL聚乙二醇200搅拌混合后,置于微波炉中加热2min,得到的产物经离心(10000rpm,15min)去除不溶的颗粒,并透析(透析袋分子量为1000KD)除去没有反应的小分子,得到表面富含羧基的碳量子点。将碳量子点溶液(1mL)加入到EDC/NHS混合液(9mL)中搅拌15min,随后加入氨基修饰的适配体并搅拌3h,适配体最终浓度为20μM,最后得到适配体修饰的碳量子点溶液(aptamer-CQDs)。大肠杆菌适配体的序列为GCAATGGTACGGTACTT CCCCATGAGT GTT GTGAAATGTT GGGACACTAG GTGGCATAGAGCCGCA AAAG TGCACG CTACTTTGCTAA-NH2。
步骤3、磁性荧光探针的制备:
将步骤1中得到的1.2mL Fe3O4@SiO2-cDNA和步骤2中得到的1mL aptamer-CQDs混合孵育15h,通过磁性分离除去多余的aptamer-CQDs,获得高磁性荧光探针Fe3O4@SiO2-CQDs。由附图1b中可看出该磁性荧光探针具有优异的荧光特性,最佳发射波长为450nm,在365nm激发光激发下显示蓝色荧光。
步骤4、牛奶中菌株菌落的培养:
牛奶样品过滤和稀释等预处理步骤按照GB4789.36-2016《食品安全国家标准食品微生物学检验大肠埃希氏菌O157:H7/NM检验》进行。在无菌条件下,取25mL牛奶置盛有225mL生理盐水的无菌锥形瓶中,然后将样品溶液放入高速分散机中进行分散,充分混匀,过滤离心后样品滤液,并且将样品滤液依次制成十倍递增系列稀释样品匀液,得到的样品稀释梯度分别为10-1,10-2,10-3,10-4,和10-5。每个梯度接种1mL样品匀液至1个普通固体培养基中,涂布均匀,倒置于36±1℃培养12h,得到了牛奶菌株的5个菌落平板,获取在自然光下菌落平板图像(附图2),附图2中的(a)、(b)、(c)、(d)和(e)分别是接种了稀释梯度为10-1,10-2,10-3,10-4,和10-5样品菌液的菌落平板图像。从附图2中可以看出大肠杆菌菌落与其他菌株菌落类似,无法识别大肠杆菌菌落。
步骤5、大肠杆菌菌落的快速识别:
将2mL磁性荧光探针加入到步骤4中的菌落平板中,静置15min。若菌落为大肠杆菌,则菌落会与aptamer-CQDs结合,导致Fe3O4@SiO2和aptamer-CQDs分离;若菌落不是大肠杆菌菌落,Fe3O4@SiO2和aptamer-CQDs不会分离,仍然是以Fe3O4@SiO2-CQDs的形式存在。将磁铁置于培养皿盖上方,可将分离的磁性纳米材料Fe3O4@SiO2-cDNA和残留的Fe3O4@SiO2-CQDs与菌落平板分离,并附着在培养皿盖内表面。将磁铁以及平板皿盖与平板皿底分离后,将平板皿底放入便携式荧光成像仪中,获取菌落荧光平板图像(附图3)。附图3中的(a)、(b)、(c)、(d)和(e)分别是接种了稀释梯度为10-1,10-2,10-3,10-4,和10-5样品菌液的菌落荧光平板图像。从附图3可看出,荧光碳量子点(aptamer-CQDs)会残留在大肠杆菌菌落上,使大肠杆菌的菌落显示蓝色的荧光;而aptamer-CQDs不会残留在非大肠杆菌菌落上,其他的菌落不显示荧光。由此,实现了大肠杆菌菌落的识别。
步骤6、牛奶中大肠杆菌菌落荧光平板计数:
通过图像处理工具对荧光平板中的大肠杆菌菌落进行自动计数,软件中的计数步骤主要包括:
(1)图像的预处理:利用彩色图像滤波函数imfilter对步骤5中的5个荧光平板图像进行滤波,去除图像中的噪声;
(2)阈值分割:提取预处理后荧光平板图像的蓝(B)通道分量图像,并将分量图像彩色图像灰度化,选取荧光平板图像的分割阈值为0.3。利用阈值0.3对大肠杆菌菌落进行分割,将高于阈值的像素点定为1,低于阈值的像素点定为0,由此得到了荧光平板菌落分割图像(附图4)。附图4(a)、(b)、(c)、(d)和(e)分别是稀释梯度为10-1,10-2,10-3,10-4,和10-5的荧光平板菌落分割图像;
(3)菌落计数:对步骤6(2)中得到的5个荧光平板菌落分割图像进行菌落计数,菌落计数采用八邻域边缘跟踪法检测菌落边缘并利用连通区域计数法对大肠杆菌菌落计数。本发明的荧光平板计数步骤首先是利用荧光成像技术获取荧光平板图像,输入计算机,然后利用计算机自动计数软件对荧光平板图像进行图像预处理、图像分割以及图像中菌落计数,并计算每个梯度的大肠杆菌平均菌落数,得到以下结果:
表1每个稀释度的平板中菌落数计数结果
(4)牛奶中大肠杆菌荧光平板计数
荧光平板中大肠杆菌计数符合第四种情况,即有2个连续梯度的平板中大肠杆菌菌落均在20~200CFU之间,按式C(CFU/mL)=(Nk+Nk+1)/(1.1V×10-(p+k))计算(C为牛奶样品中的大肠杆菌菌落数,Nk为低稀释度大肠杆菌菌落总数,Nk+1为高稀释度大肠杆菌菌落总数,1.1为计算系数,10-(p+k)为低稀释度的稀释度),则牛奶中的大肠杆菌数为7×103CFU/mL。国标法中大肠杆菌平板计数法得到菌落数为6×103CFU/mL。结果发现本发明的方法与标准方法一致,表明本发明的可靠性。
国标法中平板计数法首先是挑选典型和可疑的菌落,并挑选一部分疑似大肠杆菌菌落于肉汤管中,观察产气情况。若肉汤管产气,则可报告该菌落为大肠杆菌阳性,根据大肠杆菌肉汤管中的阳性管数,得到大肠杆菌数。由于传统的大肠杆菌平板计数法随机性大且受环境的影响大,菌落计数结果普遍偏低,且检测时还需要再次培养证实是否为大肠杆菌。与传统的相比,本发明的方法操作简单,无须证实试验,能够快速、准确及自动化检测大肠杆菌数。
图1(a)为磁性纳米微球的TEM图;(b)为磁性荧光探针的荧光光谱曲线,插图为磁性荧光探针在365nm激发光激发下的荧光图片。由图可以看出本发明成功制备了磁性荧光纳米探针,且磁性荧光探针显示强烈的蓝色荧光。
图2为自然光下的菌落平板图像。由图可以看出该平板为食品中多种菌株菌落的混合,通过肉眼无法判断菌落是否为大肠杆菌菌落,无法实现大肠杆菌计数的目的。
图3为添加磁性荧光探针后获取的菌落荧光平板图像;该平板中大肠杆菌菌落显示蓝色的荧光,非大肠杆菌菌落则不显示荧光,说明磁性荧光探针能够特异性识别大肠杆菌菌落,利用肉眼能够从混合菌落平板中辨别出大肠杆菌菌落。
图4是荧光平板菌落分割图像。该图像中白色的区域为大肠杆菌菌落,黑色的为背景,利用荧光平板图像的特点能够快速且准确分割出大肠杆菌菌落,实现大肠杆菌快速、准确计数的目的。
说明:以上实施例仅用以说明本发明而并非限制本发明所描述的技术方案;因此,尽管本说明书参照上述的各个实施例对本发明已进行了详细的说明,但是本领域的普通技术人员应当理解,仍然可以对本发明进行修改或等同替换;而一切不脱离本发明的精神和范围的技术方案及其改进,其均应涵盖在本发明的权利要求范围内。
- 还没有人留言评论。精彩留言会获得点赞!