一种测定肺表面活性物质蛋白的方法及其应用与流程
本发明涉及生物检测领域,具体涉及无需繁琐的分离制备等过程而直接检测肺表面活性物质蛋白的方法。
背景技术:
肺表面活性物质(pulmonarysurfactant,ps)是肺泡ⅱ型细胞分泌的磷脂蛋白复合物。ps具有降低肺泡气液界面表面张力,防止肺不张和肺水肿,保持肺泡稳定,参与肺的防御功能等重要作用。ps的组成包括约90%的脂类和10%的蛋白,其中与ps生理功能有关的蛋白主要有四种肺表面活性相关蛋白(surfactant-associatedproteins,sp),亲水性的sp-a、sp-d和疏水性的sp-b、sp-c。四种sp蛋白在ps的功能活性中具有重要意义。
在支气管肺泡灌洗液(balf)的蛋白中,也含有20%左右的sp[hammh,kroegelc,hohlfeldj.surfactant:areviewofitsfunctionsandrelevanceinadultrespiratorydisorders.respirmed1996;90:251–270],其中亲水性蛋白sp-a最多,占总sp蛋白的90%,亲水性sp-d占2–5%,疏水性蛋白sp-b和sp-c共计5%。sp-a、sp-d与表面活性脂质有关,在免疫调节及脂质代谢等方面起重要作用,但不具有降低表面张力的作用;sp-b、sp-c则与磷脂一起协同作用,直接参与ps的生理功能(kaushiknag,lungsurfactantsfunctionanddisorder,由taylor&francisgroup出版,2005年)。
肺表面活性物质制剂是指牛、猪或其他哺乳动物的肺灌洗液或全肺匀浆提取液,经分离、提取、纯化得到的磷脂蛋白复合物,组成以磷脂为主,仅含有少量疏水性蛋白sp-b和sp-c,是治疗早产儿呼吸窘迫综合征(neonatalrespiratorydistresssyndrome,nrds)的重要急救药,已在全球大多数国家和地区应用,自上市以来早产儿死亡率下降一半以上。
在现有技术中,测定或鉴定肺表面活性物质相关蛋白必须首先将肺表面活性物质相关蛋白与磷脂分开,然后才能进行测定;或者需要使用相应抗体采用蛋白质印迹法才能分离鉴定肺表面活性物质相关蛋白。
磷脂与表面活性蛋白之间存在相互作用从而相互干扰并影响测定结果,因此测定肺表面活性蛋白的重点和难点是破坏磷脂-蛋白间的作用力,以达到准确测定磷脂组分或蛋白组分的目的。现有测定肺表面活性物质蛋白的文献和技术包括葡聚糖凝胶渗透层析法、固相萃取法、正相/反相高效液相色谱法等。上述方法中对于疏水的小分子蛋白sp-b、sp-c均需要采用将蛋白与磷脂分离的方式,才能准确测定各肺表面活性物质蛋白成分(董声焕主编:肺表面活性物质基础与临床,第九章肺表面活性物质的检测,人民军医出版社)。现有文献报道通过pag,8–16%,蛋白质印迹检测获得羊肺的亲水的大分子蛋白sp-a、sp-d(tatjanalazic,etal.,effectsofnicotineonpulmonarysurfactantproteinsaanddinovinelungepithelia,pediatrpulmonol.2010march;45(3):255–262)。上述两种方法均不能直接通过电泳技术分离鉴定各肺表面活性物质蛋白。
现有技术中的肺表面活性物质蛋白的分析测定存在如下问题:
鉴定肺表面活性物质蛋白之前需要采用繁琐的分离方法,将蛋白组分与磷脂组分分开,才能进行后续各肺表面活性物质蛋白的检测,特别是对于疏水的小分子蛋白sp-c、sp-b,由于其具有分子量小、疏水性强、与磷脂双分子层相互作用等特点很难通过直接电泳获得。
现有测定肺表面活性蛋白的方法和技术存在如下缺陷:试验流程长;对实验仪器要求高且分离过程中均使用对环境及操作人员不利的甲醇、氯仿等有机溶剂,而且分离操作可能会导致蛋白成分的丢失,影响后续测定的准确性。
技术实现要素:
为了解决上述技术问题或克服上述缺陷,本发明采用独特的样品处理手段和适宜的电泳技术,能够不经磷脂-蛋白分离直接测定样品中的四种肺表面活性物质蛋白,解决了现有文献和技术中必须先将蛋白与磷脂分开再进行分析测定的技术难题。
本发明涉及测定肺表面活性物质、尤其是哺乳动物的肺表面活性物质相关蛋白的新技术、新方法及其应用。更具体地说,是一种不需要分离制备等繁琐过程,能够直接测定肺表面活性物质制剂(或肺功能研究样品)及其制备过程起始物料、中间体中的肺表面活性物质相关蛋白sp-a、sp-b、sp-c、sp-d的电泳技术和方法,本方法采用独特的样品处理手段和适宜的电泳技术,能够不经磷脂-蛋白分离,而直接分离、测定样品中的四种肺表面活性物质相关蛋白,解决了现有技术中必须先将肺表面活性物质相关蛋白与磷脂分开才能进行测定、或采用蛋白质印迹法才能分离鉴定sp蛋白的技术难题。
本发明提供了一种能够直接测定肺表面活性物质(尤其是哺乳动物的肺表面活性物质)制剂及其制备过程的起始物料(例如支气管肺泡灌洗液balf)、中间体中的肺表面活性物质蛋白sp-a、sp-b、sp-c、sp-d的电泳技术和方法。本发明的方法能够不经磷脂-蛋白分离、也不需采用蛋白质印迹技术,能够直接分析检测样品中的四种肺表面活性物质蛋白,解决了现有文献中必须先将蛋白与磷脂分开再进行测定的技术难题。本发明的方法也可用于肺功能样品的检测。
在一个方面,本发明的检测方法所涉及的样品是与肺表面活性物质相关的样品,其包括肺表面活性物质制剂,也包括制备肺表面活性物质制剂过程的起始物料(例如支气管肺泡灌洗液balf)、中间体,还包括肺功能研究样品。
在另一个方面,本发明涉及的四种肺表面活性蛋白来自哺乳动物如牛肺灌洗液,其中亲水的大分子蛋白sp-a、sp-d分子量分别约为24kda、35kda;疏水的小分子蛋白sp-b、sp-c分子量分别约为8.7kda、3.5kda(http://www.ncbi.nlm.nih.gov/protein)。
在一个实施方案中,本发明测定四种肺表面活性蛋白的方法包括如下步骤:
1.样品处理
a.肺表面活性提取物样品、肺表面活性物质制剂样品:将样品配制为原料药浓度为5~10mg/ml的混悬液,量取0.5~2ml混悬液,加入0.2ml~1ml的浓度为0.1~1m的二硫苏糖醇(dtt),再加入质量百分浓度为2%~10%的十二烷基硫酸钠(sds)溶液1~4ml,其中sds在原料、制剂样品处理混合液中的最终浓度约2~5%,混匀,煮沸10min~40min,以不低于10,000rpm的转速或离心力不低于28,000g、在5℃~25℃离心10min~30min,取上清液备用;
b.起始物料样品、中间体样品及肺功能样品:取1~10ml样品(起始物料样品、中间体样品或肺功能样品),加入0.1m-1m浓度的二硫苏糖醇(dtt)溶液0.01~1ml,再加入质量百分浓度为2%~10%的十二烷基硫酸钠(sds)溶液0.1~10ml,其中sds在灌洗液、浓缩灌洗液样品处理混合液中的最终浓度约2~5%,sds在起始物料样品、中间体样品及肺功能样品处理混合液中的最终浓度为2%~5%,混匀,煮沸10min~40min,以不低于10,000rpm的转速或离心力不低于25,000g,在5℃~25℃离心10min~30min,取上清液备用;
2.点样
a.取出预制胶(浓度不低于16%的tricineproteingels,赛默飞),按操作要求放置于电泳槽,加电泳缓冲液;
b.经上述方法处理后的样品0.1~2μl,可根据样品总蛋白的测定结果预试验电泳几个邻近浓度梯度样品,再根据电泳结果选择最优浓度进行电泳,加入5μl上样缓冲液,补水,3,000~5,000rpm离心5min,点样;
c.将蛋白标准品室温放置几分钟至溶解,点样5μl。
3.电泳
恒压125v,电泳分离80~95min。
4.银染
电泳结束,取出凝胶,按银染试剂盒操作要求,经固定、致敏、水洗、银染、水洗、终止等步骤,得到清晰的电泳条带。
5.鉴别
切下蛋白胶上的目的条带,用胶内胰蛋白酶(由中科院蛋白质科学中心提供)酶解,所得肽段混合物经液相色谱-质谱分析,然后使用proteindiscover1.4基于uniprot-bovine.fasta.gz数据库进行检索和蛋白条带鉴定(本鉴别是在中科院蛋白质科学中心进行的)。
其中,sds溶液的配制方法为按质量体积百分比w/v%配制10%的sds溶液,分别取10%的sds溶液稀释制得8%的sds、6%的sds、4%的sds、2%的sds。
工作浓度是指经过优化筛选适宜处理本文中样品的最优浓度(即表面活性剂在供试品溶液中的质量/体积百分比)。
本发明测定或鉴别四种肺表面活性蛋白的方法涉及聚丙烯酰氨凝胶电泳的使用。
聚丙烯酰胺凝胶电泳(page)是以聚丙烯酰胺为支持介质的电泳,分离以分子大小和净电荷数为基础,适合分离电泳淌度相近的大分子。根据需要,丙烯酰胺能够原位聚合成具有不同孔径的聚丙烯酰胺凝胶。聚丙烯酰胺凝胶的特性是机械强度好,不带电荷,不产生电渗,焦耳热低,分离过程扩散小,具化学惰性。因此,聚丙烯酰胺凝胶广泛适用于蛋白质、核酸等生物大分子进行分离、制备、定性、定量以及相对分子量测定等。
聚丙烯酰胺凝胶电泳使用的凝胶浓度、孔径和分级范围如下:
对于相对分子量更大的分子,可以采用孔径更大的凝胶,如聚丙烯酰胺与琼脂糖的混合胶,或纯琼脂糖凝胶。
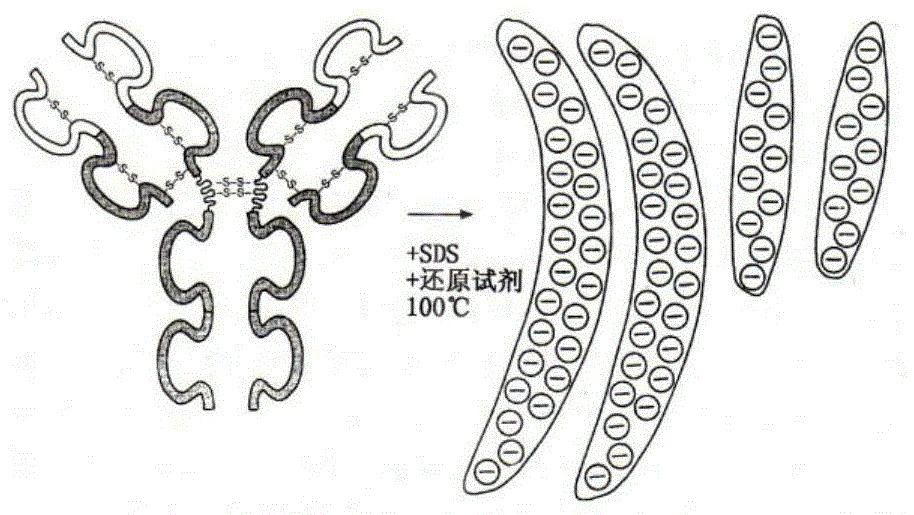
变性聚丙烯酰胺凝胶电泳(例如十二烷基硫酸钠聚丙烯酰胺凝胶电泳sds-page)是在样品介质和聚丙烯酰胺凝胶中加入离子表面活性剂(例如十二烷基硫酸钠sds)和强还原剂(巯基乙醇、二硫苏糖醇)后,使分子内和分子间的氢键断裂,使分子去折叠,破坏了蛋白质分子的二级和三级结构,形成sds-蛋白质复合物(参见图1)。
表面活性剂sds以一定比例与蛋白质结合形成sds-蛋白质复合物,使蛋白质分子带有大量的负电荷,超过其本身所带电荷,从而使各天然蛋白质分子间的电荷差别下降,甚至消除;同时蛋白质的结构也发生变化,变得松散,形状趋于一致。
变性聚丙烯酰胺凝胶电泳消除了电泳过程中分子电荷和形状的影响,使得迁移率的差异仅是复合物分子质量差异的反映。蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小,而电荷因素可被忽略。据此可测蛋白质分子量大小和亚基组成。
各种sds-蛋白质复合物在电泳时的迁移率差异仅仅是分子质量差异的反映。可以根据蛋白质分子在变性聚丙烯酰胺凝胶电泳中的迁移率测定分子量。
因此,在一个方面,本发明提供了检测哺乳动物肺表面活性物质样品中sp-a、sp-b、sp-c、sp-d的方法,所述方法包括使用离子表面活性剂和还原剂处理样品的步骤,其中向样品中加入质量体积百分比为2%~10%、优选2%~5%的离子表面活性剂。
在本发明所述方法的一个实施方案中,其中所述离子表面活性剂包括阴离子表面活性剂。
在本发明所述方法的另一个实施方案中,其中所述阴离子表面活性剂包括十二烷基硫酸钠sds。
在本发明所述方法的又一个实施方案中,其中所述还原剂包括选自巯基乙醇和二硫苏糖醇的还原剂。
在本发明所述方法的另一个实施方案中,其中处理样品的步骤还包括加入非离子表面活性剂。
在本发明所述方法的又一个实施方案中,其中所述非离子表面活性剂选自吐温和泊洛沙姆,其中所述吐温优选包括吐温80。
在本发明所述方法的又一个实施方案中,其中处理样品的步骤还包括以转速10,000rpm~20000rpm、优选15000~18000rpm,或离心力25,000g~50000g、优选30000~45000g进行离心。
在本发明所述方法的另一个实施方案中,还包括直接采用电泳测定样品中的四种肺表面活性物质相关蛋白中的任一种。
在本发明所述方法的又一个实施方案中,其中所述电泳包括聚丙烯酰胺凝胶电泳;任选地,电泳所用聚丙烯酰胺凝胶的浓度不低于16%。
在另一个方面,本发明提供了离子表面活性剂在制备用于检测哺乳动物肺表面活性物质样品中sp-a、sp-b、sp-c、sp-d的试剂盒中的用途,其中所述检测包括使用离子表面活性剂和还原剂处理样品的步骤,其中所述离子表面活性剂的工作浓度任选质量体积百分比为2%~10%的浓度;任选地,所述离子表面活性剂包括阴离子表面活性剂;任选地,所述阴离子表面活性剂包括十二烷基硫酸钠sds。
在又一个方面,本发明提供了试剂盒,其包含离子表面活性剂,所述离子表面活性剂用于检测哺乳动物肺表面活性物质样品中sp-a、sp-b、sp-c、sp-d,其中所述离子表面活性剂的工作浓度任选质量体积百分比为2%~10%的浓度;任选地,所述离子表面活性剂包括阴离子表面活性剂;任选地,所述阴离子表面活性剂包括十二烷基硫酸钠sds。
在本发明的样品处理方法中,加入了表面活性剂。表面活性剂的作用有三:第一点是帮助蛋白离子化,去除离子化对迁移的影响;第二点是帮助蛋白解聚,高级结构的蛋白解聚成低级结构,形成单一肽链;更重要的是第三点,本发明人发现表面活性剂的加入能够帮助不溶于水的疏水性蛋白成分如sp-b、sp-c混悬于测试溶液中,而且能够消弭磷脂的干扰。
本发明的方法优势1:既适合哺乳动物肺灌洗液样品(蛋白含量高),更适用于提纯的ps样品,尤其是总蛋白低于10%(甚至低于5%)的ps样品,本发明的方法优势更强;
本发明的方法优势2:本发明人筛选确定的方法不仅能够测定大分子、水溶性肺表面活性物质蛋白如sp-a、sp-d,更适合测定含量低的小分子疏水性肺表面活性物质蛋白sp-b、sp-c;
本发明的方法优势3:本发明人对sds浓度进行了筛选,确定了最佳工作浓度(即表面活性剂在供试品溶液中的质量/体积百分比)为2%~10%,其高于现有技术文献中常用的1%。值得说明的是,现有技术中并没有采用sds用于直接电泳分离和/或准确测定样品中的四种肺表面活性物质相关蛋白。
除了sds和dtt等常规电泳试剂的应用,本发明人还加入了1~10%浓度的其他表面活性剂如吐温80、泊洛沙姆等,协助肺表面活性物质蛋白尤其是疏水性不溶于水的小分子蛋白sp-b、sp-c在测试溶液中的溶解,并消除磷脂对蛋白电泳结果的影响。
本发明人发现,样品来源不同,样品的总蛋白含量不同,这对于蛋白电泳试验结果影响较大;尤其是对于蛋白含量本身很低的疏水性小分子蛋白sp-b、sp-c影响更大。例如,在肺灌洗液中总磷脂和总蛋白的浓度相当;且在其中的肺表面活性物质蛋白(四种sp)中,大分子的亲水性蛋白sp-a最多,占总sp蛋白的90%,亲水性蛋白sp-d占2–5%,而疏水性小分子蛋白sp-b和sp-c共计5%。由于sp-b和sp-c的分子量小、含量少、疏水性强等特点,其与磷脂通过分子间相互作用,互相影响各自的测定,很难直接电泳分离。同样,在提纯的肺表面活性物质中,总磷脂含量中80%~90%且多数是疏水性强的磷脂,而总蛋白含量更低,约2-5%,其中主要是小分子疏水性蛋白sp-b和sp-c,磷脂对sp-b和sp-c的分离、测定影响很大,极难分离得到这两种蛋白。在现有技术中未见直接采用电泳技术得到这两种蛋白的清晰条带的报道。
本发明解决其技术问题所采用的技术方案是:采用独特的样品处理手段,经筛选表面活性剂浓度、离心条件、处理温度时间等样品处理手段,经筛选凝胶浓度、银染条件等电泳参数,消除了样品中磷脂对蛋白的影响,形成带有大量的负电荷的sds-蛋白质复合物,该复合物在电泳时的迁移率差异仅仅是分子质量差异的反映。这样经过预处理的样品能够不经磷脂-蛋白分离,而直接采用筛选的电泳条件进行分离,从而能够准确测定样品中的四种肺表面活性物质相关蛋白,解决了现有技术中必须先将蛋白与磷脂分开、再进行测定并且测量不准确的技术难题。
本发明的有益效果是:试验周期短,试验流程简单可控,避免有机溶剂等高污染试剂的使用,同时,避免了分离操作可能会导致的蛋白成分丢失。采用本发明技术测定肺表面活性物质及肺功能样品中的肺表面活性物质相关蛋白,结果更为直观、可靠,提高了测定结果的准确性和精确度。
附图说明
图1为蛋白在100℃用sds和还原剂处理后解聚成亚基的示意图。
图2为常规方法与本发明方法测定牛肺表面活性物质制剂样品的凝胶电泳图,图中泳道1、4为标准分子量蛋白,泳道2、3为经常规方法处理的牛肺表面活性物质样品凝胶电泳图谱,泳道5、6为经本发明方法处理的牛肺表面活性物质样品的凝胶电泳图谱。图中可见,常规方法电泳结果不清晰,各条带间拖尾严重,不能得到清晰的蛋白(或肽段)条带,而采用本发明方法可得到清晰、界限分明的电泳条带。
图2中泳道1、2、3用12%bis-tris预制胶电泳分离、银染;泳道4、5、6用16%tricine预制胶电泳分离、银染;不同的凝胶体系对应分离的蛋白区间大小不同,故对应的标准蛋白不同。由于sp-c、sp-b为小分子蛋白,相对含量低,必须通过浓度不低于16%的凝胶电泳分离、银染才能得到清晰的条带。
图3为本发明方法测定牛肺表面活性物质制剂的凝胶电泳图(条带经序列鉴定)。蛋白sp-b存在二聚体、三聚体等多聚体形式,经dtt还原处理,出现三条带。
图4为本发明方法测定支气管肺泡浓缩灌洗液的凝胶电泳图。蛋白sp-a、sp-b、sp-d均有多聚体形式存在,且经dtt还原处理。
图5为本发明方法测定支气管肺泡灌洗液的凝胶电泳图。
图6为蛋白sp-b和sp-c与脂质的相互作用的图。
图7为对比例供试品蛋白凝胶电泳图。
具体实施方式
为了促进对本发明的理解,以下将参考某些实施方式,并且将使用特定语言来描述本发明。然而,应当理解的是,这些具体实施方式不意图限制本发明的范围。所描述的实施方式中的任何改变和进一步的修改,以及本发明的任何进一步应用,均为本领域技术人员通常会想到的。
下述实施例中所述试验方法,如无特别说明,均为常规方法;所述试剂和生物材料,如无特别说明,均可从商业途径获得。
下述实施例中,所述百分含量如无特别说明,均为质量百分含量。
下述实施例对本发明的具体实施做进一步说明,但并不仅限于此实施例。
实施例1
1、供试品
本实施例采用的供试品为华润双鹤药业自制的牛肺表面活性提取物(即肺表面活性物质制剂),批号170922d、gx0924d。
2、供试品上清液的制备
称量牛肺表面活性提取物,配制10mg/ml浓度(原料药浓度(磷脂蛋白总浓度))的供试品溶液,取1ml供试品溶液,加入0.5m浓度的dtt(sigma-aldrichpcode1001992646)0.2ml,再加入质量百分比为4%的sds(sigma-aldrichpcode1002357998)溶液2ml(sds在供试品溶液中质量百分比约为2.5%),混匀,煮沸20min,以不低于10,000rpm的转速或离心力不低于25,000g离心20min(sorvallrc5c落地离心机,转子ss-34),取上清液备用,由此得到供试品上清液;
3、电泳
3.1蛋白标准品:spectratmmulticolorlowrangeproteinladder(26628)(thermoscientifictm)。
3.2电泳条件(thermoscientifictm):
预制胶:novextm16%tricineproteingels,1.0mm,12-well(ec66952box)(thermoscientifictm);
上样缓冲液:
还原剂:
电泳缓冲液:
3.3点样:
取出预制胶,撕掉一端的白色封口胶,取出另一端的梳齿;将预制胶放置于电泳槽,加电泳缓冲液(lc1675稀释10倍);取供试品上清液2μl,加入5μl上样缓冲液(lc1676),补水至10μl,5,000rpm离心5min,点样;
将蛋白标准品室温放置几分钟至溶解,点样5μl。
3.4电泳:
设置电泳参数,恒压125v,电泳分离80~95min。
3.5银染:
使用
1)固定:配制固定液:100ml纯水+100ml甲醇+20ml乙酸,取200ml固定液固定凝胶10min;
2)致敏:配制致敏液:105ml纯水+100ml甲醇+5mlsensitizer(来自
3)水洗:取200ml纯水将凝胶洗涤2次,每次5min;
4)银染:配制银染液:stainera(来自
5)水洗:200ml双蒸水洗2次,每次5min;
6)延展:配制延展液:5mldeveloper(来自
7)终止:直接加入5mlstopper(来自
8)水洗:200ml纯水洗3次,每次10min。
4、鉴别
将上述蛋白胶上的目的条带切下,用胶内胰蛋白酶(由中科院蛋白质科学中心提供)酶解,所得肽段混合物经液相色谱-质谱分析,然后使用proteindiscover1.4基于uniprot-bovine.fasta.gz数据库进行检索和蛋白条带鉴定(本鉴别是在中科院蛋白质科学中心进行的)。
5、结果分析
实施例1中牛肺表面活性提取物蛋白凝胶电泳图及鉴定结果见图3:其中泳道1为标准分子量蛋白,泳道2为170922d批牛肺表面活性提取物,泳道3为gx0924d批牛肺表面活性提取物;蛋白条带由下至上第一条带为蛋白sp-c,第二条带为蛋白sp-b,第四条带为蛋白sp-b的二聚体,均与牛肺表面活性蛋白的理论分子量一致;由于本案方法未进行脱脂,故第三条带可能是蛋白sp-b单体与磷脂分子相结合的物质。蛋白sp-b和sp-c与脂质的相互作用见图6(parrae,perez-gilj.composition,structureandmechanicalpropertiesdefineperformanceofpulmonarysurfactantmembranesandfilms.chemistryandphysicsoflipids.2015;185:153-75.doi:10.1016/j.chemphyslip.2014.09.002.pubmedpmid:25260665)。蛋白sp-b的氨基酸组成,碱性氨基酸多,净正电荷较多,易与酸性磷脂如磷脂酰丝氨酸(phosphatidylserine,ps)、双分子层或单分子层中的磷脂酰甘油(phosphatidylglycerol,pg)、磷脂酰肌醇(phosphatidylinositol,pi)发生相互作用;含有多个半胱氨酸,形成二硫键,易与极性脂质分子发生相互作用。
如图所示,图3中牛肺表面活性物质制剂因经过提取,其中的表面活性蛋白sp-c浓度高,故经凝胶电泳获得该目标条带并经鉴别确定。
实施例2
1、供试品
本实施例采用的供试品为华润双鹤药业自制的牛肺支气管肺泡浓缩灌洗液,批号160701a-05。
2、供试品上清液的制备
取浓缩灌洗液1.2ml,加入0.5m浓度的dtt(sigma-aldrichpcode1001992646)溶液0.2ml,加入4%(质量百分比)浓度的sds(sigma-aldrichpcode1002357998,sds在供试品溶液中质量百分比约为2.2%)溶液1.75ml,混匀,煮沸20min,以不低于10,000rpm的转速或离心力不低于25,000g离心20min(sorvallrc5c落地离心机,转子ss-34),取上清液备用,由此得到供试品上清液;
3、电泳
3.1蛋白标准品:spectratmmulticolorlowrangeproteinladder(26628)(thermoscientifictm)。
3.2电泳条件(thermoscientifictm):
预制胶:novextm16%tricineproteingels,1.0mm,12-well(ec66952box);
上样缓冲液:
还原剂:
电泳缓冲液:
3.3点样:
取出预制胶,撕掉一端的白色封口胶,取出另一端的梳齿;将预制胶放置于电泳槽,加电泳缓冲液(lc1675稀释10倍);取供试品上清液0.5μl,加入5μl上样缓冲液(lc1676),补水至10μl,5,000rpm离心5min,点样;
蛋白标准品:室温放置几分钟至溶解,点样5μl。
3.4电泳:
设置电泳参数,恒压125v,电泳分离80~95min。
3.5银染:
使用
1)固定:配制固定液100ml纯水+100ml甲醇+20ml乙酸,200ml固定10min;
2)致敏:配制致敏液105ml纯水+100ml甲醇+5mlsensitizer,100ml致敏30min,重复致敏一次;
3)水洗:200ml双蒸水洗2次,每次5min;
4)银染:配制银染液stainera5ml+stainerb5ml+90ml纯水,100ml银染15min;
5)水洗:200ml双蒸水洗2次,每次5min;
6)延展:配制延展液5mldeveloper+95ml纯水,100ml延展3至15min;
7)终止:直接加入5mlstopper终止10min;
8)水洗:200ml双蒸水洗3次,每次10min。
4、鉴别
将上述蛋白胶上的目的条带切下,用胶内胰蛋白酶(由中科院蛋白质科学中心提供)酶解,所得肽段混合物经液相色谱-质谱分析,然后使用proteindiscover1.4基于uniprot-bovine.fasta.gz数据库进行检索和蛋白条带鉴定(本鉴别是在中科院蛋白质科学中心进行的)。
5、结果分析
实施例2中牛肺支气管肺泡浓缩灌洗液蛋白凝胶电泳图及鉴定结果见图4:其中泳道1为标准分子量蛋白,泳道2、3为牛肺支气管肺泡浓缩灌洗液;由于支气管肺泡浓缩灌洗液表面活性蛋白sp-c浓度较低,且电泳载样量有限,故没有获得清晰的表面活性蛋白sp-c条带。蛋白条带由下至上第一条带为蛋白sp-b,第三条带为sp-b的二聚体,第四条带为sp-b的三聚体及sp-a,均与牛肺表面活性蛋白的理论分子量一致;由于本案方法未进行脱脂,故第二条带可能是sp-b单体与磷脂分子相结合的物质;第五条带可能是sp-a与磷脂作用的复合体;第六条带可能是sp-a、sp-d分别与磷脂作用的复合体。
实施例3
1、供试品
本实施例采用的供试品为华润双鹤药业自制的牛肺支气管肺泡灌洗液,批号160701a-03。
2、供试品上清液的制备
取灌洗液1.2ml,加入0.5m浓度的dtt(sigma-aldrichpcode1001992646)溶液0.2ml,加入4%(质量百分比)浓度的sds(sigma-aldrichpcode1002357998,sds在供试品溶液中质量百分比约为2.2%)溶液1.75ml,混匀,煮沸20min,以不低于10,000rpm的转速或离心力不低于25,000g离心20min(sorvallrc5c落地离心机,转子ss-34),取上清液备用,由此得到供试品上清液;
3、电泳
3.1蛋白标准品:spectratmmulticolorlowrangeproteinladder(26628)(thermoscientifictm)。
3.2电泳条件(thermoscientifictm):
预制胶:novextm16%tricineproteingels,1.0mm,12-well(ec66952box);
上样缓冲液:
还原剂:
电泳缓冲液:
3.3点样:
取出预制胶,撕掉一端的白色封口胶,取出另一端的梳齿;将预制胶放置于电泳槽,加电泳缓冲液(lc1675稀释10倍);取供试品上清液0.5μl,加入5μl上样缓冲液(lc1676),补水至10μl,5,000rpm离心5min,点样;
蛋白标准品:室温放置几分钟至溶解,点样5μl。
3.4电泳:
设置电泳参数,恒压125v,电泳分离80~95min。
3.5银染:
使用
1)固定:配制固定液100ml纯水+100ml甲醇+20ml乙酸,200ml固定10min;
2)致敏:配制致敏液105ml纯水+100ml甲醇+5mlsensitizer,100ml致敏30min,重复致敏一次;
3)水洗:200ml双蒸水洗2次,每次5min;
4)银染:配制银染液stainera5ml+stainerb5ml+90ml纯水,100ml银染15min;
5)水洗:200ml双蒸水洗2次,每次5min;
6)延展:配制延展液5mldeveloper+95ml纯水,100ml延展3至15min;
7)终止:直接加入5mlstopper终止10min;
8)水洗:200ml双蒸水洗3次,每次10min。
4、鉴别
将上述蛋白胶上的目的条带切下,用胶内胰蛋白酶(由中科院蛋白质科学中心提供)酶解,所得肽段混合物经液相色谱-质谱分析,然后使用proteindiscover1.4基于uniprot-bovine.fasta.gz数据库进行检索和蛋白条带鉴定(本鉴别是在中科院蛋白质科学中心进行的)。
5、结果分析
实施例3中牛肺支气管肺泡灌洗液蛋白凝胶电泳图及鉴定结果见图5:其中泳道1为标准分子量蛋白,泳道2、3为牛肺支气管肺泡灌洗液;由于支气管肺泡灌洗液表面活性蛋白sp-c浓度较低,且电泳载样量有限,故没有获得清晰的表面活性蛋白sp-c条带。蛋白条带由下至上第一条带为蛋白sp-b,第三条带为sp-b的二聚体,第四条带为sp-b的三聚体及sp-a,均与牛肺表面活性蛋白的理论分子量一致;由于本案方法未进行脱脂,故第二条带可能是sp-b单体与磷脂分子相结合的物质;第五条带可能是sp-a与磷脂作用的复合体;第六条带可能是sp-a、sp-d分别与磷脂作用的复合体。
对比例
1、供试品
本对比例采用的供试品为牛肺表面活性提取物混悬液(批号160201,双鹤药业自制),牛肺表面活性提取物(批号151123xⅱ,双鹤药业自制),牛肺支气管肺泡浓缩灌洗液(批号160118a-05,双鹤药业自制)。
2、供试品溶液的制备:
牛肺表面活性提取物混悬液、牛肺表面活性提取物均配制成10mg/ml浓度(以原料药浓度计)的供试品溶液,取1ml供试品溶液,加入10%(w/v%)(质量体积百分比)的sds(sigma-aldrichpcode1002357998)溶液1ml,混匀。直接取牛肺支气管肺泡浓缩灌洗液3.5μl加3μl的4%(质量体积百分比w/v%)的sds(sigma-aldrichpcode1002357998)溶液,混匀。上述混匀后样品分别煮沸10min,以不低于15,000rpm的转速或离心力不低于15,000g离心20min(上海安亭台式高速离心机),取上清液备用,由此得到供试品上清液;
3、电泳
3.1蛋白标准品:
3.2电泳条件(thermoscientifictm):
预制胶:
上样缓冲液:
还原剂:
电泳缓冲液:
3.3点样:
取出预制胶,撕掉一端的白色封口胶,取出另一端的梳齿;将预制胶放置于电泳槽,加电泳缓冲液(np0002稀释20倍);分别取供试品溶液2.5μl依次分别加4μl纯水,1μlsamplereducingagent(10×)置于ep管70℃加热10min,再分别加入2.5μl的ldssamplebuffer(4×),5,000rpm离心2min,点样;
蛋白标准品:室温放置几分钟至溶解,点样10μl。
3.4电泳:
设置电泳参数,恒压200v,电泳分离36min。
3.5银染:
(1)试剂配制:
1)固定液:40%乙醇+10%乙酸+50%纯水;
2)致敏液:五水合硫代硫酸钠0.785g,三水合乙酸钠28.6g,乙醇75ml,加入双蒸水至250ml;
3)银染液:硝酸银(sigma)0.625g,加双蒸水250ml(用时加入37%的甲醛100μl),避光保存;
4)显色液:无水碳酸钠6.25g,加双蒸水250ml(用时加入37%的甲醛50μl);
5)终止液:edta.2na3.65g,加双蒸水250ml。
银染步骤:
1)凝胶用固定液固定1小时后,用双蒸水洗10min;
2)致敏:加入致敏液,室温晃动30min;
3)水洗:双蒸水洗3次,每次10min;
4)染色:加入染色液,室温晃动20min;
5)水洗:双蒸水洗2次,每次3min;
6)显色:加入少量显色液,晃动,待颜色变黄后,马上倒掉后再加入显色液,边晃动边显色,观察条带显色情况;
7)终止:待条带显色后,马上倒掉显色液,加入终止液,晃动10min终止反应;
8)倒掉终止液,加入双蒸水洗胶。
4、结果分析
对比例中供试品蛋白凝胶电泳图见图7:其中泳道m为标准分子量蛋白,泳道1为牛肺表面活性提取物混悬液(批号160201),泳道2为牛肺表面活性提取物(批号151123xⅱ),泳道3为牛肺支气管肺泡浓缩灌洗液(批号160118a-05),从图7可见常规方法电泳结果不清晰,各条带间拖尾严重,不能得到清晰的蛋白(或肽段)条带。
本发明中所使用的四种牛肺表面活性物质相关蛋白的序列及文献依据如下:
1、sp-a
氨基酸序列:
dvkevclgspgipgtpgshglpgrdgrdgikgdpgppgpmgppggmpglpgrdgmtgapglpgergekgepgergppgfpayldeelqgtlheirhqvlqsqgvlrlqgsvlavgekvfstngqsvnfdaikelcarvgghiaaprspeeneaivsivkkyntyaylglvegptagdfyyldgapvnytnwypgeprgrgkekcveiytdgqwndknclqyrlaicef
理论等电点:pi=5.19,分子量:24201.13da
文献出处:http://www.ncbi.nlm.nih.gov/protein/np_001071306.2
2、sp-b:
氨基酸序列:
fpipipycwlcrtlikriqavipkgvlamtvaqvchvvpllvggicqclverysvilldtllgrmlpqlvcglvlrcss
理论等电点:pi=9.03,分子量:8705.82da
文献出处:http://www.ncbi.nlm.nih.gov/protein/np_001068779.1
3、sp-c:
氨基酸序列:
lipccpvnikrllivvvvvvlvvvvivgallmgl
理论等电点:pi=8.96,分子量:3567.71da
文献出处:http://www.ncbi.nlm.nih.gov/protein/np_776887.1
4、sp-d:
氨基酸序列:
aemkiysqktmanactlvmcsppedglpgrdgrdgregprgekgdpgspgpagragmpgpagpiglkgdngsagepgpkgdtgppgppgmpgpagregpsgkqgsmgppgtpgpkgdtgpkggvgapgiqgspgpaglkgergapgepgapgragapgpagaigpqgpsgargppglkgdrgtpgergakgesglaevnalrqrvgilegqlqrlqnafsqykkamlfpngrsvgekifktegsektfqdaqqictqaggqlpsprsaaenealtqlataqnkaaflsmsdtrkegtfiyptgeplvysnwapqepnndggsencveifpngkwndkvcgeqrlvicef
理论等电点:pi=8.20,分子量:35159.16da
文献出处:http://www.ncbi.nlm.nih.gov/protein/np_851369.1
上述实施例只是用于对本发明的内容进行阐述,而不是限制;因此在和本发明的权利要求书相当的含义和范围内的任何改变,都应该认为是包括在权利要求书的范围内。
本说明书中引用的所有出版物和专利申请通过引用并入本文,如同每个单独的出版物或专利申请被具体地和单独地指明通过引用并入。此外,本文所述的任何理论、机制、证明或发现旨在进一步增强对本发明的理解,并且不意图以任何方式将本发明限制到这样的理论、机制、证明或发现。尽管已经在附图和前面的描述中详细地示出和描述了本发明,但是本发明应当被认为是说明性的而不是限制性的。
序列表
<110>华润双鹤药业股份有限公司
<120>一种测定肺表面活性物质蛋白的方法及其应用
<130>idc180259
<160>4
<170>patentinversion3.5
<210>1
<211>228
<212>prt
<213>sp-a
<400>1
aspvallysgluvalcysleuglyserproglyileproglythrpro
151015
glyserhisglyleuproglyargaspglyargaspglyilelysgly
202530
aspproglyproproglyprometglyproproglyglymetprogly
354045
leuproglyargaspglymetthrglyalaproglyleuproglyglu
505560
argglyglulysglygluproglygluargglyproproglyphepro
65707580
alatyrleuaspglugluleuglnglythrleuhisgluilearghis
859095
glnvalleuglnserglnglyvalleuargleuglnglyservalleu
100105110
alavalglyglulysvalpheserthrasnglyglnservalasnphe
115120125
aspalailelysgluleucysalaargvalglyglyhisilealaala
130135140
proargserproglugluasnglualailevalserilevallyslys
145150155160
tyrasnthrtyralatyrleuglyleuvalgluglyprothralagly
165170175
aspphetyrtyrleuaspglyalaprovalasntyrthrasntrptyr
180185190
proglygluproargglyargglylysglulyscysvalgluiletyr
195200205
thraspglyglntrpasnasplysasncysleuglntyrargleuala
210215220
ilecysgluphe
225
<210>2
<211>79
<212>prt
<213>sp-b
<400>2
pheproileproileprotyrcystrpleucysargthrleuilelys
151015
argileglnalavalileprolysglyvalleualametthrvalala
202530
glnvalcyshisvalvalproleuleuvalglyglyilecysglncys
354045
leuvalgluargtyrservalileleuleuaspthrleuleuglyarg
505560
metleuproglnleuvalcysglyleuvalleuargcysserser
657075
<210>3
<211>34
<212>prt
<213>sp-c
<400>3
leuileprocyscysprovalasnilelysargleuleuilevalval
151015
valvalvalvalleuvalvalvalvalilevalglyalaleuleumet
202530
glyleu
<210>4
<211>349
<212>prt
<213>sp-d
<400>4
alaglumetlysiletyrserglnlysthrmetalaasnalacysthr
151015
leuvalmetcysserproprogluaspglyleuproglyargaspgly
202530
argaspglyarggluglyproargglyglulysglyaspproglyser
354045
proglyproalaglyargalaglymetproglyproalaglyproile
505560
glyleulysglyaspasnglyseralaglygluproglyprolysgly
65707580
aspthrglyproproglyproproglymetproglyproalaglyarg
859095
gluglyproserglylysglnglysermetglyproproglythrpro
100105110
glyprolysglyaspthrglyprolysglyglyvalglyalaprogly
115120125
ileglnglyserproglyproalaglyleulysglygluargglyala
130135140
proglygluproglyalaproglyargalaglyalaproglyproala
145150155160
glyalaileglyproglnglyproserglyalaargglyproprogly
165170175
leulysglyaspargglythrproglygluargglyalalysglyglu
180185190
serglyleualagluvalasnalaleuargglnargvalglyileleu
195200205
gluglyglnleuglnargleuglnasnalapheserglntyrlyslys
210215220
alametleupheproasnglyargservalglyglulysilephelys
225230235240
thrgluglyserglulysthrpheglnaspalaglnglnilecysthr
245250255
glnalaglyglyglnleuproserproargseralaalagluasnglu
260265270
alaleuthrglnleualathralaglnasnlysalaalapheleuser
275280285
metseraspthrarglysgluglythrpheiletyrprothrglyglu
290295300
proleuvaltyrserasntrpalaproglngluproasnasnaspgly
305310315320
glysergluasncysvalgluilepheproasnglylystrpasnasp
325330335
lysvalcysglygluglnargleuvalilecysgluphe
340345
- 还没有人留言评论。精彩留言会获得点赞!