一种利用热红外监测获取微生物AM和DSE真菌联合菌剂施加剂量的方法与流程
本发明属于微生物领域,具体涉及一种利用热红外监测获取微生物AM和DSE真菌联合菌剂施加剂量的方法。
背景技术:
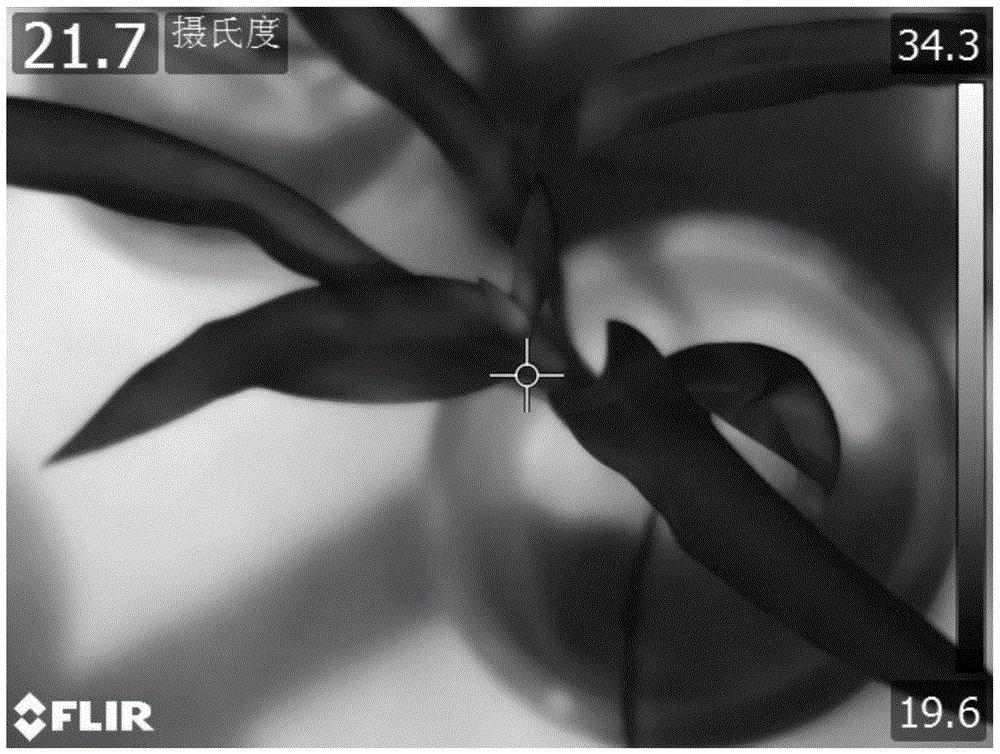
:丛枝菌根真菌(arbuscularmycorrhiza,AMF)是自然界中普遍存在的一种土壤微生物,由菌根孢子(果)、丛枝体、泡囊、菌丝组成,与根系接触后侵染形成一种互惠互利的共生体。陆地90%以上的有花植物都能够与AMF真菌形成菌根共生体。AMF真菌表面具许多外延菌丝生长在植物根际土壤中,形成根外菌丝网,扩大了植物根的吸收面积,可穿越到根际范围的缺磷区以外的土壤吸收养分,有效增强了宿主植物对磷及矿质元素、水分的吸收能力,促进植物的生长发育,提高其产量和生物量;也能降低极端环境对植物对造成的伤害,提高其抗旱性、抗寒性和耐盐碱性,降低病虫害对植物的破坏,提高其抗病性及酶活性,提高植物成活率,恢复植物群落等等。深色有隔内生真菌(darkseptateendophytes,DSE)是植物内生真菌的主要类群,其主要特征是菌丝颜色较深,具有明显隔膜,定植于健康植物根系的表皮、皮层甚至纤维管束组织的细胞或细胞间隙,形成共生体,而不引起植物病变。DSE可以在高山、极地、低pH土壤等逆境和极端环境中生存。据统计,DSE宿主范围涵盖114科320属的近600种植物,在菌根植物和莎草科、十字花科、藜科等传统非菌根植物的根中均发现DSE定植。DSE能促进植物生长,提高宿主植物的抗逆性和抗病性。DSE能增加宿主植物的光合效果,促进植物根系发育,从而提高植物对土壤中水分的利用率,根系可以将更多的水分运输到植物地上部分,保持水势平衡。DSE真菌的研究主要集中在真菌与植物菌苗的培养方法以及真菌对宿主植物的促生、抗逆效应研究。热红外成像仪是通过非接触方式探测物体的红外能量,并将其转换为电信号,进而在显示器上生成热图像,并可以对热图像进行处理的一种电子检测设备。热红外成像技术是利用热红外成像仪监测物体热反应特征的一种技术。近些年,热红外成像技术在精准农业中应用较多,可有效指导生产实践。植物气孔开闭和应激产生的化学物质对植物温度的影响较大,这也是应用热红外监测植物温度的前提条件。其中,农作物在生长过程中受环境和气候的影响较大,在农产品的质量和产量上间接反应出来,运用热红外技术可以快速准确的测定农作物表面温度变化和热反应特征,并同步监测环境因子,实时监测农作物的生长状况,以探索环境因子对农作物生长生理指标的影响,对作物的生理状况,是否受到干旱、高温、盐碱、寒潮、病虫害等非生物或生物胁迫做出判断和预警。技术实现要素:本发明的目的是获取具有促进植物生长功能的微生物菌剂的施加剂量。本发明首先保护一种获取微生物菌剂施加剂量的方法,可包括如下步骤:(1)播种若干粒植物种子并施加不同剂量的微生物菌剂;(2)完成步骤(1)后,培养,根据植物的冠层温度确定微生物菌剂的施加剂量。上述方法中,所述微生物菌剂具有促进植物生长的功能。上述方法中,所述植物种子可为植物出芽种子。本发明还保护一种制备具有促进植物生长功能的微生物菌剂的方法,可包括如下步骤:(a1)将各个组分按照不同的配比混合,得到相应的微生物菌剂;(a2)用步骤(a1)制备的微生物菌剂分别处理植物;(a3)完成步骤(a2)后,培养,根据植物的冠层温度确定微生物菌剂的组成。上述任一所述的方法中,所述“根据植物的冠层温度确定微生物菌剂的施加剂量”或所述“根据植物的冠层温度确定微生物菌剂的组成”的判定原则可为植物的冠层温度越低,微生物菌剂促进植物生长的效果越好。上述任一所述微生物菌剂可包括链格孢(Alternariasp.)真菌和地表球囊霉。上述任一所述微生物菌剂的活性成分可为链格孢(Alternariasp.)真菌和地表球囊霉。上述任一所述微生物菌剂具体可由链格孢(Alternariasp.)真菌和地表球囊霉组成。上述任一所述微生物菌剂中,链格孢(Alternariasp.)真菌和地表球囊霉的比例可为(30-140)mg链格孢(Alternariasp.)真菌的干物质:1300个孢子(如(30-62)mg链格孢(Alternariasp.)真菌的干物质:1300个孢子、(62-140)mg链格孢(Alternariasp.)真菌的干物质:1300个孢子、30mg链格孢(Alternariasp.)真菌的干物质:1300个孢子、31.1mg链格孢(Alternariasp.)真菌的干物质:1300个孢子、62mg链格孢(Alternariasp.)真菌的干物质:1300个孢子、62.2mg链格孢(Alternariasp.)真菌的干物质:1300个孢子、124.4mg链格孢(Alternariasp.)真菌的干物质:1300个孢子或140mg链格孢(Alternariasp.)真菌的干物质:1300个孢子)。上述任一所述植物可为如下c1)至c5)中的任一种:c1)双子叶植物;c2)单子叶植物;c3)禾本科植物;c4)玉米;c5)玉米品种中糯一号。上文中,当植物为玉米品种中糯一号时,每株玉米施加的微生物菌剂的最佳剂量可为1300个地表球囊霉孢子和124.4mg链格孢(Alternariasp.)真菌的干物质。上述任一所述微生物菌剂中,链格孢(Alternariasp.)真菌可为链格孢(Alternariasp.)001,其在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为CGMCCNo.17463。上述任一所述微生物菌剂中,地表球囊霉可为地表球囊霉(Glomusversiforme,G.V)。地表球囊霉(Glomusversiforme,G.V)具体可由北京市农林科学院植物营养与资源研究所提供,菌株编号为BGCNM04B。上述任一所述“植物的冠层温度”可为植物出苗后40d以后的冠层温度。当植物为玉米品种中糯一号时,可为出苗后40d以后(如出苗后第44d、出苗后第57d)的冠层温度。上述任一所述冠层温度可由热红外成像仪采集图像后测定。本发明还保护上述任一所述的方法的应用,可为b1)至b3)中的至少一种:b1)植物生产;b2)植物种植;b3)调节植物生长。本发明还保护植物的冠层温度的应用,可为d1)至d4)中的至少一种:d1)获取微生物菌剂施加剂量;d2)制备微生物菌剂;d3)调节植物生长;d4)制备用于调节植物生长的产品。上述应用中,所述“用于调节植物生长的产品”具体可为微生物菌剂。上文中,促进植物生长可表现为生物量增加和/或株高增加。所述生物量可为根干重、茎干重和叶干重中的至少一种。生物量和株高属于玉米成熟期获得的指标。本发明通过热红外成像仪检测玉米出苗后40d以后(如玉米出苗后第44d、玉米出苗后第57d)的冠层温度,根据冠层温度确定微生物菌剂的施加剂量或组成;冠层温度越低,微生物菌剂促进玉米生长的效果越好。采用本发明提供的方法可以制备微生物菌剂和/或获取微生物菌剂的施加剂量。本发明具有重要的应用价值。附图说明图1为玉米出苗后第35d的玉米热红外图像。图2为用软件处理玉米出苗后第35d的玉米热红外图像时选择的感兴趣区域。图3为用软件处理玉米出苗后第35d的玉米热红外图像时获得冠层温度。图4为各组玉米出苗后第35d、第44d和第57d的冠层温度的统计结果。图5为各组玉米出苗后第57d的冠层温度与总生物量的相关性。图6为各组玉米出苗后第57d的冠层温度与株高的相关性。保藏说明菌种名称:链格孢拉丁名:Alternariasp.菌株编号:001保藏机构:中国微生物菌种保藏管理委员会普通微生物中心保藏机构简称:CGMCC地址:北京市朝阳区北辰西路1号院3号保藏日期:2019年04月08日保藏中心登记入册编号:CGMCCNo.17463具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。玉米品种中糯一号(以下简称中糯一号)的种子为北京中农作科技发展有限公司的产品,认证号为0103006-2000。PDA固体培养基:取去皮马铃薯200g,切成小块,加入1.0L蒸馏水,煮沸30min;纱布过滤后收集滤液,向滤液中加入葡萄糖20.0g、KH2PO43.0g、MgSO4.7H2O1.5g、维生素B110μg和琼脂15.0g,调节pH值至6.0并用蒸馏水定容至1.0L,然后115℃灭菌15min。PDA抗性平板:向冷却至55℃的PDA固体培养基中加入氨苄青霉素和硫酸链霉素,得到PDA抗性培养基;PDA抗性培养基中,氨苄青霉素和硫酸链霉素的浓度均为50mg/L;将PDA抗性培养基倒入无菌培养皿(直径为9cm),自然冷却,得到PDA抗性平板。MMN液体培养基:向适量蒸馏水中加入CaCl20.05g、MgSO40.15g、NaCl0.025g、FeCl30.01g、KH2PO40.5g、VitamibB10.0001g、(NH4)2HPO40.25g、Glucose10g、Citricacid0.2g和Maltextract10g,调节pH值至5.5并用蒸馏水定容至1.0L,然后121℃灭菌30min。地表球囊霉(Glomusversiforme,G.V)为北京市农林科学院植物营养与资源研究所提供,菌株编号为BGCNM04B。在下文中,地表球囊霉(Glomusversiforme,G.V)简称地表球囊霉。下述实施例中的热红外成像仪为菲力尔公司的产品,型号为FLIRT630sc。热红外成像仪的主要参数见表1。表1.热红外成像仪的主要参数下述实施例中热红外成像仪采集玉米热红外图像的步骤参考说明书,具体如下:①打开热红外成像仪,待仪器稳定后即热红外成像仪进入工作模式;②记录热红外成像仪工作环境的温度和湿度信息;③在热红外成像仪内设置辐射率、环境温度和湿度信息便于校正热图信息;④使热红外成像仪的镜头对准玉米冠层,适当调节镜头与玉米冠层之间的距离,使用手动调焦或自动调焦功能,使得玉米冠层图像清晰,按下拍摄键;⑤下一个玉米冠层热红外图像获取重复③-④步骤。⑥拍摄完成后将热图数据导出到电脑端,在热红外专业数据处理软件(如FLIRResearchIRMax软件)中进行图像处理与分析。下述实施例中FLIRResearchIRMax软件处理玉米热红外图像,得到冠层温度的步骤具体如下:①在FLIRResearchIRMax软件中打开拍摄的玉米热红外图像;②用矩形框选择感兴趣区域,考虑到玉米叶片弯曲和叶尖部位有枯萎的现象,感兴趣区域选择玉米顶端的两片叶子各自的中间三分之一的部位,拍摄所得的玉米叶片在图像中不一定水平,旋转矩形框使得矩形框框选在叶片中间三分之一处;③通过添加函数计算每个感兴趣区域的平均温度,再对感兴趣区域的平均温度取平均值作为该株玉米的冠层温度。实施例1、链格孢(Alternariasp.)001CGMCCNo.17463的分离、鉴定和保藏一、分离1、用无菌水充分清洗根部样品(采自内蒙古自治区锡林郭勒盟锡林浩特市北电胜利矿区的针茅根系),然后用75%(v/v)乙醇水溶液浸泡消毒5min,无菌水冲洗2次。2、完成步骤1后,将所述根部样品置于10%(v/v)次氯酸钠水溶液浸泡消毒5min,无菌水冲洗3次。3、完成步骤2后,用滤纸吸去所述根部样品表面的水分,然后剪成长为1cm左右的根段。4、完成步骤3后,将所述根段置于PDA抗性平板(每个平板上放置2-3个根段),28℃黑暗培养14d。将在PDA抗性平板上可以生长的菌落进行分离培养并纯化。将筛选到的真菌命名为深色有隔内生真菌001。二、鉴定1、形态学鉴定将深色有隔内生真菌001接种至PDA抗性平板,28℃黑暗倒置培养14d,观察菌落特征;然后进行插片培养,观察菌丝体及产孢情况。菌落的生长状态见图1。结果表明,菌落正面颜色为黑灰色,背面无裂痕,中央平整,边缘圆整,同心圆。菌丝体及产孢情况如下:菌丝深灰色,局部膨大,隔间距5-25μm,厚垣孢子,聚合球形。2、分子鉴定(1)采用真菌基因组DNA提取试剂盒(AXYGEN公司的产品)提取深色有隔内生真菌001的基因组DNA并以其作为模板,采用ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′组成的引物对进行PCR扩增,得到PCR扩增产物。反应体系为50μL,由5μL10×ExTaqbuffer(北京索莱宝科技有限公司的产品)、2μLITS1水溶液(浓度为10μmol/L)、2μLITS4(浓度为10μmol/L)、2μL模板、4μLdNTPMix(浓度为2.5mM)和35μLddH2O组成。反应条件为:94℃3min;94℃30s,55℃30s,72℃90s,28个循环。(2)将步骤(1)得到的PCR扩增产物进行测序。测序结果表明,步骤(1)得到的PCR扩增产物中含有序列表中序列1所示的DNA分子。将序列表中序列1所示的核苷酸序列提交到GenBank数据库进行Blast分析,确定其分类地位。然后用MEGA6构建系统发育树,用于亲缘关系和系统发育分析。结果表明,深色有隔内生真菌001与链格孢(Alternariasp.)的同源性最高。因此,深色有隔内生真菌001被鉴定为链格孢(Alternariasp.)。三、保藏步骤一分离的深色有隔内生真菌001已于2019年04月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为CGMCCNo.17463。深色有隔内生真菌001的全称为链格孢(Alternariasp.)001CGMCCNo.17463,简称为DSE菌株。实施例2、微生物菌剂的制备一、DSE培养菌液的制备1、将DSE菌株接种至PDA固体培养基,28℃黑暗倒置培养14d,得到DSE菌落。2、完成步骤1后,无菌条件下在DSE菌落上取一个菌饼,然后置于MMN液体培养基,28℃、170r/min震荡培养15d,得到DSE培养菌液。1mLDSE培养菌液中DSE菌株干物质质量为3.11mg。二、地表球囊霉菌剂的制备取地表球囊霉,接种至灭菌沙土基质的玉米植株根部进行扩繁,得到地表球囊霉菌剂。地表球囊霉菌剂包含孢子、根外菌丝和被侵染根段,孢子密度为26个/g,侵染率为87%,菌丝长度为3.12m/g。三、微生物菌剂的制备制备微生物菌剂甲、微生物菌剂乙和微生物菌剂丙。微生物菌剂甲由10mLDSE培养菌液、40mLMMN液体培养基和50g地表球囊霉菌剂组成。微生物菌剂甲中,DSE菌株的干物质质量31.1mg,地表球囊霉的孢子数为1300个。微生物菌剂乙由20mLDSE培养菌液、30mLMMN液体培养基和50g地表球囊霉培养菌液组成。微生物菌剂乙中,DSE菌株的干物质质量62.2mg,地表球囊霉的孢子数为1300个。微生物菌剂丙由40mLDSE培养菌液、10mLMMN液体培养基和50g地表球囊霉培养菌液组成。微生物菌剂丙中,DSE菌株的干物质质量124.4mg,地表球囊霉的孢子数为1300个。实施例3、实施例2制备的微生物菌剂对玉米冠层温度、总生物量和株高的影响一、玉米芽的制备取中糯一号的种子,先用75%(v/v)乙醇水溶液浸泡消毒5min,无菌水冲洗3次;然后用10%(m/v)次氯酸钠水溶液浸泡消毒10min,无菌水冲洗3次;最后置于铺有湿润的无菌滤纸的培养皿中,25℃黑暗培养3d,挑选长势一致的玉米芽备用。二、DSE灭活菌液和地表球囊霉灭活菌剂的制备1、取实施例2步骤一中2制备的DSE培养菌液,121℃灭菌30min,得到DSE灭活菌液。2、取实施例2中步骤二制备的地表球囊霉菌剂,121℃灭菌30min,得到地表球囊霉灭活菌剂。三、实施例2制备的微生物菌剂对玉米冠层温度、总生物量和株高的影响1、将粘土和沙土分别粉碎后,过筛(目数为2mm),然后121℃灭菌2h,自然风干,依次得到风干粘土和风干沙土。2、完成步骤1后,将风干粘土和风干沙土按照质量比为1∶1充分混匀,得到混合土壤。3、完成步骤2后,取16个塑料盆(塑料盆的规格均为外口径23.5cm,内口径20cm,高度21.5cm,底直径15cm),先用75%(v/v)乙醇水溶液擦拭,然后用无菌水清洗数遍,晾干后装入5kg混合土壤,同时浇水至土壤最大持水量的70%,48h后加入NH4NO3、KH2PO4和KNO3晶体(作为底肥),混匀,使土壤中N、P、K的质量分数分别为100mg/kg、25mg/kg和150mg/kg。4、完成步骤3后,将16个塑料盆随机分成对照组、试验组1、试验组2和试验组3四组,每组4个塑料盆,进行如下实验:对照组(即CK):每个塑料盆播种3颗步骤一制备的玉米芽,同时每个塑料盆中加入50mLDSE灭活菌液和50g地表球囊霉灭活菌剂;试验组1(即DSE20%+AM或DSE20%+AMF):每个塑料盆播种3颗步骤一制备的玉米芽,同时每个塑料盆中加入微生物菌剂甲;试验组2(即DSE40%+AM或DSE40%+AMF):每个塑料盆播种3颗步骤一制备的玉米芽,同时每个塑料盆中加入微生物菌剂乙;试验组3(即DSE80%+AM或DSE80%+AMF):每个塑料盆播种3颗步骤一制备的玉米芽,同时每个塑料盆中加入微生物菌剂丙。5、完成步骤4后,定量浇水并使土壤湿度约为土壤最大持水量的70%。出苗后每盆定苗为1株。分别在玉米出苗后第35d、第44d和第57d,用热红外成像仪采集(采集的时刻为12∶00)玉米热红外图像,然后用FLIRResearchIRMax软件(热红外成像仪自带)处理,得到各株玉米的冠层温度;最后按组计算平均值,即获得各组玉米的冠层温度。此外,玉米收获后测量株高,然后将根、茎、叶分离,分别测定干重(80℃烘干48h),按组计算平均值。玉米出苗后第35d的玉米热红外图像见图1。用软件处理玉米出苗后第35d的玉米热红外图像时选择的感兴趣区域见图2。用软件处理玉米出苗后第35d的玉米热红外图像时获得冠层温度见图3。各组玉米出苗后第35d、第44d和第57d的冠层温度统计结果见表2和图4。表2注:同列不同小写字母表示差异显著(P<0.05)。各组玉米植株的根干重、茎干重、叶干重和株高的测定结果见表3。表3根干重(g)茎干重(g)叶干重(g)株高(cm)对照组0.74±0.29b0.24±0.15b1.08±0.24b35.47±4.83b试验组13.38±0.63b0.58±0.08a3.52±0.89b61.33±5.69a试验组23.65±0.50b0.65±0.09a3.16±0.46b62.4±1.92a试验组34.15±0.79a1.92±0.84a4.20±0.75a65.63±5.27a注:同列不同小写字母表示差异显著(P<0.05)。各组玉米出苗后第57d的冠层温度与总生物量(总生物量=根干重+茎干重+叶干重)的相关性结果见图5。各组玉米出苗后第57d的冠层温度与株高的相关性结果见图6。实验结果具体如下:(1)玉米出苗后第35d和第57d,对照组和试验组1的冠层温度基本相同;玉米出苗后第44d,试验组1的冠层温度显著低于对照组;玉米出苗后第35d、第44d和第57d,试验组2和试验组3的冠层温度均显著低于对照组,且试验组3的冠层温度低于试验组2。(2)冠层温度与总生物量之间存在负相关关系。试验组3的总生物量、根干重和叶干重均高于试验组2。(3)冠层温度与株高之间存在负相关关系。试验组1、试验组2和试验组3的株高均显著高于对照组,且随着DSE培养菌液的增加,株高也有一定程度的增加。上述结果表明,试验组1、试验组2和试验组3的株高均无显著差异,但试验组3的物质积累能力最强(即总生物量最大),由此认为试验组3中施用的微生物菌剂丙的剂量最佳。由于株高和总生物量属于玉米成熟期获得的指标,为了节省人力、物力和财力,可通过热红外成像仪检测玉米出苗后40d以后(如玉米出苗后第44d、玉米出苗后第57d)的冠层温度,从而评价微生物菌剂促进植物生长的效果,即获得微生物菌剂的最佳施加剂量。玉米出苗后40d以后的冠层温度越低,则该微生物菌剂促进植物生长的效果越好,该微生物菌剂的施用剂量最佳。<110>中国矿业大学(北京)北京合生元生态环境工程技术有限公司<120>一种利用热红外监测获取微生物AM和DSE真菌联合菌剂施加剂量的方法<160>1<170>PatentInversion3.5<210>1<211>608<212>DNA<213>链格孢(Alternariasp.)<400>1cccttccgtagggtgaacctgcggagggatcattacacaatatgaaagcgggctggatac60tctgtagtagtggattgctttacggcgtgcgctgctggagagcctagccttgctgaatta120ttcacccgtgtcttttgcgtacttcttgtttccttggtgggctcgcccgccacaaggaca180actcataaaccttttgtaatagcaatcagcgtcagtaacaacataataattacaactttc240aacaacggatctcttggttctggcatcgatgaagaacgcagcgaaatgcgatacgtagtg300tgaattgcagaattcagtgaatcatcgaatctttgaacgcacattgcgccctttggtatt360ccaaagggcatgcctgttcgagcgtcatttgtaccctcaagctttgcttggtgttgggcg420tcttgtctccagtccgctggagactcgccttaaagtcattggcagccggcctactggttt480cggagcgcagcacaagtcgcactcttttccagccaaggtcagcgtccaacaagccttttt540tcaacttttgacctcggatcaggtagggatacccgctgaacttaagcatatcaataagcg600gaggaaaa608当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1