一种基于驼源抗体直接检测细交链孢菌酮酸的化学发光免疫分析方法及试剂盒与流程
本发明涉及食品安全检测技术领域,更具体地,涉及一种基于驼源抗体直接检测细交链孢菌酮酸的化学发光免疫分析方法及试剂盒。
背景技术:
链格孢菌能产生70多种有毒次级代谢产物,在谷物、花生、果酱、新鲜蔬菜水果和果汁饮品等中的残留已备受社会关注,且链格孢菌可以侵染油料种子,造成食用油污染,严重影响农产品的市场价值。细交链孢菌酮酸(tenuazonicacid,tea),作为链格孢霉毒素中毒性最强的次级代谢物,被美国食品与药品管理局列入有毒化学物质登记册中。研究表明,tea对鼠、狗等动物具有很强的急性或亚急性毒害作用,且与链格孢酚(alternariol,aoh),链格孢酚甲基醚(alternariolmethylether,ame)等多种毒素产生协同作用,产生急性毒性。
近些年,在婴儿食品、啤酒、土豆、水果、胡椒等多种食品中均有检出tea,这使得食品中tea毒素的检测也越来越值得关注。目前,对食品中细交链孢菌酮酸tea的检测方法有很多,但多为仪器分析方法,仪器方法设备昂贵,条件苛刻,并不适用于tea的快速检测。少数报道采用的是免疫快速检测方法,但仅是通过tea衍生物的分析来实现tea的间接检测,且衍生方法操作复杂,效率不高,产物纯化难度很大。目前并未见直接针对tea分析的化学发光免疫分析方法及免疫检测试剂盒,因此非常有必要提供一种直接检测细交链孢菌酮酸的化学发光免疫分析方法及试剂盒。
技术实现要素:
本发明的目的是为了克服现有技术的不足,提供一种基于驼源抗体直接检测细交链孢菌酮酸的化学发光免疫分析方法及试剂盒。
本发明的第一个目的是提供一种细交链孢菌酮酸的人工抗原。
本发明的第二个目的是提供所述的人工抗原在检测细交链孢菌酮酸中的应用。
本发明的第三个目的是提供所述的人工抗原制备得到的抗体在检测细交链孢菌酮酸中的应用。
本发明的第四个目的是提供一种检测细交链孢菌酮酸的方法。
本发明的第五个目的是提供一种检测细交链孢菌酮酸的化学发光免疫检测试剂盒。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
一种细交链孢菌酮酸的人工抗原,具有如式(i)所示,
(i)
其中n=1~6。
优选地,n=1。
优选地,所述载体蛋白为钥孔血蓝蛋白、牛血清蛋白或卵白蛋白。
所述的人工抗原在检测细交链孢菌酮酸中的应用。
所述的人工抗原制备得到的抗体在检测细交链孢菌酮酸中的应用。
优选地,所述抗体为人工抗原免疫骆驼科动物制备得到的驼源抗体。
更优选的,所述骆驼科动物为羊驼、双峰驼或单峰驼。
更优选的,所述抗体包括但不限于多克隆抗体、基因工程抗体。
一种抗细交链孢菌酮酸的驼源抗体,制备方法包括以下步骤:
s1.用所述细交链孢菌酮酸人工抗原免疫骆驼科动物;
s2.然后分别在第15、29、43、57天各加强免疫一次;
s3.在第64天,采集全血,收集细交链孢菌酮酸驼源抗体。
一种检测细交链孢菌酮酸的方法,所述人工抗原载体蛋白为钥孔血蓝蛋白(tea-aoaa-klh)作为免疫原,所述人工抗原载体蛋白为卵白蛋白(tea-aoaa-ova)作为包被原,进行细交链孢菌酮酸的检测。
优选地,所述人工抗原载体蛋白为钥孔血蓝蛋白作为免疫原免疫骆驼科动物制备驼源抗体,进行细交链孢菌酮酸的检测。
优选地,所述人工抗原载体蛋白为钥孔血蓝蛋白作为免疫原免疫骆驼科动物制备抗体的为上述抗体。
优选地,检测细交链孢菌酮酸的方法为化学发光免疫分析方法,包括以下步骤:
s1.将具有式(i)结构的人工抗原作为包被原,将包被原包被于化学发光板的微孔内,孵育、洗板、封闭、干燥;
s2.将梯度稀释的细交链孢菌酮酸标准品或待测样品加入化学发光板微孔内,并将所述驼源抗体加入酶标板微孔内,孵育、洗板;
s3.将酶标抗驼二抗加入化学发光板微孔内,孵育、洗板;
s4.将发光液加入化学发光板微孔内,振荡混匀,在一定波长下测定发光值;
s5.以各标准品浓度孔发光值为纵坐标,以药物标准液浓度的log10值为横坐标,绘制免疫检测方法的标准曲线。
s6.根据建立的标准曲线计算出检测限lod(10%抑制率的药物浓度,ic10)和半数抑制量(50%抑制率的药物浓度,ic50),定量分析样品中细交链孢菌酮酸含量,抑制率按下式计算:
其中,rlu0为细交链孢菌酮酸药物浓度为0时的发光值,rlux为细交链孢菌酮酸为x时的发光值,rlumin为空白对照孔的发光值。
优选地,包被原浓度为31.25ng/ml,制备得到的驼源抗体稀释2000倍使用。
优选地,步骤s2中,孵育40min。
优选地,步骤s3中,孵育40min。
优选地,步骤s3中,选用ph7.4tris-hcl稀释驼源抗体。
优选地,步骤s2中,梯度稀释的细交链孢菌酮酸标准品的药物稀释液为h2o。
一种检测细交链孢菌酮酸的化学发光免疫检测试剂盒,所述试剂盒含有所述人工抗原载体蛋白为钥孔血蓝蛋白(tea-aoaa-klh)作为免疫原制备得到的驼源抗体,以及所述人工抗原载体蛋白为卵白蛋白(tea-aoaa-ova)作为包被原包被的化学发光板。
优选地,所述人工抗原载体蛋白为钥孔血蓝蛋白(tea-aoaa-klh)作为免疫原制备得到的驼源抗体为所述驼源抗体。
优选地,还包括辣根过氧化物酶标记的二抗,细交链孢菌酮酸标准溶液,样品复溶液,样品稀释液,浓缩洗涤液,发光底物液,底物缓冲液、盖板膜、自封袋、手套、使用说明书。
与现有技术相比,本发明具有如下有益效果:
(1)利用细交链孢菌酮酸人工抗原作为免疫原,制备获得直接针对细交链孢菌酮酸的高特异性驼源抗体,效价为1:128000;(2)提供一种直接检测细交链孢菌酮酸的化学发光免疫分析方法;(3)提供一种直接检测细交链孢菌酮酸的化学发光免疫检测试剂盒;(4)该发明具有简便快速、特异性强、灵敏度较高的特点,对细交链孢菌酮酸的检测限为0.2ng/ml,半抑制浓度为8.0ng/ml,线性范围为0.9~69.8ng/ml。
附图说明
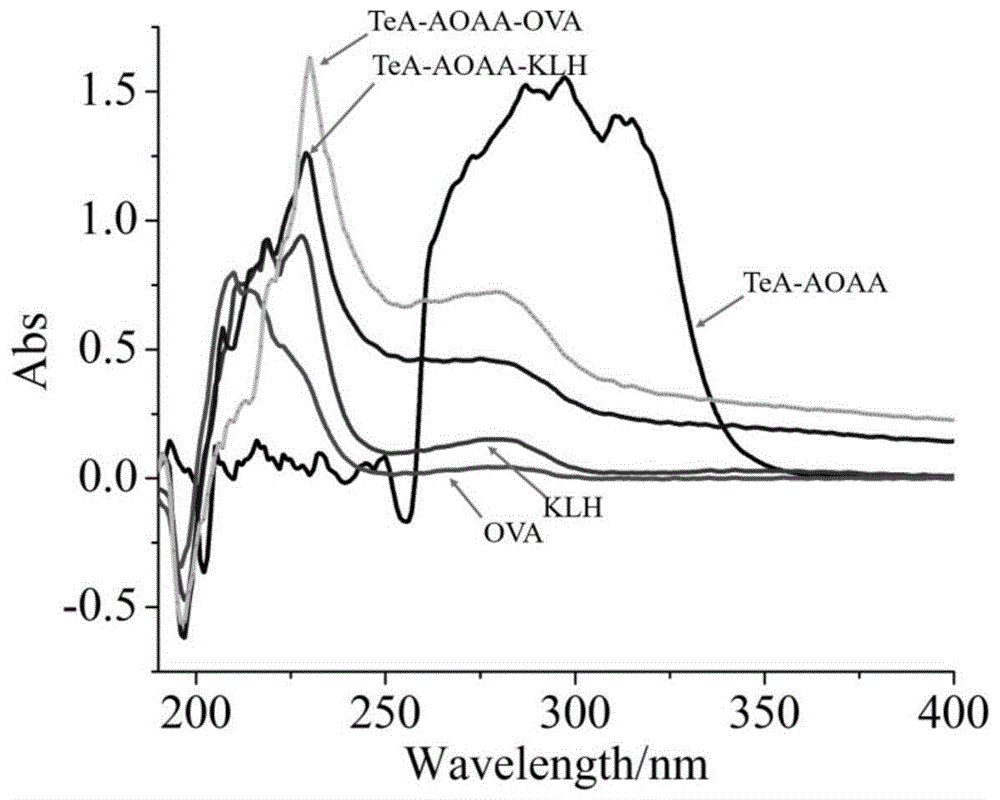
图1为细交链孢菌酮酸半抗原tea-aoaa(n=1)及人工抗原紫外鉴定图。
图2为不同包被原浓度及驼源抗体稀释倍数的rlu/ic50、ic50、rlu曲线。
图3为不同酶标二抗稀释倍数的rlu/ic50、ic50、rlu曲线。
图4为不同一抗竞争反应时间的rlu/ic50、ic50、rlu曲线。
图5为不同酶标二抗反应时间的rlu/ic50、ic50、rlu曲线。
图6为不同抗体稀释液的rlu/ic50、ic50、rlu曲线。
图7为不同抗体稀释液ph的rlu/ic50、ic50、rlu曲线。
图8为不同药物稀释液的rlu/ic50、ic50、rlu曲线。
图9以tea-aoaa(n=1)为半抗原制备的驼源抗体对细交链孢菌酮酸的抑制曲线。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1细交链孢菌酮酸驼源抗体的制备及鉴定
一、实验方法
对半抗原与载体蛋白偶联获得的人工抗原进行紫外鉴定,将细交链孢菌酮酸免疫原tea-aoaa-klh与弗氏佐剂(第1次免疫用弗氏完全佐剂,以后加强免疫均用弗氏不完全佐剂)完全佐剂乳化,采用颈部皮下多点免疫3岁健康的雄性双峰骆驼。步骤如下:取0.5mg细交链孢菌酮酸免疫原tea-aoaa-klh与500μl的弗氏不完全佐剂乳化,分别在第15,29,43,57天加强免疫,在第64天,从骆驼颈部采集全血50ml,将血液在37℃水浴锅中放置30分钟,4℃12000rpm离心30分钟,收集上清液即为细交链孢菌酮酸驼源抗体,分装,-20℃保存。采用间接竞争elisa法测定抗体效价。
二、实验结果
图1为细交链孢菌酮酸半抗原tea-aoaa(n=1)及人工抗原紫外鉴定图,间接竞争elisa法测定细交链孢菌酮酸驼源抗体效价为1:128000,抑制率为69%。
实施例2一种细交链孢菌酮酸化学发光免疫分析方法
一、细交链孢菌酮酸化学发光免疫分析方法的建立
(1)将一定浓度包被原(tea-aoaa-ova)包被在化学发光板的微孔内,经37℃包被过夜后,每孔加入120μl5%脱脂奶粉溶液于37℃封闭3h。甩干孔内液体后,37℃烘1h,备用;
(2)将50μl一系列浓度细交链孢菌酮酸标准液或经前处理的的待测样品液加入化学发光板的微孔内,向化学发光板的微孔内加入50μl一定稀释倍数的抗血清,37℃孵育一段时间,倒出孔内液体,用洗涤液洗涤5次,在吸水纸上拍干;
(3)向化学发光板的微孔内加入100μl一定稀释倍数的hrp标记羊抗驼二抗溶液,37℃温育一段时间,用洗涤液洗涤5次,拍干;
(4)向化学发光板的微孔内加入100μl发光液,振荡混匀。在波长425nm下测定各孔发光值。以各标准品浓度孔发光值为纵坐标,以药物标准液浓度的log10值为横坐标,绘制标准曲线图。
(5)根据标准曲线图和待测样品的发光值,可计算出待测样品中细交链孢菌酮酸的含量。
化学发光免疫分析方法中各种反应参数对方法的灵敏度有着很大影响,因此,选择以下条件进行参数优化。
二、包被原和驼源抗体的浓度
1、实验方法
通过棋盘滴定法优化包被原浓度和多克隆抗体稀释倍数,设定包被原浓度(1000、500、250、125、62.5、31.25ng/ml)及驼源抗体稀释倍数(2000、4000、8000、16000、32000、64000、128000、256000倍),按照上文的方法检测相对发光强度(rlu),作竞争抑制曲线,通过比较rlu/ic50、ic50、rlu的大小选择最佳参数。
2、实验结果
结果如图2所示,最优包被原浓度和双峰驼多克隆抗体稀释倍数为31.25ng/ml-2000倍。
三、酶标二抗稀释倍数
1、实验方法
设定酶标二抗稀释倍数分别为6000、8000、10000、12000、14000倍,按照上文的方法检测相对发光强度(rlu),作竞争抑制曲线,通过比较rlu/ic50、ic50、rlu的大小选择最佳参数。
2、实验结果
结果如图3所示,最优酶标二抗稀释倍数为10000倍。
四、一抗竞争反应时间
1、实验方法
设定一抗竞争反应时间为30、40、50min,按照上文的方法检测相对发光强度(rlu),作竞争抑制曲线,通过比较rlu/ic50、ic50、rlu的大小选择最佳参数。
2、实验结果
结果如图4所示,最优一抗竞争反应时间为40min。
五、酶标二抗反应时间
1、实验方法
设定酶标二抗反应时间为30、40、50min,按照上文的方法检测相对发光强度(rlu),作竞争抑制曲线,通过比较rlu/ic50、ic50、rlu的大小选择最佳参数。
2、实验结果
结果如图5所示,最优酶标二抗反应时间为40min。
六、抗体稀释液
1、实验方法
设定抗体稀释液为pbs、pbst、tris-hcl,按照上文的方法检测相对发光强度(rlu),作竞争抑制曲线,通过比较rlu/ic50、ic50、rlu的大小选择最佳参数。
2、实验结果
结果如图6所示,最佳抗体稀释液为tris-hcl。
七、抗体稀释液ph
1、实验方法
设定抗体稀释液tris-hcl的ph为6.5、7.0、7.4、8.0、8.5,按照上文的方法检测相对发光强度(rlu),作竞争抑制曲线,通过比较rlu/ic50、ic50、rlu的大小选择最佳参数。
2、实验结果
结果如图7所示,最佳抗体稀释液tris-hcl的ph为7.4。
八、药物稀释液
1、实验方法
设定药物稀释液为pbs、pbst、h2o,按照上文的方法检测相对发光强度(rlu),作竞争抑制曲线,通过比较rlu/ic50、ic50、rlu的大小选择最佳参数。
2、实验结果
结果如图8所示,最优药物稀释液为h2o。
九、一种细交链孢菌酮酸化学发光免疫分析方法
(1)将31.25ng/ml包被原(tea-aoaa-ova)包被在化学发光板的微孔内,经37℃包被过夜后,每孔加入120μl5%脱脂奶粉溶液于37℃封闭3h。甩干孔内液体后,37℃烘1h,备用;
(2)将50μl一系列浓度细交链孢菌酮酸标准液(h2o作为稀释液)或经前处理的待测样品液加入化学发光板的微孔内,向化学发光板的微孔内加入50μl稀释2000倍的抗血清(ph7.4的tris-hcl作为稀释液),37℃孵育40min,倒出孔内液体,用洗涤液洗涤5次,在吸水纸上拍干;
(3)向化学发光板的微孔内加入100μl稀释2000倍数的hrp标记羊抗驼二抗溶液,37℃温育40min,用洗涤液洗涤5次,拍干;
(4)向化学发光板的微孔内加入100μl发光液,振荡混匀。在波长425nm下测定各孔发光值。以各标准品浓度孔发光值为纵坐标,以药物标准液浓度的log10值为横坐标,建立ic-cleia标准曲线。
(5)根据标准曲线图和待测样品的发光值,可计算出待测样品中细交链孢菌酮酸的含量。
以tea-aoaa(n=1)为半抗原制备的驼源抗体对细交链孢菌酮酸的抑制曲线如图9所示。
实施例3一种细交链孢菌酮酸化学发光免疫分析方法
一、实验方法
将包被原(tea-aoaa-ova)包被在化学发光板的微孔内,孵育、洗板、封闭、干燥;将50μl系列浓度的细交链孢菌酮酸标准品和50μl适当稀释倍数的驼源抗体加入到包被好的化学发光板不同微孔中,37℃下温育40min,洗板5次,加100μlhrp酶标记的羊抗驼二抗,37℃下温育40min,洗板5次,加100μl发光液,振荡混匀,在波长425nm下测定各孔发光值。以发光值为纵坐标,相应标准品浓度对数值为横坐标,应用origin8.5软件四参数对数函数进行曲线拟合。将细交链孢菌酮酸的几种类似物进行梯度稀释,然后与驼源抗体进行反应,制作标准曲线。通过曲线分别计算出各类似物的ic50,计算建立的化学发光免疫分析方法对细交链孢菌酮酸类似物的交叉反应率:交叉反应率=ic50(tea)/ic50(类似物)×100%。
曲线拟合为y=(a-d)/[1+(x/c)b]+d,
其中,a和d分别代表细交链孢菌酮酸标准品浓度最小和最大时的发光值,c为中点浓度;当标准品浓度等于c时的吸光值值为(a+d)/2,正处于曲线的拐点处,半数抑制量浓度为ic50,b表示曲线的陡峭程度,称斜率因子;以ic10为检测限,以ic20~ic80为检测范围。以梯度的细交链孢菌酮酸溶液为标准品,建立化学发光免疫分析的标准曲线。
二、实验结果
结果见表1。结果分析可知,本发明建立的化学发光免疫分析方法对细交链孢菌酮酸的检测限为0.2ng/ml,半抑制浓度为8.0ng/ml,线性范围为0.9~69.8ng/ml,抑制率与细交链孢菌酮酸浓度的对数值成显著的s型曲线关系,相关系数r2为0.996。因此,该方法可以直接检测食品中细交链孢菌酮酸的含量,且具有高灵敏度和高特异性的优点。
表1本发明建立的检测方法对细交链孢菌酮酸类似物的交叉反应率:
实施例4细交链孢菌酮酸化学发光免疫检测试剂盒
一、细交链孢菌酮酸化学发光免疫检测试剂盒各组分的准备
(1)包被有细交链孢菌酮酸包被原(tea-aoaa-ova)的化学发光板:用ph9.6的0.5mol/l碳酸盐缓冲液将人工抗原tea-aoaa-ova稀释成31.25ng/ml,在化学发光板微孔中每孔加100μl,37℃包被过夜,用洗涤液洗涤2次,每孔加入120μl5%脱脂奶粉溶液于37℃封闭3h。甩干孔内液体后,37℃烘1h,将包被好的化学发光板保存于干燥的铝箔袋中。
(2)细交链孢菌酮酸驼源抗体工作液:将细交链孢菌酮酸驼源抗体稀释1:2000,将稀释液保存于6ml棕色瓶内;
(3)辣根过氧化物酶标记的二抗溶液:将羊抗驼酶标二抗稀释1:10000,将稀释液保存于10ml棕色瓶内;
(4)细交链孢菌酮酸标准溶液:将细交链孢菌酮酸标准液稀释成一系列浓度(0、0.128、0.64、3.2、16、80、400、2000ng/ml),将一系列稀释液分别保存于8个10ml棕色瓶内,并分别标记;
(5)发光底物液:2.0mg鲁米诺、0.8mg对碘苯酚溶于10ml的tris-hcl缓冲液(ph9.0)中,将稀释液保存于6ml棕色瓶内;
(6)底物缓冲液:20ul过氧化氢(30%)溶于10mltris-hcl缓冲液(ph7.0)中,将稀释液保存于6ml棕色瓶内;
(7)浓缩洗涤液:含有1.0%吐温20和0.1mol/ml磷酸盐缓冲液,将溶液保存于10ml棕色瓶内,20倍稀释使用。
(8)样品复溶液:含1%甲醇的磷酸盐缓冲液(ph7.4pbs)kh2po40.2g,na2hpo4·12h2o2.9g,nacl8.5g,kcl0.2g,加入10ml无水甲醇,加蒸馏水至1000ml。
(9)样品稀释液:磷酸盐缓冲液(ph7.4pbs)kh2po40.2g,na2hpo4·12h2o2.9g,nacl8.5g,kcl0.2g,加蒸馏水至1000ml。
二、细交链孢菌酮酸化学发光免疫检测试剂盒的组装
组装细交链孢菌酮酸化学发光免疫检测试剂盒,包含以下组份:
(1)包被有细交链孢菌酮酸包被原的化学发光板:1块;
(2)细交链孢菌酮酸双峰驼多克隆抗体工作液:1瓶,6ml/瓶;
(3)辣根过氧化物酶标记的二抗溶液:1瓶,10ml/瓶;
(4)细交链孢菌酮酸标准溶液:分别为0ng/ml、0.128ng/ml、0.64ng/ml、3.2ng/ml、16ng/ml、80ng/ml、400ng/ml、2000ng/ml,各1瓶,6ml/瓶;
(5)样品复溶液:1瓶,10ml/瓶;
(6)样品稀释液:1瓶,10ml/瓶;
(7)发光底物液:1瓶,6ml/瓶;
(8)底物缓冲液:1瓶,6ml/瓶;
(9)浓缩洗涤液,1瓶,10ml/瓶;
(10)盖板膜:2张;
(11)自封袋:6个;
(12)手套,6只;
(13)使用说明书:1份;
三、使用方法
1、待测样品前处理方法:
果汁样品:直接用样品稀释液稀释一定倍数即可用于测定。
谷物样品:取谷物样品1g,粉碎均匀后用甲醇/pbs混合液萃取2次,8000rpm离心10min,上清液氮吹吹干,复溶液复溶后稀释一定倍数即可用于测定。
2、细交链孢菌酮酸化学发光免疫检测:
(1)将试剂盒从冷藏环境在取出,置于室温条件下平衡;
(2)将50μl细交链孢菌酮酸标准品溶液或经前处理的待测样品溶液加入试剂盒的化学发光板微孔中,然后每孔加入50μl细交链孢菌酮酸双峰驼多克隆抗体,轻微震荡混匀,37℃环境中孵育40min;
(3)用洗涤液对化学发光板微孔进行洗涤5次,拍干;
(4)每孔加入100μl辣根过氧化物酶标记的羊抗驼二抗,轻微震荡混匀,37℃环境中孵育30min;
(5)用洗涤液对化学发光板微孔进行洗涤5次,拍干;
(6)向每孔中加入100μl发光液(将底物缓冲液与底物液等体积混合),轻微震荡混匀;在波长425nm下测定化学发光板各微孔的发光值;
(7)以各标准品浓度孔发光值与零标准孔发光值为纵坐标,以药物标准液浓度的log10值为横坐标,绘制标准曲线图,从而根据待测样品的发光值来计算样品中细交链孢菌酮酸的含量。
实施例5细交链孢菌酮酸化学发光免疫检测试剂盒
一、实验方法
使用实施例4中的试剂盒检测分别添加了20、200和500ng/ml细交链孢菌酮酸的果汁样品,每个浓度三个重复。
二、实验结果
结果如表2所示,果汁样品的回收率的高低,能够反映该方法的准确度,样品回收率高,则该方法准确可靠。本方法的ic-cleia检测果汁样品的回收率为82.6%~106.5%,cv都小于15%,说明方法准确性高,可用于检测实际样品中的tea。
表2果汁样品添加回收率的测定:
- 还没有人留言评论。精彩留言会获得点赞!