一种中药复方降糖药中格列本脲含量测定方法与流程
本发明涉及格列本脲含量测定方法,尤其涉及一种中药复方降糖药中格列本脲含量测定方法,所属药品质量控制方法
技术领域:
。
背景技术:
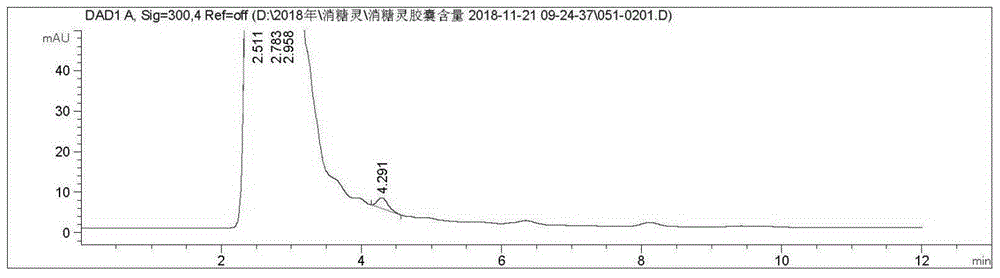
:中药复方降糖药是用于治疗糖尿病的代表性中药复方制剂品种,中药复方降糖药是由人参、黄连、天花粉等11味中药及格列本脲制成的胶囊剂,中药复方降糖药含有唯一的化药原料格列本脲,含量为0.7mg/粒,该中药复方降糖药的现行质量标准均未对该化药原料格列本脲进行质量控制。有文献报道采用薄层色谱扫描法和高效液相色谱法等方法对该成分进行定量分析的方法研究,例如中国药典收载了格列本脲及格列本脲制剂的高效液相色谱含量测定方法,因为是针对单一成分格列本脲进行测定,采用的试液浓度较高,格列本脲不能从大量粘稠的中药浸膏混合液中完全浸出,该方法不能适用于中药复方降糖药体系。其它文献收载的测定中药复方制剂中格列本脲含量的方法,因色谱条件或试液制备方法差异,其色谱适用性或准确性不同程序地存在缺陷。技术实现要素:针对上述问题,本发明的目的是提供一种中药复方降糖药中格列本脲含量测定方法,准确检测该化药成分格列本脲的成分,以控制该化药成分格列本脲可能的安全性、有效性、稳定性和均一性方面的风险。本发明提供了一种中药复方降糖药中格列本脲含量测定方法,包括以下步骤:采用液相色谱法,分别取对照品溶液、供试品溶液10μl进行测量;其中使用c185μm250mm×4.6mm色谱柱;采用体积比为3:6-7的磷酸二氢铵溶液-甲醇为流动相,其中磷酸二氢铵溶液浓度为0.05mol/l,用磷酸调节ph至3.5±0.05;检测波长为300nm;流速为1.0ml/min;理论塔板数按格列本脲计不低于2000;测量并记录色谱图,按外标法以峰面积计算,得到所述中药复方降糖药中格列本脲的含量。具体的,所述对照品溶液为格列本脲对照品甲醇溶液,所述格列本脲对照品甲醇溶液的浓度为40-60μg/ml;所述供试品溶液为中药复方降糖药甲醇溶液,所述中药复方降糖药甲醇溶液中的格列本脲的浓度为40-60μg/ml。具体的,所述供试品溶液的配制方法为取中药复方降糖药置于容器中,加入甲醇,进行超声处理30min,取出,冷却后称重,用甲醇补足减轻的重量,摇匀、过滤。进一步地,所述测定方法还包括取10μl阴性对照液,采用液相色谱法进行测量,记录色谱图,所述阴性对照液的配制方法为按所述中药复方降糖药配方取除格列本脲的其它成分0.64-0.96g混合均匀,加甲醇25ml,超声处理30min,摇匀,滤过,制得所述阴性对照液。进一步地,所述中药复方降糖药由重量比为120-140:13.5:13.5:12.0:14.1:13.5:0.6:58的中药复方降糖药干浸膏、人参粉、黄连粉、羧甲淀粉钠、滑石粉、微粉硅胶、硬脂酸镁、95%乙醇制备而成。进一步地,所述中药复方降糖药干浸膏由重量比为220.5:40.5:20.5:81.0:60.75:81.0:81.0:60.75:27.0的天花粉、杜仲、黄芪、丹参、枸杞子、沙苑子、白芍、知母、五味子制备而成。进一步地,所述测定方法还包括取10μl格列本脲对照品溶液,采用液相色谱法进行测量,记录色谱图,所述格列本脲对照品溶液的配制方法为取格列本脲对照品12.5mg,精密称定,置50ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,制得所述格列本脲对照品溶液。进一步地,所述测定方法还包括取10μl混合杂质对照品溶液,采用液相色谱法进行测量,记录色谱图,所述混合杂质对照品溶液的配制方法为取格列本脲杂质i与格列本脲杂质ii,置于同一容器中,加甲醇溶解并稀释至刻度,混合均匀,所述混合杂质对照品溶液的浓度为40-60μg/ml,所述格列本脲杂质i为4-[2-(5-氯-2-甲氧基苯甲酰氨基)乙基]苯磺酸胺,所述格列本脲杂质ii为n-[4-[2-(5-氯-2-甲氧基苯甲酰氨基)乙基]苯磺酰基]氨基甲酸乙酯。进一步地,所述测定方法还包括取10μl系统适用性试验液,采用液相色谱法进行测量,记录色谱图,所述系统适用性试验液的配制方法为分别取等量的所述混合杂质对照品溶液与所述格列本脲对照品溶液,混合均匀。与现有技术相比,本发明的优点是测定的中药复方降糖药中格列本脲含量专属性良好;格列本脲进样量在0.1~1.1μg的范围内线性关系良好;加样回收率达99.0%,准确性良好;不同检验员、仪器、色谱柱,并于不同时间试验的重现性良好,且试验液7天内稳定,适用于中药复方降糖药中格列本脲的含量测定。调整磷酸二氢铵溶液-甲醇流动相体积比为3:6-7,在保障色谱适用性的基础上将主峰保留时间提前,提高了检验效率,更利于日常生产过程的质量控制;调整试液浓度至40-60μg,解决了试液浓度过高格列本脲不能从大量粘稠的中药浸膏混合液中完全浸出的问题,进样量调整至0.4-0.6μg,改善了峰型、分离度,克服了中药复杂成分对主峰的干扰,提高了分析方法的准确性。通过对产品质量考察、评价,建立中药复方降糖药质量标准的格列本脲含量测定项,用于产品的质量控制,方法准确、可靠,适用性良好,且分析效率高。格列本脲作为中药复方降糖药中唯一的化药成分,且该成分的重量百分含量较低,建立该成分的质量标准,用于产品的生产过程控制、出厂检验把关,提高了本品质量安全性、有效性、稳定性及均一性的控制水平。附图说明图1为阴性对照液的液相色谱图;图2为供试品溶液的液相色谱图;图3为格列本脲对照品的液相色谱图;图4为混合杂质对照品溶液的液相色谱图;图5为系统适用性试验液的液相色谱图;图6为格列本脲线性回归分析。具体实施方式下面结合具体实施例,进一步阐明本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。一种中药复方降糖药中格列本脲含量测定方法,包括以下步骤:使用c185μm250mm×4.6mm色谱柱;采用体积比为3:5-7的磷酸二氢铵溶液-甲醇为流动相,其中磷酸二氢铵溶液浓度为0.05mol/l,用磷酸调节ph至3.5±0.05;检测波长为300nm;流速为1.0ml/min;理论塔板数按格列本脲计不低于2000;测量并记录色谱图,按外标法以峰面积计算,得到中药复方降糖药中格列本脲的含量。配制对照品溶液,对照品溶液为格列本脲对照品甲醇溶液,格列本脲对照品甲醇溶液的浓度为40-60μg/ml。配制供试品溶液,供试品溶液为中药复方降糖药甲醇溶液,中药复方降糖药甲醇溶液中的格列本脲浓度为40-60μg/ml;供试品溶液的配制方法为取中药复方降糖药至容器中,加入甲醇,进行超声处理30min,取出,冷却后称重,用甲醇补足减轻的重量,摇匀、过滤;分别取对照品溶液、供试品溶液0.1-1.1μl注入液相色谱仪。配制阴性对照液,配制方法为按中药复方降糖药配方取除格列本脲的其它成分混合均匀,称取0.64-0.96g,加甲醇25ml,超声处理30min,摇匀,滤过,制得阴性对照液。所述中药复方降糖药由重量比为120-140:13.5:13.5:12.0:14.1:13.5:0.6:58的中药复方降糖药干浸膏、人参粉、黄连粉、羧甲淀粉钠、滑石粉、微粉硅胶、硬脂酸镁、95%乙醇制备而成。所述中药复方降糖药干浸膏由重量比为220.5:40.5:220.5:81.0:60.75:81.0:81.0:60.75:27.0的天花粉、杜仲、黄芪、丹参、枸杞子、沙苑子、白芍、知母、五味子制备而成。配制混合杂质对照品溶液,配制方法为取格列本脲杂质i与格列本脲杂质ii,置于同一容器中,加甲醇溶解并稀释至刻度,混合均匀,混合杂质对照品溶液的浓度为40-60μg/ml,所述格列本脲杂质i为4-[2-(5-氯-2-甲氧基苯甲酰氨基)乙基]苯磺酸胺,所述格列本脲杂质ii为n-[4-[2-(5-氯-2-甲氧基苯甲酰氨基)乙基]苯磺酰基]氨基甲酸乙酯。配制系统适用性试验液,配制方法为分别取等量的混合杂质对照品溶液与格列本脲对照品溶液,混合均匀。实施例1色谱条件与系统适用性试验:diamonsilc18(2)5μm250mm×4.6mm色谱柱;以磷酸二氢铵溶液(取磷酸二氢铵1.725g加水300ml使溶解,用磷酸调节ph至3.5±0.05)-甲醇(3:7)为流动相;检测波长为300nm;流速1.0ml/min;理论塔板数按格列本脲计不低于2000。1.系统适用性(专属性)a.中药复方降糖药干浸膏由重量比为220.5:40.5:220.5:81.0:60.75:81.0:81.0:60.75:27.0的天花粉、杜仲、黄芪、丹参、枸杞子、沙苑子、白芍、知母、五味子制备而成。取重量比为120-140:13.5:13.5:12.0:14.1:13.5:0.6:58的中药复方降糖药干浸膏、人参粉、黄连粉、羧甲淀粉钠、滑石粉、微粉硅胶、硬脂酸镁、95%乙醇0.8g混合均匀,加甲醇25ml,超声处理30min,摇匀,滤过,制得阴性对照液。b.取中药复方降糖药供试品,依法制得供试品溶液(批号:1809205)。取中药复方降糖药10粒,取内容物混匀,研细,取0.8g,精密称定,置50ml具塞锥形瓶中,精密加入甲醇25ml,称定重量,超声处理30min,取出,放冷,称定重量,用甲醇补足减失的重量,摇匀,滤过,既得供试品溶液。c.取格列本脲对照品,依法制得对照品溶液。取格列本脲对照品12.5mg,精密称定,置250ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,既得格列本脲对照品溶液。d.取格列本脲杂质i与格列本脲杂质ii各10mg,精密称定,置同一200ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,既得混合杂质对照品溶液。其中格列本脲杂质i为4-[2-(5-氯-2-甲氧基苯甲酰氨基)乙基]苯磺酸胺,格列本脲杂质ii为n-[4-[2-(5-氯-2-甲氧基苯甲酰氨基)乙基]苯磺酰基]氨基甲酸乙酯。e.分别取等量的混合杂质对照品溶液与格列本脲对照品溶液,混匀,作为系统适用性试验液。分别精密量取上述溶液各10μl注入液相色谱仪,记录色谱图,如附图1-5所示;格列本脲对照品溶液连续进样5针,所得数据如表1所示。可知本法测定试样的阴性对照无干扰,已知杂质及试样中相邻杂质与主峰分离度良好,且连续进样的峰面积rsd值为0.2%,本法系统适用性、专属性良好,保留时间缩短至8min,每针采集时间约12分钟,在保障色谱适用性的基础上将主峰保留时间提前,提高了检验效率,更利于日常生产过程的质量控制。2.线性关系试验精密量取格列本脲对照品溶液1ml、3ml、5ml、7ml、9ml、11ml分别置于25ml量瓶中,加甲醇溶解并稀释至刻度,制得线性关系试验液。分别精密量取上述溶液各10μl注入液相色谱仪,记录色谱图,计算线性回归方程为y=0.7416x+1.175,r=0.99997,如附图6所示。结果表明,格列本脲进样量在0.1~1.1μg的范围内线性关系良好。3.准确度(加样回收)试验按处方取中药复方降糖药干浸膏、人参粉、黄连粉及其它辅料混合均匀,作为阴性试样;取阴性试样7.2g,置于250ml量瓶中,另取格列本脲对照品12.5mg,精密称定,置于同一量瓶中,加甲醇使溶解并稀释至刻度,摇匀,作为加样回收试液,平行制备3份;另同法制备格列本脲加入量为10mg、15mg的试验液各3份。依法检测,计算回收率。结果如表2所示,结果表明本法加样回收率平均达99.0%,9份平行试验的rsd为0.21%,本法准确性良好。4.重现性取同一批供试品(批号:1809205),由三名检验员,分别于不同日期,使用三台高效液相色谱,及三个不同品牌的色谱柱,按第1项分别制备阴性对照液、供试品溶液、格列本脲对照品溶液、混合杂质对照品溶液、系统适用性试验液,并依法检测。如表3所示,三名检验员检验结果的rsd值为0.8%,本法重现性良好。5.稳定性取本品(批号:1809205),按第1项分别制备对照品溶液、供试品溶液,并依法检测,计算本品格列本脲含量;将该对照品溶液与供试品溶液于30℃密封贮存7天,依法测定,计算本品格列本脲含量,如表4所示,与0天比较,rsd值为0.2%,本法试验液7天内稳定性良好。6.产品检验按本法进行了共12批中药复方降糖药产品的检验。按工艺总混后于放料的前中后段随机取样5份,分别依法测定含量(单位:mg/0.4g)。考察结果如表5所示,总混后格列本脲含量均匀性良好(rsd≤3.0%),但因本品为中药浸膏制剂,批间差异相对较大。表1.同一对照品溶液连续进样的精密度no.iiiiiiivvrsd峰面积367.18283368.74658367.60495369.23865368.481260.23%表2.方法加样回收分析表表3.方法复现性分析表表4.试液稳定性分析表表5.中药复方降糖药产品检验结果统计表实施例2色谱条件与系统适用性试验:diamonsilc18(2)5μm250mm×4.6mm色谱柱;以磷酸二氢铵溶液(取磷酸二氢铵1.725g加水300ml使溶解,用磷酸调节ph至3.5±0.05)-甲醇(3:6)为流动相;检测波长为300nm;流速1.0ml/min;理论塔板数按格列本脲计不低于2000。a.中药复方降糖药干浸膏由重量比为220.5:40.5:220.5:81.0:60.75:81.0:81.0:60.75:27.0的天花粉、杜仲、黄芪、丹参、枸杞子、沙苑子、白芍、知母、五味子制备而成。取重量比为120-140:13.5:13.5:12.0:14.1:13.5:0.6:58的中药复方降糖药干浸膏、人参粉、黄连粉、羧甲淀粉钠、滑石粉、微粉硅胶、硬脂酸镁、95%乙醇0.8g混合均匀,加甲醇25ml,超声处理30min,摇匀,滤过,制得阴性对照液。b.取中药复方降糖药供试品,依法制得供试品溶液(批号:1809205)。取中药复方降糖药10粒,取内容物混匀,研细,取0.8g,精密称定,置50ml具塞锥形瓶中,精密加入甲醇25ml,称定重量,超声处理30min,取出,放冷,称定重量,用甲醇补足减失的重量,摇匀,滤过,既得供试品溶液。c.取格列本脲对照品,依法制得对照品溶液。取格列本脲对照品12.5mg,精密称定,置250ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,既得格列本脲对照品溶液。d.取格列本脲杂质i与格列本脲杂质ii各10mg,精密称定,置同一200ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,既得混合杂质对照品溶液。其中格列本脲杂质i为4-[2-(5-氯-2-甲氧基苯甲酰氨基)乙基]苯磺酸胺,格列本脲杂质ii为n-[4-[2-(5-氯-2-甲氧基苯甲酰氨基)乙基]苯磺酰基]氨基甲酸乙酯。e.分别取等量的混合杂质对照品溶液与格列本脲对照品溶液,混匀,作为系统适用性试验液。分别精密量取上述溶液各10μl注入液相色谱仪,记录色谱图,如附图1-5所示;格列本脲对照品溶液连续进样5针,所得数据如表1所示。可知本法测定试样的阴性对照无干扰,已知杂质及试样中相邻杂质与主峰分离度良好,且连续进样的峰面积rsd值为0.2%,本法系统适用性、专属性良好。保留时间缩短至10min,每针采集时间约13分钟,在保障色谱适用性的基础上将主峰保留时间提前,提高了检验效率,更利于日常生产过程的质量控制。综上,磷酸二氢铵溶液-甲醇流动相比例为3:7时,保留时间为8min,现有技术中采用的磷酸二氢铵溶液-甲醇流动相比例为3:5,当流动相比例为3:5时,保留时间约12min,每针采集时间通常不少于18min,通过调整流动相比例,使保留时间缩短约30%,明显提高检测效率。通过实验验证得,当磷酸二氢铵溶液-甲醇流动相比例调整至3:8、3:9或更小时,无法保证检测正常进行。本法测定中药复方降糖药中格列本脲含量专属性良好;格列本脲进样量在0.1~1.1μg的范围内线性关系良好;加样回收率达99.0%,准确性良好;不同检验员、仪器、色谱柱,并于不同时间试验的重现性良好,且试验液7天内稳定,本法适用于中药复方降糖药中格列本脲的含量测定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1