基于代谢标记物检测食品中金黄色葡萄球菌活菌的方法与流程
本发明属于食品检测技术领域,具体涉及基于代谢标记物检测食品中金黄色葡萄球菌活菌的方法。
背景技术:
金黄色葡萄球菌广泛存在于自然界中,如空气、水及人和动物的排泄物中等。人和动物的皮肤、粘膜,特别是鼻咽部带菌率均较高,30%~80%的人群为该病原菌的携带者,因此金黄色葡萄球菌污染食品的几率较大。金黄色葡萄球菌易污染的食品主要有奶、肉、蛋、鱼及其制品,是引起食物中毒的主要病原菌之一。据美国疾病控制中心(cdc)报告,33%的细菌性食物中毒是由金黄色葡萄球菌引起的,在加拿大占比达到45%,在一些欧洲国家如芬兰、匈牙利等更高达50%以上。在我国,金黄色葡萄球菌引起的食物中毒占细菌性食物中毒事件的32.5%(alarconb,vicedob,aznarr.pcrbasedproceduresfordetectionandquantificationofstaphylococcusaureusandtheirapplicationinfood[j].journalofappliedmicrobiology,2006,100(2):352-364.tangjn,zhangr,chenj,etal.incidenceandcharacterizationofstaphylococcusaureusstrainsisolatedfromfoodmarkets[j].annalsofmicrobiology,2015,65(1):279-286.)。
金黄色葡萄球菌在污染了营养丰富的食品后,生长条件适宜的情况下,8~10h内即可迅速繁殖且产生足量的肠毒素从而引起食物中毒。金黄色葡萄球菌污染食品的主要途径有:①加工前污染,如所采用的原材料受到污染;②加工过程中污染,如加工仪器设备消毒不彻底或食品加工人员携带金黄色葡萄球菌等;③加工后污染(运输及销售过程中污染)、食用过程时交叉污染等其它原因。由金黄色葡萄球菌引起的食物中毒事件仍是威胁广大消费者生命健康的主要食品安全问题之一。
如何快速准确地检测金黄色葡萄球菌是预防其大规模食物中毒爆发的关键环节。目前,对金黄色葡萄球菌的检测方法主要包括细菌培养法、免疫学试验和基于特异性基因的pcr检测方法。细菌培养法和免疫学试验存在耗时费力、操作繁琐等缺点。传统的pcr技术不易区分死活菌,容易造成假阳性的结果。开发准确快速的金黄色葡萄球菌活菌检测技术就显得至关重要。随着分析化学技术的进步,挖掘各种微生物的特征性代谢产物目前已成为病原微生物快速检测和鉴定研究的一个重要方向。但是由于食品中微生物污染并不是仅仅为单一金黄色葡萄球菌的污染,因此,其他杂菌的存在往往影响金黄色葡萄球菌特征性代谢产物的特异性和稳定性。
技术实现要素:
有鉴于此,本发明的目的在于提供基于代谢标记物检测食品中金黄色葡萄球菌活菌的方法,使所述检测方法具有检测准确性高,重复性好的特点。
本发明提供的基于代谢标记物检测食品中金黄色葡萄球菌活菌的方法,包括以下步骤:
1)将待测食品样本转移至质量浓度7.5%氯化钠肉汤中,经增菌培养,得到培养液;
2)从步骤1)中所述培养液中萃取挥发性代谢产物,将得到的挥发性代谢产物用气相色谱质谱联用仪分析,得到离子流色谱图;
3)当步骤2)中所述离子流色谱图中存在3-甲基丁酸的特征峰,判断待测食品样本污染了金黄色葡萄球菌;当离子流色谱图中不存在3-甲基丁酸的特征峰,判断待测食品样本中没有污染金黄色葡萄球菌。
优选的,步骤2)中所述萃取是采用50/30μm二乙基苯/碳分子筛/聚二甲基硅氧烷萃取头进行。
优选的,步骤2)中所述萃取的过程依次包括预孵化和萃取;
所述预孵化的温度为80℃;所述预孵化的时间为10min;
所述萃取的时间为30min;萃取期间伴随80℃加热。
优选的,步骤2)中所述气相色谱质谱联用仪进行气相色谱分析时,所述气相色谱分析的条件如下:
长×宽×粒径分别为30m×0.25mm×0.25μm的tr-ffap色谱柱;
不分流模式,不分流1min之后分流比为50:1;流速1ml/min;
升温程序:40℃保持3min,7℃/min升温至220℃并保持2min;载气为99.999%氦气;进样口温度230℃;解吸时间2min。
优选的,步骤2)中所述气相色谱质谱联用仪进行质谱分析时,所述质谱分析的条件如下:
电子电离源,电子能量70ev;离子源温度250℃;传输线温度220℃;
选择离子流扫描模式;所述选择离子流扫描参数:扫描时间为0~14.99min;扫描质量碎片为86amu,71amu,41amu和43amu。扫描时间为15.00~30.71min;扫描质量碎片为60amu、87amu、45amu和43amu。
优选的,步骤1)中所述增菌培养的温度为35~37℃;所述增菌培养过程伴随振荡培养;所述振荡培养的转速为200~250r/min。
优选的,步骤1)中所述增菌培养的时间为20~22h。
优选的,步骤1)中所述待测食品样本包括肉类、蛋奶类、谷稻类或蔬菜类。
优选的,步骤1)中所述待测食品样本包括由金黄色葡萄球菌、大肠杆菌和肠炎沙门氏菌中一种或多种微生物污染的食品。
优选的,步骤1)中所述接种时接种量为5%~10%。
本发明提供了基于代谢标记物检测食品中金黄色葡萄球菌活菌的方法,根据实验表明,金黄色葡萄球菌与其他杂菌(包括大肠杆菌和肠炎沙门氏菌)共同污染食品时,不影响金黄色葡萄球菌释放3-甲基丁酸代谢物,虽然3-甲基丁酸的含量会随着杂菌的种类和含量的增加而降低,但是仍能用气质联用仪检测到3-甲基丁酸,说明3-甲基丁酸物质较为稳定,适合作为检测金黄色葡萄球菌活菌的检测代谢标志物。同时,对于含有多种微生物污染的食品,虽然与其他杂菌(包括大肠杆菌和肠炎沙门氏菌)共同存在于食品中的金黄色葡萄球菌的含量明显低于其他微生物的含量,但是其产生的挥发性代谢物3-甲基丁酸仍然通过气质联用仪准确检测到,这说明本发明提供的方法以3-甲基丁酸作为代谢标志物来检测食品中金黄色葡萄球菌具有检测准确性高、重复性好,适用范围广的特点,大大简化了以往常规技术中检测金黄色葡萄球菌的繁琐操作。
同时,本发明提供的方法,是以活菌的代谢产物为检测标志物进行检测,因此能够清楚得到食品中存在的金黄色葡萄球菌为活菌状态,克服了常规技术中pcr方法的检出结果不能区分死菌还是活菌的弊端。此外,本发明提供的方法还具有检测周期短的特点,相对于传统培养法至少需要42h,pcr检测法需要24h,本发明提供的基于挥发性代谢标记物检测法大约仅需要22h,进一步提高了实验效率。
附图说明
图1为7.5%nacl肉汤中不同时间点3-甲基丁酸提取离子流色谱图,其中图1-a为7.5%nacl肉汤中在培养12h、16h时间点3-甲基丁酸提取离子流色谱图;图1-b为7.5%nacl肉汤中在培养20h、24h时间点3-甲基丁酸提取离子流色谱图;
图2为金黄色葡萄球菌培养物和空白培养基的3-甲基丁醛在不同时间点得到的提取离子流色谱图,其中图2-a为金黄色葡萄球菌培养物和空白培养基的3-甲基丁醛在12h、16h时间点得到的提取离子流色谱图,图2-b为金黄色葡萄球菌培养物和空白培养基的3-甲基丁醛在20h、24h时间点得到的提取离子流色谱图;
图3为不同金黄色葡萄球菌菌株3-甲基丁酸的释放规律曲线;
图4为不同金黄色葡萄球菌的菌体生长情况;
图5为金黄色葡萄球菌和大肠杆菌按照数量比1:1混合培养时菌体生长与3-甲基丁酸释放规律曲线;
图6为金黄色葡萄球菌和大肠杆菌按照数量比1:10混合培养时菌体生长与3-甲基丁酸释放规律曲线;
图7为金黄色葡萄球菌和大肠杆菌按照数量比1:100混合培养时菌体生长与3-甲基丁酸释放规律曲线;
图8为金黄色葡萄球菌和肠炎沙门氏菌按照数量比1:1混合培养时菌体生长与3-甲基丁酸释放规律曲线;
图9为金黄色葡萄球菌和肠炎沙门氏菌按照数量比1:10混合培养时菌体生长与3-甲基丁酸释放规律曲线;
图10为金黄色葡萄球菌和肠炎沙门氏菌按照数量比1:100混合培养时菌体生长与3-甲基丁酸释放规律;
图11为金黄色葡萄球菌、大肠杆菌和肠炎沙门氏菌按照数量比1:1:1混合培养时菌体生长与3-甲基丁酸释放规律曲线;
图12为生鲜猪肉样品金黄色葡萄球菌16srrnapcr扩增产物电泳图;
图13为生乳样品金黄色葡萄球菌16srrnapcr扩增产物电泳图;
图14为米饭样品金黄色葡萄球菌16srrnapcr扩增产物电泳图。
具体实施方式
本发明提供的基于代谢标记物检测食品中金黄色葡萄球菌活菌的方法,包括以下步骤:
1)将待测食品样本转移至质量浓度7.5%氯化钠肉汤中,经增菌培养,得到培养液;
2)从步骤1)中所述培养液中萃取挥发性代谢产物,将得到的挥发性代谢产物用气相色谱质谱联用仪分析,得到离子流色谱图;
3)当步骤2)中所述离子流色谱图中存在3-甲基丁酸的特征峰,判断待测食品样本污染了金黄色葡萄球菌;当离子流色谱图中不存在3-甲基丁酸的特征峰,判断待测食品样本中没有污染金黄色葡萄球菌。
本发明将待测食品样本转移至质量浓度7.5%氯化钠肉汤中,经增菌培养,得到培养液。
在本发明中,所述待测食品样本优选包括肉类、蛋奶类、谷稻类或蔬菜类。所述待测食品样本包括由多种微生物污染的食品。为了具体说明本发明检测食品的范围,本发明以大肠杆菌和肠炎沙门氏菌作为代表,说明这两种菌的存在对检测金黄色葡萄球菌的影响。在本发明实施例中,所述待检测样本模拟由金黄色葡萄球菌、大肠杆菌和肠炎沙门氏菌中一种或多种微生物污染的食品。
本发明对所述接种的操作没有特殊限制,采用本领域所熟知的操作手段即可。所述接种时接种量为5%~10%,更优选为8%。接种后,优选对接种有待测食品样本的7.5%氯化钠肉汤进行均质。本发明对所述均质没有特殊限制,采用本领域所熟知的均质手段即可。所述均质有利于待测食品样本充分混合在氯化钠肉汤中,以便微生物快速繁殖。
在本发明中,所述增菌培养的温度优选为35~37℃,更优选为36℃。所述增菌培养过程优选伴随振荡培养;所述振荡培养的转速优选为200~250r/min,更优选为220~240r/min。所述增菌培养的时间优选为20~22h,更优选为21h。
得到培养液后,本发明从所述培养液中萃取挥发性代谢产物,将得到的挥发性代谢产物用气相色谱质谱联用仪分析,得到离子流色谱图。
在本发明中,所述萃取优选是采用50/30μm二乙基苯/碳分子筛/聚二甲基硅氧烷萃取头进行。所述萃取的过程优选依次包括预孵化和萃取;所述预孵化的温度优选为80℃;所述预孵化的时间优选为10min。所述萃取的时间为30min;萃取期间伴随80℃加热。所述萃取过程优选在thermotriplus顶空自动进样器的孵化器中进行。
在本发明中,所述气相色谱质谱联用仪进行气相色谱分析时,所述气相色谱分析的条件优选如下:
长×宽×粒径分别为30m×0.25mm×0.25μm的tr-ffap色谱柱;
不分流模式,不分流1min之后分流比为50:1;流速1ml/min;
升温程序:40℃保持3min,7℃/min升温至220℃并保持2min;载气为99.999%氦气;进样口温度230℃;解吸时间2min。
在本发明中,所述气相色谱质谱联用仪进行质谱分析时,所述质谱分析的条件优选如下:
电子电离源,电子能量70ev;离子源温度250℃;传输线温度220℃;
选择离子流扫描模式;所述选择离子流扫描参数:扫描时间为0~14.99min;扫描质量碎片为86amu,71amu,41amu和43amu。扫描时间为15.00~30.71min;扫描质量碎片为60amu、87amu、45amu和43amu。
得到离子流色谱图后,本发明根据离子流色谱图中3-甲基丁酸的特征峰的有无判断待检测样本中是否存在金黄色葡萄球菌活菌,具体判断方法如下:当离子流色谱图中存在3-甲基丁酸的特征峰,判断待测食品样本污染了金黄色葡萄球菌;当离子流色谱图中不存在3-甲基丁酸的特征峰,判断待测食品样本中没有污染金黄色葡萄球菌。所述3-甲基丁酸的特征峰位于离子流色谱图中保留时间为17.0~17.5min之间。
下面结合实施例对本发明提供的基于代谢标记物检测食品中金黄色葡萄球菌活菌的方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
1材料与仪器
(1)实验材料
金黄色葡萄球菌参考菌株(staphylococcusaureusatcc6538,staphylococcusaureusatcc43300),购自美国模式培养物集存库;大肠杆菌o157:h7参考菌株(escherichiacolio157:h7cicc21530)和肠炎沙门氏菌参考菌株(salmonellaenteritidiscicc21482),购自中国工业微生物菌种保藏管理中心;金黄色葡萄球菌分离菌株(编号分别为127、134、137、140、y4、b83、h5和f19),上述菌株保存于西南民族大学食品质量与安全实验室。
(2)主要实验材料、试剂及培养基
表1实验材料及培养基
(3)主要实验仪器与设备
表2主要仪器与设备
2实验方法
(1)细菌的活化
从冻藏的保菌管中吸取50μl金黄色葡萄球菌冷冻保藏菌液接种于灭菌后的5mltsb培养基中,放入36℃,200r/min恒温振荡培养13h。勾取一环金黄色葡萄球菌培养液,划线于bp平板上,在36℃条件下,培养24h,至平板上长出灰黑色至黑色且周围绕以浑浊带和透明圈的菌落,备用。
从冻藏的保菌管中吸取50μl大肠杆菌冷冻保藏菌液接种于灭菌后的5mltsb培养基中,放入36℃,200r/min恒温振荡培养13h。勾取一环大肠杆菌培养液,划线于ct-smac平板上,在36℃±1℃条件下,培养24h±1h,至平板上长出灰褐色的菌落,备用。
从冻藏的保菌管中吸取50μl肠炎沙门氏菌冷冻保藏菌液接种于灭菌后的5mltsb培养基中,放入36℃±1℃,200r/min恒温振荡培养13h。勾取一环肠炎沙门氏菌培养液,划线于xld平板上,在36℃±1℃条件下,培养24h±1h,至平板上长出中心有黑点的无色透明菌落,备用。
(2)样品的制备
1)金黄色葡萄球菌挥发性代谢标记物的特异性分析
从平板上挑取s.aureus6538、e.colio157:h721530和s.enteritidis21482典型菌落分别接入5mltsb培养基中,于36℃±1℃,200r/min条件下培养13h。然后,将该新鲜培养物进行梯度稀释至10-5,分别吸取s.aureus6538菌悬液240μl、e.colio157:h721530菌悬液120μl或s.enteritidis21482菌悬液120μl分别接入400ml无菌7.5%氯化钠肉汤中,使初始接种量分别为100cfu/ml,于36℃、200r/min条件下增菌培养至12h、16h、20h和24h,取样测定挥发性代谢标记物,每个时间点做3个平行样品。挥发性代谢产物采用气质联用仪测定,采用50/30μmdvb/car/pdms萃取头,在80℃预孵化10min,萃取30min。气相色谱分析条件如下:tr-ffap色谱柱(30m×0.25mm×0.25μm);不分流模式,不分流1min之后分流比为50:1;流速1ml/min;升温程序:40℃保持3min,7℃/min升温至220℃并保持2min;载气为99.999%氦气;进样口温度230℃;解吸时间2min。质谱定性分析条件如下:电子电离源,电子能量70ev;离子源温度250℃;传输线温度220℃;选择离子流扫描模式(sim),参数见表3。
表3选择离子流扫描参数
注:1扫描物质是3-甲基丁醛,2扫描物质是3-甲基丁酸。
以不接种任何细菌的7.5%氯化钠肉汤为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。进行两次重复试验。
3-甲基丁酸的特异性结果见表4。
表47.5%氯化钠肉汤中3-甲基丁酸的检测结果(单位:counts×sec)
注:-表示检出量低于空白,记作没有产生。
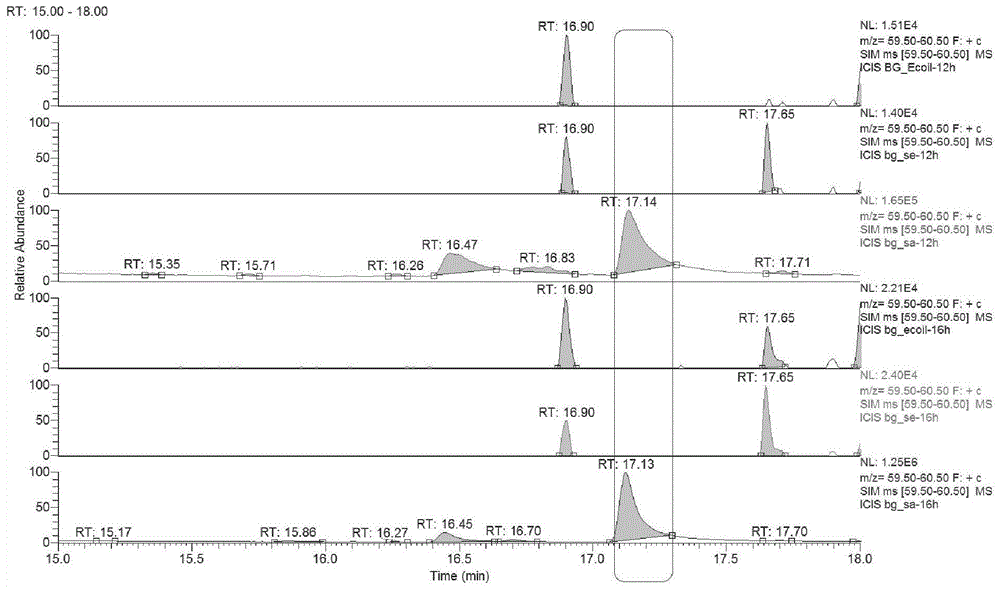
图1为3-甲基丁酸提取离子流色谱图,其中图中方框内色谱峰为3-甲基丁酸(rt=17.12~17.14min),由上到下依次为大肠杆菌、沙门氏菌和金黄色葡萄球12h培养物,大肠杆菌、沙门氏菌和金黄色葡萄球16h培养物,大肠杆菌、沙门氏菌和金黄色葡萄球20h培养物,大肠杆菌、沙门氏菌和金黄色葡萄球24h培养物。
由表4和图1可知,在7.5%氯化钠肉汤中,培养至12h、16h、20h和24h时只有金黄色葡萄球菌能检出3-甲基丁酸,大肠杆菌o157:h7和肠炎沙门氏菌都没有检出3-甲基丁酸。因此,3-甲基丁酸可以作为金黄色葡萄球菌的特征挥发性代谢标记物。
3-甲基丁醛的检测结果见表5。
表53-甲基丁醛的检测结果(单位:counts×sec)
注:-表示检出量低于空白,记作没有产生。
图2为金黄色葡萄球菌培养物和空白培养基的3-甲基丁醛提取离子流色谱图,其中图中方框内色谱峰为3-甲基丁醛(rt=2.97~2.99min),样品由上到下依次为7.5%nacl肉汤空白,s.aureus6538的12h培养物,12h培养物扣除空白;7.5%nacl肉汤空白,s.aureus6538的16h培养物,16h培养物扣除空白;7.5%nacl肉汤空白,s.aureus6538的20h培养物,20h培养物扣除空白;7.5%nacl肉汤空白,s.aureus6538的24h培养物,24h培养物扣除空白。
由表5和图2可见,以不接种金黄色葡萄球菌的7.5%氯化钠肉汤为空白样品,与接种了金黄色葡萄球菌的7.5%氯化钠肉汤培养物进行比较,发现空白样品和培养样品都检出了一定强度的3-甲基丁醛,但是当培养样品检出强度扣除空白样品检出强度以后,3-甲基丁醛没有表现出净增长。说明3-甲基丁醛不能作为金黄色葡萄球菌的检测标记物。
实施例2
不同金黄色葡萄球菌单独培养
挑取金黄色葡萄球菌典型菌落(编号分别为atcc6538、atcc43300、127、134、137、140、y4、b83、h5和f19)接入5mltsb培养基中,于36℃,200r/min条件下培养13h。然后,将该新鲜培养物进行梯度稀释至10-5,吸取金黄色葡萄球菌菌悬液240μl接入400ml无菌7.5%氯化钠肉汤中,使金黄色葡萄球菌初始接种量为100cfu/ml,于36℃,200r/min条件下培养24h。每隔2h取样按照上述测定方法测定挥发性代谢标记物和金黄色葡萄球菌的生长数量,每个时间点做3个平行样品。所述金黄色葡萄球菌的生长数量的测定方法如下:吸取1ml食物样品的氯化钠肉汤增菌液,经10倍梯度稀释至适宜的稀释度,吸取1ml于灭菌平板中,倒入bp培养基,混摇均匀,置于36℃,培养24h。以不接种金黄色葡萄球菌的7.5%氯化钠肉汤为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。进行两次重复试验。
图3为不同金黄色葡萄球菌菌株3-甲基丁酸的释放规律,图4为不同金黄色葡萄球菌的菌体生长情况。由图3和图4可知,在7.5%氯化钠肉汤中,10株金黄色葡萄球菌单独生长至6~10h时3-甲基丁酸信号强度出现首次显著增长(p<0.05),对应的菌体生长量在0.05~2.46×107cfu/g;在整个培养过程中,3-甲基丁酸信号呈持续增长趋势,24h时达到最大值0.05~1.68×108counts×sec,对应的菌体生长量为0.86~1.21×1013cfu/g。其中,24h时s.aureus6538产生的3-甲基丁酸为1.09×108counts×sec,菌体生长量为9.55×1012cfu/g。
实施例3
金黄色葡萄球菌与大肠杆菌混合样本培养
①金黄色葡萄球菌和大肠杆菌(数量比为1:1)混合培养
挑取s.aureus6538和e.colio157:h721530典型菌落分别接入5mltsb中,于36℃,200r/min条件下培养13h。然后,将该新鲜培养物进行梯度稀释至10-5,分别吸取s.aureus6538菌悬液240μl和e.colio157:h721530菌悬液120μl同时接入400ml无菌7.5%氯化钠肉汤中,使s.aureus6538和e.colio157:h721530初始接种量均为100cfu/ml(s.aureus6538和e.colio157:h721530的数量比为1:1),于36℃±1℃,200r/min条件下增菌培养24h。每隔2h取样测定挥发性代谢标记物和s.aureus6538的生长数量,每个时间点做3个平行样品。以不接种s.aureus6538和e.colio157:h721530的7.5%氯化钠肉汤为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。进行两次重复试验。
图5为金黄色葡萄球菌和大肠杆菌(1:1)混合培养时菌体生长与3-甲基丁酸释放规律曲线。
由图5可知,在7.5%氯化钠肉汤中,s.aureus6538和e.colio157:h721530(1:1)混合生长至14h时3-甲基丁酸信号强度出现首次显著增长(p<0.05),之后逐渐上升,24h时达到3.36×107counts×sec。与s.aureus6538单独培养相比,3-甲基丁酸的信号强度降低。s.aureus6538的对数生长期大约在2h~10h之间,之后进入稳定期,最终菌体生长量可以达到1012cfu/g,与s.aureus6538单独培养时菌体生长量相近。
②金黄色葡萄球菌和大肠杆菌(1:10)混合培养
挑取s.aureus6538和e.colio157:h721530典型菌落分别接入5mltsb中,于36℃±1℃,200r/min条件下培养13h。然后,将s.aureus6538新鲜培养物梯度稀释至10-5、e.colio157:h721530新鲜培养物梯度稀释至10-4,分别吸取10-5s.aureus6538菌悬液240μl和10-4e.colio157:h721530菌悬液120μl同时接入400ml无菌7.5%氯化钠肉汤中,使s.aureus6538初始接种量为100cfu/ml,e.colio157:h721530初始接种量为1000cfu/ml(s.aureus6538和e.colio157:h721530数量比为1:10),于36℃,200r/min条件下增菌培养24h。每隔2h取样测定挥发性代谢标记物和s.aureus6538的生长数量,每个时间点做3个平行样品。以不接种s.aureus6538和e.colio157:h721530的7.5%氯化钠肉汤为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。进行两次重复试验。
图6为金黄色葡萄球菌和大肠杆菌(1:10)混合培养时菌体生长与3-甲基丁酸释放规律曲线。
由图6可知,在7.5%氯化钠肉汤中,s.aureus6538和e.colio157:h721530(1:10)混合生长至12h时3-甲基丁酸信号强度出现首次显著增长(p<0.05),之后逐渐上升,24h时达到2.72×107counts×sec。与s.aureus6538单独培养相比,3-甲基丁酸的信号强度降低,与s.aureus6538和e.colio157:h721530(1:1)的信号强度相近。s.aureus6538的对数生长期大约在0h~6h之间,之后进入稳定期,最终菌体生长量可以达到1012cfu/g,与s.aureus6538单独培养时菌体生长量相近。
③金黄色葡萄球菌和大肠杆菌(1:100)混合培养
挑取s.aureus6538和e.colio157:h721530典型菌落分别接入5mltsb中,于36℃,200r/min条件下培养13h。然后,将s.aureus6538新鲜培养物梯度稀释至10-5、e.colio157:h721530新鲜培养物梯度稀释至10-3,分别吸取10-5s.aureus6538菌悬液240μl和10-3e.colio157:h721530菌悬液120μl同时接入400ml无菌7.5%氯化钠肉汤中,使s.aureus6538初始接种量为200cfu/ml,e.colio157:h721530初始接种量为20000cfu/ml(s.aureus6538与e.colio157:h721530的数量比为1:100),于36℃±1℃,200r/min条件下增菌培养24h。每隔2h取样测定挥发性代谢标记物和s.aureus6538的生长数量,每个时间点做3个平行样品。以不接种s.aureus6538和e.colio157:h721530的7.5%氯化钠肉汤为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。进行两次重复试验。
图7为金黄色葡萄球菌和大肠杆菌(1:100)混合培养时菌体生长与3-甲基丁酸释放规律曲线。
由图7可知,在7.5%氯化钠肉汤中,s.aureus6538和e.colio157:h721530(1:100)混合生长至14h时3-甲基丁酸信号强度出现首次显著增长(p<0.05),之后逐渐上升,24h时达到5.21×107counts×sec。与s.aureus6538单独培养相比,3-甲基丁酸得信号强度降低,与s.aureus6538和e.colio157:h721530(1:1,1:10)的信号强度相似。s.aureus6538的对数生长期大约在0h~6h之间,之后进入稳定期,最终菌体生长量可以达到1012cfu/g,与s.aureus6538单独培养时菌体生长量相近。
4)金黄色葡萄球菌与肠炎沙门氏菌混合污染
①金黄色葡萄球菌和肠炎沙门氏菌(1:1)混合培养
具体培养方法同金黄色葡萄球菌和大肠杆菌(1:1)混合培养。
图8为金黄色葡萄球菌和肠炎沙门氏菌(1:1)混合培养时菌体生长与3-甲基丁酸释放规律曲线。
由图8可知,在7.5%氯化钠肉汤中,s.aureus6538和s.enteritidis21482(1:1)混合生长至12h时3-甲基丁酸信号强度出现首次显著增长(p<0.05),之后逐渐上升,24h时达到1.37×108counts×sec,与s.aureus6538单独培养时3-甲基丁酸的释放量相似。s.aureus6538的对数生长期大约在0h~12h之间,之后进入稳定期,最终菌体生长量可以达到1011cfu/g,略低于s.aureus6538单独培养时菌体生长量。
②金黄色葡萄球菌和肠炎沙门氏菌(1:10)混合培养
具体培养方法同金黄色葡萄球菌和大肠杆菌(1:10)混合培养。
图9为金黄色葡萄球菌和肠炎沙门氏菌(1:10)混合培养时菌体生长与3-甲基丁酸释放规律曲线。
由图9可知,在7.5%氯化钠肉汤中,s.aureus6538和s.enteritidis21482(1:10)混合生长至12h时3-甲基丁酸信号强度出现首次显著增长(p<0.05),之后逐渐上升,24h时达到4.66×107counts×sec,低于s.aureus6538单独培养以及s.aureus6538和s.enteritidis21482(1:1)混合培养。s.aureus6538的对数生长期大约在0h~14h之间,之后进入稳定期,最终菌体生长量可以达到1011cfu/g,略低于s.aureus6538单独培养时菌体生长量。
③金黄色葡萄球菌和肠炎沙门氏菌(1:100)混合培养
具体培养方法同金黄色葡萄球菌和大肠杆菌(1:100)混合培养。
图10为金黄色葡萄球菌和肠炎沙门氏菌(1:100)混合培养时菌体生长与3-甲基丁酸释放规律曲线。
由图10可知,在7.5%氯化钠肉汤中,s.aureus6538和s.enteritidis21482(1:100)混合生长至12h时3-甲基丁酸信号强度出现首次显著增长(p<0.05),之后逐渐上升,24h时达到6.31×107counts×sec,低于s.aureus6538单独培养以及s.aureus6538和s.enteritidis21482(1:1,1:10)混合培养。s.aureus6538的对数生长期大约在0h~12h之间,之后进入稳定期,最终菌体生长量可以达到1011cfu/g,略低于s.aureus6538单独培养时菌体生长量。
5)金黄色葡萄球菌和大肠杆菌、肠炎沙门氏菌(1:1:1)混合污染
挑取s.aureus6538、e.colio157:h721530和s.enteritidis21482典型菌落分别接入5mltsb中,于36℃,200r/min条件下培养13h。然后,将该新鲜培养物进行梯度稀释至10-5,分别吸取s.aureus6538菌悬液240μl、e.colio157:h721530菌悬液120μl和s.enteritidis21482菌悬液120μl同时接入400ml无菌7.5%氯化钠肉汤中,使s.aureus6538、e.colio157:h721530和s.enteritidis21482初始接种量分别为100cfu/ml(s.aureus6538、e.colio157:h721530和s.enteritidis21482的数量比为1:1:1),于36℃,200r/min条件下培养24h。每隔2h取样测定挥发性代谢标记物和s.aureus6538的生长数量的生长数量,每个时间点做3个平行样品。以不接种s.aureus6538、e.colio157:h721530和s.enteritidis21482的7.5%氯化钠肉汤为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。进行两次重复试验。
图11金黄色葡萄球菌、大肠杆菌和肠炎沙门氏菌(1:1:1)混合培养时菌体生长与3-甲基丁酸释放规律曲线。
由图11可知,在7.5%氯化钠肉汤中,s.aureus6538、e.colio157:h7和s.enteritidis21482(1:1:1)混合生长至12h时3-甲基丁酸信号强度出现首次显著增长(p<0.05),之后逐渐上升,24h时达到8.10×107counts×sec,低于s.aureus6538单独培养。s.aureus6538的对数生长期大约在0h~16h之间,之后进入稳定期,最终菌体生长量可以达到1011cfu/g。
对比例1
7.5%氯化钠肉汤中乳酸菌的生长和代谢产物情况
(1)实验材料
干酪乳杆菌(lactobacilluscaseicmcc34103),购自中国医学细菌菌种保藏管理中心。
(2)实验方法
从冻藏的保菌管中吸取50μl干酪乳杆菌cmcc34103冷冻保藏菌液接种于灭菌后的5mlmrs液体培养基中,放入42℃,恒温培养24h。勾取一环干酪乳杆菌培养液,划线于mrs平板上,在42℃条件下,培养48h,至平板上长出乳白色的菌落,备用。
从平板上挑取干酪乳杆菌典型菌落分别接入5mlmrs液体培养基中,于42℃,恒温培养24h。然后,将该新鲜培养物进行梯度稀释后接入400ml无菌7.5%氯化钠肉汤中,使初始接种量分别为100cfu/ml,于37℃恒温下增菌培养至12、16、20和24h,取样测定菌体生长量和挥发性代谢标记物,以不接种干酪乳杆菌的7.5%氯化钠肉汤为空白样品,每个时间点做3个平行样品。
有研究报道(helincketal.,2004;afzaletal.,2017)指出,食品发酵菌种乳酸菌能发酵产生3-甲基丁醛和3-甲基丁酸,因此以干酪乳杆菌cmcc34103为代表接种入7.5%氯化钠肉汤中,观察其生长和目标代谢产物的产生情况。从表6中结果可见,干酪乳杆菌在7.5%氯化钠肉汤中生长被完全抑制,3-甲基丁醛和3-甲基丁酸也没有被检测到。说明7.5%氯化钠肉汤能很好地抑制干酪乳杆菌的生长和代谢活动,可以消除干酪乳杆菌等乳酸菌对金黄色葡萄球菌代谢标记物的干扰。
表6干酪乳杆菌在7.5%氯化钠肉汤中生长和代谢物产生情况
注:-表示检出量低于空白,记作没有产生。
实施例4
生鲜猪肉样品中金黄色葡萄球菌检出情况
采集成都各超市、菜市场、便利店的不同部位的猪精瘦肉20份,每份25g,转移至225ml无菌7.5%氯化钠肉汤中,均质。于36℃,200r/min条件下增菌培养至20h,取样分别进行挥发性代谢产物测定、bp平板培养以及细菌pcr鉴定,每份样品做3个平行。以不培养的猪肉为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。
按照实施例1中的方法检测挥发性代谢产物。所述金黄色葡萄球菌pcr鉴定方法如下:
(1)dna提取:吸取培养20h的7.5%氯化钠肉汤培养物1ml于1.5ml的ep管中,4℃,12000r/min离心2min,收集菌体;加入适量te缓冲溶液充分洗涤菌体,离心弃上清;加入1ml的te缓冲溶液重悬菌体,涡旋使菌体充分混匀;采用微波炉(额定微波频率2.45ghz,最大输出功率800w,微波火力为100)加热2min,离心取上清,-20℃保存。
(2)pcr扩增反应体系为:taqpcrmastermix10μl,10μm的上下游引物各0.8μl,dna模板0.4μl,ddh2o补足20μl体系。
上游引物f-gtgcacatcttgacggtacc5’-3’(seqidno.1);
下游引物r-cgaaggggaaggctctatc5’-3’(seqidno.2)。
产物理论长度565bp。
(3)pcr扩增条件为:95℃预变性5min;进入pcr循环,95℃变性40s,58℃退火50s,72℃延伸40s,35个循环;72℃延伸7min,4℃保存。
(4)pcr产物琼脂糖电泳检测:配置1%琼脂糖凝胶,取5μlpcr扩增产物上样,80v电泳45min,凝胶成像系统观察与储存电泳图片。
表7生鲜猪肉样品中金黄色葡萄球菌生长与代谢标记物检出情况
图12为生鲜猪肉样品金黄色葡萄球菌16srrnapcr扩增产物电泳图,其中阴性为空白对照;m为dl2000dnamarker;阳性对照为s.aureus6538;泳道1-20分别为肉样品1-20。
由表7的结果可知,采集的20份生鲜猪肉样品经7.5%氯化钠肉汤增菌培养20h后,顶空固相微萃取-气相色谱/质谱的结果全部显示检出3-甲基丁酸,峰信号强度在105~106counts×sec。bp平板培养结果也显示全部检出金黄色葡萄球菌,细菌生长量在109~1011cfu/g。对培养的菌液进行pcr鉴定,发现20份样品培养液基因组dna全都能扩增出金黄色葡萄球菌16srrna特异性片段(如图12),表明鉴定结果均为金黄色葡萄球菌。可以看出传统培养法、pcr法和基于挥发性代谢标记物检测方法对于生鲜猪肉样品中金黄色葡萄球菌检测所得结果一致,三种方法结果之间的符合率为100%。
实施例5
生牛乳样品中金黄色葡萄球菌检出情况
采集成都市郊区散养牛场生牛乳样品20份,每份25g,转移至225ml无菌7.5%氯化钠肉汤中,均质。于36℃,200r/min条件下增菌培养至20h,取样分别按照实施例1和实施例2中的方法进行挥发性代谢产物测定、bp平板培养以及细菌pcr鉴定,每份样品做3个平行。以不培养的生牛乳为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。
表8生牛乳样品中金黄色葡萄球菌生长与代谢标记物检出情况
图13为生乳样品金黄色葡萄球菌16srrnapcr扩增产物电泳图,其中:阴性为空白对照;m为dl2000dnamarker;阳性对照为s.aureus6538;泳道1-20分别为生乳样品1-20。
由表8的结果可知,采集的20份生牛乳样品经7.5%氯化钠肉汤增菌培养20h后,顶空固相微萃取-气相色谱/质谱的结果全部显示检出3-甲基丁酸,峰信号强度在105~106counts×sec。bp平板培养结果也显示全部检出金黄色葡萄球菌,细菌生长量在109~1011cfu/g。对培养的菌液进行pcr鉴定,发现20份样品培养液基因组dna全都能扩增出金黄色葡萄球菌16srrna特异性片段(如图13),表明鉴定结果均为金黄色葡萄球菌。可以看出传统培养法、pcr法和基于挥发性代谢标记物检测方法对于生牛乳样品中金黄色葡萄球菌检测所得结果一致,三种方法结果之间的符合率为100%。
实施例6
米饭样品中金黄色葡萄球菌检出情况
采集成都各单位食堂、饭店、外卖的米饭20份,每份25g,转移至225ml无菌7.5%氯化钠肉汤中,均质。于36℃,200r/min条件下增菌培养至20h,取样分别进行挥发性代谢产物测定、bp平板培养以及细菌pcr鉴定,每份样品做3个平行。以不培养的米饭为空白样品,用增菌培养样品的峰面积值扣除空白样品的峰面积值作为产生量。
表9米饭样品中金黄色葡萄球菌生长与代谢标记物检出情况
图14为米饭样品金黄色葡萄球菌16srrnapcr扩增产物电泳图,其中阴性为空白对照;m为dl2000dnamarker;阳性对照为s.aureus6538;泳道1-20分别为米饭样品1-20。
由表9的结果可知,采集的20份米饭样品经7.5%氯化钠肉汤增菌培养20h后,9号样品没有检出3-甲基丁酸,传统培养发也没有检出金黄色葡萄球菌,pcr结果也为阴性,说明9号样品不存在金黄色葡萄球菌的污染。在剩下的19份样品中,顶空固相微萃取-气相色谱/质谱检测结果除2号样品外,其他样品均检出3-甲基丁酸,峰信号强度在105~106counts×sec;而bp平板培养结果显示全部样品检出金黄色葡萄球菌,细菌生长量在106~1011cfu/g,表明代谢标记物检测方法与传统培养方法结果之间的符合率为95%(19/20);对培养液进行pcr鉴定,14号样品基因组dna未能扩增出金黄色葡萄球菌16srrna特异性片段,其余样品基因组dna都能扩增出该片段(如图14),表明代谢标记物检测方法与pcr检测方法之间的符合率为95%(19/20)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>西南民族大学
<120>基于代谢标记物检测食品中金黄色葡萄球菌活菌的方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
gtgcacatcttgacggtacc20
<210>2
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgaaggggaaggctctatc19
- 还没有人留言评论。精彩留言会获得点赞!