一种简易的鱼类染色体核型制备方法与流程
[0001]
本发明涉及细胞生物学技术领域,具体涉及一种简易的鱼类染色体核型制备方法。
背景技术:
[0002]
染色体标本的制备操作简单、价格低廉、实验场地要求低的特点,一直是传统的生物遗传学研究技术,染色体标本制备包括:前处理、低渗处理、固定、滴片、染色以及洗片等步骤,在生物遗传学的许多领域得到了广泛应用。
[0003]
而根据已发布的鱼类染色体制备的标准,目前常规制备鱼类染色体的方法,一般有3种:体细胞体外培养法,体细胞体内培养法以及体细胞直接法,此外,还有胚胎细胞直接法,这个主要是制备胚胎细胞的染色体核型的。但按照常规的染色体制备方法,获取困难、成本较高、制作染色体标本效果差、时间长,并且对于设备依赖性及实验条件更高。
技术实现要素:
[0004]
针对现有技术的不足,本发明提供了一种简易的鱼类染色体核型制备方法,克服了现有技术的不足,在制备鱼类染色体核型最快所需时间只要3-4小时,提高了鱼类染色体核型制备的效率;并且本发明所描述方法未使用离心机分离细胞,降低了实验对仪器的依赖性,避免了离心操作对细胞的影响,提高了制备核型玻片标本的成功率。
[0005]
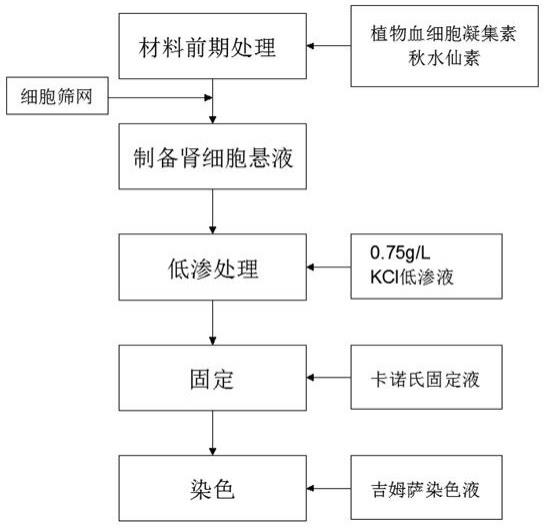
为实现以上目的,本发明通过以下技术方案予以实现:一种简易的鱼类染色体核型制备方法,包括以下步骤:(1)材料前期处理,先按10-30μg/g鱼体重的剂量,向实验鱼的胸鳍基部注射植物血细胞凝集素,再按照般1-2μg/g鱼体重的剂量注射秋水仙素溶液,在1h-2h后取出头肾置于hank氏液或生理盐水中备用;(2)制备肾细胞悬液,将步骤(1)中所取出的头肾组织于hank氏液或生理盐水中清洗,除去血块及其它组织,然后即置于细胞筛网中,并将细胞筛网置于盛有kcl低渗液的培养皿中,将置于细胞筛网中的头肾组织进行反复撕碎后取出细胞筛网,并吹打含有头肾细胞的低渗液1-2分钟,静置后制成细胞悬液;(3)低渗处理,取10-15个培养皿并在每个培养皿中放置1个载玻片,取步骤(2)中所制成的细胞悬液滴加到培养皿中的载玻片上,并在载玻片上添加1ml kcl低渗液,盖上培养皿盖,在30℃下低渗30-40分钟;(4)固定,低渗处理结束后,再向培养皿中加入5-6ml新鲜配制的卡诺氏固定液固定25-35分钟,再更换新鲜配制的卡诺氏固定液再固定1-2小时后取出载玻片,用新鲜配制的卡诺氏固定液冲洗载玻片2-3次后,将载玻片置于空气中干燥;(5)染色,待玻片完全干燥后,进行染色处理5-10分钟,再用蒸馏水冲洗干净后晾干,即得到鱼类染色体核型。
[0006]
优选地,所述步骤(1)中采用植物血细胞凝集素体内注射法向实验鱼的胸鳍基部
注射植物血细胞凝集素。
[0007]
优选地,所述步骤(1)中,可在注射植物血细胞凝集素前15-20h先注射1次植物血细胞凝集素,并在第二次注射植物血细胞凝集素的同时或间隔1-2h再注射秋水仙素溶液。
[0008]
优选地,所述步骤(1)中,在注射植物血细胞凝集素后4-6h后再注射秋水仙素溶液。
[0009]
优选地,所述步骤(2)中,细胞筛网的筛网孔径为100μm。
[0010]
优选地,所述步骤(2)和步骤(3)中,kcl低渗液的浓度为0.75g/l。
[0011]
优选地,所述步骤(3)中,通过滴管进行吸取细胞悬液,并从20-30厘米高处滴加到放入培养皿中的载玻片上,每个载玻片滴加3滴。
[0012]
优选地,所述步骤(4)中,向培养皿中所加卡诺氏固定液的量以没过培养皿中载玻片为准。
[0013]
优选地,所述步骤(4)中,卡诺氏固定液中甲醇和冰醋酸的体积比为3∶1。
[0014]
优选地,所述步骤(5)中,染色处理采用用10%体积比的吉姆萨染色液进行染色。
[0015]
本发明提供了一种简易的鱼类染色体核型制备方法。具备以下有益效果:具有制备时间短、制备步骤少,操作简单,在制备鱼类染色体核型最快所需时间只要3-4小时,提高了鱼类染色体核型制备的效率;并且本发明所描述方法未使用离心机分离细胞,降低了实验对仪器的依赖性,避免了离心操作对细胞的影响,提高了制备核型玻片标本的成功率。
附图说明
[0016]
为了更清楚地说明本发明或现有技术中的技术方案,下面将对现有技术描述中所需要使用的附图作简单地介绍。
[0017]
图1 本发明的方法步骤原理图;图2 使用本发明方法在40倍物镜下观察到的三角鲂染色体图。
具体实施方式
[0018]
为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明中的附图,对本发明中的技术方案进行清楚、完整地描述。
[0019]
实施例一如图1所示,一种简易的鱼类染色体核型制备方法,包括以下步骤:(1)材料前期处理,先按25μg/g鱼体重的剂量,采用植物血细胞凝集素体内注射法向实验鱼的胸鳍基部注射植物血细胞凝集素(pha),并且同时再按照般2μg/g鱼体重的剂量注射秋水仙素溶液,在2h后取出头肾置于hank氏液或生理盐水中备用;(2)制备肾细胞悬液,将步骤(1)中所取出的头肾组织于hank氏液或生理盐水中清洗,除去血块及其它组织,然后即置于筛网孔径为100μm的细胞筛网中,并将细胞筛网置于盛有0.75g/l kcl低渗液的培养皿中,将置于细胞筛网中的头肾组织进行反复撕碎后取出细胞筛网,并吹打含有头肾细胞的低渗液1分钟,静置后制成细胞悬液;(3)低渗处理,取10个培养皿并在每个培养皿中放置1个载玻片,通过滴管进行吸取步骤(2)中所制成的细胞悬液,并从20厘米高处滴加到放入培养皿中的载玻片上,并在载玻片上添加1ml 的0.75g/l kcl低渗液,盖上培养皿盖,在30℃下低渗40分钟;
(4)固定,低渗处理结束后,再向培养皿中加入新鲜配制的卡诺氏固定液固定30分钟,再更换新鲜配制的卡诺氏固定液再固定1小时后取出载玻片,用新鲜配制的卡诺氏固定液冲洗载玻片3次后,将载玻片置于空气中干燥;其中,卡诺氏固定液中甲醇和冰醋酸的体积比为3∶1,并且所加卡诺氏固定液的量以没过培养皿中载玻片为准;(5)染色,待玻片完全干燥后,采用10%体积比的吉姆萨(giemsa)染色液进行染色处理5分钟,再用蒸馏水冲洗干净后晾干,即得到鱼类染色体核型。
[0020]
实施例二一种简易的鱼类染色体核型制备方法,包括以下步骤:(1)材料前期处理,先按25μg/g鱼体重的剂量,采用植物血细胞凝集素体内注射法向实验鱼的胸鳍基部注射第一次植物血细胞凝集素(pha),再15h后再进行注射第二次植物血细胞凝集素(pha),并同时按照2μg/g鱼体重的剂量注射秋水仙素溶液,在2h后取出头肾置于hank氏液或生理盐水中备用;通过分两次注射植物血细胞凝集素以提高中期分裂相细胞数。
[0021]
(2)制备肾细胞悬液,将步骤(1)中所取出的头肾组织于hank氏液或生理盐水中清洗,除去血块及其它组织,然后即置于筛网孔径为100μm的细胞筛网中,并将细胞筛网置于盛有0.75g/l kcl低渗液的培养皿中,将置于细胞筛网中的头肾组织进行反复撕碎后取出细胞筛网,并吹打含有头肾细胞的低渗液2分钟,静置后制成细胞悬液;(3)低渗处理,取10个培养皿并在每个培养皿中放置1个载玻片,通过滴管进行吸取步骤(2)中所制成的细胞悬液,并从20-30厘米高处滴加到放入培养皿中的载玻片上,并在载玻片上添加1ml 的0.75g/l kcl低渗液,盖上培养皿盖,在30℃下低渗30分钟;(4)固定,低渗处理结束后,再向培养皿中加入5-6ml新鲜配制的卡诺氏固定液固定35分钟,再更换新鲜配制的卡诺氏固定液再固定1.5小时后取出载玻片,用新鲜配制的卡诺氏固定液冲洗载玻片3次后,将载玻片置于空气中干燥;其中,卡诺氏固定液中甲醇和冰醋酸的体积比为3∶1,并且所加卡诺氏固定液的量以没过培养皿中载玻片为准;(5)染色,待玻片完全干燥后,采用10%体积比的吉姆萨(giemsa)染色液进行染色处理7分钟,再用蒸馏水冲洗干净后晾干,即得到鱼类染色体核型。
[0022]
实施例三一种简易的鱼类染色体核型制备方法,包括以下步骤:(1)材料前期处理,先按25μg/g鱼体重的剂量,采用植物血细胞凝集素体内注射法向实验鱼的胸鳍基部注射植物血细胞凝集素(pha),再按照2μg/g鱼体重的剂量注射秋水仙素溶液,注射植物血细胞凝集素(pha)与秋水仙素溶液之间的间隔时间为4h,在2h后取出头肾置于hank氏液或生理盐水中备用;通过分两次注射植物血细胞凝集素以提高中期分裂相细胞数。
[0023]
(2)制备肾细胞悬液,将步骤(1)中所取出的头肾组织于hank氏液或生理盐水中清洗,除去血块及其它组织,然后即置于筛网孔径为100μm的细胞筛网中,并将细胞筛网置于盛有0.75g/l kcl低渗液的培养皿中,将置于细胞筛网中的头肾组织进行反复撕碎后取出细胞筛网,并吹打含有头肾细胞的低渗液2分钟,静置后制成细胞悬液;(3)低渗处理,取10个培养皿并在每个培养皿中放置1个载玻片,通过滴管进行吸取步骤(2)中所制成的细胞悬液,并从30厘米高处滴加到放入培养皿中的载玻片上,并在载玻片
上添加1ml 的0.75g/l kcl低渗液,盖上培养皿盖,在30℃下低渗30分钟;(4)固定,低渗处理结束后,再向培养皿中加入5-6ml新鲜配制的卡诺氏固定液固定35分钟,再更换新鲜配制的卡诺氏固定液再固定1.5小时后取出载玻片,用新鲜配制的卡诺氏固定液冲洗载玻片3次后,将载玻片置于空气中干燥;其中,卡诺氏固定液中甲醇和冰醋酸的体积比为3∶1,并且所加卡诺氏固定液的量以没过培养皿中载玻片为准;(5)染色,待玻片完全干燥后,采用10%体积比的吉姆萨(giemsa)染色液进行染色处理7分钟,再用蒸馏水冲洗干净后晾干,即得到鱼类染色体核型。
[0024]
对比例现有技术中的鱼类染色体核型制备方法,包括以下步骤:(1)材料前期处理,采用植物血细胞凝集素体内注射法,向实验鱼的胸鳍基部注射pha(注射剂量一般10-30μg/g鱼体重都有),24h(一般6h-120h范围内)后注射秋水仙素溶液(一般1-2μg/g鱼体重的剂量范围内),在5h(一般2-6h范围内)后,取出头肾;(2)制备肾细胞悬液,将头肾组织于0.8%重量百分比的生理盐水中清洗,除去血块及其它 组织,然后置于盛有生理盐水的培养皿中,充分剪碎,再用四层医用纱布滤入离心管内,加入生理盐水,用吸管吹打数分钟,静置片刻,制成细胞悬液;(3)低渗处理,将细胞悬液用2000r/min(一般500-3000r/min范围内)的速度离心5min,弃上清,留底部0.8-1ml沉淀,加入10ml(一般3-10ml范围内)的0.75g/l的kcl低渗液,30℃下处理30min,低渗后用四层纱布重新过滤一遍;(4)固定,低渗处理过滤后的滤液2000r/min离心5分钟,去上清,留底部0.8-1ml沉淀,加入10ml(一般2-10ml范围内)卡诺固定液,用吸管慢慢吹打沉淀至充分混匀,固定10分钟以上后2000r/min离心5min,弃上清,留底部0.8-1ml沉淀,加7ml固定液,固定,离心,再重复上述步骤两次;(5)滴片,第3次固定后弃上清,加卡诺固定液至1ml,轻轻弹打离心管底部,采用热滴片法或冷冻滴片法进行滴片(热滴片法是指将清洁干净的玻片放在50℃的培养箱中预热30min以上备用;冷冻滴片法是指将清洁干净的玻片放入-20℃预先冷冻30min以上备用),每次取出2张玻片进行滴片,于0.5-1m的高处滴到载玻片上,每片滴1-2滴,自然风干;(6)染色,待玻片完全干燥后,用10%(体积比)的吉姆萨染液染色30min,后用蒸馏水冲洗干净后晾干得到鱼类染色体核型。
[0025]
根据上述的制备方法对比可以得到:本申请是将头肾组织清洗后,利用细胞筛网直接在kcl低渗液中,制备成了肾细胞悬液,而后直接在玻片上进行低渗、固定处理;这样做的目的避免了离心操作,使制备时并不依赖于离心机进行离心收集细胞,避免了离心操作对细胞的影响,提高了制备核型玻片标本的成功率;并且本申请中pha可以和秋水仙素同时注射,依然可以制备出鱼类染色体核型玻片标本;这样就减少了注射pha和秋水仙素之间的等待时间,也就缩短了鱼类染色体核型玻片标本的制备时间。
[0026]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1