PD-1和/或p53自身抗体作为肿瘤疗效预测或预后评估的标志物的制作方法
本发明涉及生物医学检测技术领域,具体涉及一种pd-1和/或p53自身抗体在制备疗效预测或预后评估肿瘤的产品中的应用、一种肿瘤疗效预测或预后评估的标志物、一种肿瘤疗效预测或预后评估的产品及一种pd-1和/或p53自身抗体的检测方法。
背景技术:
目前,对于肿瘤治疗疾病的疗效预测、治疗及预后评估,多采用血清中肿瘤的自身抗体作为标志物,例如:ny-seo-1、annexini、14-3-3θ、lamr1、pgp9.5、c-myc、her2、cage、gbu-4-5、sox2等自身抗体用于肺癌诊断;hsp70、hcc-22-5、peroxiredoxinvi、km-hn-1、p90等自身抗体用于胃癌诊断;p62、hcc1等自身抗体用于肝癌诊断;interleukin-29(il29)、survivin(sur)、growthhormone(grh)、osteoprotegerin(opg)、andresistin(res)等自身抗体用于乳腺癌的诊断。但是对于通过免疫检查点抑制剂治疗的肿瘤患者疗效预测及预后评估仍在研究中。
p53自身抗体为生长抑制蛋白3,是一种肿瘤相关抗原,可用于各种肿瘤的早期诊断和肿瘤的筛选试验。例如文献:p53自身抗体和bmi-1自身抗体联合检测在肺癌诊断中的价值,中国医师杂志,2017,采用酶联免疫吸附试验检测92例肺癌患者和80例正常对照者血清中p53、bmi-1自身抗体的表达水平,应用受试者工作特征曲线(roc)分析两种自身抗体的联合诊断效能。结果表明,肺癌患者血清p53、bmi-1自身抗体水平均高于正常对照,差异具有统计学意义,同时敏感度为63%,特异度91.2%,roc曲线下面积为0.881,其诊断效能优于单一自身抗体。专利cn108885208a公开了一种检测肺癌的方法,包括将患者样品与抗原组接触,检测是否形成复合物,从而确定患者体内自身抗体的存在,以诊断肺癌,其中,自身抗体包括血清中的p53。专利cn109342727a公开了检测食管鳞状细胞癌自身抗体分子标志物来区分食管鳞癌患者和健康体检者,所述的标志物包括aldoa自身抗体、p53自身抗体、eno1自身抗体及ny-eso-1自身抗体,检测方法为酶联免疫吸附实验。专利cn103869086a公开了一种用于检测哺乳动物血清自身抗体的检测试剂盒,包括p53、hud、cage等,该试剂盒采用5种或5种以上自身抗体的结合,从而提高血清自身抗体检测的敏感性和准确性。但是上述现有技术均未公开p53自身抗体或其编码基因在免疫检查点抑制剂治疗肿瘤的疗效预测或预后评估。同时免疫检查点抑制剂治疗肿瘤与常规药物治疗肿瘤的病理、生理特征是不同的。
程序性死亡受体1(pd-1)是一种重要的免疫抑制分子,其配体为pd-l1,针对pd-1通路的抗体药物现已被批准对黑色素瘤、肺癌、淋巴瘤等多个瘤种的治疗。pd-1自身抗体是人体产生的针对pd-1分子的抗体,是一种潜在的免疫治疗的疗效标志物。专利cn107667119a公开了肿瘤细胞或肿瘤浸润性免疫细胞中pd-l1表达水平,确定罹患非小细胞肺癌的患者是否有可能响应包含pd-l1轴结合拮抗剂的治疗,该发明表示肿瘤细胞具有5%或更多的pd-l1的表达水平,肿瘤的治疗才可以施用有效量的pd-l1轴结合拮抗剂。以及直接检测肿瘤细胞上的pd-l1的表达已被fda推荐为使用派姆单抗的非小细胞肺癌(nsclc)患者的伴随诊断。同时大量临床试验结果均表明,与pd-l1低表达的患者相比,高表达的患者对于pd-1/pd-l1通路抑制剂有较高的有效率和更长的生存期。例如:美国临床肿瘤协会年会(asco)上最新发布的keynote-042研究结果显示,相比于pd-l1低表达(1%≤tps≤49%)的人群,pd-l1高表达(tps≥50%)的病人获得更显著的生存获益,死亡风险降低31%。但是,上述现有技术均未公开pd-1自身抗体在免疫检查点抑制剂治疗肿瘤的疗效预测或预后评估中的应用。
技术实现要素:
本发明的第一方面,提供了自身抗体在制备疗效预测或预后评估肿瘤的产品中的应用,所述的疗效预测或预后评估肿瘤为免疫检查点抑制剂治疗肿瘤的疗效预测或预后评估,所述的自身抗体为pd-1和/或p53自身抗体。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
优选的,所述的免疫检查点抑制剂选自pd-1、pd-l1、ctla-4、btla、tim-3、lag-3、tigit、lair1、2b4或cd160抑制剂中的一种或两种以上的组合,或免疫检查点抑制剂和其他药物及治疗手段的组合。
优选的,所述的免疫检查点抑制剂治疗肿瘤为单独施用免疫检查点抑制剂治疗肿瘤或免疫检查点抑制剂与药物、化疗、放疗或其他手段联合治疗肿瘤。
在本发明的一个具体实施方式中,所述的免疫检查点抑制剂为pd-1抑制剂。
本发明的第二方面,提供了检测pd-1和/或p53自身抗体的试剂在制备疗效预测或预后评估肿瘤的产品中的应用,所述的疗效预测或预后评估肿瘤为免疫检查点抑制剂治疗肿瘤的疗效预测或预后评估。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
优选的,所述的检测pd-1和/或p53自身抗体为检测pd-1和/或p53自身抗体的有无,或者表达水平。
优选的,所述的检测pd-1和/或p53自身抗体的试剂检测pd-1和/或p53自身抗体的方法选自elisa、免疫印迹法、间接免疫荧光法、酶免疫斑点法或免疫发光法中的一种或两种以上的组合。
在本发明的一个具体实施方式中,所述的检测pd-1和/或p53自身抗体的试剂检测pd-1和/或p53自身抗体的方法为elisa。
优选的,所述的免疫检查点抑制剂选自pd-1、pd-l1、ctla-4、btla、tim-3、lag-3、tigit、lair1、2b4或cd160抑制剂中的一种或两种以上的组合,或免疫检查点抑制剂和其他药物及治疗手段的组合。
优选的,所述的免疫检查点抑制剂治疗肿瘤为单独施用免疫检查点抑制剂治疗肿瘤或免疫检查点抑制剂与药物、化疗、放疗或其他手段联合治疗肿瘤。
在本发明的一个具体实施方式中,所述的免疫检查点抑制剂为pd-1抑制剂。
本发明的第三方面,提供了pd-1和/或p53自身抗体在制备诊断和/或治疗肿瘤或自身免疫疾病的产品中的应用。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
本发明的第四方面,提供了检测pd-1和/或p53自身抗体的试剂在制备诊断和/或治疗肿瘤或自身免疫疾病的产品中的应用。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
优选的,所述的检测pd-1和/或p53自身抗体为检测pd-1和/或p53自身抗体的有无,或者表达水平。
优选的,所述的检测pd-1和/或p53自身抗体的试剂检测pd-1和/或p53自身抗体的方法选自elisa、免疫印迹法、间接免疫荧光法、酶免疫斑点法或免疫发光法中的一种或两种以上的组合。
在本发明的一个具体实施方式中,所述的检测pd-1和/或p53自身抗体的试剂检测pd-1和/或p53自身抗体的方法为elisa。
本发明的第五方面,提供了一种肿瘤疗效预测或预后评估的标志物,所述的标志物包含pd-1和/或p53自身抗体,所述肿瘤疗效预测或预后评估为免疫检查点抑制剂治疗肿瘤的疗效预测或预后评估。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
优选的,所述的免疫检查点抑制剂选自pd-1、pd-l1、ctla-4、btla、tim-3、lag-3、tigit、lair1、2b4或cd160抑制剂中的一种或两种以上的组合,或免疫检查点抑制剂和其他药物及治疗手段的组合。
优选的,所述的免疫检查点抑制剂治疗肿瘤为单独施用免疫检查点抑制剂治疗肿瘤或免疫检查点抑制剂与药物、化疗、放疗或其他手段联合治疗肿瘤。
在本发明的一个具体实施方式中,所述的免疫检查点抑制剂为pd-1抑制剂。
优选的,所述的标志物还包括伴随标志物,所述的伴随标志物选自pd-l1蛋白或其自身抗体、ctla-4蛋白或其自身抗体、btla蛋白或其自身抗体、tim-3蛋白或其自身抗体、lag-3蛋白或其自身抗体、tigit蛋白或其自身抗体、lair1蛋白或其自身抗体、2b4蛋白或其自身抗体或cd160蛋白或其自身抗体中的一种或两种以上的组合。
本发明的第六方面,提供了一种诊断和/或治疗肿瘤、自身免疫疾病的标志物,所述的标志物为pd-1和/或p53自身抗体。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
优选的,所述的标志物还包括伴随标志物,所述的伴随标志物选自pd-l1蛋白或其自身抗体、ctla-4蛋白或其自身抗体、btla蛋白或其自身抗体、tim-3蛋白或其自身抗体、lag-3蛋白或其自身抗体、tigit蛋白或其自身抗体、lair1蛋白或其自身抗体、2b4蛋白或其自身抗体或cd160蛋白或其自身抗体中的一种或两种以上的组合。
本发明的第七方面,提供了一种肿瘤疗效预测或预后评估的产品,所述的产品包含检测pd-1和/或p53自身抗体的试剂,所述的肿瘤疗效预测或预后评估为免疫检查点抑制剂治疗肿瘤的疗效预测或预后评估。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的产品选自试剂盒、质谱。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
优选的,所述的检测pd-1和/或p53自身抗体为检测pd-1和/或p53自身抗体的有无,或者表达水平。
优选的,所述的检测pd-1和/或p53自身抗体的试剂检测pd-1和/或p53自身抗体的方法选自elisa、免疫印迹法、间接免疫荧光法、酶免疫斑点法或免疫发光法中的一种或两种以上的组合。
在本发明的一个具体实施方式中,所述的检测pd-1和/或p53自身抗体的试剂检测pd-1和/或p53自身抗体的方法为elisa。
优选的,所述的免疫检查点抑制剂选自pd-1、pd-l1、ctla-4、btla、tim-3、lag-3、tigit、lair1、2b4或cd160抑制剂中的一种或两种以上的组合,或免疫检查点抑制剂和其他药物及治疗手段的组合。
优选的,所述的免疫检查点抑制剂治疗肿瘤为单独施用免疫检查点抑制剂治疗肿瘤或免疫检查点抑制剂与药物、化疗、放疗或其他手段联合治疗肿瘤。
在本发明的一个具体实施方式中,所述的免疫检查点抑制剂为pd-1抑制剂。
本发明的第八方面,提供了一种诊断和/或治疗肿瘤、自身免疫疾病的产品,所述的产品包含检测pd-1和/或p53自身抗体的试剂。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的产品选自试剂盒、质谱。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
优选的,所述的检测pd-1和/或p53自身抗体为检测pd-1和/或p53自身抗体的有无,或者表达水平。
优选的,所述的检测pd-1和/或p53自身抗体的试剂检测pd-1和/或p53自身抗体的方法选自elisa、免疫印迹法、间接免疫荧光法、酶免疫斑点法或免疫发光法中的一种或两种以上的组合。
在本发明的一个具体实施方式中,所述的检测pd-1和/或p53自身抗体的试剂检测pd-1和/或p53自身抗体的方法为elisa。
本发明的第九方面,提供了一种肿瘤或自身免疫疾病的诊断方法,所述的方法包含检测生物体体内pd-1和/或p53自身抗体的有无或表达水平。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
本发明的第十方面,提供了一种肿瘤疗效预测或预后评估的方法,所述的方法包含检测生物体体内pd-1和/或p53自身抗体的有无或表达水平。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
本发明的第十一方面,提供了一种肿瘤或自身免疫疾病的治疗方法,所述的方法包括对患有肿瘤或自身免疫疾病的患者施用有效剂量的免疫检查点抑制剂,其中自该患者体内检测到pd-1和/或p53自身抗体的表达。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
优选的,自该患者体内检测到pd-1和/或p53自身抗体的表达为自该患者血清、血浆、组织间隙液、脑脊液或尿液中检测到pd-1和/或p53自身抗体的表达。其中,所述pd-1和/或p53自身抗体的表达水平越低,所述免疫检查点抑制剂治疗效果更好。
在本发明的一个具体实施方式中,自该患者体内检测到pd-1和/或p53自身抗体的表达为自该患者血清和/或血浆中检测到pd-1和/或p53自身抗体的表达。
优选的,所述的免疫检查点抑制剂选自pd-1、pd-l1、ctla-4、btla、tim-3、lag-3、tigit、lair1、2b4或cd160抑制剂中的一种或两种以上的组合,或免疫检查点抑制剂和其他药物及治疗手段的组合。
优选的,所述的免疫检查点抑制剂治疗肿瘤为单独施用免疫检查点抑制剂治疗肿瘤或免疫检查点抑制剂与药物、化疗、放疗或其他手段联合治疗肿瘤。
在本发明的一个具体实施方式中,所述的免疫检查点抑制剂为pd-1抑制剂。
本发明的第十二方面,提供了一种pd-1自身抗体的检测方法,包括将pd-1蛋白包被于载体表面,加入待检测的样本,加入酶、底物,测定浓度。
优选的,所述的pd-1自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
优选的,所述的待检测的样本为生物体血清、血浆、组织间隙液、脑脊液或尿液。
在本发明的一个具体实施方式中,所述的待检测的样本为生物体血清。
优选的,所述的待检测的样本在加入之前经过稀释缓冲液稀释,所述稀释的倍数为200-1000。进一步优选的,所述稀释的倍数为300-800。
在本发明的一个具体实施方式中,所述的稀释倍数为400-600。
在本发明的一个具体实施方式中,所述的稀释缓冲液为牛奶。
优选的,所述的酶为酶标抗体。更优选的,所述的酶标抗体为igg。
在本发明的一个具体实施方式中,所述的底物为tmb。
优选的,所述的测定浓度的方法为测定450nm的吸光度值。
在本发明的一个具体实施方式中,所述的方法包括:
1)将pd-1蛋白包被于96孔板中,4℃过夜;
血清样本用牛奶稀释至1:200-1000;优选的,血清样本用牛奶稀释至1:300-800;
2)将稀释后的血清样本加入96孔板,孵育,洗涤;优选孵育时间为0.5-2小时;
3)加入新鲜稀释的抗人igghrp酶标抗体,孵育,洗涤;优选孵育时间为0.5-2小时;更优选孵育时间为0.5-1小时;
4)加入临时配制的tmb底物,避光显色;加入硫酸终止反应;优选避光显色时间为10-30分钟;
5)测定450nm的吸光度值确定样本中pd-1自身抗体表达水平。
本发明的第十三方面,提供了一种p53自身抗体的检测方法,包括将p53蛋白包被于载体表面,加入待检测的样本,加入酶、底物,测定浓度。
优选的,所述的待检测的样本为生物体血清、血浆、组织间隙液、脑脊液或尿液;所述的待检测的样本在加入之前经过稀释缓冲液稀释,所述稀释的倍数为700-1100。更优选的,所述稀释的倍数为800-1000。
在本发明的一个具体实施方式中,所述的待检测的样本为生物体血清。
在本发明的一个具体实施方式中,所述的稀释缓冲液为牛奶。
优选的,所述的酶为酶标抗体。更优选的,所述的酶标抗体为igg。
在本发明的一个具体实施方式中,所述的底物为tmb。
优选的,所述的测定浓度的方法为测定450nm的吸光度值。
在本发明的一个具体实施方式中,所述的方法包括:
1)将p53蛋白包被于96孔板中,4℃过夜;
血清样本用牛奶稀释至1:700-1100;优选的,血清样本用牛奶稀释至1:800-1000;
2)将稀释后的血清样本加入96孔板,孵育,洗涤;优选孵育时间为0.5-2小时;
3)加入新鲜稀释的抗人igghrp酶标抗体,孵育,洗涤;优选孵育时间为0.5-2小时;更优选孵育时间为0.5-1小时;
4)加入临时配制的tmb底物,避光显色;加入硫酸终止反应;优选避光显色时间为10-30分钟;
5)测定450nm的吸光度值确定样本中p53自身抗体表达水平。
本发明的第十四方面,提供了一种检测pd-1和/或p53自身抗体的试剂盒,包含检测pd-1和/或p53自身抗体水平的试剂。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
本发明的第十五方面,提供了一种检测pd-1和/或p53自身抗体的芯片,包含检测pd-1和/或p53自身抗体水平的试剂。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
本发明的第十六方面,提供了一种诊断和/或治疗肿瘤的试剂盒,包含检测pd-1和/或p53自身抗体水平的试剂与检测其他免疫检查点的试剂。所述的其他免疫检查点选自pd-l1、ctla-4、btla、tim-3、lag-3、tigit、lair1、2b4或cd160中的一种或两种以上的组合,或免疫检查点抑制剂和其他药物及治疗手段的组合。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
本发明的第十七方面,提供了一种肿瘤治疗预后评估的试剂盒,包含检测pd-1和/或p53自身抗体水平的试剂与检测其他免疫检查点的试剂。所述的其他免疫检查点选自pd-l1、ctla-4、btla、tim-3、lag-3、tigit、lair1、2b4或cd160中的一种或两种以上的组合。
优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。
在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
优选的,所述的pd-1和/或p53自身抗体为血清、血浆、组织间隙液、脑脊液或尿液中的pd-1和/或p53自身抗体。
优选的,所述的pd-1和/或p53自身抗体包括igg1、igg2、igg3、igg4、iga1、iga2、igm、ige或igd。
在本发明的一个具体实施方式中,所述的pd-1和/或p53自身抗体为血清或血浆中的pd-1和/或p53自身抗体。
本发明所述的检测pd-1和/或p53自身抗体表达水平的试剂选自试纸条、蛋白芯片、磁珠、荧光试剂等。所述的检测原理采用抗原抗体结合,其中检测抗原为pd-1和/或p53蛋白、多肽或抗体。
本发明所述的疗效预测为疾病治疗前预测药物治疗效果的有无、好坏或副作用。优选的,所述的药物为免疫检查点抑制剂。
本发明所述的预后评估为肿瘤经免疫检查点抑制剂治疗后的预后评估。
本发明所述的诊断肿瘤是指诊断是否患有肿瘤,或者肿瘤患者预后评估,或者评估肿瘤患者采用免疫检查点抑制剂治疗的获益程度。
本发明所述的治疗肿瘤是指通过检测pd-1和/或p53自身抗体表达水平,确定是否通过免疫检查点抑制剂治疗。
本发明所述的肿瘤选自淋巴瘤、非小细胞肺癌、白血病、卵巢癌、乳腺癌、子宫内膜癌、结肠癌、直肠癌、胃癌、膀胱癌、肺癌、支气管癌、骨癌、前列腺癌、胰腺癌、肝和胆管癌、食管癌、肾癌、甲状腺癌、头颈部癌、睾丸癌、胶质母细胞瘤、星形细胞瘤、黑色素瘤、骨髓增生异常综合征、以及肉瘤。其中,所述的白血病选自急性淋巴细胞性(成淋巴细胞性)白血病、急性骨髓性白血病、髓性白血病、慢性淋巴细胞性白血病、多发性骨髓瘤、浆细胞白血病、以及慢性骨髓性白血病;所述淋巴瘤选自霍奇金淋巴瘤和非霍奇金淋巴瘤,包括b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤、边缘区b细胞淋巴瘤、t细胞淋巴瘤、和瓦尔登斯特伦巨球蛋白血症;所述肉瘤选自骨肉瘤、尤文肉瘤、平滑肌肉瘤、滑膜肉瘤、软组织肉瘤、血管肉瘤、脂肪肉瘤、纤维肉瘤、横纹肌肉瘤、以及软骨肉瘤。优选的,所述的肿瘤选自淋巴瘤、非小细胞肺癌或软组织肉瘤肿瘤。在本发明的一个具体实施方式中,所述的肿瘤为软组织肉瘤肿瘤。
本发明所述的自身免疫疾病选自器官特异性自身免疫病、系统性自身免疫病。其中,器官特异性自身免疫病选自慢性淋巴细胞性甲状腺炎、甲状腺功能亢进、胰岛素依赖型糖尿病、重症肌无力、溃疡性结肠炎、恶性贫血伴慢性萎缩性胃炎、肺出血肾炎综合征、寻常天疱疮、类天疱疮、原发性胆汁性肝硬化、多发性脑脊髓硬化症、急性特发性多神经炎等。所述的系统性自身免疫病选自系统性红斑狼疮、类风湿关节炎、皮肤类风湿结节、动脉炎、心包炎、巩膜炎、淋巴结炎、肝脾肿大、神经病变、系统性血管炎、硬皮病、天疱疮、皮肌炎、混合性结缔组织病、自身免疫性溶血性贫血、甲状腺自身免疫病或溃疡性结肠炎。
附图说明
以下,结合附图来详细说明本发明的实施例,其中:
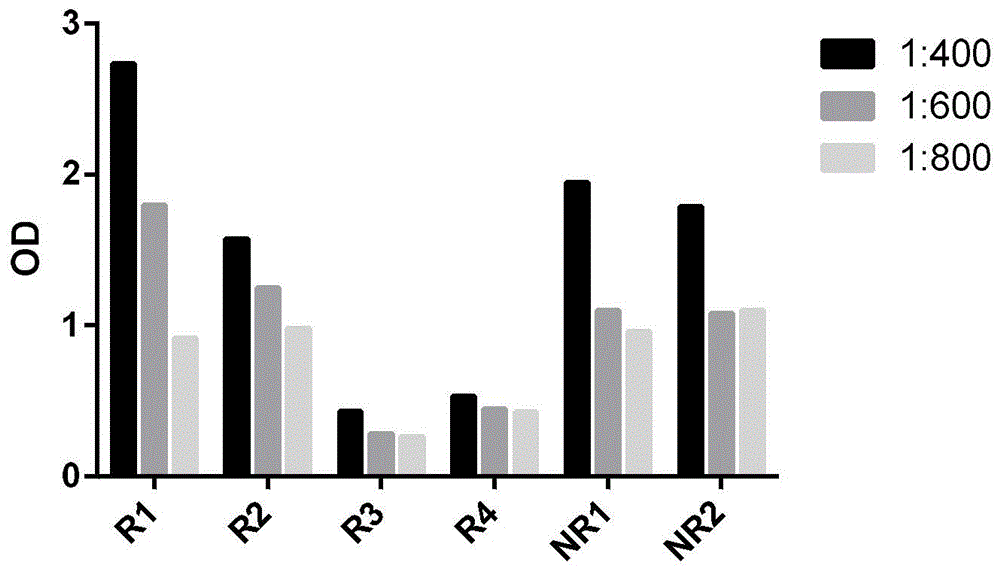
图1:elisa夹心法检测不同血清稀释度中的pd-1自身抗体相对水平的对比,其中,r1、r2、r3、r4、nr1、nr2代表六个不同的样本;
图2:elisa夹心法检测117例3种不同肿瘤患者pd-1血清自身抗体的分布情况,其中,不同肿瘤患者分别为淋巴瘤89例、肺癌(非小细胞肺癌)16例和软组织肉瘤12例;
图3:pd-1自身抗体水平对免疫治疗软组织肉瘤的疗效预测作用,其中,有效组为肿瘤免疫治疗有效组,即响应组,无效组为肿瘤免疫治疗无效组,即非响应组;
图4:pd-1自身抗体对免疫治疗的疗效预测的roc曲线。
图5:elisa夹心法检测不同血清稀释度中的p53自身抗体相对水平的对比,其中,r1、r2、r3、r4代表四个不同的样本。
图6:elisa夹心法检测117例3种不同肿瘤患者p53血清自身抗体的分布情况,其中,不同肿瘤患者分别为淋巴瘤89例、肺癌(非小细胞肺癌)16例和软组织肉瘤12例。
图7:p53自身抗体水平对免疫治疗软组织肉瘤的疗效预测作用,其中,有效组为肿瘤免疫治疗有效组,即响应组,无效组为肿瘤免疫治疗无效组,即非响应组。
图8:p53自身抗体对免疫治疗的疗效预测的roc曲线。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
1、样本收集
血清样本收集于中国医学科学院肿瘤医院,肿瘤患者中位年龄为34(18-74)岁,男女比例71:46,其中淋巴瘤患者89例,非小细胞肺癌患者16例,软组织肉瘤患者12例,所有患者均获得知情同意书。通过病理结果确认肿瘤诊断结果,所有患者均接受pd-1抗体免疫治疗,并获得疗效评价信息。
2、检测方法:酶联免疫吸附试验(elisa)
进行酶联免疫吸附试验以评估血清pd-1和p53自身抗体的浓度。
将pd-1蛋白(1ng/ul*50ul)包被在96孔板中,4℃过夜,血清样品在稀释缓冲液中稀释(稀释浓度为1:400、1:600、1:800),并将50μl稀释的样品/孔加入到96孔微量滴定板中,置37℃孵育1小时,然后洗涤。于各反应孔中,加入新鲜稀释的抗人igghrp酶标抗体(1:8000稀释)50μl,37℃孵育1小时,洗涤。随后于各反应孔中加入临时配制的tmb底物溶液0.1ml,37℃避光显色25分钟,每孔中加入0.05m硫酸50μl终止反应,通过测量450nm处的吸光度来确定信号。
将p53蛋白(1ng/μl*50μl)包被在96孔板中,4℃过夜。血清样品在稀释缓冲液中稀释(稀释浓度为1:300、1:600、1:900、1:1200),并将50μl稀释的样品/孔加入到96孔微量滴定板中,置37℃孵育1小时,然后洗涤。于各反应孔中,加入新鲜稀释的抗人igghrp酶标抗体(1:8000稀释)50μl,37℃孵育1小时,洗涤。随后于各反应孔中加入临时配制的tmb底物溶液0.1ml,37℃避光显色25分钟,每孔中加入0.05m硫酸50μl终止反应,通过测量450nm处的吸光度来确定信号。
3、统计分析
采用mann–whitneyutest检验比较组间变量差异,p<0.05被认为有显著统计学意义。
4、实验结果
1)肿瘤患者血清中pd-1和p53自身抗体水平检测条件优化
使用上述检测方法:酶联免疫吸附试验检测6名肿瘤患者血清中pd-1的自身抗体水平,将6个血清样本分别以1:400、1:600、1:800浓度稀释于牛奶中进行检测,结果显示,1:400的血清浓度检测出的抗体水平是最高的(见图1,其中,r1、r2、r3、r4、nr1、nr2表示六个不同的样本)。
使用上述检测方法:酶联免疫吸附试验检测4名肿瘤患者血清中p53自身抗体的水平,将4个血清样本分别以1:300、1:600、1:900、1:1200浓度稀释于牛奶中进行检测,结果显示,1:300和1:600的血清浓度检测出的抗体水平是最高的,但其od值接近于3,滴定板中产生沉淀,根据elisaod值略大于1为最佳检测值,确定1:900为最佳血清稀释浓度,以此最佳稀释浓度进行后续试验(见图5,r1、r2、r3、r4表示四个不同的样本)。
2)该方法能成功检测到肿瘤患者血清中pd-1和p53自身抗体水平
使用上述检测方法:酶联免疫吸附试验的条件(血清样本稀释浓度为1:400)检测了89例淋巴瘤、16例非小细胞肺癌、12例软组织肉瘤肿瘤患者血清样品的pd-1自身抗体表达水平,结果如图2所示,利用上述酶联免疫吸附方法能够成功检测肿瘤患者血清中pd-1自身抗体的相对水平,且不同肿瘤间患者血清中pd-1自身抗体水平有所不同。
使用上述检测方法:酶联免疫吸附试验的条件(血清样本稀释浓度为1:900)检测了89例淋巴瘤、16例非小细胞肺癌、12例软组织肉瘤肿瘤患者血清样品的p53自身抗体表达水平,图6结果显示,利用上述酶联免疫吸附方法能够成功检测肿瘤患者血清中p53自身抗体的相对水平,且不同肿瘤间患者血清中p53自身抗体水平有所不同。
3)肿瘤患者血清pd-1和p53自身抗体水平与免疫治疗疗效的关系
肿瘤免疫治疗中如何更有效的区分出有效和无效的患者是临床亟待解决的一大难题,首先对od值进行了标准化,并证实了软组织肉瘤中血清pd-1和p53自身抗体水平与pd-1免疫治疗的关系。结果显示,在治疗效果好的患者中,其pd-1自身抗体水平比非响应组的水平低(图3),p53自身抗体水平比非响应组的水平低(见图7),单独用这两个指标对不同疗效的患者进行区分,曲线下面积可达到0.77(pd-1见图4)、0.83(p53见图8),由此可见血清pd-1和/或p53自身抗体水平高低是潜在的肿瘤免疫治疗的标志物。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
- 还没有人留言评论。精彩留言会获得点赞!