基于滚环扩增DNA酶和共价有机骨架的电化学-ELISA免疫传感器的制作方法
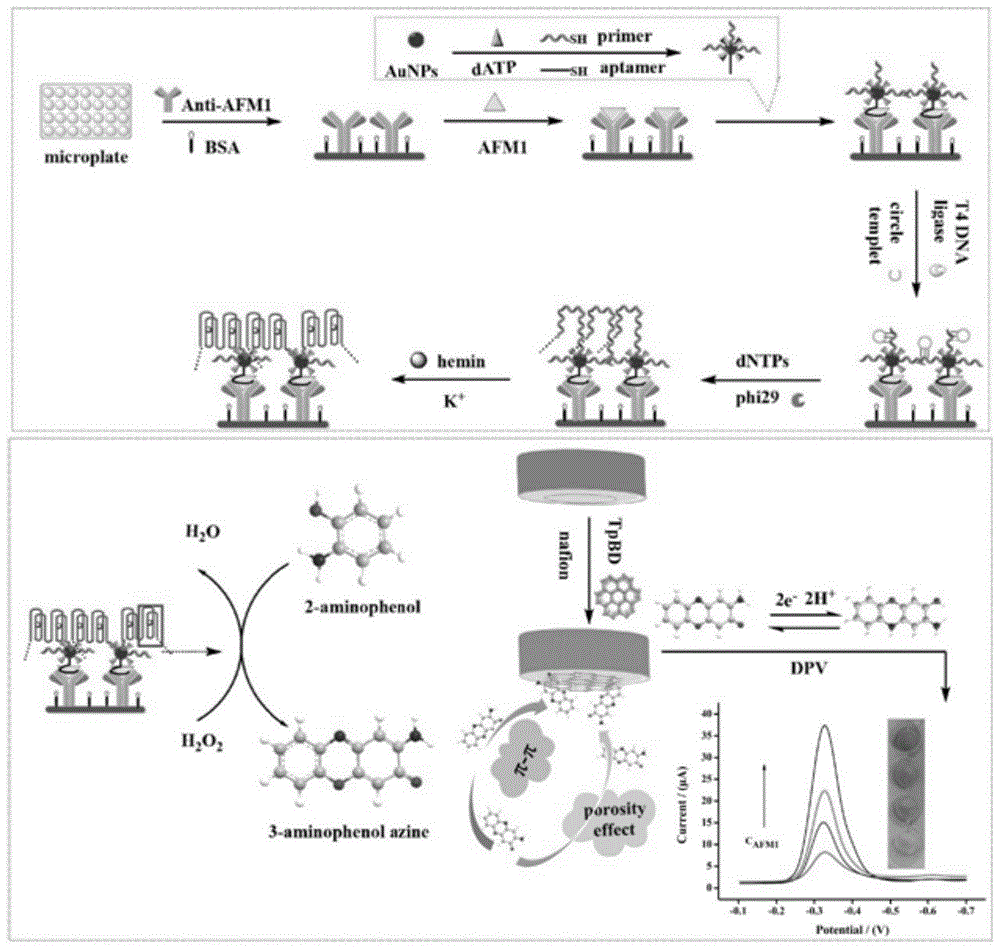
本发明涉及基于滚环扩增dna酶和共价有机骨架的电化学-elisa免疫传感器,属于电化学检测技术领域。
背景技术:
酶联免疫吸附法(elisa)依靠抗原和抗体的特异性识别,具有特异性强、稳定性好、操作简便等优点,已广泛应用于食品分析、环境、医药等领域,成为多种样品同时检测的金标准。然而,传统的elisa通常采用生物酶(通常为辣根过氧化物酶或碱性磷酸酶)作为催化剂来催化有色物质的产生,并用分光光度计读取信号,这限制了检测的灵敏度,不能满足对痕量物质检测的需要。电化学生物传感器由于电化学方法的高灵敏、操作简便、以及结合纳米材料与核酸信号放大等放大策略,可实现对痕量物质的检测。但是目前报道的电化学生物传感器通常在电极表面进行核酸信号放大,这会导致电极钝化和阻抗值增加,从而影响电极信号。所以将电化学方法与elisa联用可在实现特异性检测的同时提高灵敏度,是一种很有前景的分析技术。如ge等在酶标板上完成滚环扩增,产生长链dna,利用标记有蔗糖酶的dna(与产生的长链dna互补)催化蔗糖转化为葡萄糖,通过血糖仪进行读数用于检测甲胎蛋白,检测限达到0.087ng/ml。该方法虽然对elisa进行了核酸信号放大,但是其信号仍来源于生物酶(蔗糖酶),生物酶不仅成本高,而且易失活,且血糖仪的检测范围存在一定的局限性。
因此,开发一种准确、灵敏且能够适用于痕量物质检测的方法是有迫切需求的。
技术实现要素:
为解决上述问题,本发明提供了一种基于滚环扩增dna酶和共价有机骨架的电化学-elisa免疫传感器,将电化学方法与酶联免疫吸附测定相结合,在酶标板上放大核酸信号,用功能纳米材料修饰电极,既能够避免传统电化学免疫分析中电极的钝化,还能够有效地放大elisa的信号,降低检出限,实现痕量检测。
本发明的第一个目的是提供一种电化学-elisa免疫传感器,所述电化学-elisa免疫传感器是在引物-金纳米粒子-适配体复合物/抗原目标物/抗体三明治结构修饰的酶标板中进行滚环扩增,扩增产物经折叠形成dna酶,然后加入含邻氨基酚的溶液中,同时将经过共价有机骨架纳米材料修饰的电极也浸入溶液中。
在本发明的一种实施方式中,所述共价有机骨架纳米材料为cofs-tpbd。
在本发明的一种实施方式中,所述用于滚环扩增的引物-金纳米粒子(aunps)-适配体复合物/抗原目标物/抗体三明治结构修饰的酶标板的制备方法包括如下步骤:
(1)引物-aunps-适配体复合物的制备:利用aunps与含巯基的适配体、含巯基的引物制备得到引物-aunps-适配体复合物;
(2)制备引物-aunps-适配体/抗原目标物/抗体三明治结构修饰的酶标板:在含有相应抗体的酶标板上加入抗原目标物,然后加入引物-aunps-适配体复合物,形成引物-aunps-适配体/抗原目标物/抗体三明治结构修饰的酶标板。
在本发明的一种实施方式中,对引物-aunps-适配体/抗原目标物/抗体三明治结构修饰的酶标板进行滚环扩增反应。
在本发明的一种实施方式中,酶标板的滚环扩增过程包括:将环形模板,t4dna连接酶,t4dna连接酶缓冲液和超纯水加入到引物-aunps-适配体/抗原目标物/抗体修饰的酶标板中,室温孵育;洗板后,phi29dna聚合酶缓冲液,dntps,bsa,超纯水和phi29dna聚合酶加入到上述酶标板中,获得长的单链dna;最后,向酶标板中加入血红素(hemin)和钾离子,血红素分子将会嵌入到长单链dna中,并折叠为hemin/g-四链体结构,即dna酶。该滚环扩增dna酶具有类过氧化物酶活性,可用于催化邻氨基酚氧化为有色产物3-氨基酚嗪。
在本发明的一种实施方式中,所述环形模板的核苷酸序列如seqidno.1所示。
在本发明的一种实施方式中,所述共价有机骨架纳米材料修饰的电极是将含有共价有机骨架纳米材料的溶液滴涂到电极表面,干燥即得。
在本发明的一种实施方式中,根据溶剂热法合成共价有机骨架材料cofs-tpbd。具体包括如下步骤:将1,3,5-三醛基间苯三酚(tp)(63mg,0.3mmol),联苯胺(bd)(82.9mg,0.45mmol),均三甲苯:二恶烷(1:1,v:v,6ml)和乙酸(0.5ml,3mol/l)混合加入聚四氟乙烯管中。将混合物超声处理10min使溶液均匀分散;然后将管封好,在120℃下加热72h;通过离心收集形成的红色沉淀物,用丙酮彻底清洗,然后在60℃真空干燥12h,得到深红色粉末。
在本发明的一种实施方式中,所述步骤(1)中含巯基的适配体与含巯基的引物的摩尔比为(2-7):1。优选4:1。
在本发明的一种实施方式中,利用turkevich柠檬酸还原法制备aunps。具体包括:将2ml氯金酸(1%)和98ml超纯水加入预先经过彻底清洗的250ml圆底烧瓶中,在120℃,1200rpm下煮沸后,迅速加入10ml柠檬酸钠(1%,wt%),继续煮沸数分钟,直到颜色从深蓝色变为酒红色;将混合物继续搅拌并煮沸5min,以确保粒径均匀;溶液冷却至室温后,4℃保存备用。
在本发明的一种实施方式中,利用aunps与巯基修饰的适配体核酸链间形成的au-s键制备引物-aunps-适配体复合物。具体制备方法包括:将aunps与含巯基修饰的适配体、含巯基修饰的引物和乙酸(ph5.2)混合,室温孵育12h;然后加dntp以封闭aunps表面多余的活性位点;随后,加入nacl,室温孵育24h以增加复合物的稳定性;多余的试剂在10000rpm下离心20min去除;将所得的沉淀悬浮于tris-edta(te,0.1m,ph7.4)缓冲液中,4℃保存备用。
在本发明的一种实施方式中,所述适配体的核苷酸序列如seqidno.2所示。
在本发明的一种实施方式中,所述引物的核苷酸序列如seqidno.3所示。
在本发明的一种实施方式中,经三明治结构修饰的酶标板的制备方法具体包括:将目标抗原相应的抗体加入到酶标板中,4℃孵育过夜;为封闭多余的活性位点,向孔中加入bsa(1%)37℃孵育1h;随后,向每个孔中注入0.1ml不同浓度的目标抗原标准溶液,并在37℃孵育不低于150min;然后将引物-aunps-适配体复合物加入微孔中37℃孵育2h;通过适配体与抗体对目标抗原的特异性识别形成了引物-aunps-适配体/目标抗原/抗体三明治结构;在每个步骤后,用pbs-t(0.05%吐温-20,0.1mpbs,ph7.4)洗板两次,然后用pbs(0.1mpbs,ph7.4)再洗一次。
在本发明的一种实施方式中,所述t4dna连接酶的浓度不低于7u/ml,phi29dna聚合酶的浓度不低于0.2u/ml。
在本发明的一种实施方式中,所述血红素的浓度不低于1μm。
在本发明的一种实施方式中,所述滚环扩增反应的时间不低于60min。
在本发明的一种实施方式中,向经滚环扩增后的酶标板中加入邻氨基酚溶液、h2o2,室温反应。所述h2o2的浓度不低于25μm。该过程是利用dna酶催化邻氨基酚氧化为有色产物3-氨基酚嗪,我们可以通过测定3-氨基酚嗪的电化学信号间接得到目标抗原的浓度;另外,3-氨基酚嗪的颜色随着目标抗原浓度的增加而变化,可以通过肉眼进行粗略的定量检测。
在本发明的一种实施方式中,3-氨基酚嗪是一种理论分子直径为
本发明的第二个目的是提供一种电化学酶联免疫分析方法,所述方法是利用上述的电化学-elisa免疫传感器对抗原目标物进行检测。
在本发明的一种实施方式中,所述方法包括如下步骤:
(1)标准曲线的建立:构建上述的电传感器,利用不同浓度的目标抗原标准样品测得相应的还原峰电流值记为ii,将不含目标抗原的空白样品的还原峰电流值记为i0;以ii/i0与目标抗原的浓度构建线性关系,即得标准曲线;
(2)利用待测样品测得相应的还原峰电流值;根据步骤(1)所得的标准曲线计算得到待测样品中抗原目标物的含量。
本发明的第三个目的是提供一种检测黄曲霉毒素m1含量的方法,所述方法包括如下步骤:
(1)构建上述检测黄曲霉毒素m1的电传感器,利用不同浓度的黄曲霉毒素m1标准样品分别测得相应的还原峰电流值作为黄曲霉毒素m1的分析信号ii,将不含黄曲霉毒素m1测得空白样品的还原峰电流值记为i0;以ii/i0与黄曲霉毒素m1的浓度构建线性关系,即得黄曲霉毒素m1的标准曲线;
(2)利用未知黄曲霉毒素m1含量的待测样品测得相应的还原峰电流值,根据步骤(1)所得的标准曲线,得到待测样品中黄曲霉毒素m1的含量。
本发明的有益效果:
本发明首次将滚环扩增dna酶核酸信号放大方法和共价有机骨架纳米材料信号放大方法结合,为构建高通量、高灵敏的现场免疫传感器开辟了新思路。其中,在0.5ng/ml~80ng/ml范围内,ii/i0(ii是加入一定浓度的黄曲霉毒素m1后对应的还原峰电流信号,i0是不加黄曲霉毒素m1的还原峰电流信号)与黄曲霉毒素m1的浓度成正比,相关系数为0.993,检测限为0.15ng/ml(s/n=3)。另外,3-氨基酚嗪的颜色与黄曲霉毒素m1的浓度呈正相关,因此,我们可以用肉眼对其进行粗略的定量。
本发明将滚环扩增核酸信号放大方法应用到elisa中,利用扩增得到的dna酶催化邻氨基酚氧化生成具有电活性的氧化物3-氨基酚嗪,同时制备了基于cofs-tpbd材料的修饰电极,cof-tpbd作为一种cofs材料,具有大的比表面积、多孔性、大的π-π共轭体系和热稳定性,能够通过分子间π-π集聚作用富集3-氨基酚嗪,此外cof-tpbd的孔径
附图说明
图1为电化学-elisa免疫传感器的制备及传感示意图;
图2为滚环扩增反应的琼脂糖凝胶电泳图;
图3为cofs-tpbd修饰电极的扫描电镜图谱;
图4为gce和cofs-tpbd/gce在1mmol/l[fe(cn)6]3-/4-(含0.1mol/lkcl)溶液中不同扫描速度的循环伏安图;
图5为cofs-tpbd/gce以不同扫描速度在3-氨基酚嗪溶液中的循环伏安行为;
图6为对传感器信号放大作用验证图;其中a为裸gce,b为电极仅用滚环扩增,未经cofs-tpbd修饰;c为经滚环扩增且在电极上修饰cofs-tpbd;
图7为检测黄曲霉毒素m1的标准曲线图;
图8为实验条件的优化趋势图,其中a为引物/适配体比例对传感器信号的影响;b、c、d分别是滚环扩增(rca)反应中的t4dna连接酶和phi29聚合酶浓度、反应时间对传感器电信号的影响;
图9为实验条件的优化,其中a为afm1孵育时间对传感器信号的影响;b、c、d分别为邻氨基酚的反应时间、血红素浓度和h2o2浓度对传感器信号的影响;
图10为该传感器的选择性测试图。
具体实施方式
实验材料与试剂的获取:
黄曲霉毒素m1单克隆抗体可购于北京康诺生物科技有限公司;黄曲霉毒素m1、aftb1和ota标准品可购于j&k科学有限公司,中国北京;环形模板(5’-p-tagcacggacattttcccaacccgccctacccttttttttttcccaacccgccctacccttttgtaactgtttccttc),含巯基修饰的黄曲霉毒素m1适配体(5’-sh-actgctagagattttccaca),含巯基修饰的引物(5’-sh-gctagaaggaaacagttac)和牛血清白蛋白均可购于上海生工,中国上海;t4dna连接酶,phi29dna聚合酶,脱氧核糖核酸复合物dntp可购于新英格兰生物实验室,中国北京;三(羟甲基)氨基甲烷、乙二胺四乙酸、联苯胺、1,3,5-三醛基间苯三酚和氯金酸(haucl4·4h2o,99.9%)可购于阿拉丁,美国密苏里州。环丙沙星、葡萄糖等普通化学试剂可购于国药集团,中国上海。超纯水(18.2mωcm)可购于milliq净水系统,美国。
涉及的实验仪器和设备:
chi660c电化学工作站(辰华仪器有限公司,中国上海),dyy-8c电泳仪(六一,中国北京),bio-radgeldocxr+成像系统(bio-red,美国),1800紫外可见分光光度计(岛津,日本),x射线衍射仪(brukeraxsgmbh,德国),傅里叶红外光谱仪(尼克莱,美国),扫描电子显微镜(日立,日本)。
aunps制备:将2ml氯金酸(1%)和98ml超纯水加入预先经过彻底清洗的250ml圆底烧瓶中,在120℃,1200rpm下煮沸后,迅速加入10ml柠檬酸钠(1%,wt%),继续煮沸数分钟,直到颜色从深蓝色变为酒红色;将混合物继续搅拌并煮沸5min,以确保粒径均匀;溶液冷却至室温后,4℃保存备用。
制备cofs-tpbd修饰电极:
共价有机骨架材料cofs-tpbd的制备:将1,3,5-三醛基间苯三酚(tp)(63mg,0.3mmol),联苯胺(bd)(82.9mg,0.45mmol),均三甲苯:二恶烷(1:1,v:v,6ml)和乙酸(0.5ml,3mol/l)混合加入聚四氟乙烯管中;将混合物超声处理10min使溶液均匀分散;然后,将管封好,在120℃下加热72h。通过离心收集形成的红色沉淀物,用丙酮彻底清洗,然后在60℃真空干燥12h,得到深红色粉末;
修饰电极之前,先用0.3和0.05μm的氧化铝粉末在麂皮上对电极进行抛光处理,并用硝酸(浓硝酸:水,1:3,v/v)、乙醇和超纯水依次超声清洗;然后,将5mgcofs-tpbd与5ml乙醇混合,超声2h,然后将1%nafion乙醇溶液与cofs-tpbd分散液1:1(v/v)混合,超声处理至分散均匀;取5μlcofs-tpbd-nafion混合液小心滴涂至电极表面,室温干燥。
实施例1电化学-elisa免疫传感器构建
(1)引物-aunps-适配体复合物制备:
aunps与含巯基修饰的核酸链间形成的au-s键制备引物-aunps-适配体复合物:将1ml制备的aunps(7.5μm)与3μl含巯基修饰的黄曲霉毒素m1适配体(0.1mm)、12μl含巯基修饰的引物(0.1mm)和2μl乙酸(0.5mm,ph5.2)混合,室温孵育12h;然后加入20μldntp(0.1mm)以封闭aunps表面多余的活性位点。随后,加入1mlnacl(0.25m),室温孵育24h以增加复合物的稳定性。多余的试剂在10000rpm下离心20min去除;将所得的沉淀悬浮于1.5mltris-edta(te,0.1m,ph7.4)缓冲液中,4℃保存备用;
(2)构建引物-aunps-适配体/黄曲霉毒素m1/抗体三明治结构修饰的酶标板
将0.1ml5μg/ml的黄曲霉毒素m1单克隆抗体加入到酶标板中,4℃孵育过夜;为封闭多余的活性位点,向孔中加入bsa(1%)37℃孵育1h。随后,向每个孔中注入0.1ml一定浓度的黄曲霉毒素m1目标溶液,并在37℃孵育150min;然后将引物-aunps-适配体复合物加入微孔中37℃孵育2h;通过适配体与抗体对黄曲霉毒素m1的特异性识别形成引物-aunps-适配体/黄曲霉毒素m1/抗体三明治结构;在每个步骤后,用pbs-t(0.05%吐温-20,0.1mpbs,ph7.4)洗板两次,然后用pbs(0.1mpbs,ph7.4)再洗一次。
(3)滚环扩增反应:
将10μl环形模板(10μm),1.4μlt4dna连接酶(400u/μl),5μlt4dna连接酶缓冲液和63.6μl超纯水加入到引物-aunps-适配体/黄曲霉毒素m1/抗体修饰的酶标板中,室温孵育2h。洗板后,2μlphi29dna聚合酶缓冲液,2μldntps(10mm),1μlbsa(0.1mg/ml),73.4μl超纯水和1.6μlphi29dna聚合酶(10u/μl)加入到上述微孔中,37℃下反应1h以获得长的单链dna;最后,向孔中加入0.5μl血红素(hemin)溶液(2mm)和1mltris-hcl(50mm,ph7.4,50mmkcl),血红素分子将会嵌入到长单链dna中,并折叠为具有类过氧化物酶活性的hemin/g-四链体结构,即dna酶。
(4)检测体系构建:
向步骤(3)中修饰的酶标板中加入1ml0.4m的邻氨基酚溶液,0.9mltris-hcl(50mm,ph7.4)和0.1ml0.4mm的h2o2,室温反应60min;然后将修饰的cofs-tpbd/gce浸入溶液中,采用差分脉冲伏安法测得还原峰电流值,作为黄曲霉毒素m1的分析信号。
传感器表征:
通过琼脂糖凝胶电泳验证了滚环扩增是否可成功进行:
琼脂糖凝胶电泳:
(1)配置1%的琼脂糖:将1g琼脂糖加入100ml1×tae电泳缓冲液中,摇匀。在微波炉中加热至琼脂糖完全溶解;
(2)冷却至40℃,加入sybregreenⅰ染料,摇匀;
(3)将梳子插入胶板中,将溶解的琼脂糖倒入,室温冷却凝固;
(4)充分凝固后,将凝胶置入电泳槽中,加1×tae电泳缓冲液至液面高于凝胶1~2cm,小心垂直向上拔出梳子;
(5)将样品与上样缓冲液混合后,小心加入点样孔;
(6)恒压120v电泳约1h;
(7)电泳完成后,取出胶块,置于bio-radgeldocxr+成像系统中观察并拍照。
如图2所示,其中m代表dna分子量标准marker(200~10037bp),1、2,3分别代表条带1、条带2、条带3;,我们可以看到在没有引物(条带2)和没有phi29dna聚合酶(条带3)存在时,没有明亮的条带出现。当引物-aunps-适配体复合物与环形模板,dntp,t4dna连接酶和phi29dna聚合酶反应后,在样品孔位置出现明亮的条带(条带4),这是由于产生的长链dna阻碍了其在凝胶中的移动。这些结果表明引物-aunps-适配体复合物可引发滚环扩增反应,并产生长的单链dna。
利用扫描电镜(sem)对cofs-tpbd修饰电极进行了形貌表征,如图3所示。与裸比碳电极相比,cofs-tpbd修饰电极表面褶皱,并分布有大量小孔,这将提高电极的有效比表面积,有利于对目标物的吸附。
在1mm铁氰化钾([fe(cn)6]3-/4-,含0.1mkcl)溶液中,以0.1v/s的扫描速率,采用循环伏安(cv)法对gce和cofs-tpbd/gce的cv行为进行了研究。如图4所示,在裸gce上观察到一对可逆的氧化还原峰,用cofs-tpbd修饰电极后,电极的峰电流略有增加,这可能是由于多孔的cofs加快了电极与[fe(cn)6]3-/4-溶液间的电子转移。根据randles-sevcik方程:ip=2.69×105×a×d1/2×n3/2×v1/2×c,对电极的有效比表面积进行计算。其中,ip与氧化还原峰电流有关,a为电极的电活性表面积(cm2),分子在溶液中的扩散系数(d)为(6.70±0.02)×10-6cm/s,n为参加氧化还原反应的电子数,v为扫描速率(v/s),c对应于氧化还原探针的体积浓度(mol/cm3),ip与v1/2成正比。裸电极的有效比表面积为0.127cm2,cofs-tpbd/gce的有效比表面积为0.219cm2。
为了进一步验证cofs-tpbd/gce对3-氨基吩嗪的吸附性能,用cofs-tpbd/gce采用cv法以不同的扫描速度在tris-hcl(ph7.4)溶液中对3-氨基酚嗪的吸附性能进行了研究。如图5所示,在50~200mv/s范围内,3-氨基酚嗪的还原峰电流与扫描速度呈线性关系,r2=0.999,表明这是一个典型的吸附控制过程。
为了评估滚环扩增和cofs-tpbd的信号放大性能,通过对80ng/ml黄曲霉毒素m1的还原峰电流响应进行了研究,如图6所示。当电极上没有cofs-tpbd修饰,且不经过滚环扩增时,电化学响应很弱,只有6.24μa;当仅用滚环扩增(电极未经cofs-tpbd修饰,图6b)时,峰电流增加到27.05μa,检出限为3.03ng/ml;说明滚环扩增能够实现有效的信号放大。
此外,电极上修饰cofs-tpbd后(图6c),与裸gce(图6a)相比,电流信号增加约1.6倍,检出限降低约20倍;当将cofs-tpbd替换为cofs-ctppa-2时(孔径大小为
实施例2构建目标抗原黄曲霉毒素m1的标准曲线
参照实施例1中的传感器对标准液进行处理:
将步骤(2)中的黄曲霉毒素m1目标溶液分别替换为不同浓度的黄曲霉毒素m1标准溶液(0.1、0.25、0.5、1、5、10、20、30、40、50、60、70、80、100、120ng/ml),分别得到含不同浓度黄曲霉毒素m1的引物-aunps-适配体/黄曲霉毒素m1/抗体三明治结构修饰的酶标板;
然后按照(3)、(4)步骤分别测得相应的还原峰电流值ii,同时测得空白样品(不含黄曲霉毒素m1)的还原峰电流值i0,利用ii/i0与浓度构建线性模型,如图7所示,以ii/i0为纵坐标,浓度为横坐标,标准曲线为y=2.076+0.039x,相关系数r2为0.993,检测限为0.15ng/ml(s/n=3)。另外,3-氨基酚嗪的颜色与黄曲霉毒素m1的浓度呈正相关,因此,我们可以用肉眼对其进行粗略的定量。
其中空白样品电流值i0是指步骤(4)中,不加目标物,直接测得的还原峰电流值。
实施例3传感器构建条件优化实验
(1)引物/适配体比例影响:
改变引物/适配体比例(2:1、3:1、4:1、5:1、6:1、和7:1,固定适配体浓度为1.5μm)研究了引物/适配体比例对分析性能的影响。
如图8a,随着引物/适配体比例的增加,电流信号增加,当引物/适配体比例高于4:1时,电流信号降低。电流的降低可能是由于多余的引物占据了aunps本来属于适配体的结合位点,甚至可能导致复合物中没有适配体。因此,采用4:1的引物/适配体比例合成了引物-aunps-适配体复合物。
(2)滚环扩增反应时间优化:
t4dna连接酶和phi29聚合酶浓度对滚环扩增反应有很大的影响。如图8b、c,随着t4dna连接酶和phi29聚合酶浓度的增加,信号分别在7u/μl和0.2u/μl时达到最大值。随着滚环扩增反应时间的增加,电流响应显著增加,但是60min后趋势变慢,这可能是由于滚环扩增底物耗尽或phi29dna聚合酶失活引起的。因此,在后续实验中选择60min作为滚环扩增的最适反应时间(图8d)。
(3)步骤(2)中黄曲霉毒素m1孵育时间影响:
黄曲霉毒素m1孵育时间对固定在微孔板上的黄曲霉毒素m1的表面密度有显著影响,进而影响滚环扩增反应。对黄曲霉毒素m1在酶标板中的培养时间进行了初步研究。如图9a,在150min时,峰值信号趋于一个稳定值,表明固定在酶标板上的黄曲霉毒素m1达到饱和。因此,选择150min作为反应的最佳时间。
此外,响应信号从根本上取决于信号分子3-氨基酚嗪的含量。其与邻氨基酚的反应时间,血红素和h2o2浓度有关。如图9b,随着反应时间的增加,还原峰电流信号逐渐增大,60min后,增长趋势下降,考虑到整个实验过程的时间,选择60min进行后续实验;血红素浓度的优化见图9c所示,当血红素浓度大于1μm时,还原峰电流的响应迅速增大并趋于稳定;类似地,当h2o2浓度高于25μm时,电流信号几乎保持恒定(如图9d所示)。
实施例4传感器特异性验证实验
通过对环丙沙星、葡萄糖、黄曲霉毒素b1和ota等干扰物的研究,对该免疫传感器的选择性进行了评价,如图10。用该实施例1所得的免疫传感器对1μg/ml的环丙沙星、葡萄糖、黄曲霉毒素b1和ota进行检测时,还原峰电流响应与空白样品相近。此外,将这些干扰物与黄曲霉毒素m1(80ng/ml)混合后,发现还原峰电流信号仅下降了8.7%,影响较小,说明实施例1构建的免疫传感器对黄曲霉毒素m1的检测具有较好的选择性。
实施例5加标回收验证实验
利用实施例1构建电化学-elisa免疫传感器,分别对脱脂牛奶、奶粉和果汁乳三种样品中的黄曲霉毒素m1进行检测。首先,分别对无锡市售的脱脂牛奶样品、奶粉和果汁乳进行检测,未获得阳性结果;然后在三种样品中分别加入不同浓度的黄曲霉毒素m1后,得到加标回收结果,如表1所示。
表1方法的准确性验证结果
由表1结构可知,回收率在93.37%~104.01%(n=3)之间,表明该电化学-elisa免疫传感器对实际样品中的黄曲霉毒素m1检测是可靠准确的。
sequencelisting
<110>江南大学
<120>基于滚环扩增dna酶和共价有机骨架的电化学-elisa免疫传感器
<160>3
<170>patentinversion3.3
<210>1
<211>78
<212>dna
<213>人工序列
<400>1
tagcacggacattttcccaacccgccctacccttttttttttcccaacccgccctaccct60
tttgtaactgtttccttc78
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
actgctagagattttccaca20
<210>3
<211>19
<212>dna
<213>人工序列
<400>3
gctagaaggaaacagttac19
- 还没有人留言评论。精彩留言会获得点赞!