金铂核壳型纳米棒及制备方法及在制备AFB1电化学传感器的应用与流程
本发明专利申请是申请日为2018.02.06、申请号为201810120139.8、发明名称为“afb1电化学免疫传感器及其制备方法及其用于黄曲霉素b1的检测”的发明专利申请的分案申请。
本发明涉及纳米材料制备技术领域,尤其涉及一种硼硫共掺杂石墨烯负载金铂核壳型纳米棒的制备方法、将硼硫共掺杂石墨烯负载金铂核壳型纳米棒用于构建afb1电化学免疫传感器,并用于黄曲霉素b1的检测。
背景技术:
黄曲霉毒素广泛存在于农作物和食品中,是由黄曲霉、寄生曲霉等产生的代谢产物,是一种毒性极强的剧毒物质,发现于上世纪60年代,是一组化学结构相似的化合物,其结构特征为都含有一个双呋喃环和一个氧杂萘邻酮,目前已发现的有20余种,确定结构的有黄曲霉毒素b1、b2、g1、m1、m2等18种。黄曲霉毒素具有强致癌性,1993年被世界卫生组织(who)的癌症研究机构划定为i类致癌物,国际癌症研究机构也将其列为致癌物质系列,而黄曲霉毒素中黄曲霉毒素b1(afb1)是毒性和致癌性最强的物质。黄曲霉毒素会损害人体器官,抑制人体免疫机能,是对人类健康危害非常严重的一类真菌毒素。黄曲霉毒素不仅致癌性强,而且十分耐热,只有加热到280℃以上才会发生裂解,理化性质稳定,难溶于水易溶于氯仿、丙酮、甲醇、和油等有机溶剂,但不溶于石油醚、乙醚和己烷中。
目前测定黄曲霉素的方法有薄层色谱法、高效液相色谱法、酶联免疫吸附测定法、质谱法以及放射免疫测定法。但是这些方法有以下不足:检测过程繁琐、耗时长,劳动强度大;仪器设备昂贵、操作复杂,难以实现快速分析;灵敏度差。因此开发一种快速灵敏检测食品中黄曲霉素的方法具有重要意义。电化学免疫分析法是目前比较有效的检测黄曲霉毒素的方法,该方法具有检测速度快,便于操作,成本低廉,检测限低、便携和反应灵敏高等性能,而且还不受样品颜色、浊度的干扰,可直接应用于病原体的测定,更适用于现场快速检测,因此利用电化学免疫传感器法检测黄曲霉素具有较为广阔的应用空间。
技术实现要素:
本发明针对上述现有问题的一个或多个,提出一种金铂核壳型纳米棒复合材料的制备方法及其在制备afb1电化学免疫传感器的应用。
金铂核壳型纳米棒复合材料的制备方法,包括以下步骤:
将金纳米棒、水和四氯铂酸钾形成混合液g,将混合液g搅拌均匀后在冰浴条件下冷却,然后缓慢地往混合液g中加入抗坏血酸溶液,滴加过程剧烈搅拌形成混合液h,冰浴条件下继续反应使得混合液h由深紫色变成灰黑色。
在一些实施方式中,混合液g在冰浴条件下的冷却时间为10-15min。
在一些实施方式中,水为超纯水。
在一些实施方式中,混合液h在冰浴条件下继续反应40-60min。
在一些实施方式中,金纳米棒为6ml,水为9ml,四氯铂酸钾为225μl、20mm,抗坏血酸溶液为3ml、0.1m。
在一些实施方式中,金纳米棒由以下制备方法制得:
制备金纳米晶种:将十六烷基三甲基溴化铵溶液与氯金酸溶液混合形成混合液a;然后往该混合液a中加入冰硼氢化钠溶液,形成混合液b并快速搅拌,然后避光静置备用;
配置生长液:将十六烷基三甲基溴化铵溶液与氯金酸溶液混合形成混合液c,往该混合液c中加入硝酸银溶液形成混合液d,备用;
往混合液d中加入抗坏血酸溶液,混合均匀形成混合液e,往所述混合液e中继续加入混合液b得最后的反应体系混合液f,所述混合液f避光静置直至混合液f变为深紫色。
在一些实施方式中,制备金纳米晶种的步骤中,十六烷基三甲基溴化铵溶液为5.0ml、0.20m;所述氯金酸为5.0ml、0.0005m;所述冰硼氢化钠溶液为0.6ml、0.010m。
在一些实施方式中,所述配置生长液的步骤中,所述十六烷基三甲基溴化铵溶液为5.0ml、0.20m;所述氯金酸为5.0ml、0.0010m;所述硝酸银为0.2ml、0.0040m;所述抗坏血酸溶液为70μl、0.0788m。
根据本申请的另一个方面,提供应用前述制备方法制得的金铂核壳型纳米棒复合材料。
根据本申请的另一个方面,提供金铂核壳型纳米棒复合材料在制备黄曲霉素b1电化学免疫传感器的应用。
本发明相比于现有技术具有以下有益效果:
1)由于b、s原子的掺杂使得石墨烯产生缺陷位点,掺杂后的bs-g呈无序、褶皱薄纱状,其中,部分薄片层叠在一起,形成多层结构。
2)金铂核壳型(au@pt)纳米棒与bs-g之间存在强效的作用力使au@pt纳米棒嵌入bs-g片层间,阻止石墨烯团聚,同时提高了au@pt纳米棒的稳定性和催化性。
3)硼硫共掺杂石墨烯(bs-g)导电性能良好,能够提高电极表面电子的转移能力,且其大的比表面积为au@pt纳米棒的负载提供良好界面,使bs-g/au@pt纳米棒复合材料的导电性能进一步提升。
4)以硼硫共掺杂石墨烯负载金铂核壳型(bs-g/au@pt)纳米棒复合材料作为传感器的界面材料,构建的afb1电化学免疫传感器感应性能良好,能够对实际样品进行快速测定,与现有的检测方法相比具有快速检测的优势。
附图说明
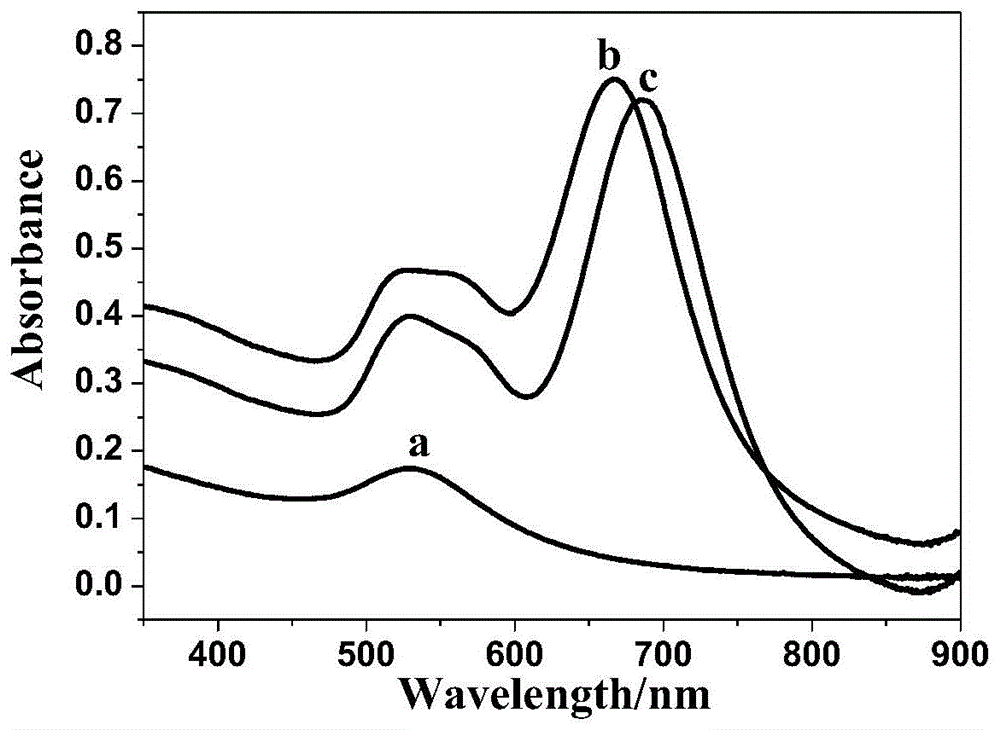
图1为本发明的不同材料的uv-vis光谱图(a-金纳米晶种;b-au纳米棒;c-au@pt纳米棒);
图2为本发明的au纳米棒的tem图;
图3为本发明的au纳米棒的tem放大图;
图4为本发明的au纳米棒的eds图;
图5为本发明的au@pt纳米棒的tem图;
图6为本发明的au@pt纳米棒的tem放大图;
图7为本发明的au@pt纳米棒的eds图;
图8为本发明的硼硫共掺杂石墨烯(bs-g)的sem图;
图9为本发明的bs-g的tem图;
图10为本发明的bs-g的xps图;
图11为本发明的bs-g/au@pt纳米棒复合材料的sem图;
图12为本发明的bs-g/au@pt纳米棒复合材料的tem图;
图13为本发明的bs-g/au@pt纳米棒复合材料的tem放大图;
图14为本发明的裸金电极及不同材料修饰的金电极的cv图;
图15为本发明的裸金电极及不同材料修饰的金电极的eis图;
图16为本发明的不同材料修饰的金电极的cv图;
图17为本发明的不同材料修饰的金电极的eis图;
图18为本发明裸金电极及不同材料修饰的金电极的dpv图;
图19为本发明免疫传感器测试不同浓度anti-afb1的dpv图谱;
图20为本发明电流响应值与anti-afb1浓度之间的对应关系;
图21为本发明免疫传感器在不同ph电解液中的dpv图谱;
图22为本发明电流响应值与ph电解液之间的对应关系;
图23为本发明免疫传感器在anti-afb1不同孵育时间下的dpv图;
图24为本发明电流响应值与anti-afb1不同孵育时间之间的对应关系;
图25为本发明免疫传感器与afb1在不同免疫反应时间下的dpv图;
图26为本发明电流响应值与afb1不同免疫反应时间之间的对应关系;
图27为本发明免疫传感器对不同浓度afb1的eis图;(曲线从下到上依次是浓度为0-60ng.ml-1的afb1阻抗图);
图28为本发明的免疫传感器对不同浓度afb1的dpv图;(曲线从上到下依次是浓度为0–60.ngml-1的afb1电流响应曲线);
图29为本发明afb1浓度与dpv电流响应值的线性关系图;
图30为本发明的afb1电化学免疫传感器的特异性测试结果。
具体实施方式
下面结合附图对本发明作进一步详细说明。
实施例1:au纳米棒和au@pt纳米棒的制备
表1所用仪器
表2-所用试剂
1.au纳米棒的制备
1)金纳米晶种的制备:25℃恒温下,首先将5.0ml、0.20m的十六烷基三甲基溴化铵(ctab)溶液与5.0ml、0.0005m的氯金酸(haucl4)溶液混合均匀形成混合液a;然后向混合液a中快速加入0.6ml、0.010m冰硼氢化钠(nabh4)溶液,形成浅褐色混合液b;快速搅拌2min,混合液b的反应体系避光静置备用,静置时间为2h。
2)配制生长液:25℃恒温下,将5.0ml、0.20m的ctab溶液与5.0ml、0.0010m的haucl4溶液混合均匀形成棕黄色混合液c;往该混合液c中加入0.2ml、0.0040m的硝酸银(agno3)溶液,混合均匀形成混合液d。
3)在上述混合液d中加入70μl、0.0788m的抗坏血酸(vc)溶液,混合均匀形成混合液e,溶液由棕黄色变为无色;继续加入12μl的种子溶液,得到最后的反应体系混合液f,避光静置8h,使au纳米棒完全生长。混合液f变为深紫色。
2.金铂核壳型(au@pt)纳米棒的制备
取上述制备好的短金纳米棒6ml加入到盛有9ml超纯水的烧杯中,再加入225μl、20mm四氯铂酸钾(k2ptcl4)形成混合液g,将混合液g搅拌均匀后在冰浴条件下冷却10min左右,用移液枪均匀、缓慢地滴入3ml、0.1m的vc,滴加过程要剧烈搅拌形成混合液h,继续保持在冰浴下反应40min。混合液h由深紫色逐渐变为灰黑色,说明短金纳米棒上已经成功包覆了一层pt,即合成au@pt纳米棒。
将制备好的金纳米棒和au@pt纳米棒放入冰箱冷藏10min后,以4000rpm的速度离心2min后去除去离心管ctab,留下上层溶液。重复上述操作5-10遍,直到离心后溶液没有ctab析出,再以12000rpm的速度离心10min,弃除上清液,再用蒸馏水稀释成10ml,冷藏,备用。
3.au纳米棒和au@pt纳米棒表征
将金纳米晶种、au纳米棒以及au@pt纳米棒置于石英比色皿中,采用uv-1800型紫外可见分光光度计(uv-vis)分别测量它们的吸收光谱,扫描范围为350-900nm,如附图1所示。金纳米晶种(a)在525nm左右有一个吸收峰,对应的是au纳米粒子的短波横向表面等离子体共振特征峰,而au纳米棒(b)在525和666nm处有两个吸收峰,525nm处的吸收峰对应的是短波横向表面等离子体共振吸收峰,666nm处的是长波纵向表面等离子体共振吸收特征峰,说明au纳米棒成功合成。当pt壳层在au纳米棒表面生长形成au@pt纳米棒(c)后,其最强吸收峰向长波方向移动,出现在690nm左右,出现红移现象,吸收峰相应的减弱,说明au纳米棒引入pt壳后au纳米棒的轴比和周围介质的介电常数发生改变。这是因为au核上出现pt壳时,au(5.32ev)和pt(5.00ev)具有不同的电子能,二者接触后,为了达到电位平衡的稳态结果,电子将从pt壳上转移到au纳米棒表面,由于au、pt间的协同作用,使得催化活性得到了提高,此时pt的光学性质占据主导地位,au纳米棒的吸收强度相应减弱,吸收峰向长波方向移动,由此说明,pt壳已经成功在au核上生长。
将上述离心后的溶液,在200kv的条件下,采用jem-2100型透射电子显微镜(tem)对au纳米棒和au@pt纳米棒进行表征,观察纳米材料的形貌及其分散性,如附图2-3所示。从图中我们可以看出,au纳米棒分散良好,且均为棒状,没有颗粒状的物质存在,说明溶液中的金纳米晶种全部生长形成了au纳米棒。另外,au纳米棒的长和宽分别为40.9nm和11.4nm,可算出au纳米棒的长径比为3.59。
采用jem-2100型透射电子显微镜的附件能谱仪(energydispersivespectrometer,eds)对au纳米棒进行表征,eds将特征x射线光信号转变成具有不同高度的电脉冲信号经放大器放大信号形成一个eds图谱,再根据eds图谱对金纳米棒和au@pt纳米棒的成分与含量进行分析,结果如附图4所示。样品中只有au和ni两种元素存在,没有观察到其它杂质成分,其中ni元素来自镍网,au元素源于au纳米棒,再次表明成功制备出au纳米棒。
图5为au@pt纳米棒的tem图,从图中可以看到,采用种子生长法合成的au@pt纳米棒保持良好的棒状结构,且分散均匀,没有出现其它形貌或团聚现象。从放大图6中看到:每个au@pt纳米棒黑色的au核与周围灰色的pt壳清晰可分,呈现出了明显的核壳型棒状结构。au@pt纳米棒的长和宽平均在40.3nm和11.1nm左右,其长径比约为3.6。pt壳层厚度约为2nm。
图7为au@pt纳米棒的eds图,从图中可以看出,只有au、pt和ni三种元素存在,除去镍网中的ni元素外,只有au@pt纳米棒中的au和pt两种元素,没有观察到其它杂质成分,可证明所制样品为au@pt纳米棒。
实施例2:硼硫共掺杂石墨烯(bs-g)的制备
表3-主要仪器
表4-主要试剂
1.bs-g的制备
准确称取10mg氧化石墨烯(go),放入含有20ml超纯水的烧杯中超声2h,使go分散均匀后,按go、氧化硼(b2o3)和硫化钠(na2s)的质量比为1:25:5的比例,加入250mgb2o3,超声30min,再加入50mgna2s超声5min,使b2o3和na2s在go溶液中分散均匀,最后将混合液放入微波消解仪中,在200℃下反应3h即得到bs-g。
2.bs-g的表征
使用扫描电子显微镜(sem,jib-4700f)进行表征,结果如图8所示,bs-g呈无序、卷曲、褶皱、多孔的网络结构,说明go已经被b2o3和na2s所还原。且bs-g的无序化程度较还原石墨烯增大,石墨烯部分晶格畸变,使得缺陷位点增多,可初步判断是由于b、s原子已经掺杂进石墨烯中所致。
使用透射电子显微镜(tem,jsm-2100)进行表征,结果如图9所示,bs-g呈无规律、褶皱的薄纱状,部分薄片层叠在一起,形成多层结构。这种边缘卷曲褶皱形貌,可归因于b、s原子掺杂进石墨烯晶格所造成的缺陷。由于缺陷位和褶皱所引入的开放性活性位点空间位阻小,有利于au@pt纳米棒及后期检测物质的化学吸附,从而提高材料的催化活性。
采用x射线光电子能谱仪(xps)对样品进行xps测试,分析b、s元素在石墨烯中的成键类型,结果如图10所示,可以看出bs-g有四个明显的特征吸收峰,分别位于160.17~170.17ev、189.17~194.17ev、276.17~297.17ev、529.17~539.17ev范围内,对应s2p、b1s、c1s和o1s的特征吸收峰。说明b、s原子与周围c原子形成共价键掺杂在碳的边缘以及缺陷位点处,即成功制备出了bs-g。
实施例3bs-g/au@pt纳米棒复合材料构建黄曲霉毒素b1免疫传感器
表5-主要仪器
表6-主要试剂
1.bs-g/au@pt纳米棒复合材料的制备:
取1ml上述实施例2制备好的bs-g于离心管中超声30min后,加入7ml的au@pt纳米棒,于旋涡混合器上震荡40min,即得到bs-g/au@pt纳米棒复合材料。
2.电化学免疫传感器的制备
a)修饰金电极
先将金电极用al2o3溶液上抛光后,依次用h2o2和h2so4溶液(1:3)超声3min,用超纯水超声清洗1min,晾干,在含有0.5m、kcl和1.0mm、k3fe(cn)6的溶液中测试电极稳定性。取制备好的bs-g/au@pt纳米棒复合材料7μl滴涂在金电极表面,室温下自然晾干。
b)构建电化学免疫传感器
取9μl、150μg.ml-1的黄曲霉毒素b1抗体(anti-afb1)滴涂于上述a)中bs-g/au@pt纳米棒修饰好的金电极表面,在t=37℃孵育40min,取出电极用超纯水轻轻的冲洗电极表面,晾干。
c)取9μl、2.0%的牛血清蛋白(bsa)溶液滴涂于修饰电极表面,在t=37℃孵育40min,取出电极用超纯水轻轻的冲洗电极表面,晾干。
d)最后,取9μl、10ngml-1黄曲霉毒素b1抗原(afb1)滴涂于电极表面37℃孵育30min后,用超纯水冲洗,室温下自然晾干,制得bs-g/au@pt纳米棒免疫传感器。
3.afb1电化学免疫传感器的电化学行为测试
采用chi660e型电化学工作站进行电化学测试。电化学测试采用三电极体系,ag/agcl电极作为参比电极,铂丝电极为对电极,金修饰电极作为工作电极。采用循环伏安法,以100mv/s的扫描速率,扫描范围为-0.1-0.7v,在含有0.5m、kcl的1.0mm、fe(cn)64-溶液中扫描循环伏安曲线(cv曲线),考察不同材料修饰电极的循环伏安行为,得到cv曲线图。采用电化学交流阻抗法(eis),以0.1-105hz的频率,在0.1m、kcl的1.0mm、fe(cn)63-/4-溶液中的测试不同材料修饰金电极的阻抗行为,得到eis图。再结合示差脉冲伏安法(dpv)对不同材料在ph7.0的含有0.1m、kcl的1.0mm、fe(cn)63-/4-溶液中的电流响应dpv图,对不同材料修饰的金电极电化学行为进行比较。
4.bs-g/au@pt纳米棒的表征
图11为bs-g/au@pt纳米棒的sem图,au@pt纳米棒分散在bs-g表面,占据b、s掺杂石墨烯而产生的缺陷位点,致使au@pt纳米棒在bs-g表面分散均匀,很少出现团聚现象。
图12-13为bs-g/au@pt纳米棒的tem图,au@pt纳米棒已成功地负载在bs-g表面,且纳米棒只存在于bs-g表面,没有发现在bs-g片层以外游离的au@pt纳米棒。从放大图中还可以清晰的看到石墨烯晶格条纹,这说明了au@pt纳米棒与bs-g之间存在某种强效的作用力使au@pt纳米棒牢固地附着在bs-g的表面。
5.afb1电化学免疫传感器的电化学性能的测试
cv曲线是用来探究氧还原活性的一种测试方法。根据cv曲线可以得到所测试材料的氧化还原峰电位,从而对不同材料的氧还原能力进行评价。为了进一步了解各材料的导电性能和感应灵敏度,我们采用eis和dpv对其进行考察。eis图反映材料的电阻大小,dpv图反应不同材料的电流响应信号,对不同材料的cv、eis、dpv图对比分析,能够了解材料导电性能的好坏,导电性能越好,电化学传感器的灵敏度越高。黄曲霉毒素电化学免疫传感器的电化学行为测试结果如图14-18所示,其中,a-裸金电极,b-bs-g修饰的金电极,c-bs-g/au@pt纳米棒修饰的金电极。d-bs-g/au@pt纳米棒复合材料修饰的金电极;e-bs-g/au@pt纳米棒复合材料/anti-afb1修饰的金电极;f-bs-g/au@pt纳米棒复合材料/anti-afb1/bsa修饰的金电极;g-bs-g/au@pt纳米棒复合材料/anti-afb1/bsa/afb1修饰的金电极。
当裸金电极表面被bs-g修饰后,还原峰和氧化峰电流明显增大(图14),从阻抗图中可以看出裸金电极经bs-g修饰后电阻值明显变小,由原来的200.9ω降为100.2ω(图15),,说明bs-g导电性能良好,能够提高溶液中fe(cn)63-/4-在电极表面发生电子转移。当金电极修饰bs-g/au@pt纳米棒后,还原峰和氧化峰进一步升高,电阻几乎消失,说明bs-g负载au@pt纳米棒后,由于au@pt纳米棒嵌入到b、s共掺杂石墨烯缺陷位点,使得bs-g/au@pt纳米棒导电性能增强,而au@pt纳米棒的嵌入使b、s共掺杂石墨烯为电子转移提供了更大的面积。所以bs-g/au@pt纳米棒复合材料具有优越的感应性能,可以作为免疫传感器的信号放大平台。
当bs-g/au@pt纳米棒复合材料修饰的金电极经anti-afb1孵育后,由于anti-afb1电阻大,且对fe(cn)63-/4-的氧化还原无任何催化作用,导致电子转移受到一定的阻碍,使得bs-g/au@pt纳米棒复合材料/anti-afb1修饰的金电极峰电流降低(图16)。从阻抗图17中可以看出,bs-g/au@pt纳米棒复合材料/anti-afb1修饰的电极电阻开始变大,电阻增大至20.2ω,说明anti-afb1已成功固定到修饰电极表面。当继续修饰bsa到上述修饰电极后,峰电流值进一步降低。从eis图可以看出bs-g/au@pt纳米棒纳米材料/anti-afb1/bsa的电阻为153.1ω,阻抗值进一步增大,表明bsa已成功固定。继续把afb1固定在电极上后,峰电流进一步降低,其电阻增大为318.6ω,表明afb1已成功固定。
从图17和图18可以直观看出,随着anti-afb1、bsa和afb1固定到修饰电极表面,其电流响应信号随之减小,电阻逐渐增大,说明anti-afb1、bsa和afb1已成功固定到bs-g/au@pt纳米棒复合材料修饰电极表面,黄曲霉毒素b1免疫传感器已成功构建。同时说明以bs-g/au@pt纳米棒复合材料作为免疫传感器的信号放大平台,其感应性能良好。
实施例4:应用bs-g/au@pt纳米棒复合材料电化学免疫传感器对afb1的检测
表7-主要仪器
表8-主要试剂
1.溶液配置:
1)小鼠单克隆抗体(afa-1)溶液的配置
将冷冻保存的小鼠单克隆抗体(afa-1)解冻,用移液枪量取浓度为1mgml-1的溶液,分别稀释为25、50、100、150μg.ml-1的溶液,放在冰箱冷藏备用。注意不能保存在冷冻层,防止冻伤afa-1导致其失活。
2)afb1标准溶液的配制
首先配置黄曲霉毒素b1母液,取1mg黄曲霉毒素afb1,量取0.5ml、h2o和0.5ml、ch3oh溶液与afb1充分混合溶解,配置成浓度为1mgml-1的母液,在分别稀释为0.025-60ng.ml-1浓度的afb1溶液,在冰箱冷藏备用。
3)dpv电解液的配制
采用不同ph值的pbs缓冲溶液,配制含有0.1m、kcl的1.0mm、fe(cn)63-/4-溶液,放入冰箱冷藏备用。
2.afb1电化学免疫传感器构建条件的优化
1)anti-afb1浓度的优化
将7μlbs-g/au@pt纳米棒复合材料修饰于金电极上,固载9μl不同浓度(浓度为25、50、100、150μg.ml-1)的anti-afb1,将构建的传感器进行孵育,采用dpv检测的电流响应值,确定anti-afb1的最佳浓度,结果如图19-20所示。构建bs-g/au@pt纳米棒复合材料/anti-afb1/bsa/afb1电化学免疫传感器时,改变anti-afb1的浓度(25、50、100、150μg.ml-1)进行孵育,采用dpv检测其电流响应值,从图中可以看到随anti-afb1浓度的增加电流响应值逐渐减小,并在100μg.ml-1出现最小值随后处于相对平稳,因此,选择100μg.ml-1作为anti-afb1的最佳浓度。
2)溶液ph的优化
将免疫传感器在上述最佳anti-afb1浓度下,测试不同ph电解液下的电流响应值,确定最佳的ph值。因为蛋白质的活性与溶液的ph有着非常重要的联系,所以优化抗体溶液的ph浓度尤为重要。为了优化免疫反应的条件,首先,固定anti-afb1的浓度为100μg.ml-1,将bs-g/au@pt纳米棒复合材料/anti-afb1/bsa/afb1电化学免疫传感器在不同ph条件(5.5、6.0、6.5、7.0、7.5、8.0)电解液(电解液含有0.1m、kcl的1.0mm、fe(cn)63-/4-)中进行dpv扫描。结果如图21-22所示,当电解液ph<7.5时,免疫传感器的响应电流值随着ph浓度的增大而逐渐减小;当ph>7.5时,免疫传感器的响应电流值随着ph浓度的增大而逐渐增大并趋于稳定状态,电化学免疫传感器的最大响应在ph=7.5处,因此,选择7.5作为本实验的最佳ph。
3)anti-afb1孵育时间的优化
孵育时间也是影响afb1检测的重要影响因素,因此考察孵育时间对免疫反应的影响具有重要意义。固定anti-afb1浓度为100μg.ml-1,anti-afb1孵育不同时间(20、30、40、50、60min,)后,将免疫传感器分别在ph7.5的电解液中进行dpv测试。结果如图23-24所示,电流响应值随着anti-afb1固定时间的增加呈降低趋势,并在50min时达到最小值,之后处于相对稳定的状态,所以确定anti-afb1最佳孵育时间为50min。
4)抗原afb1免疫反应时间的优化
抗原afb1孵育反应不同时间后,将免疫传感器在上述优化条件下测试电流响应值,以确定最佳的afb1免疫反应时间。结果如图25-26所示,afb1免疫反应时间从20-50min电流响应值呈明显的下降低趋势,并在50min出现最佳响应信号,之后随着反应时间的延长,电流响应值处于相对稳定的状态,所以50min被选择为最佳免疫反应时间。
在上述最佳条件下对不同浓度afb1进行检测,绘制标准曲线,确定检测限。
3.免疫传感器对afb1的检测
1)对不同浓度afb1的eis测试
基于上述优化条件,用ph7.5的pbs配制afb1标准品,使afb1浓度为0.025、0.05、5、10、20、30、40、50、60ng。ml-1。用ph7.5的pbs缓冲溶液配制含有0.1m、kcl的1.0mm、fe(cn)63-/4-电解液。
将7μlbs-g/au@pt纳米棒复合材料修饰于金电极上,自然晾干,取9μl浓度为100μg.ml-1的anti-afb1滴涂于修饰电极表面,在t=37℃孵育40min,之后取出电极用超纯水轻轻冲洗电极表面,自然晾干,取9μl、2.0%的bsa修饰在电极表面,在t=37℃孵育40min,取出电极用超纯水轻轻冲洗电极表面,自然晾干,取9μl、0.025-25ng.ml-1的afb1滴涂于电极表面37℃孵育30min后,用超纯水冲洗,自然晾干后,在ph为7.5的电解液中测定其eis,扫描频率范围为:0.1-105hz。
如图27所示,随afb1浓度的增加,其bs-g/au@pt纳米棒复合材料/anti-afb1/bsa/afb1电化学免疫传感器阻抗值依次增加,且感应性能良好,能够实现对不同浓度afb1的检测。
2)免疫传感器标准曲线的建立
根据上述优化得到的最佳条件,在ph7.5的电解液中,采用dpv对基于bs-g/au@pt纳米棒复合材料构建的免疫传感器对不同浓度的afb1进行检测。其结果如图28-29所示,从图中可以看出,随着afb1浓度的增大,dpv的峰电流响应信号呈规律性的减弱。以免疫反应电流响应值为纵坐标,afb1浓度为横坐标,绘制标准曲线图(图29),线性方程为y=35.49443-0.47039x,线性相关系数为r2=0.9947。从而得出该免疫传感器的检测线性范围为0.05-60ng.ml-1,检出限为0.013ng.ml-1。
综上所述,本发明的afb1电化学免疫传感器能够实现对afb1的检测,并且检测的线性范围较宽,检出限低,可以用来检测afb1。和下表中其他人所做结果对比,本发明所构建的黄曲霉毒素b1电化学免疫传感器具有一定的优势。
4.传感器的特异性测试
将制备好的bs-g/au@pt纳米棒纳米材料/anti-afb1/bsa分别与浓度为40ng.ml-1的afb1、afm1和afb2反应。采用dpv测试各自的电流响应值,以测试电化学免疫传感器的特异性。每组实验平行做三次,其结果如图29所示。从图中可以直观地看出,我们所发明的afb1电化学免疫传感器对afb1有明显的响应信号,而它的类似物afb2、afm1的响应信号很接近空白值,经过计算得到afb2的交叉反应率仅为6.87%,afm1的交叉反应率稍差,为31.19%。该结果表明,本发明所制备的afb1电化学免疫传感器与afb2、afm1有一定的交叉反应,这主要由抗体本身的性质所决定的,但交叉反应率低,即非特异性吸附现象不明显,可以满足对afb1的测定。
5.实际样品的处理及其加标回收实验
1)首先将大米样品和花生样品研碎,分别称取6份1g的大米样品和花生样品,分别取两种样品中的三份加入afb1标准品,使afb1浓度为90.ml-1,37℃培养箱中孵育1h,活化afb1。
2)将上述样品加入3ml甲醇(80%),剧烈震荡15min,提取afb1。
3)10000rpm离心15min,上清液用滤纸过滤,取1ml滤液于离心管,37℃蒸发至干,加入1mlpbs溶液充分溶解,用于免疫传感器测试分析,计算加标回收率。
测试结果如表10所示,样品加标回收率在95-105%之间,表明本发明制备的afb1免疫传感器可以满足实际样品中黄曲霉毒素b1的检测需求。
表9大米和花生加标回收实验结果(n=3)
利用本发明的方法,具有以下有益效果:
1)xps结果表明b、s原子已经成功地掺杂到石墨烯中,由于b、s原子的掺杂使得石墨烯产生缺陷位点,使掺杂后的bs-g呈无序、褶皱的薄纱状,部分薄片层叠在一起,形成多层结构。
2)au@pt纳米棒与bs-g之间存在某种强效的作用力使au@pt纳米棒嵌入bs-g片层间,将石墨烯剥离为单层结构,同时提高了au@pt纳米棒的稳定性和催化性能。
3)对裸金电极和不同材料修饰的电极进行cv和eis测试,结果表明:bs-g导电性能良好,能够提高电极表面电子的转移能力,其大的比表面积为au@pt纳米棒的负载提供良好的界面,使bs-g/au@pt纳米棒复合材料的导电性能进一步提升。
4)以bs-g/au@pt纳米棒复合材料作为传感器的界面材料构建afb1电化学免疫传感器,其感应性能良好,能够对实际样品进行测定,检出限为0.013ng.ml-1,检测线性范围为0.05-60ng.ml-1,与现有技术关于afb1的检测方法对比,具有一定的优势。
5)特异性实验结果显示,该传感器与afb2、afm1的非特异性吸附现象不明显,交叉反应率低。通过加标回收实验也证明了该传感器可以实现实际样品中afb1的检测。
以上所述的仅是本发明的一些实施方式。对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种纳米粉体工业生产系统的制作方法
- 一种高红外辐射粉体及其制备方法
- 一种铈锌共掺NiFe<sub>2</sub>O<sub>4</sub>纳米粉体及其制备方法
- 一种纳米Al<sub>2</sub>O<sub>3</sub>/Er<sub>3</sub>Al<sub>5</sub>O<sub>12</sub>/ZrO<sub>2</sub>复合粉体材料的制备方法
- 一种β?氢氧化镍纳米片的制备方法
- 一种硫化亚铜纳米玫瑰花的制备方法
- 一种球形氧化钇粉体的制备方法
- 一种亚微米级碳化硼粉体及其制备方法和用图
- 一种B<sub>4</sub>C纳米片的制备方法及B<sub>4</sub>C纳米片的制作方法
- 氮化铝粉体的制备方法