一种茶叶中检测锌含量的方法与流程
本发明涉及一种茶叶中检测锌含量的方法,属于金属离子检测技术领域。
背景技术:
茶叶一直对我国的文化有影响,在我国是现代人们生活中必不可少的物质国医药典籍中,记载了茶叶的20余种药用功能和61种保健作用。茶叶含有多种化学成分,如氨基酸、咖啡碱、维生素、蛋白质、单宁芳香族化合物、矿物质、碳水化合物等,另外还含有人体所必需的14种微量元素,其中包括硒、锌、钼等。锌对人体具有重要的生理功能,早已得到现代科学的证明。测定锌的方法主要有双硫腙比色法,pan比色法,原子吸收分光光度法等。催化褪色光度法,是以催化反应为基础来测定物质含量的分析方法,比一般光度法具有较高的灵敏度和更好的选择性,且操作简单、仪器设备便宜。相比于其他元素,人们对锌的研究比较少。
本发明采用催化褪色光度法测定锌在茶叶中的含量,与双硫腙比色法传统方法相比,该方法操作简便、分析速度快、干扰少。
技术实现要素:
鉴于上述内容,本发明的发明目的在于:针对上述存在的问题,本发明提供的一种检测茶叶中锌含量的方法能快速检测上述中茶叶锌含量的检测问题,而且可以达到快速检测的效果,提高了检测效率。
为达到上述目的,本发明所采用的技术方案是:一种检测茶叶中锌含量的方法,所述方法包括以下步骤:(1)待测液制备:取茶叶样品放入去离子水中浸泡20~60s,在清洗的过程中不断的搅拌样品,然后捞出样品沥干水,再将沥干的样品加入煮沸的蒸馏水中恒温煮沸浸泡4~8h后抽滤,冷却至室温过滤定容;(2)最大吸收峰的确定:用硫酸作为介质,用甲基橙作为显色剂,用双氧水作为氧化剂与锌标准溶液相互作用;(3)反应条件的选择:在反应体系中,设置不同反应条件如:硫酸加入量、甲基橙的用量、h2o2的用量、反应的时间和反应温度条件对体系的影响;(4)正交试验确定最优体系:采用四因素三水平的正交表;(5)样品分析;(6)结果分析。
进一步地,本发明所述步骤(1)中过滤用的材料为400~800目筛网。
进一步地,本发明所述步骤(3)中硫酸的加入量为2.0~3.0ml,且浓度为4mol/l。
进一步地,本发明所述步骤(3)中甲基橙溶液加入量为0.5-2.0ml,且浓度为0.05%的甲基橙。
进一步地,本发明所述步骤(3)中h2o2加入量2~4ml,浓度为3%的h2o2溶液。
进一步地,本发明所述步骤(3)中反应时间为30~60min。
进一步地,本发明所述步骤(3)中所述反应的温度条件为反应物质在100℃持续沸腾状态。
进一步地,本发明所述样品分析采用紫外可见分光光度计测量。
本发明具有以下有益效果:
1、本发明提供的一种检测茶叶中锌含量的方法能快速检测上述中茶叶锌含量的检测问题,而且可以达到快速检测的效果,提高了检测效率。
2、本发明采用催化褪色光度法测定锌在茶叶中的含量,与传统方法相比,该方法操作简便、分析速度快、干扰少。
3、在本发明中,先将样品用去离子水清洗,保证样品表面的灰尘等不会影响样品的锌离子检测浓度,同时用400~800目筛网来过滤,保证过滤的材料不会干扰锌离子后续的检测,大大提高了离子含量的准确度。
4、本发明通过检测影响吸光度差值△a最优条件为3.0ml4mol/l硫酸溶液,3.0ml3%h2o2溶液,1.0ml0.05%甲基橙溶液,在以上条件下反应半小时,反应温度为100℃。
附图说明
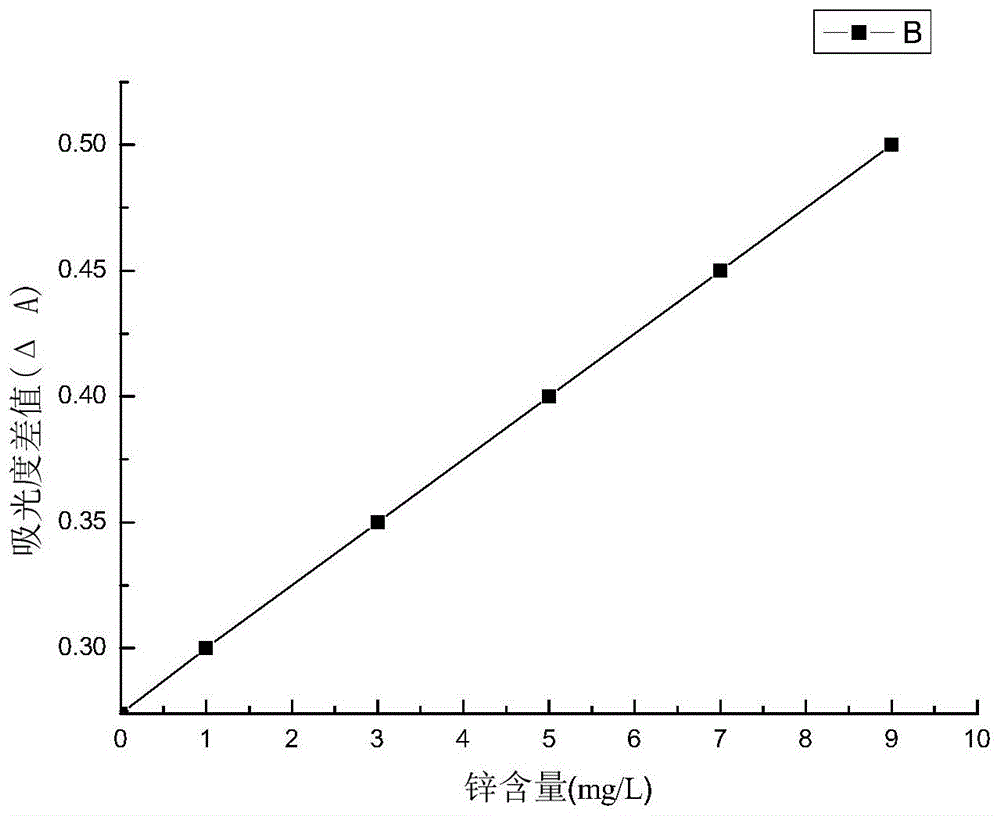
图1是本发明检测的空白实验曲线。
图2是本发明各反应体系的吸光光谱。
图3是本发明硫酸加入量对吸光度差值△a的影响曲线。
图4是本发明甲基橙溶液加入量对吸光度差值△a的影响曲线。
图5是本发明h2o2溶液加入量对吸光度差值△a的影响曲线。
图6是本发明反应时间对吸光度差值△a的影响曲线。
图7是本发明反应温度对吸光度差值△a的影响曲线。
图8是本发明体系的稳定性测定结果曲线。
如下具体实施方式将结合上述附图进一步说明本发明。
具体实施方式
在本发明的一种较佳实施方式中:本发明一种检测茶叶中锌含量的方法,所述方法包括以下步骤:(1)待测液制备:取茶叶样品放入去离子水中浸泡20~60s,在清洗的过程中不断的搅拌样品,然后捞出样品沥干水,再将沥干的样品加入煮沸的蒸馏水中恒温煮沸浸泡4~8h后抽滤,冷却至室温过滤定容,过滤用的材料为400~800目筛网;(2)最大吸收峰的确定:用硫酸作为介质,用甲基橙作为显色剂,用双氧水作为氧化剂与锌标准溶液相互作用;(3)反应条件的选择:在反应体系中,设置不同反应条件如:硫酸加入量、甲基橙的用量、h2o2的用量、反应的时间和反应温度条件对体系的影响;(4)正交试验确定最优体系:采用四因素三水平的正交表;(5)样品分析,采用紫外可见分光光度计测量吸光度;(6)结果分析。
另外,本发明所述步骤(3)中硫酸的加入量为2.0~3.0ml,且浓度为4mol/l。甲基橙溶液加入量0.5-2.0ml,且浓度为0.05%的甲基橙;h2o2加入量2~4ml,浓度为3%的h2o2溶液;反应时间为30~60min;反应的温度条件为反应物质在100℃持续沸腾状态。
验证实施例:
(1)绘制锌标准曲线:在50ml容量瓶中依次加入3ml硫酸溶液、1.0ml甲基橙溶液、3.0mlh2o2溶液和1.0ml锌标准使用液,定容。在100℃的水浴锅放置半小时,然后取出于冷水中降温,在紫外可见分光光度计(506nm)下测定,得到吸光度a。另做空白组,得到吸光度a0,求吸光度差值δa=a0-a。以蒸馏水为空白,得出锌的标准曲线y=0.0252x+0.274,其线性范围在0~10mg/l,相关系数r2=0.9991。说明浓度和吸光度差值△a成线性关系,相关系良好。
(2)最大吸收峰的确定:依次加入硫酸、甲基橙、锌标准使用液、双氧水。
可选地,根据本发明的方法,其中加入0~6ml4mol/l硫酸、0~3ml0.05%甲基橙溶液、0~6ml3%h2o2、0~2ml2.4mg/l锌标准使用液。
由图2所示,a1与a2的曲线靠得比较近,由此可以判断甲基橙与锌基本上不发生反应。a3为加入h2o2后的曲线,加入h2o2溶液后,曲线比a1低,由此可以判断h2o2溶液氧化了甲基橙溶液。a4是在a3的基础上加入锌标准使用液,加入锌标准使用液后,a4的曲线变得更低,由此可以说明锌可以催化h2o2溶液氧化甲基橙,使该氧化反应进行的程度加深,褪色的程度更大。且四条曲线的最高点基本相同,反应体系最大吸收波长均在506nm左右,所以本实验选取506nm为测定波长。
(3)反应条件的选择:在反应体系中,涉及到的反应条件有:茶叶待测液取样量、硫酸加入量、甲基橙的用量、h2o2的用量、反应的时间等。
①硫酸加入量的影响
如图3所示,硫酸溶液从1.0ml增加至2.0ml时,吸光度差值△a慢慢变大,当硫酸加入量增至3.0ml,吸光度差值△a达到最大值,硫酸加入量从3.0ml增至4.0ml时,吸光度差值△a开始下降,硫酸加入量从4.0ml增至5.0ml,吸光度差值△a继续下降,硫酸加入量从5.0ml增至6.0ml,吸光度差值△a基本平衡。从3.0ml之后,吸光度差值△a开始持续下降,原因可能是此反应需在弱酸性条件下反应,硫酸加入量越多,浓度越高,条件变为强酸介质,反而抑制了反应的进行。硫酸加入量到达3.0ml时,吸光度差值△a达到最大,灵敏度最高,所以用3.0ml4mol/l硫酸溶液最适宜。
②甲基橙溶液加入量的影响
由图4所示,甲基橙溶液加入量也是影响吸光度差值△a的因素之一。甲基橙溶液加入量从0.5.0ml增加至1.0ml时,吸光度差值△a有上升的幅度,但上升幅度并不大,甲基橙溶液加入量从1.0ml增加至1.5ml时,吸光度差值△a开始下降,甲基橙溶液加入量从1.5ml增加至2.0ml、2.5ml、3.0ml时吸光度差值△a持续下降。且0.5ml、1.0ml、1.5ml时,甲基橙完全褪色,溶液变为无色透明,当甲基橙溶液加入量为2.0ml、2.5ml、3.0ml时,溶液呈淡淡的橙红色,由此说明当甲基橙溶液加入量为0.5ml、1.0ml、1.5ml时,褪色反应进行完全。当加入甲基橙溶液1.0ml时,可以得到最大的吸光度差值△a,所以用1.0ml0.05%甲基橙溶液最适宜。
③h2o2溶液加入量的影响
由图5所示,当h2o2溶液加入量从1.0ml增至2.0ml时,可以发现吸光度差值△a变大;从2.0ml增至3.0ml时,可以达到最高值的吸光度差值△a;之后h2o2溶液的用量不断增大,吸光度差值△a反而会下降。h2o2溶液加入量越多,反应体系反而不稳定,当加入的h2o2溶液3.0ml时,可以得到最高值的吸光度差值△a,所以用3.0ml3%h2o2溶液加入量最适宜。
④反应时间的影响
由图6所示,刚开始,吸光度差值△a是最低的,且溶液颜色无褪色,说明催化反应的很慢;反应时间为20min时,吸光度差值△a增大,溶液颜色变淡,说明催化反应发生;反应时间为30min时,吸光度差值△a继续增大,且溶液变为无色,说明催化反应完全;当反应时间为40min、50min、60min时,吸光度差值△a趋于平衡,说明催化反应进行完全。从变化曲线可以看出,反应时间到达30min之后,反应已经达到平衡,所以反应时间为30min最适宜。
⑤温度的影响
如图7所示,反应初期,吸光度差值△a接近零,说明催化反应不发生或进行的十分缓慢;当反应温度为40℃时,溶液颜色无变化,吸光度差值△a比20℃时呈现小幅度上升,说明催化反应进行,但是进行的十分缓慢;当反应温度为60℃时,溶液颜色稍微变浅,吸光度差值△a增大,说明催化反应发生;当反应温度为80℃时,吸光度差值△a呈大幅度增大;当反应温度到达100℃时,吸光度差值△a到达最大值。考虑到实际因素及为了实验易于控制,选择100℃沸水浴加热进行反应。
⑥体系的稳定性
如图8所示,在100℃的水浴锅中反应半小时后,放置一边待其降温,放置在室温内2小时去测定吸光度,其在2小时内基本保持稳定,说明反应体系的稳定良好。
(4)正交试验确定最优体系
根据单因素试验,设计以硫酸溶液、甲基橙溶液、h2o2溶液反应时间为正交试验的影响因素,选用四因素三水平的正交表。
4种因素中的极差r值可以看出b>c>d>a,即甲基橙溶液对吸光度差值△a的影响最大,其次是h2o2溶液,反应时间,而硫酸溶液的影响最小。由于吸光度差值△a越大越好,由此分析得最优方案为a3b1c3d3,即硫酸溶液为4.0ml,甲基橙溶液为0.5ml,h2o2溶液为4.0ml,反应时间为40min。
表3因素水平
表4四因素三水平九组正交实验结果
验证性试验
用a3b1c3d3方案重复做三次验证性试验,对比单因素试验a2b2c2d2,得到a3b1c3d3试验吸光度差值△a=0.288,a2b2c2d2试验吸光度差值△a=0.113,说明a3b1c3d3确实为最佳方案。
(5)实际样品分析
样品分析结果如表5所示,加标回收率的范围在93.71-99.51%,方法的准确度很高。
表5样品中锌的测定结果
(6)结果分析
(1)单因素探究实验结果表明影响吸光度差值△a最优条件为:3.0ml4mol/l硫酸溶液,3.0ml3%h2o2溶液,1.0ml0.05%甲基橙溶液,在以上条件下反应半小时,反应温度为100℃。
(2)正交实验分析法对影响吸光度差值△a的结果表明,4mol/l硫酸溶液为4.0ml,3%h2o2溶液为4.0ml,0.05%甲基橙溶液为0.5ml,反应时间为40min,反应温度为100℃时,此时的△a为0.288,去除率为67.2%。
(3)本次实验测得茶叶中锌含量约4.74mg/l,回收率的平均值在97.2%。
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
- 还没有人留言评论。精彩留言会获得点赞!