本发明涉及一种核酸酶检测方法及试剂盒,具体涉及一种基于鱼精蛋白辅助的核酸酶检测方法及试剂盒,属于核酸酶检测技术领域。
背景技术:
核酸酶是一种能够将核酸适体切割成单核苷酸或寡核苷酸片段的酶类,属于水解酶。有些核酸酶能从核酸适体的一端逐个水解下单核苷酸或寡核苷酸片段,这些核酸酶被称为核酸外切酶;有些核酸酶则催化水解核酸适体内部的磷酸二酯键,这些核酸酶被称为核酸内切酶。核酸内切酶和核酸外切酶对核酸适体的切割已被证明在涉及复制、重组、dna修复、分子克隆、基因分型和作图的生物过程中发挥关键作用。因此,精确分析核酸酶的活性具有重要意义。
传统的检测核酸酶的方法有:凝胶电泳法、放射性标记法、高效液相色谱法(hplc法)及酶联免疫吸附测定法(elisa法)。虽然这些传统的检测方法具有较高的准确度,但这些传统的检测方法依然存在许多亟待解决的问题,如:操作繁琐,检测周期长,需引入放射性物质,仪器昂贵,需要复杂的修饰过程。这些问题的使存在得核酸酶的检测难以实现高通量和自动化。
技术实现要素:
为解决现有技术的不足,本发明的目的在于提供一种能够实现高通量和自动化检测的核酸酶检测方法以及在该检测方法中所使用的试剂盒。
为了实现上述目标,本发明采用如下的技术方案:
一种基于鱼精蛋白辅助的核酸酶检测方法,其特征在于,包括以下步骤:
step1:合成带有负电荷的金纳米粒子,并将合成的带有负电荷的金纳米粒子稀释至吸光度值在0.2-0.8之间;
step2:在0.0-2.0μg/ml这个浓度范围内配制一系列不同浓度的鱼精蛋白溶液,然后将配制好的鱼精蛋白溶液加入到step1中稀释好的金纳米粒子溶液中,优化出能够使金纳米粒子恰好发生团聚的鱼精蛋白溶液的浓度;
step3:在0-6μm这个浓度范围内配制一系列不同浓度的核酸适体溶液,然后将配制好的核酸适体溶液加入到step2中优化好的鱼精蛋白溶液中,反应20min,然后加入step1中稀释好的金纳米粒子溶液,优化出使金纳米粒子恰好不发生团聚的核酸适体溶液的浓度;
step4:配制一系列不同浓度的核酸酶标准溶液,然后将配制好的核酸酶标准溶液与step3中优化好的核酸适体溶液在37℃下反应90min,然后在高温下灭活20min,接着加入step2中优化好的鱼精蛋白溶液反应10min,然后加入step1中稀释好的金纳米粒子溶液反应10min,最后根据加入不同浓度的核酸酶标准溶液后金纳米粒子吸光度值的变化绘制出核酸酶的标准工作曲线;
step5:在相同条件下将待测样品加入体系中,产生样品信号,通过将样品溶液中金纳米粒子的吸光度值与核酸酶的标准工作曲线对照得到待测样品中核酸酶的浓度。
前述的基于鱼精蛋白辅助的核酸酶检测方法,其特征在于,在step1中,合成带有负电荷的金纳米粒子的方法为一步合成法或种子合成法,还原剂为柠檬酸钠、硼氢化钠、抗坏血酸或盐酸羟胺。
前述的基于鱼精蛋白辅助的核酸酶检测方法,其特征在于,合成的带有负电荷的金纳米粒子形状为球形、三角形、棒状或片状,粒径在10-100nm范围内。
前述的基于鱼精蛋白辅助的核酸酶检测方法,其特征在于,在step4中,前述核酸酶包括:核酸外切酶和核酸内切酶。
前述的基于鱼精蛋白辅助的核酸酶检测方法,其特征在于,在step4中,在加入鱼精蛋白溶液之前,先将高温灭火后的溶液置于冷水中冷却至室温。
一种用于检测待测样品中核酸酶的试剂盒,其特征在于,该试剂盒中含有:核酸酶标准品、核酸适体和鱼精蛋白。
前述的用于检测待测样品中核酸酶的试剂盒,其特征在于,前述核酸适体为配制好的在0-6μm这个浓度范围内的一系列不同浓度的核酸适体溶液。
前述的用于检测待测样品中核酸酶的试剂盒,其特征在于,前述鱼精蛋白为配制好的在0.0-2.0μg/ml这个浓度范围内的一系列不同浓度的鱼精蛋白溶液。
本发明的有益之处在于:
(1)本发明提供的核酸酶检测方法:基于鱼精蛋白辅助(以聚阳离子鱼精蛋白作为中间媒介,它能够有效地分别与核酸适体和金纳米粒子发生静电吸附作用,大大降低了方法的检出限,从而提高了检测的灵敏度),具有简单、快速、灵敏、检测范围宽、检测费用低的特点,可以实现核酸酶的高通量和自动化检测,是一种通用型的核酸酶检测方法,对于多种早期疾病的早期检测具有极高的应用价值;
(2)本发明提供的核酸酶检测方法:采用金纳米粒子作为比色传感方法的信号指示,其合成方法简单,稳定性好,颜色变化明显、易于肉眼观察。
附图说明
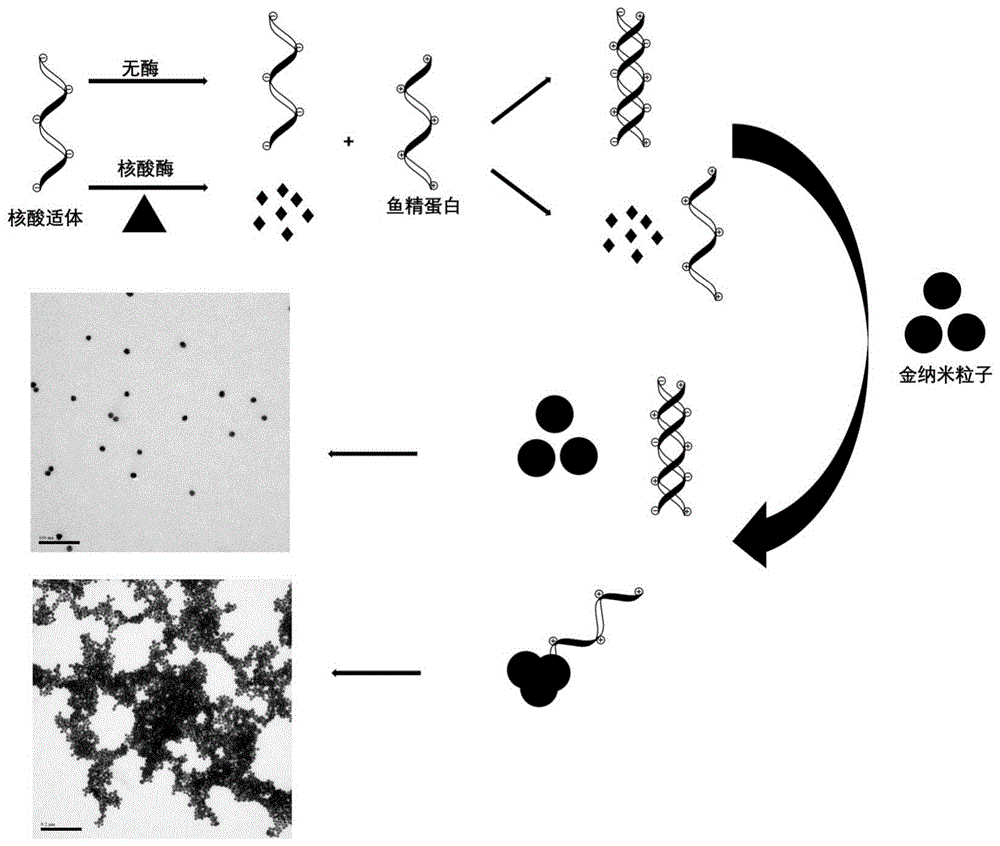
图1是本发明提供的基于鱼精蛋白辅助的核酸酶检测方法的检测原理图;
图2是鱼精蛋白溶液浓度优化图;
图3是核酸适体溶液浓度优化图;
图4是不同浓度s1核酸酶的标准信号响应曲线;
图5是不同浓度s1核酸酶的标准工作曲线。
具体实施方式
本发明提供的核酸酶检测方法是基于鱼精蛋白辅助的,检测原理如图1所示,具体的:
当向核酸适体(带负电荷)中加入核酸酶(既可以是核酸外切酶,也可以是核酸内切酶)后,核酸酶能够水解或切断核酸适体,其中,被核酸酶水解或切断的核酸适体成为单核苷酸或寡核苷酸片段,这些单核苷酸或寡核苷酸片段不再带负电荷,而未被核酸酶水解或切断的核酸适体仍带负电荷,此时向体系中加入鱼精蛋白,鱼精蛋白带正电荷,能够与带负电荷的核酸适体发生静电吸附作用,而不会与不带负电荷的单核苷酸或寡核苷酸片段发生静电吸附作用,然后向体系中加入带负电荷的金纳米粒子,此时,体系中未与核酸适体发生静电吸附作用的鱼精蛋白(即剩余的鱼精蛋白)能够使金纳米粒子发生团聚,从而引起金纳米粒子紫外吸收信号的改变,根据金纳米粒子吸光度值的变化即可得到待测溶液中核酸酶的浓度。
以下结合具体实施例对本发明作具体的介绍。
实施例1
检测s1核酸酶(s1nuclease)。s1核酸酶是一种核酸内切酶,其能够降解单链dna和单链rna,产生5'-单链核苷酸或寡核苷酸。
利用本发明提供的方法检测s1核酸酶的步骤具体如下:
step1:合成带有负电荷的金纳米粒子,并稀释至吸光度值在0.2-0.8之间。
采用frens法(一步合成法),以氯金酸作为原始材料,以柠檬酸钠作为还原剂,合成带有负电荷的金纳米粒子,具体的:
将100ml浓度为1mm的氯金酸溶液煮沸,然后向煮沸的氯金酸溶液中快速加入10ml浓度为38.8mm的柠檬酸钠溶液,此时,溶液的颜色由黄色逐渐变为浅灰色,最终变为酒红色,继续煮沸30min后停止加热,搅拌冷却至室温,最后置于4℃冰箱中保存待用。
使用时,用纯净水将溶液稀释至在520nm处吸光度值为0.45。
step2:优化鱼精蛋白溶液的浓度。
在0.0-2.0μg/ml这个浓度范围内配制一系列不同浓度的鱼精蛋白溶液,具体有:0.0μg/ml、0.5μg/ml、1.0μg/ml、1.5μg/ml、2.0μg/ml五个浓度,每个浓度取100μl,然后分别加入400μlstep1中稀释好的金纳米粒子溶液,测定混合溶液在520nm处和615nm处的吸光度值,以鱼精蛋白溶液浓度为横坐标,以a615/a520为纵坐标,做柱形图,得到图2,以使金纳米粒子恰好发生团聚的鱼精蛋白溶液的浓度为最佳浓度,根据图2所示结果我们优化出的鱼精蛋白溶液的浓度为1.5μg/ml。
step3:优化核酸适体溶液的浓度。
在0-6μm这个浓度范围内配制一系列不同浓度的核酸适体溶液,具体有:0μm、1μm、2μm、4μm、6μm五个浓度,每个浓度取10μl,与100μlstep2中优化的鱼精蛋白溶液混合反应20min,然后加入400μlstep1中稀释好的金纳米粒子溶液,测定混合溶液在520nm处和615nm处的吸光度值,以核酸适体溶液浓度为横坐标,以a615/a520为纵坐标,做柱形图,得到图3,以使金纳米粒子恰好不发生团聚的核酸适体溶液的浓度为最佳浓度,根据图3所示结果我们优化出的核酸适体溶液的浓度为4μm。
step4:绘制核酸酶的标准工作曲线。
配制一系列不同浓度的s1核酸酶标准溶液,具体有:0u/ml、0.001u/ml、0.002u/ml、0.004u/ml、0.01u/ml、0.02u/ml、0.1u/ml、0.2u/ml、0.3u/ml、0.4u/ml十个浓度,取10μl配制好的s1核酸酶标准溶液与10μlstep3中优化好的核酸适体溶液在37℃下反应90min,然后在70℃的高温下灭活20min,为了避免鱼精蛋白在较高温度下失活,将反应后的溶液置于冷水中冷却至室温,接着加入100μlstep2中优化好的鱼精蛋白溶液反应10min,最后加入400μlstep1中稀释好的金纳米粒子溶液反应10min,先记录不同波长下混合溶液的吸光度值,绘出不同浓度s1核酸酶的标准信号响应曲线,得到的标准信号响应曲线如图4所示,从图4中可以看出,随着核酸酶浓度的增加,金纳米粒子的团聚程度依次增大,然后以s1核酸酶标准溶液的浓度为横坐标,以a615/a520为纵坐标,做拟合曲线,得到不同浓度s1核酸酶的标准工作曲线,在本实施例中,我们绘制得到的标准工作曲线如图5所示,该标准工作曲线对应的表达式为:
其中,x0=-2.1101,y0=0.1171,a=4.1877,b=-0.4518。
另外,通过iupac规定的检出限的标准计算方法(lod=y0+3sd0,y0是空白的平均信号强度,sd0是空白测量的标准偏差)以及该标准工作曲线我们可以确定的是:该方法的检出限可以低至1×10-4u/ml,检测范围可以扩大至0.001u/ml-0.4u/ml。
step5:在相同条件下测量待测样品,产生样品信号。
在s1缓冲溶液(30mmch3coona,1mm(ch3coo)2zn,50mmnacl,ph4.6)中配制两个加标试样,浓度分别为0.005u/ml和0.2u/ml,依照step4中的操作步骤,在相同条件下测量待测样品,具体的:
取10μl配制好的加标试样与10μlstep3中优化好的核酸适体溶液在37℃下反应90min,然后在70℃的高温下灭活20min,为了避免鱼精蛋白在较高温度下失活,将反应后的溶液置于冷水中冷却至室温,接着加入100μlstep2中优化好的鱼精蛋白溶液反应10min,最后加入400μlstep1中稀释好的金纳米粒子溶液反应10min,之后测量混合溶液在520nm处和615nm处的吸光度值,计算a615/a520,根据计算结果,对照s1核酸酶的标准工作曲线(图5)再计算出待测样品中s1核酸酶相应的浓度。
经测量,第一个加标试样a520=0.38、a615=0.22,第二个加标试样a520=0.35、a615=0.39。
经计算,第一个加标试样a615/a520=0.57,第二个加标试样a615/a520=1.11。
对照s1核酸酶的标准工作曲线,经计算,两个加标试样的s1核酸酶的浓度分别为0.012u/ml和0.149u/ml,与实际浓度大致相同。
可见,本发明提供的检测方法可以用于实际测定核酸酶。
需要说明的是,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
