一种红花注射液中游离槲皮素的富集方法及含量测定方法与流程
本发明涉及检测分析领域,尤其涉及一种红花注射液中游离槲皮素的富集方法及含量测定方法。
背景技术:
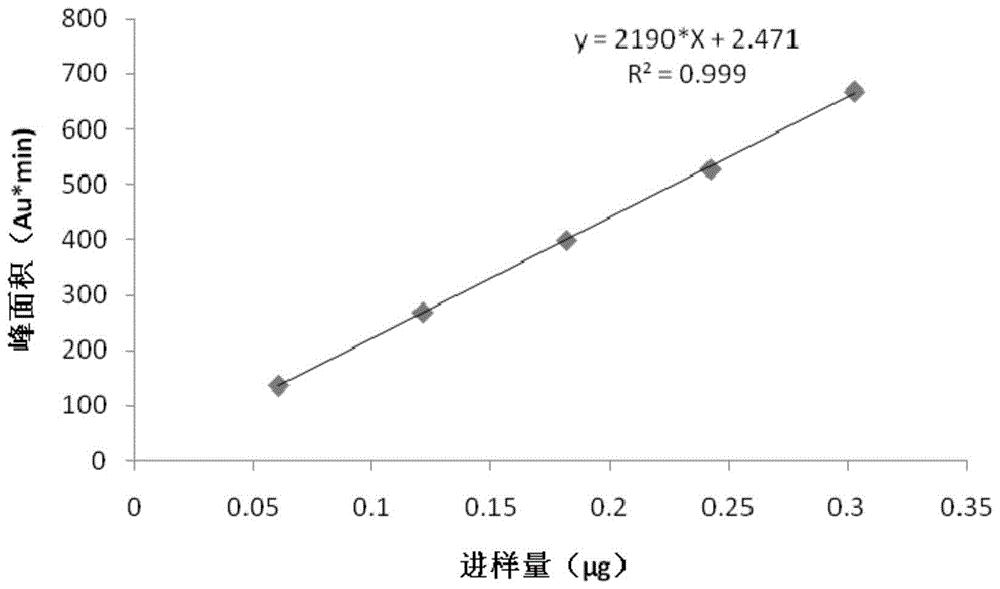
:红花注射液化学成分复杂,主要含16种化合物。槲皮素是一类水难溶性成分,其在红花注射液中主要是以槲皮素为母核的糖苷组成的黄酮醇类化合物存在,其仍旧有游离成分存在。游离槲皮素与红花注射液可见异物成因有极大关系,监测红花注射液中水不溶性游离槲皮素含量对红花注射液质量控制有很大联系。相关文献表明,大量中药成分中检测槲皮素含量的方法是用酸水解以槲皮素为母体的糖苷组成的黄酮醇类化合物,目前还没有关于红花注射液中游离槲皮素含量测定方法的相关研究。并且,红花注射液中游离槲皮素含量极低,其他成分对游离槲皮素的含量测定也有一定干扰,游离槲皮素含量测定难度较大。技术实现要素:本发明的目的在于提供一种红花注射液中游离槲皮素的富集方法及含量测定方法。为实现以上目的,本发明提供以下技术方案。本发明第一方面提供一种红花注射液中游离槲皮素的富集方法,包括如下步骤:步骤a.在红花注射液中加盐,混匀得到混合溶液a,所述盐在混合溶液a中为过饱和状态;步骤b.使用乙腈吸附混合溶液a中的游离槲皮素。作为上述技术方案的进一步改进,所述盐选自氯化钠、硫酸钠、硫酸铵中的任意一种。作为上述技术方案的进一步改进,20ml红花注射液中加入至少4.5g氯化钠。作为上述技术方案的进一步改进,在使用乙腈吸附之前还需要将混合溶液a静置30~60min。作为上述技术方案的进一步改进,所述乙腈与红花注射液的体积比为(0.5~2):1。作为上述技术方案的进一步改进,步骤b中使用乙腈多次吸附混合溶液a中的游离槲皮素;作为上述技术方案的进一步改进,所述多次为至少3次。作为上述技术方案的进一步改进,使用乙腈吸附混合溶液a中的游离槲皮素包括:在混合溶液a中加入乙腈、混匀、离心,离心后上层溶液即为吸附有游离槲皮素的乙腈溶液。本发明第二方面提供一种红花注射液中游离槲皮素的含量测定方法,包括如下步骤:步骤1.采用第一方面所述的富集方法富集待测红花注射液中的游离槲皮素;步骤2.对富集的游离槲皮素进行定量检测。作为上述技术方案的进一步改进,所述定量检测为hplc检测。作为上述技术方案的进一步改进,步骤1包括:除去吸附有游离槲皮素的乙腈溶液中的乙腈后将其溶于甲醇,然后进行hplc检测。作为上述技术方案的进一步改进,通过蒸发除去所述乙腈溶液中的乙腈。作为上述技术方案的进一步改进,甲醇溶液使用微孔滤膜过滤后进行hplc检测,所述微孔滤膜孔径为0.22μm或0.45μm。作为上述技术方案的进一步改进,微孔滤膜孔径为0.22μm。作为上述技术方案的进一步改进,hplc的检测条件包括如下a至f中的一项或多项:a.色谱柱为十八烷基硅烷键合硅胶反向色谱柱;b.流动相包括流动相a和流动相b,流动相a为甲醇,流动相b为磷酸水溶液,流动相a和流动相b体积比为(45~50)∶(55~50);优选地,磷酸水溶液的浓度为0.4wt%;c.柱温为30℃;d.柱流量为1ml/min;e.进样量为20~40μl;f.检测器为紫外检测器;优选地,检测波长为370nm。本发明的有益效果:本发明的红花注射液中游离槲皮素的富集方法采用盐析吸附法富集红花注射液中的游离槲皮素,该方法富集的游离槲皮素纯度高,杂质含量较低,降低了在后续游离槲皮素含量测定过程中杂质的干扰,提高了含量测定的准确度。本发明的红花注射液中游离槲皮素的含量测定方法精密度高,重复性好,稳定性好,准确度高。附图说明为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对本发明范围的限定。图1为实施例1中的标准工作曲线。图2为不同流动相得到的高效液相图谱。图3为乙腈富集的游离槲皮素与槲皮素对照品的高效液相图谱。图4为丙酮富集的游离槲皮素与槲皮素对照品的高效液相图谱。图5为乙酸乙酯富集的游离槲皮素与槲皮素对照品的高效液相图谱。具体实施方式如本文所用之术语:“由……制备”与“包含”同义。本文中所用的术语“包含”、“包括”、“具有”、“含有”或其任何其它变形,意在覆盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。连接词“由……组成”排除任何未指出的要素、步骤或组分。如果用于权利要求中,此短语将使权利要求为封闭式,使其不包含除那些描述的材料以外的材料,但与其相关的常规杂质除外。当短语“由……组成”出现在权利要求主体的子句中而不是紧接在主题之后时,其仅限定在该子句中描述的要素;其它要素并不被排除在作为整体的所述权利要求之外。当量、浓度、或者其它值或参数以范围、优选范围、或一系列上限优选值和下限优选值限定的范围表示时,这应当被理解为具体公开了由任何范围上限或优选值与任何范围下限或优选值的任一配对所形成的所有范围,而不论该范围是否单独公开了。例如,当公开了范围“1~5”时,所描述的范围应被解释为包括范围“1~4”、“1~3”、“1~2”、“1~2和4~5”、“1~3和5”等。当数值范围在本文中被描述时,除非另外说明,否则该范围意图包括其端值和在该范围内的所有整数和分数。在这些实施例中,除非另有指明,所述的份和百分比均按质量计。“质量份”指表示多个组分的质量比例关系的基本计量单位,1份可表示任意的单位质量,如可以表示为1g,也可表示2.689g等。假如我们说a组分的质量份为a份,b组分的质量份为b份,则表示a组分的质量和b组分的质量之比a:b。或者,表示a组分的质量为ak,b组分的质量为bk(k为任意数,表示倍数因子)。不可误解的是,与质量份数不同的是,所有组分的质量份之和并不受限于100份之限制。“和/或”用于表示所说明的情况的一者或两者均可能发生,例如,a和/或b包括(a和b)和(a或b)。本发明第一方面提供一种红花注射液中游离槲皮素的富集方法,包括如下步骤:步骤a.在红花注射液中加盐,混匀得到混合溶液a,所述盐在混合溶液a中为过饱和状态;步骤b.使用乙腈吸附混合溶液a中的游离槲皮素。本方法采用盐析吸附法,加过量盐使红花注射液中的游离槲皮素析出并溶于乙腈,乙腈与红花注射液分层,取乙腈层,通过乙腈反复充分吸附即可实现红花注射液中的游离槲皮素的富集。该方法中使用乙腈富集的游离槲皮素纯度高,杂质含量较低,降低了在后续游离槲皮素含量测定过程中杂质的干扰,提高了检测准确度。可选地,所述盐选自氯化钠、硫酸钠、硫酸铵中的任意一种。当使用的盐为氯化钠时,20ml红花注射液加入至少4.5g氯化钠时,氯化钠在混合溶液a中达过饱和状态。可选地,在使用乙腈吸附之前还需要将混合溶液a静置,静置时间优选30~60min。通过静置可以使红花注射液中的游离槲皮素充分析出。可选地,所述乙腈与红花注射液的体积比为(0.5~2):1。可选地,步骤b中使用乙腈多次吸附混合溶液a中的游离槲皮素;优选地,所述多次为至少3次。多次吸附可以将红花注射液中的游离槲皮素吸附更充分,当吸附次数在4次以上时,可以将红花注射液中的游离槲皮素完全吸附。可选地,使用乙腈吸附混合溶液a中的游离槲皮素包括:在混合溶液a中加入乙腈、混匀、离心,离心后上层溶液即为吸附有游离槲皮素的乙腈溶液。离心转速为4000~6000r/min,离心时间为10~20min;优选地,离心转速为5000r/min,离心时间为15min。本发明第二方面提供一种红花注射液中游离槲皮素的含量测定方法,包括如下步骤:步骤1.采用第一方面提供的富集方法富集待测红花注射液中的游离槲皮素;步骤2.对富集的游离槲皮素进行定量检测。定量方法可以为本领域常用的定量方法,能够实现槲皮素的定量检测即可,可选地,所述定量检测为hplc检测。可选地,步骤1包括:除去吸附有游离槲皮素的乙腈溶液中的乙腈后将其溶于甲醇,然后进行hplc检测。可选地,通过蒸发除去所述乙腈溶液中的乙腈。可选地,甲醇溶液使用微孔滤膜过滤后进行hplc检测,所述微孔滤膜孔径为0.22μm或0.45μm;优选地,微孔滤膜孔径为0.22μm。可选地,hplc的检测条件包括如下a至f中的一项或多项:a.色谱柱为十八烷基硅烷键合硅胶反向色谱柱;b.流动相包括流动相a和流动相b,流动相a为甲醇,流动相b为磷酸水溶液,流动相a和流动相b体积比为(45~50)∶(55~50);优选地,磷酸水溶液的浓度为0.4wt%;c.柱温为30℃;d.柱流量为1ml/min;e.进样量为20~40μl;f.检测器为紫外检测器;优选地,检测波长为370nm。本发明中的hplc检测方法精密度高,重复性好,稳定性好,准确度高。下面将结合具体实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。乙腈:色谱纯。甲醇:分析纯。丙酮:分析纯。乙酸乙酯:分析纯。槲皮素标准品:纯度≥99.1%,中国食品药品检定研究院。红花注射液:华润三九雅安药业有限公司。实施例1红花注射液中游离槲皮素的含量测定方法步骤如下:(1)红花注射液中游离槲皮素的富集:取红花注射液20ml,置于离心管中,加入6g氯化钠,摇匀,放置30~60min后加入40ml色谱乙腈,振摇5min,离心(离心转速为5000r/min,离心时间为15min),分层,吸取上层乙腈溶液;再分别加入乙腈30ml、20ml吸附,各吸附1次,合并乙腈溶液。(2)供试品溶液的制备:将吸附了游离槲皮素的乙腈溶液置于蒸发皿中,采用常温氮气吹发蒸干除去乙腈,余下的固体部分使用少量甲醇溶解并转移至2ml容量瓶,用甲醇定容至刻度,摇匀后,用微孔(0.22μm)滤膜过滤,即得。(3)标准工作溶液制备:取槲皮素对照品1.527mg,置于50ml容量瓶中,用甲醇稀释至刻度,得标准储备液(30.27μg/ml)。再取标准储备液适量,将标准储备液稀释至3.027μg/ml、6.055μg/ml、9.082μg/ml、12.108μg/ml、15.135μg/ml用于线性研究。(4)hplc检测:将供试品溶液和标准工作溶液进行hplc分析。hplc操作条件如下:色谱柱:phenomenexgemini-c18(4.6mm×250mm,5.0μm);流动相:48%甲醇和52%0.4wt%磷酸;柱温:30℃;柱流量:1ml/min;检测器:紫外检测器;检测波长:370nm。检测:精密吸取供试品溶液和标准工作溶液各20μl,注入气相色谱仪,测定,记录槲皮素峰面积。根据标准工作溶液的测定结果,以槲皮素进样量(即20μl标准工作溶液中槲皮素的质量)为横坐标(x),以总峰面积为纵坐标(y),绘制出标准工作曲线(图1)为y=2190*x+2.471,相关系数r=0.9995,能够满足检测所需的相关性要求。将供试品测定结果代入图1的标准工作曲线,得到供试品中槲皮素的质量,再计算得到供试品中槲皮素的含量,槲皮素含量=槲皮素的质量/供试品体积。使用上述方法检测10批红花注射液中的游离槲皮素的含量。检测结果如表1所示。表1红花注射液中游离槲皮素含量测定结果实施例2精密度试验精密吸取浓度为6.055μg/ml槲皮素标准储备溶液20μl,连续进样6次,检测槲皮素含量,计算峰面积的rsd,hplc条件同实施例1,结果见表2,说明,本方法精密度良好。表2精密度检测结果序号123456rsd(%)峰面积266.231267.68262.243265.397264.726270.8541.1实施例3重复性试验按实施例1中的方法,取批次为ky180801的红花注射液,富集游离槲皮素,按供试品制备方法,制备6份供试品。分别吸取20μl进样,测定供试品槲皮素成分含量,hplc条件同实施例1,计算峰面积rsd,结果如表3所示,说明本发明方法重复性良好。表3重复性检测结果序号123456rsd(%)峰面积177.233174.806179.483175.539182.105172.0112.0实施例4稳定性试验按实施例1中的方法,取批次为ky180801的红花注射液制备供试品溶液,分别在0小时、2小时、4小时、8小时、16小时、24小时进样(20μl),记录供试品槲皮素峰面积,计算其rsd,hplc条件同实施例1,结果见表4,说明本发明方法稳定性良好。表4稳定性检测结果序号123456rsd(%)含量177.153177.055176.249173.503170.862165.9732.5实施例5回收率试验精密吸取批号ky180801红花注射液20ml6份(游离槲皮素成分含量为0.39μg/ml),分别加入1ml对照品溶液(7.8μg/ml),按照供试品制备法制备供试品。照实施例1中的方法进行检测,计算回收率,见表5,平均回收率为99.4%,rsd=2.5%,可见本发明方法准确性良好。表5回收率检测结果实施例6耐用性试验色谱柱采用phenomenexgemini-c18(4.6mm×250mm,5.0μm)、waterssymmetryshieldtmrp18(4.6mm×250mm,5.0μm)和acclaimtm120c18(4.6mm×250mm,5.0μm)三种色谱柱对批次为ky180801的红花注射液供试品进行含量测定,检测方法同实施例1,结果见表6,从表6可以看出,三种色谱柱检测所得含量稳定,rsd为1.93%。表6游离槲皮素成分hplc检测色谱柱耐用性考察结果实施例7乙腈吸附次数的影响取批次为ky180801的红花注射液成品10支混合均匀,分别取4份,每份20ml,测定其中的游离槲皮素含量。供试品制备过程中使用a、b、c项乙腈吸附的次数不同,d项吸附次数相同,但第二次和第三次的乙腈用量不同其他与实施例1相同。供试品a:40ml吸附1次;供试品b:40ml吸附2次;供试品c:40ml吸附3次;供试品d:40ml、30ml、20ml各吸附一次。四个供试品中游离槲皮素的含量测定结果见表7,从表7可以看出,供试品c和d中槲皮素成分较前者高,说明红花注射液经三次以上盐析吸附,游离槲皮素成分就能被完全吸附。为保证吸附完全,将含量检测样品盐析吸附次数设定为3次。表7红花注射液在乙腈盐析吸附次数的考察实施例8流动相的影响使用不同流动相对标准品进行hplc检测,考察不同流动相对检测结果的影响。hplc其他条件与实施例1中相同。流动相分别为:(1)45%甲醇和55%0.4wt%磷酸;(2)48%甲醇和52%0.4wt%磷酸;(3)50%甲醇和50%0.4wt%磷酸。结果如图2所示,图中曲线从左至右依次为流动相为(2)、(1)、(3)的检测结果,可见甲醇在45-50%的比例之间时,拖尾较小,保留时间rsd在2%以内。当甲醇比例为48%时,效果最好,拖尾因子最小。对比例1不同吸附剂的影响分别用等量丙酮、乙酸乙酯作为吸附剂代替乙腈吸附游离槲皮素,其他与实施例1相同。本对比例中使用的红花注射液的批号为ky180801。乙腈富集的游离槲皮素与槲皮素对照品高效液相图谱如图3所示。丙酮富集的游离槲皮素与槲皮素对照品高效液相图谱如图4所示。乙酸乙酯富集的游离槲皮素与槲皮素对照品高效液相图谱如图5所示。本领域公知槲皮素在丙酮中的溶解度最大为16.91mg·ml-1,由图1、4、5可知,乙腈、丙酮和乙酸乙酯吸附的游离槲皮素的高效液相图谱中峰面积差异在5%以内,但是在使用乙腈时杂峰最少,表明乙腈不仅可以较好地吸附红花注射液中的游离槲皮素,而且可以较好地排除红花注射液中其他成分的影响。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。此外,本领域的技术人员能够理解,尽管在此的一些实施例包括其它实施例中所包括的某些特征而不是其它特征,但是不同实施例的特征的组合意味着处于本发明的范围之内并且形成不同的实施例。例如,在上面的权利要求书中,所要求保护的实施例的任意之一都可以以任意的组合方式来使用。公开于该
背景技术:
部分的信息仅仅旨在加深对本发明的总体
背景技术:
的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域技术人员所公知的现有技术。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1