6-磷酸葡萄糖脱氢酶突变体及其在制备洋地黄毒苷检测试剂中的用途的制作方法
6-磷酸葡萄糖脱氢酶突变体及其在制备洋地黄毒苷检测试剂中的用途
[0001]
本申请要求2019年1月9日提交的专利申请号为201910017764.4和2019年5月21日提交的201910423122.4《6-磷酸葡萄糖脱氢酶突变体及其在制备检测试剂中的用途》的优先权,其通过引用并入此处。
技术领域
[0002]
本申请涉及生物检测领域,特别是涉及一种突变的酶6-磷酸葡萄糖脱氢酶(简称g6pdh)及其在洋地黄毒苷检测试剂盒中的应用。
背景技术:
[0003]
半抗原,某些小分子物质(分子量小于4000da),其单独不能诱导免疫应答,即不具备免疫原性,但当其与大分子蛋白质或非抗原性的多聚赖氨酸等载体交联或结合后可获得免疫原性,诱导免疫应答。这些小分子物质可与应答效应产物结合,具备抗原性,它只有免疫反应性,不具免疫原性,又称不完全抗原。
[0004]
半抗原能与对应抗体结合出现抗原-抗体反应,又不能单独激发人或动物体产生抗体的抗原。它只有免疫反应性,不具免疫原性,又称不完全抗原。大多数多糖、类脂、激素、小分子药物都属于半抗原。如果用化学方法把半抗原与某种蛋白分子(载体)结合,会获得新的免疫原性,并能刺激动物产生相应的抗体。半抗原一旦与蛋白结合,就构成该蛋白质的一个抗原簇。一些比一般半抗原分子量小,但有特异结构的化学活性基团物质(如青霉素、磺胺剂等),称为简单半抗原。
[0005]
小分子抗原或半抗原因缺乏可作夹心法的两个以上的位点,因此不能用双抗体夹心法进行测定,多采用竞争模式。原理是标本中的抗原和一定量的酶标抗原竞争与固相抗体结合。标本中抗原量含量愈多,结合在固相上的酶标抗原愈少,显色愈浅。小分子激素、药物等elisa测定多用此法。
[0006]
洋地黄毒苷(digitoxin,dg)结构式如下所示:
[0007][0008]
洋地黄毒苷属于天然存在的一类强心苷(cg),由紫花洋地黄、毛花洋地黄或其他适合洋地黄中获得的强心苷。
[0009]
洋地黄毒苷大量在胃肠道吸收快速且完全,体内代谢缓慢,在肝代谢,大部分代谢产物无活性。地高辛常用于心力衰竭,适应症为充血性心力衰竭和心率失常,由于其作用慢而持久,尤其适用于慢性心功能不全患者长期服用。洋地黄毒苷与na
+
/k
+-atp酶在细胞膜上可逆性结合,阻止了酶与atp的结合,抑制了na
+
与k
+
的主动转运,使细胞内的na
+
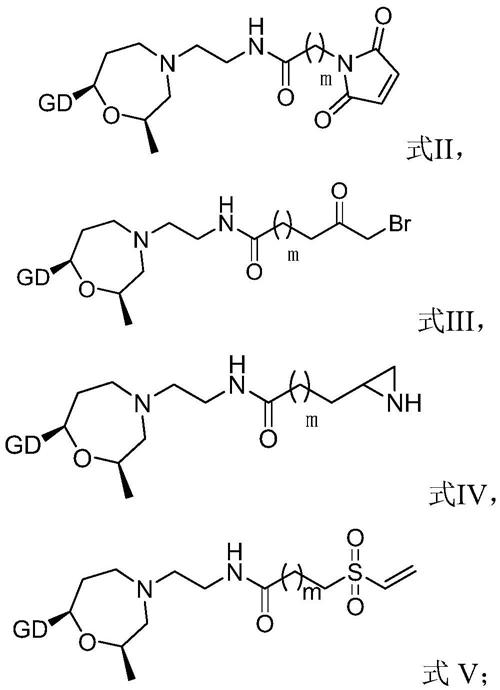
增加,k
+
减少,这是洋地黄苷类的直接电生理作用及毒性是由此而来。
[0010]
洋地黄毒苷用药量应根据患者个体需要仔细调整。洋地黄毒苷治疗性稳态血浆浓度为10至25ng/ml,更高的浓度(30ng/ml)可能伴有毒性。因此,临床上需要有效监控患者体内的洋地黄毒苷浓度。
[0011]
目前已知的洋地黄毒苷检测方法主要有:化学发光免疫分析法、高效液相色谱法、气液色谱法、气相色谱法和质谱联用等。但这些检测方法均存在较多的缺陷,如化学发光尽管灵敏度较好,但需要配套的专用设备,投入使用成本较高不利于推广。在临床检测诊断过程中,以均相酶免疫法(emit)和胶乳增强免疫比浊法检测为主。
[0012]
均相酶免疫测定的原理:在液体均相反应体系中,酶标记抗原(如g6pdh-洋地黄毒苷)与非标记抗原(洋地黄毒苷),竞争与定量的抗体(洋地黄毒苷抗体)进行结合,当抗体与非标记抗原结合越多,酶标记抗原释放的活性就越多,酶催化底物nad+生成nadh就越多,在340nm波长下检测nadh的吸光度变化,即可推算出液体中洋地黄毒苷的含量。
[0013]
现有的均相酶免疫测定法、胶乳凝集比浊法常常因制备工艺复杂、批间差大,应用受到一定限制。cn102768284a中描述了一种小分子药物-g6pdh酶偶联物的制备方法。然而,现有技术的方法依赖于对小分子药物自身所带反应基团进行的激活,之后再与酶进行反应。这样的策略难以保证小分子药物和酶之间的定向反应,而导致批间差异大。
技术实现要素:
[0014]
鉴于本领域的需求,本申请提供了一种新型的6-磷酸葡萄糖脱氢酶突变体、及其在制备洋地黄毒苷检测试剂盒中的用途。
[0015]
根据一些实施方案,提供了一种6-磷酸葡萄糖脱氢酶突变体。区别于已有发表的专利us006090567a(homogeneous immunoassays using mutant glucose-6-phosphate dehydrogenases)的6磷酸葡萄糖脱氢酶的突变体,本申请的6-磷酸葡萄糖脱氢酶突变体,其包含选自以下的突变:d306c、g426c、d375c。
[0016]
根据一些实施方案,提供了一种6-磷酸葡萄糖脱氢酶突变体,所述6-磷酸葡萄糖脱氢酶突变体是选自以下的序列所示:seq id no.2、seq id no.3、seq id no.4。
[0017]
根据一些实施方案,提供了一种多核苷酸,其编码本申请的6-磷酸葡萄糖脱氢酶突变体。
[0018]
根据一些实施方案,提供了一种表达载体,其包含本申请的多核苷酸。
[0019]
根据一些实施方案,提供了一种宿主细胞,其包含本申请的表达载体。宿主细胞可以是原核(如细菌)或真核(如酵母)。
[0020]
根据一些实施方案,提供了一种偶联物,其是本申请的6-磷酸葡萄糖脱氢酶突变体与半抗原按照摩尔比1:n偶联而成。
[0021]
在一些实施方案中,n是1至50,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、
41、42、43、44、45、46、47、48、49、50。
[0022]
在一些具体的实施方案中,本申请的6-磷酸葡萄糖脱氢酶突变体与半抗原按照摩尔比优选为1:1。
[0023]
在一些具体的实施方案中,半抗原的分子量为100da至4000da,例如:100、150、200、250、300、350、400、410、420、430、440、450、460、470、480、490、500、520、550、570、600、620、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000。
[0024]
根据本申请,技术人员将理解,“半抗原”还包含其衍生物的形式。为了便于和6-磷酸葡萄糖脱氢酶进行偶联,对于那些自身不带有偶联基团(例如,与巯基反应的基团)的半抗原(例如洋地黄毒苷),可以经改造而带有接头,以便和巯基共价结合。因此,在本申请中,半抗原衍生物是指,经改造而带有巯基反应基团的半抗原。
[0025]
半抗原选自:小分子药物(如抗生素、精神药物)、激素、代谢物、糖、脂质、氨基酸。
[0026]
半抗原例如但不限于:茶碱、苯妥英、维生素d、25羟维生素d、1,25双羟维生素d、叶酸、强心甙(包括洋地黄毒苷)、酶酚酸、雷帕明、环胞菌素a、乙胺碘复酮、甲胺喋呤、他克莫司、血清氨基酸、胆汁酸、甘胆酸、苯丙氨酸、乙醇、尿尼柯丁代谢产物柯替宁、尿吗啡、尿单羟酚衍生物、神经肽酪氨酸、血浆甘丙素、多胺、组织胺、促甲状腺激素、泌乳素、胎盘泌乳素、生长激素、促卵泡刺激素、促黄体生成素、促肾上腺皮质激素、抗利尿激素、降钙素、降钙素原、甲状旁腺激素、甲状腺素、三碘甲状原氨酸、反三碘甲状原氨酸、游离甲状腺素、游离三碘甲状原氨酸、皮质醇、尿17-羟皮质类固醇、尿17-酮类固醇、脱氢表雄酮及硫酸酯、醛固酮、尿香草苦杏仁酸、血浆肾素、血管紧张素、促红细胞生成素、睾酮、双氢睾酮、雄烯二酮、17α羟孕酮、雌酮、雌三醇、雌二醇、孕酮、人绒毛膜促性腺激素、胰岛素、胰岛素原、c肽、胃泌素、血浆前列腺素、血浆6-酮前列腺素f1α、前列环素、肾上腺素、儿茶酚胺、去甲肾上腺素、胆囊收缩素、纳素、环磷酸腺苷、环磷酸鸟苷、血管活性肽、生长抑素、促胰液素、p-物质、神经降压素、血栓素a2、血栓素b2、5羟色胺、神经肽y、骨钙素。
[0027]
在具体的实施方案中,半抗原是洋地黄毒苷或其衍生物。
[0028]
在具体的实施方案中,半抗原是洋地黄毒苷衍生物,其带有巯基反应基团,例如来酰亚胺、溴乙酰基、乙烯基砜或氮丙啶。
[0029]
在具体的实施方案中,半抗原是洋地黄毒苷衍生物,如式i所示:
[0030]
[0031]
其中,
[0032]
在一些实施方案中,m为0至20的整数,优选1至10的整数,优选1至6的整数,例如1、2、3、4、5、6。
[0033]
在一些实施方案中,x是马来酰亚胺、溴乙酰基、乙烯基砜或氮丙啶。
[0034]
技术人员能够理解,x功能在于和6-磷酸葡萄糖的巯基进行反应。马来酰亚胺、溴乙酰基、乙烯基砜、氮丙啶和巯基的共价结合是可以预期的。尽管实施例中,采用具体的特定基团,但不意图限制于此。
[0035]
在一些具体的实施方案中,所述洋地黄毒苷衍生物,其具有选自下式的结构:
[0036][0037][0038]
m为0至20的整数,优选1至10的整数,优选1至6的整数。
[0039]
在一些具体的实施方案中,所述洋地黄毒苷衍生物,其具有选自下式的结构:
[0040][0041]
根据一些实施方案,提供了一种试剂,其包含本申请的偶联物。
[0042]
根据一些实施方案,提供了本申请的6-磷酸葡萄糖脱氢酶突变体在制备洋地黄毒苷检测试剂中的用途。
[0043]
根据一些实施方案,提供了本申请的偶联物在制备洋地黄毒苷检测试剂中的用途。
[0044]
在具体的实施方案中,所述的检测试剂选自:酶联免疫法检测试剂、化学发光免疫法检测试剂、均相酶免疫法检测试剂、胶乳增强免疫比浊法检测试剂。
[0045]
在具体的实施方案中,所述的检测试剂优选是基于竞争法检测的试剂。
[0046]
根据一些实施方案,提供了一种洋地黄毒苷检测试剂盒,其包含:
[0047]-第一试剂,所述第一试剂包含底物、缓冲液和洋地黄毒苷抗体;所述底物是6-磷酸葡萄糖脱氢酶的底物;
[0048]-第二试剂,所述第二试剂包含本申请的偶联物和缓冲液;
[0049]-任选地,校准品,所述校准品包含10mm至500mm缓冲液、0ng/ml至80ng/ml洋地黄毒苷;以及
[0050]-任选地,质控品,所述质控品包含10mm至500mm缓冲液、10ng/ml至50ng/ml洋地黄毒苷。
[0051]
根据一个实施方案,提供了一种洋地黄毒苷检测试剂盒,其包含:
[0052]
第一试剂,其包含:
[0053]
10mm至500mm缓冲液、
[0054]
5mm至50mm底物、
[0055]
10ng/ml至10μg/ml的洋地黄毒苷抗体、
[0056]
0.1g/l至5g/l稳定剂、
[0057]
0.1g/l至5g/l表面活性剂、
[0058]
0.1g/l至5g/l防腐剂;
[0059]
第二试剂,其包含:
[0060]
10mm至500mm缓冲液、
[0061]
0.01μg/ml至10μg/ml根据本申请的偶联物、
[0062]
0.1g/l至5g/l稳定剂、
[0063]
0.1g/l至5g/l表面活性剂、
[0064]
0.1g/l至5g/l防腐剂。
[0065]
在一些实施方案中,所述缓冲液选自以下的一种或组合:氨基丁三醇缓冲液、磷酸盐缓冲液、tris-hcl缓冲液、柠檬酸-柠檬酸钠缓冲液、巴比妥缓冲液、甘氨酸缓冲液、硼酸盐缓冲液、三羟甲基甲烷缓冲液;优选,磷酸盐缓冲液;所述缓冲液的浓度为10mmol/l至500mmol/l,优选100mm;所述缓冲液的ph为7至8。
[0066]
在一些实施方案中,所述稳定剂选自以下的一种或组合:牛血清白蛋白、海藻糖、甘油、蔗糖、甘露醇、甘氨酸、精氨酸、聚乙二醇6000、聚乙二醇8000;优选牛血清白蛋白。
[0067]
在一些实施方案中,所述表面活性剂选自以下的一种或组合:brij35、triton x-100、triton x-405、tween20、tween30、tween80、椰子油脂肪酸二乙醇酰胺、aeo7,优选tween20。
[0068]
在一些实施方案中,所述的防腐剂选自以下的一种或组合:叠氮化物、mit、pc-300、硫柳汞;所述叠氮化物选自:叠氮钠、叠氮锂。
[0069]
在一些实施方案中,所述底物包含:6-磷酸葡糖糖、β-烟酰胺腺嘌呤二核苷酸。
[0070]
在一些具体的实施方案中,所述洋地黄毒苷抗体源自:小鼠、大鼠、猫、犬、灵长类、牛、马、羊、骆驼科、禽、人。
[0071]
在一些具体的实施方案中,所述洋地黄毒苷抗体选自:单抗、多抗、重组抗体、嵌合抗体、抗原结合片段。
[0072]
根据一些实施方案,提供了一种偶联物的制备方法,包括步骤:
[0073]
1)提供根据本申请的洋地黄毒苷衍生物,尤其是在非质子性溶剂(例如但不限于乙腈、二甲基甲酰胺、二甲基亚砜)中提供根据本申请的洋地黄毒苷衍生物;
[0074]
2)提供6-磷酸葡萄糖脱氢酶突变体,优选在缓冲液(其提供反应环境,例如但不限于pbs、tris、taps、tapso,所述缓冲液ph为6.0至8.0)中提供6-磷酸葡萄糖脱氢酶突变体;
[0075]
3)在18℃至28℃,将所述6-磷酸葡萄糖脱氢酶突变体和所述洋地黄毒苷衍生物按照摩尔比1:n接触1小时至4小时(优选2小时至3小时)使得所述洋地黄毒苷衍生物和所述6-磷酸葡萄糖脱氢酶突变体发生偶联,得到所述种偶联物;
[0076]
4)根据需要,任选对所述种偶联物进行纯化,例如脱盐处理等。
[0077]
在一些实施方案中,n是1至50,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50。
[0078]
在一些具体的实施方案中,步骤1)和2)可互换。
[0079]
在一些具体的实施方案中,在偶联之前,所述6-磷酸葡萄糖脱氢酶包含一个或多
个游离的巯基,从而允许和洋地黄毒苷实现定向反应。
[0080]
野生型6-磷酸葡萄糖脱氢酶不含游离的巯基,因此在一些具体的实施方案中,6-磷酸葡萄糖脱氢酶是经过基因工程改造的,使其在特定位点(306、375或426位)上的氨基酸突变为半胱氨酸,从而带有一个游离巯基。
附图说明
[0081]
图1.洋地黄毒苷结构图。
[0082]
图2.洋地黄毒苷衍生物结构图。
[0083]
图3a.g6pdh(野生型)氨基酸序列(seq id no.1);源自明串珠菌属假肠膜明串珠菌leuconostoc pseudomesenteroides。
[0084]
图3b.g6pdh(d306c)氨基酸序列(seq id no.2)。
[0085]
图3c.g6pdh(d375c)氨基酸序列(seq id no.3)。
[0086]
图3d.g6pdh(g426c)氨基酸序列(seq id no.4)。
具体实施方式
[0087]
实施例
[0088]
实施例1.洋地黄毒苷衍生物的合成
[0089][0090]
1.化合物2的合成
[0091]
将1.0g洋地黄毒苷溶于80ml的95%乙醇中,然后向其中加入10ml高碘酸水溶液(1.0g高碘酸),室温(18至28℃,优选20至25℃)搅拌1小时。
[0092]
过滤除去残渣,减压除去溶剂,二氯甲烷萃取。有机相使用无水硫酸钠干燥,减压除去溶剂得到化合物2(白色固体,0.90g,产率90%)。
[0093]
2.化合物4的合成
[0094]
将化合物2(900mg,1.18mmol)溶于10ml干燥的甲醇中,将化合物3(318mg,1.0mmol)加入反应体系,室温搅拌5分钟。加入氰基硼氢化钠(146mg,2.32mmol),室温搅拌约12小时。
[0095]
减压除去溶剂,直接柱层析纯化得到化合物4(白色固体,400mg,46%)。
[0096]
3.化合物5的合成
[0097]
将化合物4溶于15ml二氯甲烷中,氮气条件下室温搅拌30分钟,然后加入10ml哌啶,室温搅拌2小时。减压除去溶液,柱层析纯化得到化合物5(500mg,85%)。
[0098]
4.洋地黄毒苷衍生物的合成
[0099]
化合物5(88mg,0.11mmol)和化合物6(17mg,0.11mmol)溶解于8ml dcm中,向其中滴加三乙胺(33mg,0.33mmol),然后加入hatu(50mg,0.13mmol),室温下搅拌2h,得到洋地黄毒苷衍生物(白色固体,48mg,43%)。
[0100]
按常规方法确认产物结构。本实施例使得洋地黄毒苷带有一个可以和酶结合的基团。
[0101]
实施例2.洋地黄毒苷衍生物与g6pdh分子的偶联
[0102]
根据本申请的g6pdh-洋地黄毒苷偶联物,按照以下方式进行偶联:洋地黄毒苷衍生物分子上的巯基反应性基团(如但不限于马来酰亚胺基团)与g6pdh分子上的巯基共价结合。
[0103]
1.溶液配制:
[0104]
洋地黄毒苷衍生物溶液:实施例1制备的洋地黄毒苷衍生物10mg/ml溶于dmf;
[0105]
g6pdh溶液:g6pdh(本申请的突变体或现有技术突变体)溶于pb 100mmol、nacl 100mmol、ph=8.0;
[0106]
偶联溶液:100mm pb/k、100mm edta、150mm nacl,ph=7.2;
[0107]
脱盐溶液:100mm pb/k、0.1%nan3、1%nacl,ph=8.0。
[0108]
2.偶联操作:
[0109]
将2ml g6pdh溶液、7.5ml偶联溶液和0.5ml洋地黄毒苷衍生物溶液,在室温反应4h。
[0110]
3.将上述反应体系室温振荡反应4h后,用上述脱盐溶液使用脱盐柱进行洗脱,收集蛋白峰,所得产物即g6pdh-洋地黄毒苷偶联物。
[0111]
实施例3.试剂盒的制备
[0112]
制备以下检测洋地黄毒苷的试剂盒,其包含:
[0113]
试剂r1,包含:
[0114]
50mm hepes,ph 7.0
[0115]
10mm 6-磷酸葡萄糖
[0116]
10mm β-烟酰胺腺嘌呤二核苷酸
[0117]
50ng/ml洋地黄毒苷抗体(市售抗体,无特殊限制)
[0118]
1g/l牛血清白蛋白
[0119]
1g/l tween20
[0120]
1g/l叠氮钠;
[0121]
试剂r2,包括:
[0122]
200mm tris缓冲液,ph 8.0
[0123]
0.1μg/ml g6pdh-洋地黄毒苷偶联物
[0124]
1g/l牛血清白蛋白
[0125]
1g/l tween 20
[0126]
1g/l叠氮钠;
[0127]
校准品:20mm hepes缓冲液,以及0.0、5.0、10.0、20.0、40.0、80.0ng/ml洋地黄毒苷(或按需加入);
[0128]
质控品:20mm hepes缓冲液,以及8ng/ml、15ng/ml、35ng/ml洋地黄毒苷(或按需加入)。
[0129]
将上述试剂(任选包含质控品、校准品),组装成洋地黄毒苷均相酶免疫检测试剂盒。
[0130]
检测例
[0131]
表1.全自动生化仪参数
[0132]
机型日立7180分析点[rate-a][10][25][34]波长(sub/main)[410]/[340]s.vil[10]s.r1;s.r3[150];[50]abs.limit[32000][递增]校准类型[spline]point[6]span ponit[6]校准品0.0、5.0、10.0、20.0、40.0、80.0ng/ml样本待检样本为各种生理样本,如血清、血浆
[0133]
测试例1.本申请试剂盒的准确度、精密度、线性实验(d306c突变体)
[0134]
表2.准确度、精密度
[0135][0136]
表3.线性
[0137] 测1测2测3均值理论值相对偏差绝对偏差11.812.081.681.861.28-0.5827.307.197.667.387.380.1%0.01313.2212.9012.8312.9813.48-3.7%-0.49420.1620.4519.5920.0719.582.5%0.49524.3925.6524.8924.9825.68-2.7%-0.70632.0030.4331.2431.2231.78-1.7%-0.55738.8439.0439.2039.0337.873.0%1.15844.6242.7144.0143.7843.97-0.4%-0.19948.8051.1850.1550.0450.07-0.1%-0.031057.5254.1354.7055.4556.17-1.3%-0.721162.2461.3561.5461.7162.27-0.9%-0.561267.9368.9869.5868.8368.370.7%0.461374.2578.4472.4375.0474.470.8%0.57
[0138]
检测例2.回收实验
[0139]
使用美国药典(usp)洋地黄毒苷纯品添加到混合血清样本,制备4个浓度,各水平测21次。计算均值及偏差。
[0140]
表4.回收实验
[0141][0142][0143]
检测例3.常见药物抗干扰
[0144]
表5.抗干扰的测定结果
[0145]
编号干扰物浓度(μg/ml)1n-乙酰半胱氨酸1502阿米替林23氨苄西林钠1004k-羟苯磺酸盐(氢醌磺酸钾盐)2005羟嗪二盐酸盐16甲基多巴倍半水合物207异丙嗪1008抗坏血酸309四环素50
10乙酰水杨酸100011丙磺舒50012左旋多巴(3,4-二羟基-l苯丙氨酸)2013甲硝唑10014吩噻嗪20015布洛芬50016保泰松1617对乙酰氨基酚20018氯丙嗪10019甲琥5020去甲替林121头孢西丁250022西替利嗪二盐酸盐323环孢素524地昔帕明325乙苯50265-(对羟基苯基-5-苯基海)100027丙咪嗪628苯巴比妥50029苯妥英钠50030茶碱10031丙戊酸100032乙琥胺100033扑痫酮100034利福平60
[0146]
检测例4.交叉反应
[0147]
使用缓冲液溶解洋地黄毒苷纯品,配制不同浓度洋地黄毒苷校准品。分别将以下浓度的洋地黄毒苷类似物添加到混合血清样本中。
[0148]
本申请的试剂使用洋地黄毒苷校准品定标,分别测定混合血清样品和上述样品5次,上述样品测定值与混合血清样品测定值的比值即为交叉反应率。
[0149]
表6.交叉反应率
[0150]
化学名称本申请试剂5.00ng/ml洋地黄毒甙配基309.7%20ng/ml异羟基洋地黄毒苷2.43%20ng/ml单洋地黄毒糖苷(digoxigenin-mono)0.08%20ng/ml双洋地黄毒糖苷(digoxigenin-bis)1.60%20ng/ml地高辛1.05%750ug/ml毒毛旋花子苷1.85%750ug/ml去乙酰毛花苷0.33%
[0151]
检测例5.洋地黄毒苷检测试剂盒的批间差
[0152]
使用三批次本申请试剂(含d306c突变体)分别定标,计算不同批次吸光度变化差异。
[0153]
表7.批次间的定标数据
[0154][0155]
表8.批次间的比较
[0156][0157]
对照试剂盒(和本申请试剂盒区别在于将酶替换为现有技术中的a45c突变体)按照相同方法测定批间差,cv为2.9%至4.5%范围内,显著低于本申请试剂盒。
[0158]
检测例6.抗体抑制率
[0159]
1.抗体抑制率的检测原理
[0160]
当抗体与g6pdh-洋地黄毒苷偶联物结合时,由于空间位阻导致g6pdh酶活性受到影响,从而使得其催化nad转化为nadh的效率降低,通过检测nadh量的变化,从而比较加入抗体与未加入抗体的实验组的差异,这种差异即体现为抗体对g6pdh的抑制能力。
[0161]
2.反应体系:
[0162]
表9.抗体抑制率的检测试剂制备
[0163][0164]
3.结果:
[0165]
比较加入抗体与未加入抗体时,分别检测g6pdh-洋地黄毒苷偶联物吸光度测值,即可得到抗体对g6pdh的抑制情况。
[0166]
抗体抑制率=[1-(含抗体时g6pdh-洋地黄毒苷的吸光度变化值/不含抗体时g6pdh-洋地黄毒苷的吸光度变化值)]
×
100%。
[0167]
相对于已发表的突变位点(a45c),本申请的突变体在抗体抑制率上有明显提高,能达到32%以上(g426c:32%;d375c:47%),最高达55%(d306c)。而之前已发表的突变位点(例如a45c、k55c)的抑制率在30至44%范围。
[0168]
虽然不限于具体理论,但是可以部分地解释为:
[0169]
和现有技术中的g6pdh突变体(a45c、k55c)相比,本申请酶突变体(尤其是d306c、d375c)中突变位点(即引入游离巯基的位点)是和半抗原(比如激素、小分子药物等)发生偶联的位置所在。半抗原在这个位置上与半抗原特异性抗体结合时,所构成的空间位阻对g6pdh酶的活性影响最小,同时在引入突变后,还不能实质上影响分子的空间折叠。因此,这个突变位点的位置非常重要,需要同时兼顾g6pdh酶的活性、偶联分子的空间折叠、以及半抗原表位的充分暴露。
[0170]
由于酶的突变体在抗体抑制率上有明显的提高。将酶的突变体与洋地黄毒苷偶联后的偶联物配制成试剂盒后,试剂在批间变异系数、线性、特异性等性能方面有明显的性能提升。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1