一种通过白色念珠菌细胞壁重构来评价中药单体抗真菌作用的方法与流程
本发明涉及一种通过白色念珠菌细胞壁重构来评价中药单体抗真菌作用的方法。
背景技术:
白色念珠菌为常见的条件致病性真菌,属于酵母科念珠菌属。白色念珠菌是在念珠菌属中发病率和死亡率排名第一的一种念珠菌。白念珠菌的耐药性主要来自长期/重复用药和/或内部生物膜的形成。它可以引起浅表的紊乱,也可以引发深层的入侵。但随着传统抗真菌药物的长期使用,临床出现越来越严重的菌株耐药,这已经严重危害患者的生命安全。
白色念珠菌细胞壁由β-葡聚糖、甘露糖蛋白和少量的壳多糖(几丁质)组成。白念珠菌的细胞壁蛋白参与白念珠菌的黏附和侵入。细胞壁是白念珠菌最外层结构,完整的细胞壁呈刚性结构,可以作为物理化学屏障保护细胞,并可以调节营养物质的吸收和代谢产物的分泌。白念珠菌感染时,正是通过其细胞壁的主要组分与宿主细胞上相应受体的相互作用介导对靶细胞的损伤。因此,研究针对细胞壁的抗白念珠菌药物对于防治白念珠菌感染具有重要意义。
白念珠菌细胞壁作为第一个接触点,是一个动态的、高度构成的细胞器,也是最早感知和响应由药物攻击引起的环境线索的部位。在大量的病原体分子模式(pamp时)共价链接到细胞壁,β-1,3-glucan通常是被埋在外层由连接有n-/o-的甘露糖基化和磷酸化的甘露糖基化装饰的糖基化的甘露糖蛋白下面。当感知外部刺激(如药物攻击),内部β-葡聚糖将会被暴露,这个过程叫做细胞壁重塑/重排(cwr),随后激活固有免疫防御。通过白色念珠菌细胞壁重构这种方法来评价药物抗真菌作用效果是具有一定的可行性和临床意义。
技术实现要素:
本发明的目的在于提供一种通过白色念珠菌细胞壁重构来评价中药单体抗真菌作用的方法。
为实现上述目的及其他相关目的,本发明提供的技术方案是:一种通过白色念珠菌细胞壁重构来评价中药单体抗真菌作用的方法,包括下列步骤:
步骤1:对保存的白色念珠菌株进行活化培养培养12-16h,直至白色念珠菌株达到指数生长阶段,然后离心后收集真菌细胞,用pbs洗涤后,将白色念珠菌株细胞在rpmi-1640培养基中复苏,然后调节rpmi-1640培养基ph值为7.5,并将白色念珠菌株细胞的浓度调节至1×103cfu/ml,得到评价菌液;
步骤2:将中药单体加入至评价菌液,孵育12h后用无菌pbs洗涤一次,再用无菌pbs配制的质量分数为2%的bsa封闭1小时,再然后用无菌pbs洗涤一次;接下来加入100ul的β-葡聚糖抗体,放在4°c冰箱进行染色4h,染色结束后,用无菌pbs洗涤2次,再用cy3单抗鼠标记igg在室温下避光染色1小时,然后用无菌pbs避光洗涤3次后用1ml的无菌pbs进行避光重悬,避光震荡混匀后用流式细胞仪进行葡聚糖荧光暴露强度的检测;
步骤3:将100ul的浓度为100μg/ml的荧光染料alexafluor488conjugatedwga、评价菌液和中药单体混合,孵育12h,然后放到37°c摇床中进行避光摇晃15分钟,然后用无菌pbs避光洗涤3次后用流式细胞仪进行几丁质荧光暴露强度的检测;
步骤4:用倒置荧光显微镜,选择激发波长488nm和发射波长525nm,将菌液滴在粘附载玻片上,然后盖上粘附盖玻片在倒置荧光显微镜亮场和暗场下记录β-葡聚糖与几丁质荧光图像;用含有抗体的无药菌液做空白对照。
优选的技术方案为:所述中药单体的浓度为最低抑菌浓度。
优选的技术方案为:用流式细胞仪bdaccuric6的fl1通道,488nm激发波长和520nm发射波长,白色念珠菌细胞进样5000个测几丁质的荧光暴露强度。
优选的技术方案为:用流式细胞仪bdaccuric6的fl2通道,488nm激发波长和570nm发射波长,白色念珠菌细胞进样5000个测β-葡聚糖的荧光暴露强度。
由于上述技术方案运用,本发明与现有技术相比具有的优点是:
本发明通过白色念珠菌细胞壁重构这种方法来评价药物抗真菌作用效果,具有一定的可行性和临床意义。
附图说明
图1为药敏结果。
图2为od结果。
图3为倒置显微镜检测结果。
图4为β-葡聚糖的荧光暴露强度。
图5为流式细胞仪检测结果。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
请参阅图1-5。须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
实施例1:一种通过白色念珠菌细胞壁重构来评价中药单体抗真菌作用的方法
白念珠菌细胞壁的β-葡聚糖的暴露是通过用接种菌液(=1×103cfu/ml)与thms在其mics浓度上在4mlep管中孵育12h,然后用无菌pbs洗涤一次,再用无菌pbs配制的2%的bsa(albuminfractionv)封闭1小时(cat.no.9048-46-8,biofroxx,shanghai,china),再然后用无菌pbs洗涤一次;接下来加入100ul的β-葡聚糖抗体(β-葡聚糖抗体:无菌pbs=1:300,cat.no.400-2,biosciencesupplies,australia)放在4°c冰箱进行染色4h,染色结束后,用无菌pbs洗涤2次,再用cy3单抗鼠标记igg(cy3:无菌pbs=1:100,cat.no143702a,abbkine,shanghai,china)在室温下避光染色1小时,然后用无菌pbs避光洗涤3次后用1ml的无菌pbs进行避光重悬,避光震荡混匀后用流式细胞仪进行葡聚糖荧光暴露强度的检测。耳道念珠菌细胞壁的几丁质的暴露检测是通过避光用加100ul的100μg/mlalexafluor488conjugatedwga(thermofisherscienfiric)到接种菌液(=1×103cfu/ml)与thms在其mics浓度上用4mlep管孵育12h的药菌中,然后放到37°c摇床中进行避光摇晃15分钟,然后用无菌pbs避光洗涤3次后用流式细胞仪进行几丁质荧光暴露强度的检测。
定量检测荧光暴露强度是用流式细胞仪bdaccuric6(上海,中国)的fl1通道(488nm激发波长和520nm发射波长),菌细胞进样5000个测几丁质的荧光暴露强度和fl2通道(488nm激发波长和570nm发射波长),菌细胞进样5000个测β-葡聚糖的荧光暴露强度。用倒置荧光显微镜(olympusix81,japan)选择激发波长488nm和发射波长525nm,将菌液滴一滴在粘附载玻片上,然后盖上粘附盖玻片在倒置荧光显微镜(olympusix81,japan)亮场和暗场下记录β-葡聚糖与几丁质荧光图像。用含有抗体的无药菌液做空白对照。
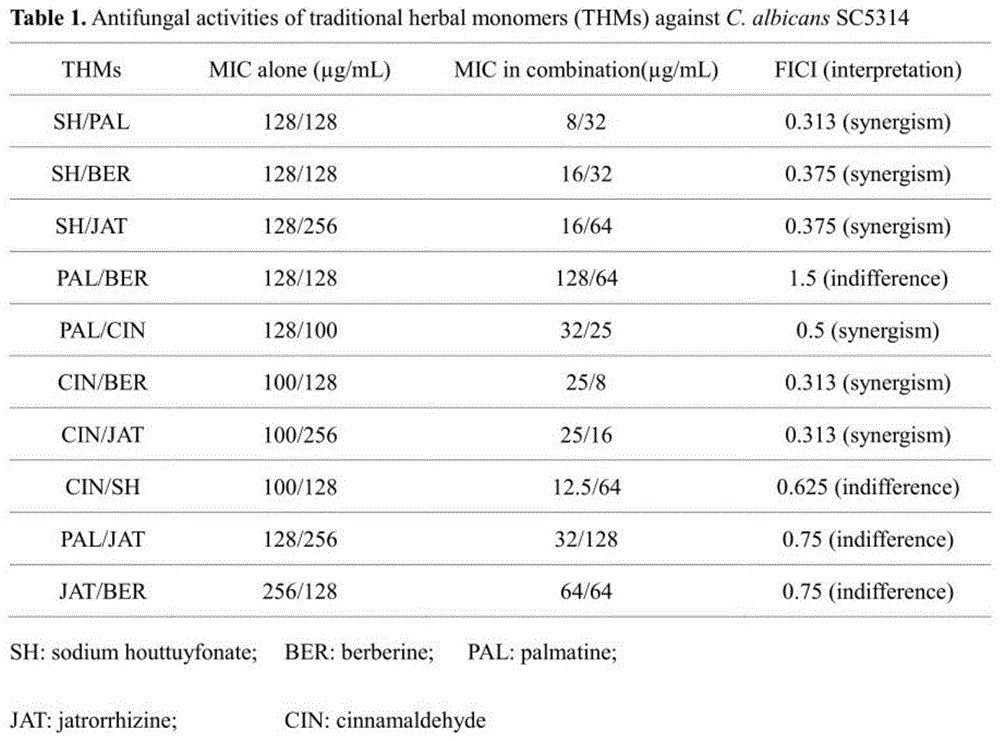
为了探究鱼腥草素钠(sh)、小檗碱(ber)、巴马汀(pal)、药根碱(jat)、肉桂醛(cin)这5种中药单体单独和互相联合的抗真菌活性,并寻找更好的方法评估它们在体内的作用,我们采用微量稀释法、斑点法、od测定法、倒置显微镜法和荧光显微镜法,流式细胞术法检测其对白色念珠菌sc5314敏感性,和在念珠菌属中细胞壁成分葡聚糖与几丁质的曝光强度。真菌细胞初始浓度为1×10^3cfu/ml。在96孔板(corning,na,美国)中采用基于clsim27-a3的微稀释法(clsi,2008)来测中药单体sh(中国西安开来生物工程有限公司),ber,pal,jat,cin(中国上海源叶生物科技有限公司)的mic,真菌细胞与连续两倍稀释的thms在37°c温度下孵育48h。对照组含有真菌细胞和rpmi-1640培养基,但其中不含药物。最低抑菌浓度(mic)为无明显细胞生长的最低药物浓度。用棋盘法评价thms相互作用。真菌细胞(=1×10^3cfu/ml)与两种浓度为连续稀释的thms在37°c下连续孵育48h。2种中药单体协同抑制浓度指数(fici)计算为(micthm1在组合/micthm1中单独)+(micthm2在组合中/micthm2单独),其中协同作用为fici≤0.5,有差异定义为0.5<fici≤4.0,拮抗解释为fici>4.0(odds,2003)。
筛选传统的中药单体作为抗真菌药物是一个广阔的研究领域,并且目前使用的合成药物对白色念珠菌能引起其耐药性的患病率和高发生率。然而,人们对thm的联合却很少关注其体外和体内抗真菌效果的差异。为了探究鱼腥草素钠(sh)、小檗碱(ber)、巴马汀(pal)、药根碱(jat)、肉桂醛(cin)这5种中药单体单独和互相联合的抗真菌活性,并寻找更好的方法评估它们在体内的作用,我们采用微量稀释法、斑点法、od测定法、倒置显微镜法和荧光显微镜法,流式细胞术法检测其对白色念珠菌sc5314敏感性,和在这念珠菌属中细胞壁成分葡聚糖与几丁质的曝光强度。我们发现sh/cin+ber/pal/jat与fici对白念珠菌sc5314有协同作用其fici值在0.313-0.5,其中fici为0.5,这与显微镜观察,斑点实验和od值实验结果一致。与此同时,一些与sh有关的中药单体联合用药(sh+ber/pal/jat对白念珠菌sc5314)的暴露率高于这些中药单体单独用药,而与cin相关的中药单体联合用药(cin+ber/pal/jat抗白念珠菌sc5314与单独使用cin相比,刺激暴露更少。结果表明,在这五种thms(sh、ber、pal、jat、cin)单独用药和联合用药抗白色念珠菌均有抗真菌活性。测量β-glucan和几丁质的暴露可能是一个合适的方法来作为评价活性化合物单独或联合传统/非传统合成抗真菌药物在体内的功效。
实施例2:一种通过白色念珠菌细胞壁重构来评价中药单体抗真菌作用的方法
一、配制菌液
c.白念珠菌sc5314是由中国上海第二军医大学药学院蒋元英教授赠送的。所有菌株常规保存于沙氏琼脂上,在37℃液体sabouraud培养基(hopebiotechology,青岛,山东)中活化培养12-16h,直到菌株达到指数生长阶段。3000r/min离心后收集真菌细胞。pbs(leagene,北京,中国)洗涤2次后,合并菌体细胞在rpmi-1640培养基(invitrogen,carlsbad,ca,usa)中复苏,用浓度为1mnaoh调节rpmi-1640培养基ph为7.5。
二、中药单体的药敏试验
真菌细胞初始浓度为1×103cfu/ml。在96孔板(corning,na,美国)中采用基于clsim27-a3的微稀释法(clsi,2008)来测sh(中国西安开来生物工程有限公司),ber,pal,jat,cin(中国上海源叶生物科技有限公司)的mic,真菌细胞与连续两倍稀释的鱼腥草素钠(sh)、小檗碱(ber)、巴马汀(pal)、药根碱(jat)、肉桂醛(cin)在37°c温度下孵育48h。对照含有真菌细胞和rpmi-1640培养基,但其中不含药物。最低抑菌浓度(mic)为无明显细胞生长的最低药物浓度。用棋盘法评价鱼腥草素钠(sh)、小檗碱(ber)、巴马汀(pal)、药根碱(jat)、肉桂醛(cin)相互作用。真菌细胞(=1×10^3cfu/ml)与两种浓度为连续稀释的鱼腥草素钠(sh)、小檗碱(ber)、巴马汀(pal)、药根碱(jat)、肉桂醛(cin)在37°c下连续孵育48h。2种中药单体协同抑制浓度指数(fici)计算为(micthm1在组合/micthm1中单独)+(micthm2在组合中/micthm2单独),其中协同作用为fici≤0.5,有差异定义为0.5<fici≤4.0,拮抗解释为fici>4.0(odds,2003)。药敏结果如图1所示。
二、中药单体的od实验
菌液初始接浓度为1×103cfu/ml,在它们与鱼腥草素钠(sh)、小檗碱(ber)、巴马汀(pal)、药根碱(jat)、肉桂醛(cin)孵育的0、2、4、8、12和24小时的协同作用下,用酶标仪测其在600纳米波长下的od值。od结果如图2。
三、中药单体的斑点试验
用rpmi-1640培养基对真菌细胞进行复苏和稀释至终浓度1×10^3cfu/ml、1×10^4cfu/ml和1×10^5cfu/ml。然后将3种不同浓度的菌液震荡1min后取3种终浓度的菌液10微升涂布到含有空白对照和含有mic浓度下的巴马汀(pal)、药根碱(jat)、肉桂醛(cin)中药单体的沙氏琼脂板块上37℃孵育24h。
四、中药单体的倒置显微镜观察
将配制好的药物浓度与菌液浓度放在4ml的ep管里,然后放到37℃真菌培养箱孵育12h,然后用离心机9000r/min,离心20s,离心后弃上清,再用100ulpbs重悬。用倒置荧光显微镜(olympusix81,japan)选择激发波长488nm和发射波长525nm,将菌液滴一滴在粘附载玻片上,然后盖上粘附盖玻片在倒置荧光显微镜(olympusix81,japan)亮场和暗场下记录β-葡聚糖与几丁质荧光图像。用含有抗体的无药菌液做空白对照。荧光强度暴露实验结果如图3,均有荧光。
五、中药单体的荧光强度暴露实验
耳道念珠菌细胞壁的β-葡聚糖的暴露是通过用接种菌液(=1×103cfu/ml)与巴马汀(pal)、药根碱(jat)、肉桂醛(cin)在其mics浓度上在4mlep管中孵育12h,然后用无菌pbs洗涤一次,再用无菌pbs配制的2%的bsa(albuminfractionv)封闭1小时(cat.no.9048-46-8,biofroxx,shanghai,china),再然后用无菌pbs洗涤一次;接下来加入100ul的β-葡聚糖抗体(β-葡聚糖抗体:无菌pbs=1:300,cat.no.400-2,biosciencesupplies,australia)放在4°c冰箱进行染色4h,染色结束后,用无菌pbs洗涤2次,再用cy3单抗鼠标记igg(cy3:无菌pbs=1:100,cat.no143702a,abbkine,shanghai,china)在室温下避光染色1小时,然后用无菌pbs避光洗涤3次后用1ml的无菌pbs进行避光重悬,避光震荡混匀后用流式细胞仪进行葡聚糖荧光暴露强度的检测。耳道念珠菌细胞壁的几丁质的暴露检测是通过避光用加100ul的100μg/mlalexafluor488conjugatedwga(thermofisherscienfiric)到接种菌液(=1×103cfu/ml)与thms在其mics浓度上用4mlep管孵育12h的药菌中,然后放到37°c摇床中进行避光摇晃15分钟,然后用无菌pbs避光洗涤3次后用流式细胞仪进行几丁质荧光暴露强度的检测,如图4所示,空白对照组均没有荧光,实施例均有荧光。
定量检测荧光暴露强度是用流式细胞仪bdaccuric6(上海,中国)的fl1通道(488nm激发波长和520nm发射波长),菌细胞进样5000个测几丁质的荧光暴露强度和fl2通道(488nm激发波长和570nm发射波长),菌细胞进样5000个测β-葡聚糖的荧光暴露强度。β-葡聚糖的荧光暴露强度如图5,空白对照组均没有荧光,实施例均有荧光。
实施例3:一种通过白色念珠菌细胞壁重构来评价中药单体抗真菌作用的方法
一种通过白色念珠菌细胞壁重构来评价中药单体抗真菌作用的方法,包括下列步骤:
步骤1:对保存的白色念珠菌株进行活化培养培养12-16h,直至白色念珠菌株达到指数生长阶段,然后离心后收集真菌细胞,用pbs洗涤后,将白色念珠菌株细胞在rpmi-1640培养基中复苏,然后调节rpmi-1640培养基ph值为7.5,并将白色念珠菌株细胞的浓度调节至1×103cfu/ml,得到评价菌液;
步骤2:将中药单体加入至评价菌液,孵育12h后用无菌pbs洗涤一次,再用无菌pbs配制的质量分数为2%的bsa封闭1小时,再然后用无菌pbs洗涤一次;接下来加入100ul的β-葡聚糖抗体,放在4°c冰箱进行染色4h,染色结束后,用无菌pbs洗涤2次,再用cy3单抗鼠标记igg在室温下避光染色1小时,然后用无菌pbs避光洗涤3次后用1ml的无菌pbs进行避光重悬,避光震荡混匀后用流式细胞仪进行葡聚糖荧光暴露强度的检测,如果检测到荧光,则说明该中药单体引起白色念珠菌细胞壁重构;
步骤3:将100ul的浓度为100μg/ml的荧光染料alexafluor488conjugatedwga、评价菌液和中药单体混合,孵育12h,然后放到37°c摇床中进行避光摇晃15分钟,然后用无菌pbs避光洗涤3次后用流式细胞仪进行几丁质荧光暴露强度的检测,如果检测到荧光,则说明该中药单体引起白色念珠菌细胞壁重构;
步骤4:用倒置荧光显微镜,选择激发波长488nm和发射波长525nm,将菌液滴在粘附载玻片上,然后盖上粘附盖玻片在倒置荧光显微镜亮场和暗场下记录β-葡聚糖与几丁质荧光图像;用含有抗体的无药菌液做空白对照,如果检测到荧光,则说明该中药单体引起白色念珠菌细胞壁重构。
优选的技术方案为:所述中药单体的浓度为最低抑菌浓度。
优选的技术方案为:用流式细胞仪bdaccuric6的fl1通道,488nm激发波长和520nm发射波长,白色念珠菌细胞进样5000个测几丁质的荧光暴露强度。
优选的技术方案为:用流式细胞仪bdaccuric6的fl2通道,488nm激发波长和570nm发射波长,白色念珠菌细胞进样5000个测β-葡聚糖的荧光暴露强度。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!