一种奥马珠单抗疏水性的检测方法与流程
本发明属于化学分析
技术领域:
,具体涉及一种奥马珠单抗疏水性的检测方法。
背景技术:
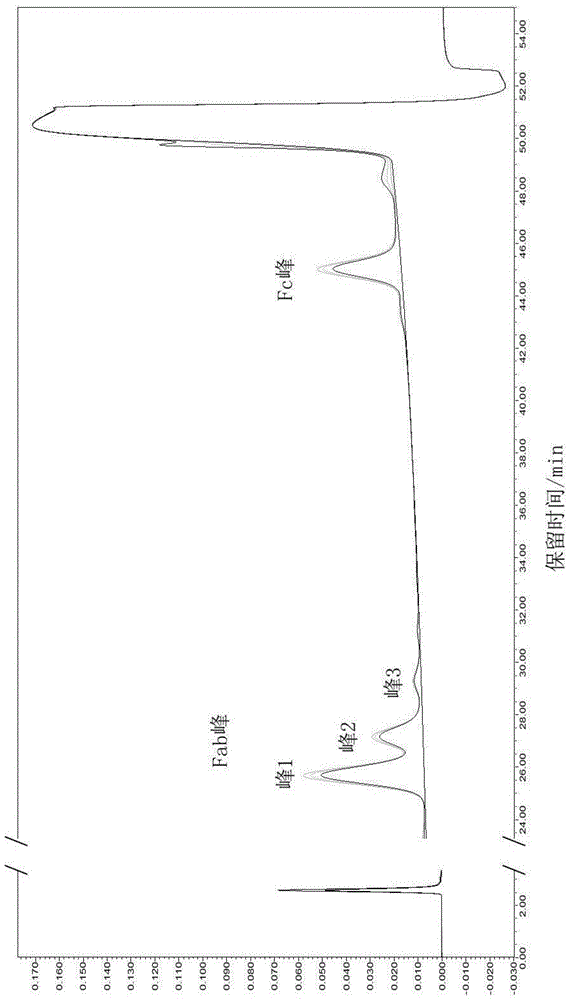
:奥马珠单抗(xolair)是选择性结合人类免疫球蛋白e(ige)的一种重组dna衍生的人源化单克隆抗体,具有约149kd的分子量。奥马珠单抗目前适用于治疗皮肤测试呈阳性或在体外对长期气源性致敏原具有反应性且具有吸入性皮质类固醇不充分控制的症状的患者中的中度至重度持久性哮喘。是全球首个批准治疗中至重度哮喘的靶向治疗药物,该产品于2003年首次在全球上市,已在96个国家获得批准,包括美国、欧盟、日本等。用奥马珠单抗的问题在于:1)其在药学相关剂量下靶向游离ige,但不靶向(或不能有效靶向)ige/fcεri复合物的致病性种类;2)可能由于ige/fcεri复合物的的致病性种类不被靶向;3)其不应当用于具有高ige水平的患者(例如,因为ige/fcεri复合物的致病性种类不被靶向,且鉴于患者中的高游离ige水平而不会随时间耗散);4)“当服用奥马珠单抗时可以发生i型局部或全身反应,包括过敏反应和过敏性休克”;5)其对ige的亲和力并不是特别好。奥马珠单抗fab片段的修饰不同会影响其疏水性,进而会影响奥马珠单抗的结合活性。故开发适宜的检测方法,检测奥马珠单抗的疏水性能具有重要意义。技术实现要素:针对现有技术存在的不足,本发明的目的在于提供一种奥马珠单抗疏水性的检测方法。该检测方法稳定可行,具有较高的专属性和准确度。为达此目的,本发明采用以下技术方案:本发明提供一种奥马珠单抗疏水性的检测方法,所述检测方法包括如下步骤:(1)用木瓜蛋白酶将奥马珠单抗酶解为fab片段和fc片段;(2)用疏水色谱串联高效液相色谱对所述fab片段和fc片段进行分离,根据所述fab片段的谱图分析得到fab片段的疏水性分布,进而得到奥马珠单抗的疏水性。疏水色谱(hydrophobicinteractionchromatography,hic)是利用样品中蛋白质组分具有不同的疏水作用的性质进行分离的方法。在高盐环境下(初始色谱条件),被分离蛋白质组分分子表面的疏水微区、(可逆)变性后暴露出的疏水残基,与色谱柱填料(固定相)表面的疏水基团作用而被保留。当流动相的离子强度逐渐降低时,洗脱能力逐渐增强,蛋白质分子按其疏水性由小到大依次流出,从而达到分离目的。本发明使用木瓜蛋白酶(papain)将奥马珠单抗(xolair)酶解为fab及fc片段,利用不同组分疏水性质不同,使用疏水色谱串联高效液相色谱(hic-hplc)实现分离。fab不同修饰,如:天冬氨酸残基异构化及未配对二硫键,会导致fab片段疏水性不同,进而影响奥马珠单抗(xolair)结合活性。对fab片段的出峰时间(保留时间)和峰积分面积进行分析即可得知奥马珠单抗的疏水性。作为本发明的优选技术方案,步骤(1)中所述木瓜蛋白酶与所述奥马珠单抗的质量比为(0.5-2):100,例如可以是0.5:100、0.6:100、0.8:100、1:100、1.2:100、1.3:100、1.5:100、1.6:100、1.8:100或2:100等;进一步优选为1:100。优选地,步骤(1)中所述酶解是在溶液中进行,所述溶液中奥马珠单抗的浓度为2-5mg/ml,例如可以是2mg/ml、2.2mg/ml、2.5mg/ml、2.8mg/ml、3mg/ml、3.2mg/ml、3.5mg/ml、3.8mg/ml、4mg/ml、4.2mg/ml、4.5mg/ml、4.8mg/ml或5mg/ml等;进一步优选为2mg/ml。作为本发明的优选技术方案,步骤(1)中所述酶解的反应温度为35-40℃,例如可以是35℃、35.5℃、36℃、36.5℃、37℃、37.5℃、38℃、38.5℃、39℃、39.5℃或40℃等;进一步优选为37℃;优选地,步骤(1)中所述酶解的反应时间为1-4h,例如可以是1h、1.2h、1.5h、1.8h、2h、2.2h、2.5h、2.8h、3h、3.2h、3.5h、3.8h或4h等;进一步优选为2h。作为本发明的优选技术方案,所述疏水色谱串联高效液相色谱采用的色谱柱的固定相为苯基键合相。优选地,所述疏水色谱串联高效液相色谱采用的色谱柱的温度为35-40℃,例如可以是35℃、35.5℃、36℃、36.5℃、37℃、37.5℃、38℃、38.5℃、39℃、39.5℃或40℃等;进一步优选为40℃。作为本发明的优选技术方案,所述疏水色谱串联高效液相色谱的检测波长为210-220nm,例如可以是210nm、211nm、212nm、213nm、214nm、215nm、216nm、217nm、218nm、219nm或220nm等;进一步优选为214nm。作为本发明的优选技术方案,所述疏水色谱串联高效液相色谱采用的流动相中含有tris和硫酸铵。优选地,所述流动相的流速为0.8-1.2ml/min,例如可以是0.8ml/min、0.85ml/min、0.9ml/min、0.95ml/min、1ml/min、1.05ml/min、1.1ml/min、1.15ml/min或1.2ml/min等;进一步优选为1ml/min。作为本发明的优选技术方案,所述疏水色谱串联高效液相色谱采用流动相进行梯度洗脱。优选地,所述梯度洗脱使用的流动相的浓度随洗脱时间先减小后增大。作为本发明的优选技术方案,所述梯度洗脱使用的流动相由如下体积百分比的流动相a和流动相b组成:0-3min:72-78%流动相a和22-28%流动相b;3-(20.5±2.5)min:50-60%流动相a和40-50%流动相b;(20.5±2.5)-(26±1)min:15-20%流动相a和80-85%流动相b;(26±1)-(28.5±1)min:100%流动相b;(28.5±1)-(36±1)min:72-78%流动相a和22-28%流动相b;所述流动相a的包括20mmtris和2m硫酸铵,ph为7.5;所述流动相b包括20mmtris,ph为7.5。优选地,所述梯度洗脱使用的流动相由如下体积百分比的流动相a和流动相b组成:0-3min:75%流动相a和25%流动相b;3-23min:57%流动相a和43%流动相b;23-27min:17%流动相a和83%流动相b;27-29.5min:100%流动相b;29.5-37min:75%流动相a和25%流动相b;所述流动相a的包括20mmtris和2m硫酸铵,ph为7.5;所述流动相b包括20mmtris,ph为7.5。作为本发明的优选技术方案,所述疏水色谱串联高效液相色谱的试样的制备方法为:用所述疏水色谱串联高效液相色谱的起始流动相对步骤(1)得到的反应液进行稀释,得到试样。需要说明的是,本发明中所述“起始流动相”是指疏水色谱串联高效液相色谱开始时使用的流动相。优选地,所述试样中奥马珠单抗的酶解产物的浓度为0.5-1.5mg/ml,0.5mg/ml、0.6mg/ml、0.7mg/ml、0.8mg/ml、0.9mg/ml、1mg/ml、1.1mg/ml、1.2mg/ml、1.3mg/ml、1.4mg/ml或1.5mg/ml等;进一步优选为1mg/ml。优选地,所述试样的温度为4-10℃,例如可以是4℃、5℃、6℃、7℃、8℃、9℃或10℃等;进一步优选为10℃。作为本发明的优选技术方案,所述疏水色谱串联高效液相色谱的进样体积为5-15μl,例如可以是5μl、6μl、7μl、8μl、9μl、10μl、11μl、12μl、13μl、14μl或15μl等;进一步优选为5μl。与现有技术相比,本发明具有以下有益效果:本发明提供的检测方法检测时间适宜,35-37min即可完成检测,fab片段和fc片段的出峰时间适宜,各峰的分离度高,该检测方法具有较高的专属性、准确度及精密度,稳定可行。附图说明图1为实施例1中酶切1h、2h、4h条件下的色谱图。图2为实施例1-8在酶切2h条件下的色谱图。图3为超纯水、mv缓冲液、mv样品及强制降解高温破坏后的mv样品在色谱条件8下的色谱图。具体实施方式下面结合附图并通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述具体实施方式仅仅是帮助理解本发明,不应视为对本发明的具体限制。本发明实施例中使用的样品、试剂及仪器信息如下表1-3所示:表1样品信息表2试剂信息表3仪器设备信息实施例1本实施例提供一种奥马珠单抗疏水性的检测方法,包括如下步骤:(1)将mv-inv(xolair)样品用样品稀释液稀释到2mg/ml,加入木瓜蛋白酶,木瓜蛋白酶:xolair=1:100(w:w),在37℃下分别酶切1h、2h、4h,形成fab片段和fc片段;用起始流动相(75%流动相a+25%流动相b)稀释到1mg/ml,作为试样;步骤(1)的样品酶切稀释处理过程如下表4所示表4样品酶切稀释处理过程(2)将步骤(1)得到的试样加入hplc色谱仪中,采用色谱条件1进行梯度洗脱,色谱条件1如下表5所示:表5色谱条件1(3)数据分析步骤(2)得到的色谱图如图1所示(从下到上依次为酶切1h、2h、4h),fab峰的数据分析结果如下表6所示;表6数据分析结果由图1可以看出,酶切1h、2h、4h的色谱图几乎完全重合。由表6可以看出,酶切1h、2h、4h的分离结果差异很小,但检测时间较长(55min),fab虽出峰在中间,但fc出峰靠后,故需优化流动相梯度,使fab和fc出峰时间适宜,并缩短检测时间。实施例2本实施例提供一种奥马珠单抗疏水性的检测方法,与实施例1的区别在于,步骤(2)采用色谱条件2,如下表7所示:表7色谱条件2实施例3本实施例提供一种奥马珠单抗疏水性的检测方法,与实施例1的区别在于,步骤(2)采用色谱条件3,如下表8所示:表8色谱条件3实施例4本实施例提供一种奥马珠单抗疏水性的检测方法,与实施例1的区别在于,步骤(2)采用色谱条件4,如下表9所示:表9色谱条件4实施例5本实施例提供一种奥马珠单抗疏水性的检测方法,与实施例1的区别在于,步骤(2)采用色谱条件5,如下表10所示:表10色谱条件5实施例6本实施例提供一种奥马珠单抗疏水性的检测方法,与实施例1的区别在于,步骤(2)采用色谱条件6,如下表11所示:表11色谱条件6实施例7本实施例提供一种奥马珠单抗疏水性的检测方法,与实施例1的区别在于,步骤(2)采用色谱条件7,如下表12所示:表12色谱条件7实施例8本实施例提供一种奥马珠单抗疏水性的检测方法,与实施例1的区别在于,步骤(2)采用色谱条件8,如下表13所示:表13色谱条件8上述实施例1-8在2h酶切条件下得到的色谱图如图2所示,数据分析结果如下表14所示:表14数据分析结果其中,色谱条件8为最优的色谱条件。实施例9本实施例提供一种奥马珠单抗疏水性的检测方法,与实施例8的区别在于,样品和进样量不同。色谱图的数据分析结果如下表15所示:表15数据分析结果从积分结果可以看出,三种进样量无明显差别,5μl进样量对于很多小峰可能较难积分,而15μl进样量的峰高过高,所以选择10μl进样量较为合适。准确度确认按照实施例8的方法对xolair样品进行酶切和检测,酶切产物用初始流动相稀释到0.5mg/ml,1.0mg/ml和1.5mg/ml,每个浓度制备三份,每份进样一针。统计样品各个峰纯度回收率,结果如下表16所示:表16方法准确度确认统计结果由表16的统计结果可以看出,每个浓度下各个峰纯度rsd(相对标准偏差)≤5%,峰面积rsd≤10%,纯度回收率在90%~110%之间,表明本发明提供的检测方法具有较高的准确度。重复性确认按照实施例8的方法对xolair样品进行酶切和检测,酶切产物用初始流动相稀释到1.0mg/ml,平行制备6份,每份进样一针。计算6个平行样品的峰1、峰2和峰3的峰面积、保留时间和纯度的rsd。结果如下表17所示:表17方法重复性确认统计结果由表17可以看出,重复6个平行实验各个峰纯度rsd≤5%,峰面积rsd≤10%,表明本发明提供的检测方法具有较高的重复性。专属性确认采用色谱条件8,检测超纯水、mv缓冲液(制剂缓冲液)、mv样品(奥马珠单抗生物类似药)及强制降解高温破坏(37℃,18h)后的mv166样品。色谱图如图3所示,数据分析结果如下表18所示:表18方法专属性确认检测结果样品名称峰1%峰2%峰3%峰2与峰1分离度h2onanananamv缓冲液nanananamv样品66.725.53.82.0高温破坏的mv样品49.916.317.01.6从图3及表18可知,超纯水及mv缓冲液在mv样品的峰1,峰2和峰3出峰附近不出峰,高温破坏后mv样品峰1和峰2纯度明显下降,峰3纯度明显上升,由此可推测,高温可引起某些修饰的增加,如天冬氨酸异构化为异天冬氨酸或琥珀酰亚胺等,由此完成了专属性确认。申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属
技术领域:
的技术人员应该明了,任何属于本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1