一种生乳细胞分析用微流控芯片及微流控取样装置的制作方法
本实用新型属于生物医学检测技术领域,具体涉及一种生乳细胞分析用微流控芯片及微流控取样装置。
背景技术:
生乳中的体细胞通常包括巨噬细胞、淋巴细胞、多形核嗜中性白细胞和少量的乳腺组织上皮细胞等,每毫升生乳中含有的体细胞总数(ssc)是生乳质量的衡量指标。以牛生乳为例,在正常情况下,每毫升牛生乳约有2万-20万个体细胞。一般来说,当泌乳系统发生感染与损伤(例如受到细菌侵袭)时,白细胞会大幅增高至50万/ml至100万/ml,甚至更高。体细胞的浓度与畜牧管理、食品安全密切关联,例如,在畜牧业,体细胞的浓度可以直接反映奶牛的乳房健康程度、潜在产奶能力等;在食品安全方面,体细胞的浓度与牛奶的成分、品质、风味息息相关。因此,对生乳体细胞进行快速准确的计数,有助于对牲畜健康管理和奶品质量监测。
现有的体细胞总数检测技术,主要针对牛体细胞,包括间接法与直接法。间接法是指对因体细胞增多而导致的牛奶理化特性变化进行检测,从而间接反映牛体细胞总数;直接法则直接针对细胞进行检测计数。常见的间接法包括加利福尼亚细胞数测定法(cmt)、威斯康辛乳腺炎检测法(wmt)、黏度法等,都是利用表面活性剂使细胞中的dna释放,进而针对dna的聚集团块、胶束胶体、黏度等进行测量,这些方法最主要的缺陷是上述理化特征不够典型,在牛奶不新鲜、脂肪含量过高、温度差异过大等情况下会产生较大的误差。直接法最为经典的是人工镜检法,由于该方法过多依赖人工经验,而逐渐被流式细胞技术所替代。流式细胞技术是将预先经过荧光染色的细胞,在鞘液的包裹下被稀释、驱动,从而依次通过光学检测系统实现精确计数。其作为目前最为先进的技术,检测速度快、准确率较高,但操作流程复杂,设备单价与使用成本均较高。
针对流式细胞技术的优势与问题,在先技术us8906697b2公开了一种新型的直接法检测技术。整个检测装置包括三个部分,即促进奶样吸取的活塞部分、实现奶样中细胞染色的流路部分、对染色后细胞进行分析的检测部分。在使用过程中,将流路部分的前端置入奶样中,推动活塞部分使奶样被吸入流路部分,并在流路中与预先固定的试剂混合,最终奶样与试剂混合物流进检测部分,根据荧光信号对细胞个数与形态进行检测。与流式细胞技术相比,此种方法最为显著的优势是,使用简单的成像系统即可同时对细胞个数及形态进行现场快速分析。然而,该技术存在以下缺陷:
(1)缺少防止气泡干扰的设计:生乳中蛋白含量高,极易在晃动的过程中产生气泡。由于缺少相应的排气结构设计,检测部分存在的微小的气泡也将造成细胞计数较大误差;检测部分存在的较大的气泡将形成大面积的空腔,会造成更大的分析偏差;
(2)缺少防止流路中乳样堵塞的设计:生乳中脂肪、蛋白含量均较高,因而较为粘稠,同时温度的变化易使其发生凝结进一步增加黏度,较细且长的流路部分极易发生堵塞;
(3)缺少细胞精细分析的设计:检测部分通常只具有均一的厚度,因而无法同时兼顾小厚度单细胞精细分析(小厚度、小景深、单位生乳体积铺展面积大,适宜单个细胞精细分析)、大厚度细胞总数精准计量(大厚度、大景深、单位检测部分面积承载体积大,适宜更多细胞精准计数)的需求;
(4)缺少结果精准复核的设计:生乳中体细胞含量极低(2万/ml-20万/ml),极易产生较大的采样与检测的偏差,缺少结果复核会对检测结果的精准性、可靠性造成影响。
技术实现要素:
为解决上述问题,本实用新型提供一种改进的生乳细胞分析用微流控芯片。
本实用新型所采用的技术方案为:
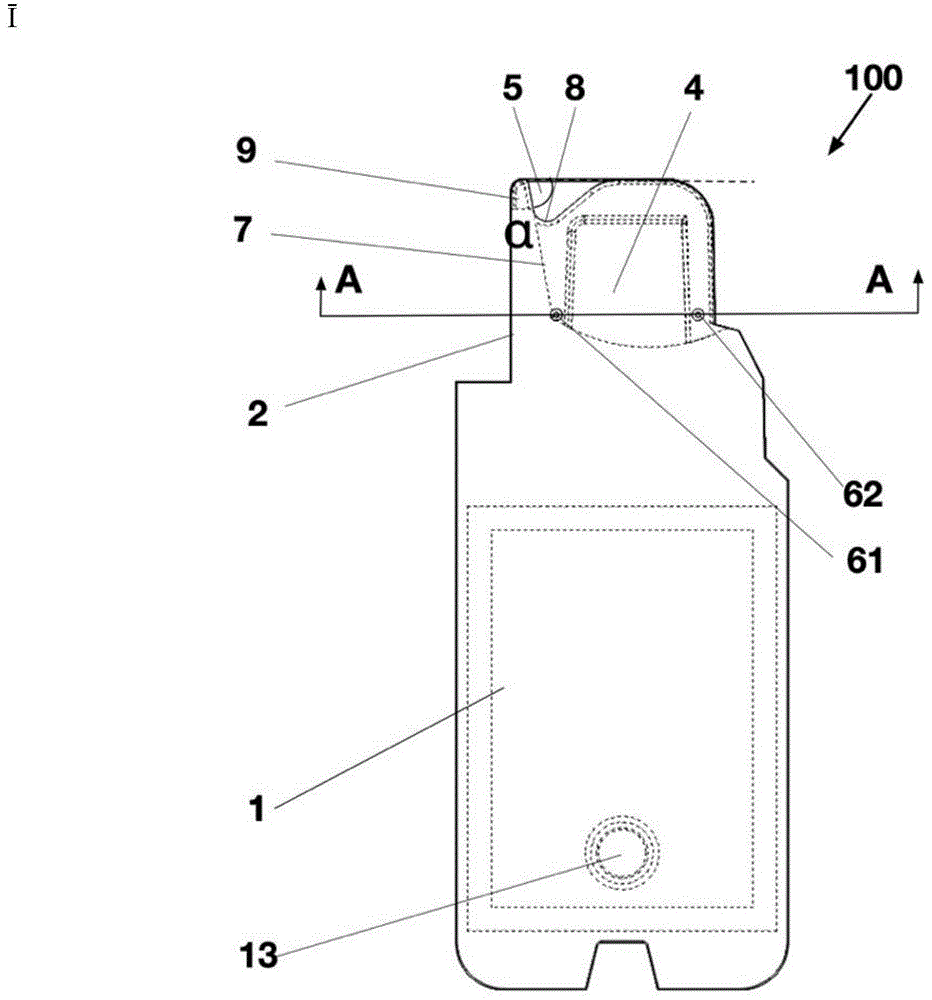
一种生乳细胞分析用微流控芯片,包括基座(1)以及设于基座(1)上的进样检测腔(2),所述进样检测腔(2)为两个有一定间隙的平行的芯片侧壁(3)形成的半开放空腔,具有分析区(4)、进样口(5)以及连通进样口(5)和分析区(4)的引流槽区(7),分析区(4)的厚度h分小于引流槽区(7)的厚度h引,所述进样口(5)位于进样检测腔(2)的两芯片侧壁(3)上端缘开口处,其中两芯片侧壁(3)中的一个位于进样口(5)处的上端缘设有进样豁口(8),以通过该进样豁口(8)处注入生乳样品;在进样检测腔(2)封闭的一端的进样口(5)靠近基座的一侧开设有一缺口作为通气槽(9),通气槽(9)的底部不低于进样豁口(8)的底部。
上述生乳细胞分析用微流控芯片中,所述进样检测腔(2)上设置有至少一个排气孔(6),所述排气孔(6)为连通进样检测腔(2)内部与外界大气的通孔,其贯穿分析区(4)或引流槽区(7)的一侧侧壁或对称贯穿分析区(4)或引流槽区(7)的两侧壁。
上述生乳细胞分析用微流控芯片中,所述排气孔(6)为倒锥形通孔,锥形小端开口朝向分析区(4)或引流槽区(7)的内部,锥形大端开口朝向外界大气。
上述生乳细胞分析用微流控芯片中,所述进样检测腔(2)内设有一个分析区(4),分析区(4)单侧总面积占进样检测腔(2)单侧总面积50%-90%,且分析区(4)具有单一厚度h分,厚度h分的范围为50μm-400μm。
上述生乳细胞分析用微流控芯片中,所述进样检测腔(2)设有多个分析区(4),分析区(4)单侧总面积占进样检测腔(2)单侧总面积50%-90%;多个分析区(4)相互独立且连通,厚度相同或不同,任一分析区(4)的厚度均小于引流槽区(7)的厚度h引,任一分析区(4)的厚度范围为50μm-400μm,引流槽区(7)的厚度h引的范围为120μm~500μm。
上述生乳细胞分析用微流控芯片中,所述进样检测腔(2)设有两个不同厚度的分析区(4),分别为第一分析区(41)和第二分析区(42),第一分析区(41)和第二分析区(42)之间由引流槽区(7)连通。
上述生乳细胞分析用微流控芯片中,所述进样口(5)呈凹弧形,其下滑弧线的切线与进样口(5)的水平基准面之间的夹角α的取值范围为15°~85°,优选45°~85°,更优选80°。
上述生乳细胞分析用微流控芯片中,每一分析区设有对应的进样口。
上述生乳细胞分析用微流控芯片中,每一进样口设有一进样豁口。
上述生乳细胞分析用微流控芯片中,所述芯片侧壁(3)的端缘内楞设有过渡圆角(10),过渡圆角r的范围为0.2mm-1.5mm。
上述生乳细胞分析用微流控芯片中,所述的分析区(4)为长方形、正方形、梯形、圆形或弧形与其他形状的组合,且各形状可设有圆角、直角或圆角、直角的组合。
本实用新型还提供一种生乳细胞分析用微流控取样装置,配合生乳细胞计数分型用检测分析仪器使用,包括托架组件(200)以及安装在托架组件(200)上的至少一个上述任一所述的生乳细胞分析用微流控芯片;优选托架组件(200)上并列设置两个生乳细胞分析用微流控芯片。
上述生乳细胞分析用微流控取样装置中,所述托架组件(200)设有用于卡接生乳细胞分析用微流控芯片的卡接部(201)。
上述生乳细胞分析用微流控取样装置中,所述生乳细胞分析用微流控芯片上设有内定位槽(13),该内定位槽设置在基座(1)的下方,与托架组件(200)上的凸起配合,以实现生乳细胞分析用微流控芯片的准确组装卡位。
上述生乳细胞分析用微流控取样装置还设置有外定位槽(14),外定位槽(14)设置在托架组件(200)的尾端底面上,与生乳检测分析仪器内的承载台上的凸起相匹配,以实现微流控取样装置的精确定位。
上述生乳细胞分析用微流控取样装置中,所述托架组件(200)上设置有试剂腔(12),用于试剂的存储以及作为试剂与生乳样品的混合容器。
上述生乳细胞分析用微流控取样装置中,所述试剂腔(12)为圆柱形、倒圆台形或半球形,容积为30μl-100μl,深度为5mm-14mm。
本实用新型的有益效果是:本实用新型微流控芯片设置半开放式进样检测腔,进样检测腔具有进样口、分析区以及连通进样口和分析区的引流槽区,分析区的厚度小于引流槽区的厚度,且引流槽区和/或分析区上设置多个排气孔,进样口靠近基座的一侧开设有一缺口作为通气槽,该微流控芯片通过设置进样豁口、通气槽、排气孔、一个或者厚度不同的多个分析区,能够防止生乳样品堵塞流路以实现生乳样品快速进样,避免了气泡的产生,实现生乳细胞样品量的精确控制以及同时兼顾细胞计数与分型检测的精密度,为生乳细胞的现场精准分析奠定了基础。
附图说明
图1a是本实用新型微流控芯片的实施例一的平面结构示意图;
图1b图1a的左视图;
图1c是本实用新型微流控芯片的实施例一的立体结构示意图;
图1d是图1a中沿a-a线截取的截面图;
图2a是本实用新型微流控芯片的实施例二的平面结构示意图;
图2b是本实用新型微流控芯片的实施例二的立体结构示意图;
图2c是图2a中沿c1-c1线截取的截面图;
图2d是图2a中沿c2-c2线截取的截面图;
图3a是本实用新型微流控芯片的实施例三的平面结构示意图;
图3b是本实用新型微流控芯片的实施例三的立体结构示意图;
图3c是本实用新型微流控芯片的实施例三的进样检测腔的局部结构示意图;
图4a是本实用新型微流控取样装置的实施方式一的平面结构示意图;
图4b是本实用新型微流控取样装置的实施方式一的立体结构示意图;
图4c是图4a中沿b-b线截取的截面图;
图5是本实用新型微流控取样装置的实施方式二的平面结构示意图;
图6是本实用新型微流控取样装置的实施方式三的立体结构示意图;
图7是本实用新型微流控取样装置的实施方式四的立体结构示意图。
图中附图标记表示为:
100-微流控芯片;
200-托架组件,201-卡接部;
1-基座;2-进样检测腔;3-芯片侧壁;
4-分析区,41-第一分析区,42-第二分析区;
5-进样口,51-第一进样口,52-第二进样口;
6-排气孔,61-第一排气孔,62-第二排气孔,63-第三排气孔,64-第四排气孔;
7-引流槽区;
8-进样豁口,81-第一进样豁口,82-第二进样豁口;
9-通气槽;
10-过渡圆角,11-液桥面,12-试剂腔;
13-内定位槽;14-外定位槽。
具体实施方式
为了解决现有的生乳细胞分析方法中存在的无法同时兼顾单细胞精细分析与细胞总数精准计量的需求、检测部分易产生气泡干扰、流路中易出现乳样堵塞、缺少检测结果的复核等问题,本实用新型提供一种生乳细胞分析用微流控芯片及微流控取样装置,该微流控取样装置包括托架组件和设置在托架组件上的至少一个微流控芯片,微流控芯片包括基座和设置在基座上的进样检测腔,进样检测腔为两个有一定间隙的平行的芯片侧壁形成的半开放空腔,具有一个或者不同厚度的多个分析区设计以及用于连通进样口和分析区的引流槽区设计、用于排除气泡的通气槽和排气孔设计;该微流控芯片通过在进样检测腔中设置一个或者厚度不同的多个分析区、进样豁口、通气槽和排气孔,能够防止粘稠乳样堵塞流路,以实现生乳样品的快速、顺畅进样,避免了气泡的产生,实现细胞样品量的精确控制以及同时兼顾细胞计数与分型检测的精密度,为生乳细胞的现场精确分析奠定了基础。
以下结合实施例一至实施例三及附图对本实用新型生乳细胞分析用微流控芯片及微流控取样装置进行详细说明。
实施例一
图1a-图1d为本实用新型微流控芯片的结构示例。图1a-图1d所示的实施例一中,该微流控芯片100包括基座1和设置在基座1上的进样检测腔2,其中,基座1的尾端为该微流控芯片100的手持部,其设计为适于手持的形状,如该实施例一中,手持部为长方形,基座1的前端延伸有弧状边缘的进样检测腔2;进样检测腔2可与基座1一体成型,或者进样检测腔2粘结在基座1的前端。进样检测腔2为两个有一定间隙且平行的芯片侧壁3形成的半开放空腔,包括进样口5、进样豁口8、分析区4、排气孔6以及连通进样口5和分析区4的引流槽区7,其中:
该实施例中,进样口5位于进样检测腔2的两芯片侧壁3的上端缘开口处,两芯片侧壁3位于进样口5处的上端缘设有进样豁口8,便于定位生乳样品吸液管,使得通过注射的方式从该进样豁口8处注样。因生乳中脂肪、蛋白含量较高,因而较为粘稠,仅靠毛细力不足以将生乳样品吸入进样检测腔2中,本实用新型通过注射的方式从进样豁口8处将生乳样品注入进样检测腔2中,在吸液管的注射动力和毛细力的共同作用下,生乳样品顺畅进入进样检测腔2直至分析区4中并充满。为了避免生乳样品中较大的气泡进入进样检测腔2中,进样检测腔2封闭的一端进样口5靠近基底1的一侧(未开放的一侧)开设有一缺口作为通气槽9,通气槽9的厚度与引流槽区7的厚度一致,通气槽9的底部不越过进样豁口8的底部(图1a的下定义为底部)。当吸液管中的生乳样品从进样豁口8处注射时,生乳样品中的较大气泡从进样口5一侧的通气槽9处逸出,从而防止气泡进入进样检测腔2中。
分析区4位于进样检测腔2内,分析区4的形状可为长方形、正方形、梯形、圆形或弧形与其他形状的组合,且各形状可具有圆角、直角或圆角、直角的组合,本实用新型对分析区4的具体形状并不做限制;分析区4具有单一厚度h分,生乳样品进入分析区4形成了检测面,厚度大的分析区4,检测面的单位面积样品承载量大、景深大,适宜于生乳细胞数目的整体精确测量;厚度小,同样体积的液体样品在检测面的铺展面积大,适宜于生乳细胞型别的精密区分,分析区4的厚度为50μm-400μm。
分析区4单侧总面积占进样检测腔2单侧总面积50%-90%,分析区4具有较大的面积比例,可同时提升生乳细胞承载量与铺展面积,兼顾细胞总体精确计数与单细胞精密分析;同时分析区4处芯片侧壁3较厚,使得较大面积的芯片侧壁3不易发生变形,从而保证分析区4具有均一的厚度。
引流槽区7位于进样检测腔2内,与进样口5、分析区4相连通,引流槽区7的厚度h引范围一般为120μm~500μm。如图1d所示,分析区4的厚度h分小于引流槽区7的厚度h引,生乳样品由进样口5进入经引流槽区7形成的流路均匀快速导入分析区4并充满。
该实施例中,进样口5呈凹弧形,其下滑弧线(图1a中为左侧弧线)的切线与进样口5的水平基准面的夹角α(参见图1a),可决定待测生乳样品进入引流槽区7的流向方位,这样可保证待测生乳样品按照预定方式自发流入分析区4并充满。角度α的范围取15°~85°,鉴于生乳样品脂肪与蛋白含量高、粘稠度较高,角度α最好选取45°~85°,较优为80°。其中,角度α越大注入样品的流速越快,但是速度越快其前锋面变形并产生气泡的几率也越大,因而优选80°。
分析区4的厚度h分小于引流槽区7的厚度h引,有利于排出气泡。为保证液体在毛细力作用下可由引流槽区7连续流动进入分析区4并充满,要求毛细压力大于零。毛细力与分析区4的厚度h分、引流槽区7的厚度h引、被检测液体表面张力、以及被检测液体在引流槽区7材质表面所具有的接触角存在如下关系:
由式1)可知,通过设计引流槽区7的厚度h引和分析区4的厚度h分,可以实现不同的液体流动速率、液体层流特征的调整,从而避免气泡的形成。
具体的,该实施例中,分析区4设有一个,位于进样检测腔2内,且具有单一厚度h分,其形状为圆角长方形。当分析区4的厚度h分较大时,芯片侧壁3上形成的检测面景深大、单位面积样品承载量大,适宜于生乳细胞数目的整体精确计算,分析区4的厚度优选为100μm-400μm;当分析区4的厚度h分较小时,芯片侧壁3上形成的检测面景深小、单位体积样品铺展面积大,适宜于生乳细胞单个细胞的精细分析,此时分析区4的厚度优选为50μm-100μm。
为了进一步避免气泡的产生,进样检测腔2上设置有至少一个排气孔6,排气孔6为连通进样检测腔2内部与外界大气的通孔,可以位于分析区4或引流槽区7的一侧或两侧,可以为对称或非对称通孔,即排气孔6贯穿分析区4或引流槽区7的一侧侧壁或对称贯穿分析区4或引流槽区7的两侧壁。优选的,排气孔6为对称的倒锥形通孔,即锥形小端开口朝向引流槽区7内部,锥形大端开口朝向外界大气(参见图1d)。
倒锥形排气孔好处在于,其一,利用待测生乳样品与气体的表面张力,使气泡更容易排出,本实用新型提出的基于倒锥孔的排气方式,不受取样角度、距离的影响,可以有效排出气泡;在需要进样检测腔2中预先封装试剂的情况下,由于试剂与外面环境的接触面非常小,当试剂加入进样检测腔2后,其干燥过程漫长,利用排气孔6的设计可以增加试剂与外界环境的接触面,加速试剂的干燥与均匀分布,从而避免多种情况下的气泡产生;有助于精确控制样品量,待测生乳样品进入排气孔6后,受到表面张力的作用而不易产生溢出;将排气孔6设置在进样检测腔2的一侧或两侧,进样结束后只需擦拭芯片侧面,避免因擦拭进样口而使液体样品损失;同时倒锥孔结构进一步降低了样品擦拭损失的可能。
具体的,该实施例中,引流槽区7中生乳样品流入分析区4前与流入分析区4后的位置,分别设置了第一排气孔61和第二排气孔62,两个排气孔均为贯穿芯片侧壁3的对称倒锥孔,从而在生乳样品流入前与流入后都能够有效的防止气泡在分析区4内的残留。
芯片侧壁3均可用于后续细胞计数与型别的监测分析,为了防止移动微流控芯片时待测生乳样品受重力作用而流出,芯片侧壁3端缘内楞设有过渡圆角10,过渡圆角r的范围为0.2mm-1.5mm。当微流控芯片进样后,生乳样品在两芯片侧壁3端缘的过渡圆角10处形成稳定的液桥面11,可有效平衡待测液体的重力而不致其流出。
具体的,如图1d所示,排气孔6设有两个,即第一排气孔61和第二排气孔62,分别位于引流槽区7的前端(待测生乳样品进入分析区4之前的位置)和后端(待测生乳样品流出分析区4之后的位置),且为贯穿引流槽区7的对称的倒锥形通孔,可进一步避免气泡的产生。
该实施例一的结构设计,可根据所应用的场合,选择具有单一厚度的分析区4,并设置合适的厚度h分,以便进行细胞总数目的高精度测量或单个细胞的精细分析。
显然,该实施例中,一个分析区4也可具有多个厚度h分1、h分2等,且分析区4的各个厚度值均小于引流槽区7的厚度,驱动待测液体样品进入进样检测腔2的毛细力与分析区4的各个厚度、引流槽区的厚度h引的关系仍满足式1)。样品进入分析区4形成了不同景深、不同铺展状态的检测面,可同时兼顾生乳细胞总体计数与单个细胞的精细分析。
托架组件200设有卡接部201,用于卡接微流控芯片100,托架组件200与卡接在托架组件200的卡接部201中的至少一个微流控芯片100形成本实用新型的微流控取样装置。图5所示的实施例中,微流控取样装置包括一个微流控芯片100,微流控芯片100卡入托架组件200的任一卡接部201中。图4a至图4c所示的实施例中,微流控取样装置包括两个完全相同的微流控芯片100,微流控芯片100分别卡入托架组件200的两个卡接部201中。多个微流控芯片100的设计,一方面能对每一微流控芯片100的检测结果进行精确复核(即依次对两个微流控芯片100进行检测,二者检测结果的差值不超过预设阈值即为有效,取二者检测结果之和或者均值作为最终检测结果),另一方面,由于生乳细胞的荧光较弱,能将多个微流控芯片100的检测结果叠加从而保证检测的准确性。
显然,微流控取样装置中的微流控芯片100的最大个数由托架组件200的卡接部201的个数决定的。优选的,托架组件200上的卡接部201在同一水平面上并行设置。
为了便于生乳样品的预处理,托架组件200上设置有试剂腔12,用于固体或液体试剂的存储以及作为试剂与生乳样品的混合容器。一个实施例中,试剂腔12为圆柱形、倒圆台形或半球形,容积为30μl-100μl,深度为5mm-14mm。
为了便于与托架组件200的卡接部201组装卡接,微流控芯片100上还设有内定位槽13,该内定位槽设置在微流控芯片的基座1的下方,通过与托架组件200上的凸起配合,以实现微流控芯片的准确组装卡位。
为了便于在后续的生乳细胞计数分型用检测分析仪器中使用,该微流控取样装置上还设有外定位槽14,外定位槽14设置在托架组件200的尾端底面上,用于定位微流控取样装置在检测分析仪器中的位置,当将微流控取样装置放入检测分析仪器时外定位槽14将与检测分析仪器内的承载台上的凸起相匹配,从而实现精确定位功能。
实施例二
图2a-图2d示出了本实用新型微流控芯片的实施例二的结构。实施例二的结构是在实施例一的结构基础上的进一步改进,其与实施例一结构不同之处在于:
该实施例中,位于进样检测腔2中的分析区4设置有两个,分别为第一分析区41和第二分析区42,且两个分析区相互独立(呈间距设置),且两个分析区之间由引流槽区7连通。该实施例中,两个分析区均为长方形,厚度分别为h分1、h分2,其中,第一分析区41的厚度h分1大,待测生乳样品在第一分析区41内的芯片侧壁3上形成的检测面景深大、单位面积样品承载量大,适宜于生乳细胞数目的整体精确测量,厚度h分1优选为100μm-400μm;第二分析区42的厚度h分2小,待测生乳样品在第二分析区42内的芯片侧壁3上形成的检测面景深小、单位体积样品铺展面积大,可用于生乳细胞的精细分析,第二分析区42的厚度h分2优选为50μm-100μm。该实施方式可同时兼顾细胞总体计数与单个细胞的精细分析。两个分析区4由同一厚度的引流槽区7相连通。
具体的,该实施例中,排气孔6设有四个,分别为第一排气孔61、第二排气孔62和第三排气孔63、第四排气孔64,其中,第一排气孔61和第三排气孔63分别位于引流槽区7的前端(待测生乳样品进入第一分析区41之前的位置)和中部(待测生乳样品流出第一分析区41之后的位置),第二排气孔62设置在第一分析区41上,第四排气孔64设置在第二分析区42上,排气孔6均为贯穿引流槽区7或分析区4的对称的倒锥形通孔,可进一步避免气泡的产生。
显然,多个分析区4也可具有同一厚度,该厚度值小于引流槽区7的厚度值,通过设置不同分析区4,有助于对各个分析区4的检测结果的精度和一致性进行分析。实施例二的微流控芯片其它结构与实施例一相同,不再赘述。
该实施例中的微流控芯片100与托架组件200组装为一个整体形成微流控取样装置,该微流控取样装置包括至少一个微流控芯片100。如图6所示的微流控取样装置包括两个微流控芯片100,其他结构与实施例一相同,不再赘述。
该实施例二的结构设计,两个厚度不同的分析区4分别对应细胞总体计数、单个细胞精细分析的不同需求。
实施例三
图3a-图3c示出了本实用新型微流控芯片的实施例三的结构。实施例三的结构是在实施例二的结构基础上的进一步改进,其与实施例二结构不同之处在于:
该实施例中,进样口5设有两个,分别为第一进样口51和第二进样口52,分别对应第一分析区41和第二分析区42,第一进样口51设有第一进样豁口81,第一进样口51靠近基座1的一侧开设有通气槽9,第二进样口52位于进样检测腔2的开口处的中间部位;进样口5的下滑弧线的切线与取样口7的水平基准面的夹角α为15°~85°,从而促进粘稠生乳样品快速、流畅流入分析区4并充满,同时避免气泡的进入。两个进样口的设计可以防止液体过于粘稠时,位于流动末端的第二分析区42中生乳样品无法充满的情况出现。
具体的,引流槽区7可设置多个(相互连通且不同厚度的引流槽区称为不同的引流槽区),每一引流槽区7与相应的分析区4相对应,便于生乳样品可控、快速的流入对应的分析区4,通过设置不同厚度的引流槽区7和分析区4,以实现不同的液体流动速率、液体层流特征的调整,分析区4的厚度小于所有引流槽区7的厚度;同样,引流槽区7可设置为一个(相同厚度且相连通的引流槽区称为同一引流槽区),多个分析区4可以对应同一引流槽区7。
具体的,通过对进样口5的下滑弧线的切线与进样口5的水平基准面的夹角α的调整,可以指定待测生乳样品进入引流槽区7的具体方位,这样可以保证待测生乳样品按照特定的方式流入分析区并充满。角度α的优选范围取15°~85°。
同样,实施例三的微流控芯片100卡接在托架组件200的卡接部201中形成微流控取样装置,如图7所示,两个完全相同的微流控芯片100并行卡接在托架组件200上,可实现检测结果的精确复核,以增强检测结果的可信度。
实施例三的其他结构与实施例二相同,本实施例三中未提及的技术方案,请参考实施例二或实施例一,不再赘述。
基于以上实施例,进一步,本实用新型微流控芯片的材料可选用光学级的透明聚合物、玻璃和石英中的任一种或多种的组合,确保具有高透光率和低荧光自发性能。
显然,本实用新型微流控芯片和微流控取样装置的结构并不限于上述实施例所描述的结构,在本实用新型构思的基础上经过简单增减分析区、引流槽区、进样口(带有进样豁口)、排气孔以及卡接部的个数、变换形状、位置或组合形式,均落入本实用新型构思范围内。
向上述微流控芯片中加样的方式:基于吸液管的被动注样,即用吸液管吸取生乳样品或预处理后的待测生乳样品,将吸液管置于微流控芯片的进样口5的进样豁口8处,将生乳样品加入微流控芯片直至充满分析区4。
加样后的微流控芯片卡接在微流控取样装置的卡接部,并将微流控取样装置置于检测分析仪器的预定位置即可进行检测分析。
上述实施例的生乳细胞分析用微流控芯片及微流控取样装置具有以下突出特点和效果:
1)本实用新型进样检测腔2采用半开放式空腔结构,在需要试剂预封装的情况下,以通畅的气路加速了试剂封装的速度与均匀性,防止后续进样过程液体流动紊乱不畅形成气泡;
2)在进样口5靠近基座1的一侧设置有通气槽9,在加样的过程中,防止生乳样品中大的气泡进入进样检测腔2,避免产生较大的检测误差;
3)通过设置多个厚度不同的分析区4,厚度大的分析区4所形成的检测面单位面积样品承载量大,适宜于生乳细胞数目的整体精确测量,厚度小的分析区4所形成的检测面单位体积液体样品铺展面积大,适宜于细胞型别的精密区分,从而实现同一生乳样品一次完成细胞多参数精确测量;
4)通过引流槽区7与分析区4的衔接与厚度设计以及分析区总面积占进样检测腔单侧总面积50%-90%的设计,实现液体样品由引流槽区7到分析区4的可控、顺畅流动,防止液体前锋面紊乱形成气泡,使得较大面积的芯片侧壁3不易发生变形,从而保证每个分析区内均一的厚度;
5)针对生乳较为粘稠的特点,通过将进样口5的下滑弧线的切线与进样口5的水平基准面夹角α设置为较大的范围15°~85°,从而加速生乳样品流入进样检测腔2的速度与顺畅性;
6)通过排气孔6的形状、位置(引流槽区7和/或分析区4)、数量的设计,可以在气路顺畅有效排出气体防止气泡的同时,避免液体样品因毛细流动惯性力而溢出;通过排气孔6分布的设计,将排气孔6分布在进样检测腔2一侧或对称布置在两侧,取样结束后只需擦拭进样检测腔2侧面,避免液体样品因擦拭进样口而损失;
7)通过芯片侧壁3端缘内楞设置过渡圆角10,可使进样检测腔2端缘的液体形成稳定的液桥面11,避免液体样品在微流控芯片移动过程中因重力作用而流出;
8)通过托架组件200将多个微流控芯片100组装在一起同时检测,从而实现在一次检测中对同样的生乳样品进行复核验证分析,增强了检测结果的可靠性。
本领域技术人员应当理解,这些实施例仅用于说明本实用新型而不限制本实用新型的范围,对本实用新型所做的各种等价变型和修改均属于本实用新型公开内容。
- 还没有人留言评论。精彩留言会获得点赞!