一种生物传感器的制作方法
本实用新型属于分子检测技术领域,涉及一种生物传感器。
背景技术:
肝肿瘤是严重的社会和公共卫生问题,对患者的健康和生命危害极大。在全球恶性肿瘤发病率中,肝肿瘤位于第5位,死亡率居于第3位。肝肿瘤在我国发病率相当高,几乎占全世界肝肿瘤总数的50%以上,在我国由恶性肿瘤引起的死亡中,肝肿瘤仅次于肺癌居第2位。最近几年,伴随着乙肝及丙肝患者数量的不断上升,肝肿瘤的发病率和病死率也不断增加。
临床常用的肝肿瘤标志物包括甲胎蛋白(afp)、人甲胎蛋白异质体3(afp-l3)、癌胚抗原(cea)、糖类抗原125(ca125)、糖类抗原19-9(ca19-9)等。然而单一的肿瘤标志物的特异性和灵敏性较低,通常需要联合多种肿瘤标志物,以提高肿瘤检测的特异性和灵敏性。目前肿瘤标志物的检测方法主要包括胶体金纸层析法、酶联免疫法和化学发光免疫分析法等,然而不同的肿瘤标志物通常需要采用试剂盒和专业仪器逐一进行检测,操作重复高、耗费时间长、成本较高。传统的试剂盒检测法难以高效地进行多样本的快速多指标联合检测。
cn107345966a公开了一种基于生物膜干涉技术的美沙酮检测方法,所述方法检测时间短,整个检测过程仅需5min左右,且检测灵敏度最低可达到10ng/ml,可同时进行批量样本的检测,最多一次可进行80个样品的检测,而整个时间仅有30min,实现高通量样品快速检测。然而该方法的检测指标仅限于美沙酮,不能实现多指标联合检测。
因此,提供一种高通量多指标的生物传感器,用于抗原的联合检测,在分子检测领域具有重要意义。
技术实现要素:
针对现有技术的不足,本实用新型提供了一种生物传感器,所述生物传感器通过装载多个包被不同单克隆抗体的探头,配合微孔板,实现了抗原的多样本多指标联合检测,自动化程度高、检测效率高、时间短。
为达此目的,本实用新型采用以下技术方案:
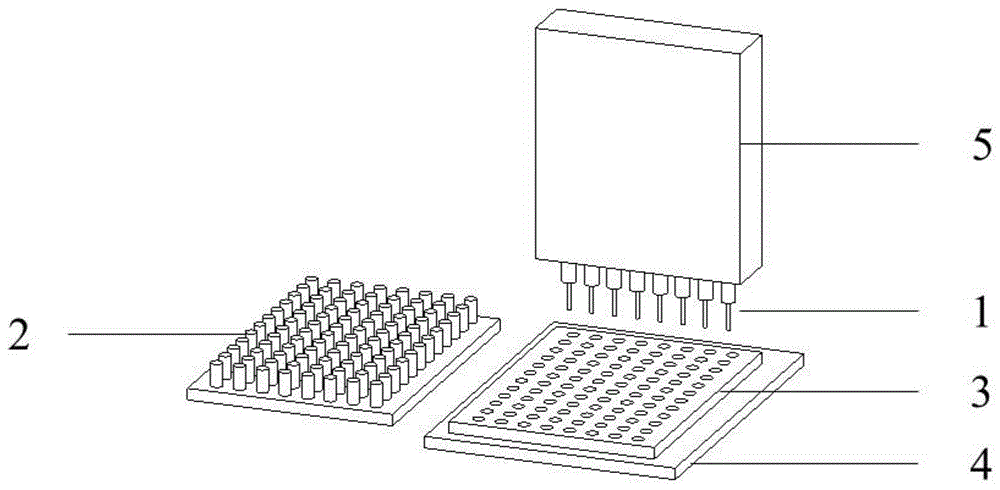
第一方面,本实用新型提供了一种生物传感器,所述生物传感器包括探头1、探头存放装置2、反应装置3、温度控制装置4和光学检测装置5;
安装在所述光学检测装置5上的所述探头1的数量为1-8个,储存在所述探头存放装置2内的所述探头1的种类为2-10种。
本实用新型中,通过在生物传感器上设置针对不同抗原的多种探头,且各探头的检测过程不会相互影响,不仅实现了同一样本中不同抗原的同时检测,而且实现了多种样本的同时检测。
优选地,所述探头的种类为2-10种,例如可以是2种、3种、4种、5种、6种、7种、8种、9种或10种,优选为3-8种,进一步优选为5-6种。
优选地,所述探头1位于所述反应装置3的上方,用于检测所述反应装置3中的抗原浓度。
优选地,所述探头存放2位于所述反应装置3的一侧,用于储存探头1。
优选地,所述反应装置3的底面设置有定位槽,用于将所述反应装置3固定于生物传感器上。
优选地,所述反应装置3为96微孔板。
优选地,所述温度控制装置4位于所述反应装置3的下方,用于控制所述反应装置3的温度。
优选地,所述光学检测装置5位于所述生物传感器的顶部,用于检测反应装置3中的光信号。
优选地,所述探头1包被有不同抗原的单克隆抗体;
所述抗原包括肝肿瘤标志物。
优选地,所述单克隆抗体包括甲胎蛋白单克隆抗体、人甲胎蛋白异质体3单克隆抗体、癌胚抗原单克隆抗体、糖类抗原125单克隆抗体或糖类抗原19-9单克隆抗体中的任意一种或至少两种的组合。
第二方面,本实用新型提供了一种如第一方面所述生物传感器的标准曲线的制定方法,所述方法包括以下步骤:
(1)将至少两种抗原标准品梯度稀释后混合,配置得到至少7份不同浓度的抗原标准液;
(2)向步骤(1)所述抗原标准液中加入抗原的胶体金标记抗体,混合孵育,得到检测液;
(3)将所述探头依次浸入步骤(2)所述检测液中,混合孵育,进行光学检测,得到厚度值;
(4)以厚度值为纵坐标,抗原的浓度为横坐标,绘制得到不同抗原的标准曲线。
优选地,步骤(2)和步骤(3)所述孵育的温度为15-40℃,例如可以是15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃或40℃,优选为37-38℃。
优选地,步骤(2)和步骤(3)所述孵育的时间为60-100s,例如可以是60s、61s、62s、63s、64s、65s、66s、67s、68s、69s、70s、71s、72s、73s、74s、75s、76s、77s、78s、79s、80s、81s、82s、83s、84s、85s、86s、87s、88s、89s、90s、91s、92s、93s、94s、95s、96s、97s、98s、99s或100s,优选为70-90s。
第三方面,本实用新型提供了一种抗原的联合检测方法,所述方法采用如第一方面所述生物传感器。
优选地,所述方法包括以下步骤:
(1’)将待测样品与胶体金标记抗体混合孵育,得到待测溶液;
(2’)将探头依次浸入步骤(1’)所述待测溶液中,混合孵育,进行光学检测,得到厚度值;
(3’)根据标准曲线,计算得到所述待测样本中抗原的浓度。
优选地,步骤(1’)所述胶体金标记抗体包括胶体金标记甲胎蛋白单克隆抗体、胶体金标记人甲胎蛋白异质体3单克隆抗体、胶体金标记癌胚抗原单克隆抗体、胶体金标记糖类抗原125单克隆抗体和胶体金标记糖类抗原19-9单克隆抗体的组合。
优选地,步骤(1’)和步骤(2’)所述孵育的温度为15-40℃,例如可以是15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃或40℃,优选为37-38℃。
优选地,步骤(1’)和步骤(2’)所述孵育的时间为60-100s,例如可以是60s、61s、62s、63s、64s、65s、66s、67s、68s、69s、70s、71s、72s、73s、74s、75s、76s、77s、78s、79s、80s、81s、82s、83s、84s、85s、86s、87s、88s、89s、90s、91s、92s、93s、94s、95s、96s、97s、98s、99s或100s,优选为70-90s。
第四方面,本实用新型提供了一种如第一方面所述的生物传感器在联合检测肝肿瘤标志物中的应用。
与现有技术相比,本实用新型具有如下有益效果:
(1)本实用新型的生物传感器可以对多个样本进行多指标检测,检测效率高,样本消耗少;
(2)本实用新型的生物传感器可以对粗样品进行检测,样本预处理要求低;
(3)本实用新型的生物传感器通过双抗体夹心法直接检测抗原的浓度,各项指标的检测在一个酶标孔中进行,检测通量大;
(4)本实用新型的生物传感器只需一次加样,其余步骤均由仪器自动完成,自动化程度高,操作简便,省时省力。
附图说明
图1为生物传感器的结构示意图;
图2为96微孔板试剂加样图。
图3a为afp标准曲线,图3b为afp-l3标准曲线,图3c为cea标准曲线,图3d为ca125标准曲线,图3e为ca19-9标准曲线。
具体实施方式
为进一步阐述本实用新型所采取的技术手段及其效果,以下结合实施例和附图对本实用新型作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本实用新型,而非对本实用新型的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
试剂:
氯金酸水溶液:称取10.00g氯金酸(haucl4)溶于800ml纯水中,容量瓶定容至1000ml,配成1.0%(w/v)的氯金酸水溶液,4℃保存,两个月内使用;
柠檬酸三钠水溶液:称取11.39g二水柠檬酸三钠(na3c6h5o7·2h2o)溶于800ml纯水中,容量瓶定容至1000ml,配成1.0%(w/v)的柠檬酸三钠水溶液,0.4μm微孔滤膜过滤后4℃保存,7天内使用;
mes缓冲液(20mm):称取4.27g吗啉乙磺酸水合物(mes)溶于800ml纯水中,调节ph至6.0,定容至1000ml制得,4℃保存备用;
edc溶液(10mg/ml):称取2.0mg碳二亚胺(edc),加入200μl预冷的mes缓冲液(20mm,ph=6.0),溶解制得,现配现用;
sulfo-nhs溶液(10mg/ml):称取4.0mgn-羟基硫代琥珀酰亚胺(sulfo-nhs),加入400μl预冷的mes缓冲液(20mm,ph=6.0),溶解制得,现配现用;
偶联洗涤液:50mmtris(ph=7.4)+0.1%tween-20;
封闭液:50mmtris(ph=7.4)+1.0%bsa+0.1%tween-20;
传感器再生液:甘氨酸-盐酸缓冲液(ph=2.0);
传感器清洗平衡缓冲液:20mmpbs缓冲液(ph=7.4)。
实施例1生物传感器的构造
本生物传感器包括探头1、探头存放装置2、反应装置3、温度控制装置4和光学检测装置5;
安装在所述光学检测装置5上的所述探头1的数量为1-8个,储存在所述探头存放装置2内的所述探头1的种类为2-10种;
所述探头1位于所述反应装置3的上方,用于检测所述反应装置3中的抗原浓度;
所述探头存放装置2位于所述反应装置3的一侧,用于储存探头1;
所述反应装置3的底面设置有定位槽,用于将所述反应装置3固定于生物传感器上;
所述反应装置3为96微孔板;
所述温度控制装置4位于所述反应装置3的下方,用于控制所述反应装置3的温度;
所述光学检测装置5位于所述生物传感器的顶部,用于检测反应装置3中的光信号;
所述探头1包被有不同抗原的单克隆抗体;所述抗原包括肝肿瘤标志物;
所述单克隆抗体包括甲胎蛋白单克隆抗体、人甲胎蛋白异质体3单克隆抗体、癌胚抗原单克隆抗体、糖类抗原125单克隆抗体或糖类抗原19-9单克隆抗体中的任意一种。
实施例2胶体金的制备
将1.0%(w/v)氯金酸水溶液用纯水稀释100倍后,量取500ml的0.01%(w/v)氯金酸水溶液置于1l烧杯中,在电磁搅拌的同时加热到95℃,持续10min,再加入5ml的1.0%(w/v)柠檬酸三钠水溶液,煮沸15min以上,直至溶液颜色变为橙红色,室温冷却后即得胶体金溶液,4℃保存备用。
实施例3胶体金标记单克隆抗体的制备
afp单克隆抗体的胶体金标记方法如下:
取10ml胶体金溶液,使用1.0mol/l碳酸钾(k2co3)水溶液调节ph至7.4,室温条件下磁力搅拌5min;加入10μl的2mg/mlafp抗体,使用hcl调节ph至抗体适宜的酸性反应环境,室温搅拌反应15min;再加入1ml的10%bsa,继续搅拌15min;冷却至4℃,使用naoh调节ph至7.4;4℃下10000r/min离心10min,向沉淀中加入100μlpbs(10mmol/l,ph7.4)重悬颗粒,即得到胶体金标记afp单克隆抗体溶液;最后通过脱盐柱浓缩及pbs(10mmol/l,ph7.4)稀释,得到2mg/ml胶体金标记afp单克隆抗体。
采用同样的方法,将afp单克隆抗体分别替换为人甲胎蛋白异质体3(afp-l3)单克隆抗体、癌胚抗原(cea)单克隆抗体、糖类抗原125(ca125)单克隆抗体和糖类抗原19-9(ca19-9)单克隆抗体,分别得到胶体金标记afp-l3单克隆抗体、胶体金标记cea单克隆抗体、胶体金标记ca125单克隆抗体和胶体金标记ca19-9单克隆抗体。
实施例4生物传感器探头的单克隆抗体修饰
(1)生物传感器探头的羧基化修饰
吸取6.6ml的aptes(3-氨丙基三乙氧基硅烷,3-aminopropyltriethoxysilane)溶于50ml无水乙醇中,制得0.6maptes乙醇溶液,加盖密封4℃保存备用;
取0.15g琥珀酸酐溶于50mln,n-二甲基甲酰胺(dmf)中,制得酸酐溶液,4℃保存备用;
将探头依次在纯水中超声10min,在无水乙醇中超声10min,在处理液(35ml浓硫酸和15ml双氧水混匀制得)中超声30min,在无水乙醇中超声10min,氮气吹干;
将处理后的洁净干燥的探头依次浸入0.6maptes乙醇溶液中约5mm,50℃下保持12小时以上;无水乙醇中约5mm保持10min;酸酐溶液中约5mm保持2h;用纯水及无水乙醇洗涤多次后,室温晾干,得到羧基化探头,4℃保存备用。
(2)生物传感器探头的单克隆抗体修饰
向10mlmes缓冲液中加入200μl10mg/ml现配edc溶液和400μl10mg/ml现配sulfo-nhs溶液,将制备的羧基化探头浸入溶液中约5mm,室温保持30min,随后浸入20mmmes溶液(ph=6.0)中洗涤10min,得活化的探头;
在10mlmes缓冲液中加入200μl浓度为2mg/ml的afp单克隆抗体,将探头浸入溶液约5mm,室温保持2h,随后依次浸入偶联洗涤液中洗涤10min,封闭液中约5mm室温保持1h,和洗涤液中洗涤10min,室温晾干,4℃保存,得到包被afp单克隆抗体的探头。
采用同样的方法,将afp单克隆抗体分别替换为人甲胎蛋白异质体3(afp-l3)单克隆抗体、癌胚抗原(cea)单克隆抗体、糖类抗原125(ca125)单克隆抗体和糖类抗原19-9(ca19-9)单克隆抗体,分别得到包被afp-l3单克隆抗体、cea单克隆抗体、ca125单克隆抗体和ca19-9单克隆抗体的探头。
实施例5标准曲线的制定
采用如图1所示的生物传感器进行标准曲线的制定,试剂的排布如图2所示,具体步骤如下:
(1)取8个ep管,每个ep管中均加入5种胶体金标记单克隆抗体各50μl,然后加入抗原标准品和阴性血清共250μl,使甲胎蛋白抗原标准品浓度依次为0ng/ml、5ng/ml、10ng/ml、50ng/ml、100ng/ml、200ng/ml、500ng/ml和1000ng/ml;人甲胎蛋白异质体3抗原标准品浓度依次为0ng/ml、5ng/ml、10ng/ml、25ng/ml、50ng/ml、100ng/ml、150ng/ml和200ng/ml;癌胚抗原标准品浓度依次为0ng/ml、5ng/ml、10ng/ml、50ng/ml、100ng/ml、200ng/ml、500ng/ml和1000ng/ml;糖类抗原125抗原标准品浓度依次为0u/ml、50u/ml、100u/ml、200u/ml、500u/ml、1000u/ml、2000u/ml和3000u/ml;糖类抗原19-9抗原标准品浓度依次为0u/ml、5u/ml、10u/ml、50u/ml、100u/ml、200u/ml、500u/ml和1000u/ml,充分混匀;
(2)在96微孔板的第一行孔中加入300μl传感器再生液,第二行孔中加入300μl传感器清洗平衡缓冲液,从第三行孔中依次加入300μl8个浓度梯度的标准品,随后将96微孔板放入仪器;
(3)将生物传感器中的8个探头浸入pbs缓冲液中60s,进行平衡;
(4)将8个包被有afp单克隆抗体的探头浸入不同浓度的标准品溶液中80s,进行光学检测,得到厚度值,制定得到afp标准曲线;
(5)将8个探头浸入传感器再生液中60s,进行再生;
(6)将再生的探头浸入传感器清洗平衡缓冲液中60s,进行清洗平衡;
(7)更换其他种探头,重复(3)~(6),制备其他指标的标准曲线。
利用上述数据,得到如图3a所示的afp标准曲线,图3b所示的afp-l3标准曲线,图3c所示的cea标准曲线,图3d所示的ca125标准曲线,图3e所示的ca19-9标准曲线。
实施例6样本处理
将全血样本在4℃下5000r/min离心5min,得到血清样本;
向ep管中加入5种胶体金标记单克隆抗体各50μl,再加入250μl血清样本,充分混匀,得到待测样本。
实施例7血清样本的多指标联合检测
采用如图1所示的生物传感器进行血清样本浓度的检测,具体步骤如下:
(1)在96微孔板的第一行孔中加入300μl传感器再生液,第二行孔中加入300μl传感器清洗平衡缓冲液,后续行孔中加入300μl待测样本,随后将96微孔板放入仪器;
(2)将生物传感器的8个探头浸入pbs缓冲液中60s,进行平衡;
(3)检测afp浓度时,仪器自动装上包被有afp单克隆抗体的探头,将探头浸入待测样本中80s,进行检测;
(4)将8个探头浸入传感器再生液中60s,进行再生;
(5)将再生的探头浸入传感器清洗平衡缓冲液中60s,进行清洗平衡;
(6)将检测结果代入对应的标准曲线,并根据待测样本的稀释倍数,计算得到待测样本中afp的浓度;
(7)仪器自动换装其他指标的探头,重复(3)~(6),可分别检测、计算得到afp-l3、cea、ca125和ca19-9的浓度。
检测得到样品中的afp浓度值为514.69ng/ml、3.47ng/ml、8.77ng/ml、845.42ng/ml、72.61ng/ml、788.62ng/ml、124.25ng/ml、361.63ng/ml;afp-l3浓度值为52.01ng/ml、8.00ng/ml、1.22ng/ml、77.56ng/ml、12.91ng/ml、100.95ng/ml、22.43ng/ml、46.87ng/ml;cea浓度值为8.77ng/ml、1.39ng/ml、46.25ng/ml、156.75ng/ml、477.31ng/ml、266.85ng/ml、44.15ng/ml、76.98ng/ml;ca125浓度值为54.1u/ml、200.65u/ml、298.32u/ml、571.21u/ml、67.56u/ml、2412.36u/ml、1624.73u/ml、941.30u/ml;ca19-9浓度值为254.91u/ml、65.74u/ml、654.96u/ml、459.85u/ml、156.96u/ml、136.01u/ml、254.65u/ml、199.84u/ml。
验证本实施例检测结果的真实性:以化学发光检测仪检测样本得到各项指标浓度值如下:afp浓度值为495.6ng/ml、3.65ng/ml、9.01ng/ml、851.36ng/ml、69.27ng/ml、790.24ng/ml、111.32ng/ml、329.3ng/ml;afp-l3浓度值为55.01ng/ml、8.24ng/ml、1.09ng/ml、73.95ng/ml、13.49ng/ml、108.57ng/ml、20.35ng/ml、49.21ng/ml;cea浓度值为7.54ng/ml、2.61ng/ml、55.1ng/ml、164.27ng/ml、498.21ng/ml、245.65ng/ml、44.36ng/ml、76.25ng/ml;ca125浓度值为52.94u/ml、211.54u/ml、303.21u/ml、588.69u/ml、69.14u/ml、259.08u/ml、1751.63u/ml、900.73u/ml;ca19-9浓度值为266.42u/ml、69.57u/ml、622.76u/ml、443.84u/ml、116.5u/ml、184.5u/ml、269.85u/ml、209.65u/ml,与本实用新型测得的结果一致。
综上所述,本实用新型的生物传感器可以同时对多个样本进行多指标检测,检测效率高,样本消耗少,样本预处理要求低;通过双抗体夹心法直接检测抗原的浓度,各项指标的检测在一个酶标孔中进行,检测通量大;只需一次加样,其余步骤均由仪器自动完成,自动化程度高,操作简便,省时省力。
本实用新型未涉及的部分均与现有技术相同或可采用现有技术加以实现。
申请人声明,本实用新型通过上述实施例来说明本实用新型的详细方法,但本实用新型并不局限于上述详细方法,即不意味着本实用新型必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本实用新型的任何改进,对本实用新型产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本实用新型的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!