试剂盒、测定试剂盒及测定方法与流程
本发明涉及一种用于测定血清淀粉样蛋白a的试剂盒、用于测定血清淀粉样蛋白a的测定试剂盒及生物样品中的血清淀粉样蛋白a的测定方法。
背景技术:
:以往在生物测定等中,作为高灵敏度且容易的测定法,广泛使用荧光检测法。该荧光检测法是对被认为包含由特定波长的光激发而发出荧光的检测对象物质的试样照射上述特定波长的激发光,此时通过检测荧光来确认检测对象物质的存在的方法。并且,当检测对象物质并非为荧光体时,使与以荧光色素进行标记的检测对象物质特异性结合的物质接触试样,之后与上述同样地检测荧光,由此确认该结合即检测对象物质的存在的方法也被广泛地使用。并且,在专利文献1等中提出在这种荧光检测法中为了提高灵敏度,利用基于等离子体激元共振的电场增强的效果的方法。这是由于为了产生等离子体激元共振,具备在透明的支撑体上的规定区域设置有金属层的传感器芯片,相对于支撑体与金属膜的界面,从与支撑体的金属层形成面相反的面侧以全反射角以上的规定的角度入射激发光,通过该激发光的照射在金属层产生表面等离子体激元,通过该电场增强作用来增加荧光,由此提高信号/噪音(s/n)。血清淀粉样蛋白a(serumamyloida:也记作saa)为分子量约11,600的疏水性非常高的蛋白质,其具有当生体被施加感染、肿瘤及外伤等各种刺激并由此而导致产生炎症时,在血液中的浓度敏锐增加的性质。因此,作为实时了解炎症的程度的炎症标志物,使用免疫学测定方法来测定血液中的saa浓度。然而,已知saa可能是由于疏水性高,通常大部分在血液中会与高密度脂蛋白(high-densitylipoprotein:hdl)缔合。saa的抗原决定簇隐藏于脂蛋白内部的不与外界接触的部分,有时无法直接与抗体进行反应。因此,在免疫学测定时,大多需要进行用于使隐藏的抗原决定簇露出的前处理。例如,在专利文献2中记载有在组织因子脱辅基蛋白的测定法中将hlb(hydrophilic-lipophilicbalance,亲水亲油平衡)值为12以上的非离子系表面活性剂混合2~15重量%。现有技术文献专利文献专利文献1:日本特开2010-190880号公报专利文献2:国际公开wo92/012429号技术实现要素:发明要解决的技术课题由专利文献2的记载可了解到,通过表面活性剂处理,血清淀粉样蛋白a从与hdl的缔合状态脱离,反应部位暴露于外部。然而,若在通过基于表面等离子体激元激发的荧光检测法(spf法)进行的测定系统中如专利文献2中所记载那样添加2~15重量%的非离子系表面活性剂,则在进行自hdl的解离的同时,抗原抗体反应被强烈抑制,存在导致信号强度显著下降的问题。本发明的课题在于提供一种用于测定血清淀粉样蛋白a的试剂盒、测定试剂盒及测定方法,其能够以相对于血清淀粉样蛋白a浓度的信号增加的相关性高的方式进行测定。用于解决技术课题的手段本发明人等为了解决上述课题而进行深入研究的结果,发现通过组合使用用与血清淀粉样蛋白a具有特异性结合性的第一结合物质进行了改性且具有标记的第一粒子及以(无机性值/有机性值)×10定义的hlb值为17~20且分子量为1000以下的至少一种的非离子性表面活性剂能够解决上述课题,直到完成了本发明。即,根据本发明,提供以下发明。[1]一种用于测定血清淀粉样蛋白a的试剂盒,其包含:用与血清淀粉样蛋白a具有特异性结合性的第一结合物质进行了改性且具有标记的第一粒子;及以(无机性值/有机性值)×10定义的hlb值为17~20且分子量为1000以下的至少一种非离子性表面活性剂。[2]根据[1]所述的试剂盒,其中,上述第一粒子的平均粒径为70nm以上且500nm以下。[3]根据[1]或[2]所述的试剂盒,还包含用与血清淀粉样蛋白a不具有特异性结合性的第二结合物质进行了改性且不具有标记的第二粒子。[4]根据[3]所述的试剂盒,其中,上述第二粒子的平均粒径为70nm以上且500nm以下。[5]根据[1]至[4]中任一项所述的试剂盒,其中,上述标记包含荧光色素。[6]根据[1]至[5]中任一项所述的试剂盒,其中,上述血清淀粉样蛋白a为猫血清或猫血浆中的血清淀粉样蛋白a。[7]根据[1]至[6]中任一项所述的试剂盒,其中,上述表面活性剂为具有疏水性基的单糖类或具有疏水性基的二糖类。[8]根据[1]至[7]中任一项所述的试剂盒,其中,上述第一结合物质为抗体。[9]一种用于测定血清淀粉样蛋白a的测定试剂盒,其包含:[1]至[8]中任一项所述的试剂盒;以及形成有第一金属膜的基板,在该第一金属膜上固定有与血清淀粉样蛋白a或上述第一结合物质具有特异性结合性的第三结合物质。[10]根据[9]所述的测定试剂盒,其中,在上述基板上还形成有第二金属膜,在该第二金属膜上固定有与血清淀粉样蛋白a不具有结合性而与上述第一结合物质具有特异性结合性的第四结合物质。[11]一种生物样品中的血清淀粉样蛋白a的测定方法,其包括以下工序:制备混合液的工序,该混合液包含:含有血清淀粉样蛋白a的生物样品;用与血清淀粉样蛋白a具有特异性结合性的第一结合物质进行了改性且具有标记的第一粒子;以(无机性值/有机性值)×10定义的hlb值为17~20且分子量为1000以下的至少一种非离子性表面活性剂;及生理盐水;向形成有第一金属膜的基板的一端的注入口添加上述混合液的工序,该第一金属膜固定有与血清淀粉样蛋白a具有特异性结合性的第三结合物质;使所述混合液流到所述基板上的工序;以及获取所述第一金属膜上的标记的信息的工序。[12]根据[11]所述的血清淀粉样蛋白a的测定方法,其中,上述混合液中的上述表面活性剂的浓度为0.01质量%以上且10质量%以下。[13]根据[11]或[12]所述的血清淀粉样蛋白a的测定方法,其中,制备上述混合液的工序为制备相对于上述生物样品稀释成5倍以上的混合液的工序。发明效果根据基于本发明的试剂盒、测定试剂盒及测定方法,能够简单且迅速地对saa进行免疫学测定。附图说明图1表示传感器芯片的示意图。图2表示传感器芯片的分解图。图3表示相对于基于对照试剂盒的saa浓度,将在实施例及比较例中测定的荧光信号值的增加速度进行制图的结果。具体实施方式以下对本发明的实施方式进行详细说明。在本说明书中,使用“~”表示的数值范围表示将记载于“~”的前后的数值分别作为最小值以及最大值包含在内的范围。[试剂盒]根据本发明,提供一种用于测定血清淀粉样蛋白a的试剂盒,其包含:用与血清淀粉样蛋白a具有特异性结合性的第一结合物质进行了改性且具有标记的第一粒子;及以(无机性值/有机性值)×10定义的hlb值为17~20且分子量为1000以下的至少一种非离子性表面活性剂。本发明的试剂盒如上述包含第一粒子及非离子性表面活性剂,但第一粒子与非离子性表面活性剂也可以作为混合物包含于试剂盒中,也可以分别包含于试剂盒中。在本发明中,通过将具有指定的hlb值的表面活性剂以低浓度进行混合,即使使用表面活性剂也不会阻碍抗原抗体反应,能够获得充分强度的spf信号。(血清淀粉样蛋白a)本发明中的被检物质为血清淀粉样蛋白a(saa)。saa作为炎症标志物是有用的。作为血清淀粉样蛋白a,例如能够举出猫血清或猫血浆中的血清淀粉样蛋白a。(表面活性剂)非离子性表面活性剂的特性在该
技术领域:
通常以hlb(亲水亲油平衡)表示,hlb值的计算方法有几种不同的方法。在本发明中,可知使用基于有机概念图(新版有机概念图-基础与应用sankyoshuppanco.,ltd.1984年第一版)的有机性值与无机性值,以(无机性值/有机性值)×10定义的hlb值为17~20的范围,且通过使用分子量为1000以下的范围的非离子性表面活性剂,在本发明的spf测定系统中可获得良好的信号强度。已知在以往技术中使用具有优选的hlb值的表面活性剂,但在本发明中,不仅是hlb值,表面活性剂分子的大小也成为重要的因素,需要在某一指定的范围内。即可以推断,仅具有适合于使血清淀粉样蛋白a从hdl解离的hlb值还不充分,若其分子量过大,则分子的体积也必然变大,抗体向用于进行解离后的抗原抗体反应所需的血清淀粉样蛋白a的接近受到阻碍,尤其会引起低浓度被检体中的信号的下降,因此需要在如成为某一指定大小的分子量的范围内。已知在血清中,saa的大部分以与高比重脂蛋白(hdl)缔合的状态存在。因此,存在相对于与血清淀粉样蛋白a具有结合性的第一结合物质及第三结合物质的血清淀粉样蛋白a的识别部位被hdl遮蔽,第一结合物质及第三结合物质无法与血清淀粉样蛋白a结合的问题。本发明为了解决这种现象,通过使用表面活性剂使血清淀粉样蛋白a从hdl解离,从而能够准确地对血清中的saa进行定量。在本发明中使用的表面活性剂为分子量1000以下的非离子性表面活性剂。若非离子性表面活性剂的分子量超过1000,则存在遮蔽如hdl那样作为被检体而被识别的部位的情况,有时无法准确测定saa,因此使用分子量为1000以下的非离子性表面活性剂。表面活性剂的分子量的下限优选为200以上,更优选为300以上。表面活性剂的分子量的上限优选为900以下,更优选为800以下,进一步优选为700以下,尤其优选为600以下。在本发明中,使用对于结合物质的结合性的影响较小的非离子性表面活性剂。在离子性表面活性剂的情况下,有时会通过与生物样品中的具有电荷的基团相互作用而对测定产生影响,难以准确地测定saa,因此在本发明中使用非离子性表面活性剂。作为非离子性表面活性剂的另一呼称,有时记作nonionic表面活性剂。有时将阴离子系表面活性剂记载为anion性表面活性剂,将阳离子系表面活性剂记载为cation性表面活性剂,且将两性离子系表面活性剂记载为甜菜碱。在本发明中,使用nonionic即非离子性表面活性剂。作为具体的非离子性表面活性剂,优选醚型的表面活性剂。作为表面活性剂,还优选具有疏水性基的单糖类或具有疏水性基的二糖类。作为具有疏水性基的单糖类或具有疏水性基的二糖类,更优选为具有葡萄糖骨架或麦芽糖骨架的化合物。作为具有葡萄糖骨架或麦芽糖骨架的化合物,能够举出由下述式(2)或下述式(3)表示的化合物。[化学式编号1]式中,r11表示可以取代的烷氧基、可以取代的烯氧基、可以取代的炔氧基、可以取代的烷硫基、可以取代的烯硫基、可以取代的炔硫基,r12、r13、r14及r15分别独立地表示氢原子或可以取代的烃基。其中,r12、r13、r14及r15中至少3个为氢原子。式中,r21表示可以取代的烷氧基、可以取代的烯氧基、可以取代的炔氧基、可以取代的烷硫基、可以取代的烯硫基、可以取代的炔硫基,r22、r23、r24、r25、r26、r27及r28分别独立地表示氢原子或可以取代的烃基。其中,r22、r23、r24、r25、r26、r27及r28中至少3个为氢原子。作为由式(2)或式(3)表示的化合物的进一步优选的例子,还能够举出由下述式(2a)或下述式(3a)表示的化合物。[化学式编号2][化学式编号3]式中,r11及r21与式(2)及式(3)中的定义的含义相同。作为由式(2a)表示的化合物,优选使用以下表面活性剂。正辛基-β-d-葡糖苷(dojindolaboratories制o001)。式(2a)中的r11为辛氧基的化合物。作为由式(3a)表示的化合物,优选使用以下表面活性剂。正十二烷基-β-d-麦芽糖苷(dojindolaboratories制d316)正癸基-β-d-麦芽糖苷(dojindolaboratories制d382)烃基、烷氧基、烯氧基、炔氧基、烷硫基、烯硫基及炔硫基分别可以被取代,作为取代基,可举出在下述取代基组a中记载的取代基。取代基组a的取代基可以进一步通过取代基组a的取代基被取代。取代基组a:被氨磺酰基、氰基、异氰基、硫氰基、异硫氰基、硝基、亚硝酰基、卤原子、羟基、氨基、巯基、酰胺基、烷氧基、芳氧基、烷硫基、芳硫基、氨甲酰基、酰基、醛基、羰基、芳基、烷基、卤原子取代的烷基、乙烯基、乙炔基、甲硅烷基以及三烷基甲硅烷基(三甲基甲硅烷基等)。作为烃基,能够举出烷基、烯基或炔基。烃基的碳原子数没有特别的限定,通常为1~20,优选为1~16,更优选为1~12。烷氧基、烯氧基、炔氧基、烷硫基、烯硫基及炔硫基的碳原子数没有特别的限定,通常为1~20,优选为1~16,更优选为1~12。(第一结合物质)在本发明中使用的第一结合物质为与血清淀粉样蛋白a具有特异性结合性的物质。作为第一结合物质,能够使用抗体,但并不限定于此。优选第一结合物质为抗体。当第一结合物质为抗体时,作为与血清淀粉样蛋白a具有特异性结合性的抗体,例如能够使用由通过血清淀粉样蛋白a免疫的动物的血清制备的抗血清、由抗血清提纯而成的免疫球蛋白级分、由使用通过血清淀粉样蛋白a免疫的动物的脾脏细胞的细胞融合而获得的单克隆抗体、或者这些的断片[例如f(ab’)2、fab、fab’或fv]等。这些抗体的制备能够以通常的方法来进行。而且,如当该抗体为嵌合抗体等时,可为进行了改性的抗体,并且也能够使用市售的抗体或通过公知的方法由动物血清或培养上清液制备的抗体。抗体能够不限于其动物种类或子类等而进行使用。例如,能够在本发明中使用的抗体为来自于小鼠、白鼠、仓鼠、山羊、兔子、羊、牛、鸡等能够引起免疫反应的生物的抗体,具体而言为小鼠igg、小鼠igm、白鼠igg、白鼠igm、仓鼠igg、仓鼠igm、兔子igg、兔子igm、山羊igg、山羊igm、羊igg、羊igm、牛igg、牛igm、鸡igy等,能够使用多克隆或单克隆中的任一种。尤其作为通过静电相互作用而与血清淀粉样蛋白a具有特异性结合性的第一结合物质,优选使用抗血清淀粉样蛋白a抗体。在本发明中,优选选择夹层方式,此时,需要将成为一对的抗体包覆于基板,能够在基板及第一粒子上使用这些抗saa单克隆抗体。(第一粒子)在本发明中使用的第一粒子为通过上述第一结合物质进行改性且具有标记的粒子。优选第一粒子为干燥粒子,但没有特别的限定。作为第一粒子,作为通常可以在免疫测定中使用的粒子例如能够使用聚苯乙烯珠等高分子粒子、玻璃珠等玻璃粒子。作为第一粒子的材质的具体例,有使用了苯乙烯、甲基丙烯酸、缩水甘油基(甲基)丙烯酸酯、丁二烯、氯乙烯、乙酸乙烯酯、甲基丙烯酸甲酯、甲基丙烯酸乙酯、甲基丙烯酸苯酯或甲基丙烯酸丁酯等单体的高分子或者使用了2个以上的单体的共聚物等合成高分子,优选使这些均匀地悬浮的胶乳。并且,可举出其他有机高分子粉末或无机物质粉末、微生物、血球或细胞膜片、脂质体等。当使用胶乳粒子时,作为胶乳的材质的具体例,可举出聚苯乙烯、苯乙烯-丙烯酸共聚物、苯乙烯-甲基丙烯酸共聚物、苯乙烯-缩水甘油基(甲基)丙烯酸酯共聚物、苯乙烯-苯乙烯磺酸盐共聚物、甲基丙烯酸聚合物、丙烯酸聚合物、丙烯腈-丁二烯-苯乙烯共聚物、氯乙烯-丙烯酸酯共聚物、聚乙酸乙烯酯丙烯酸酯等。作为胶乳,优选作为单体而至少包含苯乙烯的共聚物,尤其优选苯乙烯与丙烯酸或甲基丙烯酸的共聚物。胶乳的制作方法没有特别的限定,能够通过任意的聚合方法来制作。其中,若在标记抗体时存在表面活性剂,则抗体固定化变得困难,在胶乳的制作中,优选无乳化剂乳化聚合即不使用表面活性剂等乳化剂的乳化聚合。第一粒子具有标记。优选标记发出荧光。当通过聚合获得的胶乳本身为荧光性时,能够直接用作荧光胶乳粒子。当通过聚合获得的胶乳为非荧光性时,能够通过在胶乳中添加荧光物质(荧光色素等)来制作荧光胶乳粒子。即,荧光胶乳粒子能够通过在包含水及水溶性有机溶剂的胶乳粒子的溶液中添加荧光色素并进行搅拌来使荧光色素浸渍于胶乳粒子的内部来制造。作为具有标记的第一粒子,还能够将含有荧光色素的脂质体和微胶囊等用作荧光粒子。荧光发色只要吸收紫外光等来激发,且在返回到基底状态时被释放则没有特别的限定,例如可使用黄绿色(激发波长505nm/释放波长515nm,以下相同)、蓝色(350~356nm/415~440nm)、红色(535~580nm/575~605nm)、橙色(540nm/560nm)、红橙色(565nm/580nm)、深红色(625nm/645nm)、暗红色(660nm/680nm)等荧光发色。这些发出荧光的荧光粒子例如能够从invitrogen公司购买,在该公司以fluospheres(注册商标)的商品名出售。具有标记的第一粒子的粒径定义为平均粒径。第一粒子的平均粒径没有特别的限定优选范围根据粒子的材质和对血清淀粉样蛋白a进行定量的浓度范围、测定设备等而不同,优选为70nm以上且500nm以下,更优选为70nm以上且300nm以下,进一步优选为80nm以上且250nm以下,尤其优选为90nm以上且200nm以下。在本发明中使用的粒子的平均粒径能够以市售的粒度分布仪等进行测量。作为粒度分布的测定法,已知光学显微镜法、共聚焦激光显微镜法、电子显微镜法、原子力显微镜法、静态光散射法、激光衍射法、动态光散射法、离心沉淀法、电脉冲测量法、色谱法、超声波衰减法等,且出售与各个原理对应的装置,在这些测定法中,优选以动态光散射法进行测量,在本发明中,平均粒径作为以25℃中粘度0.8872cp(0.8872mpa·s)、水折射率1.330的条件测定的中值粒径(50%径、d50)来求出。在本发明中使用的第一粒子通过上述的第一结合物质进行改性。用于使第一结合物质与具有标记的第一粒子结合的方法没有特别的限定。例如记载于日本特开2000-206115号公报或molecularprobes公司的fluospheres(注册商标)聚苯乙烯微球粒f8813中附加的操作说明等,能够使用任一种制备免疫凝集反应用试剂的公知的方法。并且,作为将抗体等结合物质在粒子上固定化的方法,还能够采用利用了物理吸附的方法、及利用了基于共价键的化学键的方法中的任一种方法。作为在使抗体等结合物质固定于粒子后覆盖未被结合物质包覆的粒子表面的粘连剂,能够使用公知的物质,例如bsa(牛血清白蛋白)或脱酯乳、酪朊、来自大豆的成分、来自鱼的成分或聚乙二醇等、以及包含这些的物质或包含性质与这些相同的物质的市售的免疫反应用封闭剂等。这些封闭剂也能够根据需要通过热或酸/碱等来实施部分改性等前处理。(第二结合物质)本发明的试剂盒还可以包含用与血清淀粉样蛋白a不具有特异性结合性的第二结合物质进行了改性,且不具有标记的第二粒子。存在不仅对于包含血清淀粉样蛋白a的成为阳性的被检试样,对于不包含血清淀粉样蛋白a的阴性的被检试样也进行反应而成为阳性的被检试样,解决假阳性被视作课题。显示这种假阳性的原因尚不明确,但认为在血清中所含的某种因子的存在引起非特异反应有可能是原因之一。在本发明中,优选通过同时使用以与血清淀粉样蛋白a不具有特异性结合性的第二结合物质进行改性且不具有标记的第二粒子来解决这种问题。作为第二结合物质,能够使用与血清淀粉样蛋白a不具有特异性结合性的物质,优选使用有可能与如上述表示假阳性的原因物质结合的物质,进一步优选使用相对于第一结合物质不具有亲和性的化合物。作为第二结合物质,能够使用抗体或相对于抗体进行结合的蛋白质(proteina、proteing)等,优选抗体。例如,当第二结合物质为抗体时,例如能够使用由通过该抗原免疫的动物的血清制备的抗血清、由抗血清提纯而成的免疫球蛋白级分、由使用通过血清淀粉样蛋白a免疫的动物的脾脏细胞的细胞融合而获得的单克隆抗体、或者这些的断片[例如f(ab’)2、fab、fab’或fv]等。这些抗体的制备能够以通常的方法来进行。而且,如当该抗体为嵌合抗体等时,可为进行了改性的抗体,并且也能够使用市售的抗体或通过公知的方法由动物血清或培养上清液制备的抗体。在本发明中,作为第二结合物质,尤其优选使用抗crp抗体的方式。(第二粒子)第二粒子不具有标记。并且优选第二粒子为干燥粒子,但没有特别的限定。作为第二粒子,作为通常可以在免疫测定中使用粒子例如能够使用聚苯乙烯珠等高分子粒子、玻璃珠等玻璃粒子。作为第二粒子的材质的具体例,有使用了苯乙烯、甲基丙烯酸、缩水甘油基(甲基)丙烯酸酯、丁二烯、氯乙烯、乙酸乙烯酯丙烯酸酯、甲基丙烯酸甲酯、甲基丙烯酸乙酯、甲基丙烯酸苯酯或甲基丙烯酸丁酯等单体的高分子或者使用了2个以上的单体的共聚物等合成高分子,优选使这些均匀地悬浮的胶乳。并且,可举出其他有机高分子粉末或无机物质粉末、微生物、血球或细胞膜片、脂质体等。当使用胶乳粒子时,作为胶乳的材质的具体例,可举出聚苯乙烯、苯乙烯-丙烯酸共聚物、苯乙烯-甲基丙烯酸共聚物、苯乙烯-缩水甘油基(甲基)丙烯酸酯共聚物、苯乙烯-苯乙烯磺酸盐共聚物、甲基丙烯酸聚合物、丙烯酸聚合物、丙烯腈-丁二烯-苯乙烯共聚物、氯乙烯-丙烯酸酯共聚物、聚乙酸乙烯酯丙烯酸酯等。作为胶乳,优选作为单体而至少包含苯乙烯的共聚物,尤其优选苯乙烯与丙烯酸或甲基丙烯酸的共聚物。胶乳的制作方法没有特别的限定,能够通过任意的聚合方法来制作。其中,若在标记抗体时存在表面活性剂,则抗体固定化变得困难,在胶乳的制作中,优选无乳化剂乳化聚合即不使用表面活性剂等乳化剂的乳化聚合。以第二结合物质结合的第二粒子的粒径定义为平均粒径。第二粒子的平均粒径根据粒子的材质和对血清淀粉样蛋白a进行定量的浓度范围、测定设备等而不同,优选为70nm以上且500nm以下,更优选为100nm以上且200nm以下,进一步优选为120nm以上且180nm以下,尤其优选为130nm以上且170nm以下。关于第一粒子与第二粒子的使用比率,优选相对于第一粒子的第二粒子的质量比为1~10,更优选为1~6,进一步优选为2~6。[测定试剂盒]本发明的测定试剂盒包括:上述本发明的试剂盒;以及形成有第一金属膜的基板,在该第一金属膜上固定有与血清淀粉样蛋白a或上述第一结合物质具有特异性结合性的第三结合物质(即与血清淀粉样蛋白a具有特异性结合性的第三结合物质或与上述第一结合物质具有特异性结合性的第三结合物质)。在上述基板上还可以形成有第二金属膜,在该第二金属膜上固定有与血清淀粉样蛋白a不具有结合性而与第一结合物质具有特异性结合性的第四结合物质。(第三结合物质)第三结合物质只要是与血清淀粉样蛋白a或第一结合物质具有特异性结合性的物质则没有特别的限定,作为优选的例子,可举出抗原、抗体或它们的复合体,更优选使用抗体。当第三结合物质为抗体时,作为相对于血清淀粉样蛋白a具有特异性的抗体,例如能够使用由通过血清淀粉样蛋白a的动物的血清制备的抗血清、由抗血清提纯而成的免疫球蛋白级分、由使用通过血清淀粉样蛋白a免疫的动物的脾脏细胞的细胞融合而获得的单克隆抗体、或者这些的断片[例如f(ab’)2、fab、fab’或fv]等。这些抗体的制备能够以通常的方法来进行。而且,如当该抗体为嵌合抗体等时,可为进行了改性的抗体,并且也能够使用市售的抗体或通过公知的方法由动物血清或培养上清液制备的抗体。抗体能够不限于其动物种类或子类等而进行使用。例如,能够在本发明中使用的抗体为来自于小鼠、白鼠、仓鼠、山羊、兔子、羊、牛、鸡等能够引起免疫反应的生物的抗体,具体而言为小鼠igg、小鼠igm、白鼠igg、白鼠igm、仓鼠igg、仓鼠igm、兔子igg、兔子igm、山羊igg、山羊igm、羊igg、羊igm、牛igg、牛igm、鸡igy等,能够使用多克隆或单克隆中的任一种。断片化抗体为具有至少1个抗原结合位置,且由完全型抗体导出的分子,具体而言为fab、f(ab’)2等。这些断片化抗体为通过酵素或化学处理、或使用遗传工序学方法获得的分子。作为与第一结合物质具有特异性结合性的第三结合物质没有特别的限定,但作为优选的例子可举出抗原、抗体或它们的复合体。抗体的制备方法及抗体的种类与上述的内容相同。(第四结合物质)第四结合物质为与血清淀粉样蛋白a不具有结合性,而与第一结合物质具有特异性结合性的物质。作为第四结合物质,例如优选使用相对于第一结合物质(抗体)结合的抗体、相对于结合物质(抗体)结合的蛋白质(proteina、proteing)等相对于第一结合物质具有亲和性的化合物,其中能够进一步优选地使用抗体。抗体的制备方法及抗体的种类与关于第三结合物质记载的内容相同。并且,与具有标记的第一粒子结合的第一结合物质的一部分能够优选地使用与第四结合物质成为配体-非配体关系的化合物。(将结合物质在基板上固定化的方法)将抗体等第三结合物质及第四结合物质在基板上固定化的方法例如记载于nunc公司所提供的technotesvol.2-12等中,能够使用制备通常的elisa(酶联免疫吸附法)试剂的公知的任一种方法。并且,可以通过在基板上配置自组装单分子膜(sam)等来实施表面改性,作为将作为结合物质的抗体在基板上固定化的方法,能够采用利用了物理吸附的方法及利用了基于共价键的化学键的方法中的任一种方法。作为使抗体固定于基板后覆盖抗体未被包覆的基板表面的封闭剂,能够使用公知的物质,例如bsa(牛血清白蛋白)或脱酯乳、酪朊、来自大豆的成分、来自鱼的成分或聚乙二醇等、以及包含这些的物质或包含性质与这些相同的物质的市售的免疫反应用封闭剂等。这些封闭剂也能够根据需要通过热或酸/碱等来实施部分改性等前处理。(基板)在本发明中使用的基板为形成有金属膜的基板,其形态没有特别的限定,当进行基于后述的表面等离子体激元激发的荧光检测法(spf法)时,优选使用后述的流路及在表面上具有作为反应部位的金属膜的基板。作为构成金属膜的金属,能够使用如可产生表面等离子体激元共振的物质。优选地可举出金、银、铜、铝、白金等金属,尤其优选金。上述金属能够单独或组合使用。并且,考虑到上述基板上的附着性,也可以在由基板和金属构成的层之间设置由铬等构成的介在层。金属膜的膜厚没有特别的限定,例如优选为0.1nm以上且500nm以下,进一步优选为1nm以上且200nm以下,尤其优选为1nm以上且100nm以下。若超过500nm,则无法充分检测媒介物的表面等离子体激元现象。并且,当设置由铬等构成的介在层时,该介在层的厚度优选为0.1nm以上且10nm以下。金属膜的形成只要通过普通的方法进行即可,例如能够通过溅射法、磁控溅射法、蒸镀法、离子镀法、电镀法、非电解电镀法等来进行,为了实现金属膜在基板上的良好的附着性,优选通过溅射法来形成金属膜。金属膜优选配置于基板上。在此,“配置于基板上”是指除了金属膜在基板上以直接接触的方式配置的情况以外,还包含金属膜不与基板直接接触而是经由其他层配置的情况。作为能够在本发明中使用的基板,例如能够使用作为普通的光学玻璃的一种的bk7(硼硅酸盐玻璃)等光学玻璃、或合成树脂具体而言为聚甲基丙烯酸甲酯、聚对苯二甲酸乙二酯、聚碳酸酯、由环烯烃聚合物等相对于激光为透明的材料构成的材质。期望这种基板的材质优选相对于偏光不显示各向异性且加工性优异的材料。作为用于基于spf法的荧光检测的基板的一例,能够举出在聚甲基丙烯酸甲酯上将金膜以溅射法制作的基板等。[血清淀粉样蛋白a的测定方法]基于本发明的生物样品中的血清淀粉样蛋白a的测定方法包括以下工序:制备混合液的工序:该混合液包含:含有血清淀粉样蛋白a的生物样品;用与血清淀粉样蛋白a具有特异性结合性的第一结合物质进行了改性且具有标记的第一粒子;以(无机性值/有机性值)×10定义的hlb值为17~20且分子量为1000以下的至少一种非离子性表面活性剂;及生理盐水;向形成有第一金属膜的基板的一端的注入口添加上述混合液的工序,该第一金属膜固定有与血清淀粉样蛋白a具有特异性结合性的第三结合物质;使所述混合液流到所述基板上的工序;以及获取所述第一金属膜上的标记的信息的工序。作为生物样品,只要是有可能包含作为被检物质的血清淀粉样蛋白a的试样则没有特别的限定,例如能够举出生物学样品尤其是动物(尤其是猫、狗或人)的体液(例如血液、血清、血浆、脑脊液、泪液、汗、尿、脓、鼻涕或痰)或排泄物(例如粪便)、脏器、组织、粘膜、皮肤等。非离子性表面活性剂在包含saa的生物样品的前处理中使用。作为预处理液,可采用事先准备包含表面活性剂的溶液并混合到被检体液中来使用的使用方法、或在生物样品液中直接添加已干燥的固体成分的表面活性剂来熔于被检体液中的使用方法。此时,作为混合了生物样品液和表面活性剂的混合液中的表面活性剂的浓度,优选为0.01质量%以上且10质量%以下,更优选为0.05质量%以上且5质量%以下,进一步优选为0.1质量%以上且3质量%以下,尤其优选为0.1质量%以上且2质量%以下。若浓度为0.01质量%以上则能够将saa有效地从hdl分离,若浓度为10质量%以下,则saa能够在不易受到表面活性剂的影响的状态下,与具有标记的第一粒子上的第一结合物质或在基板上的第一金属膜上固定的第三结合物质发生反应。上述混合液中还可以包含用与血清淀粉样蛋白a不具有特异性结合性的第二结合物质进行了改性的第二粒子。并且,基于本发明的血清淀粉样蛋白a的测定方法还可以包含以下工序:使上述混合液和固定有与血清淀粉样蛋白a不具有结合性而相对于上述第一结合物质具有结合性的第四结合物质的第二金属膜接触的工序;从上述第二金属膜中检测与上述标记相对应的信号的工序;以及使用从上述第二金属膜中检测到的信号来校正从上述第一金属膜中检测到的信号的工序。作为上述生物样品与表面活性剂的混合液,能够使用稀释了生物样品的状态的混合液。作为在稀释中使用的溶液,只要能够显示出本发明的效果则没有特别的限定,但优选使用接近于生物样品的组成的生理盐水。作为相对于用生理盐水进行稀释的生物样品的倍率能够以任意倍率进行稀释,但在对大量被检试样进行测定时,存在与作为使用测定值与对照试剂盒的测定的对照法的测定值的背离,为了能够将该背离抑制为较小,优选以稀释为5倍以上的状态对血清淀粉样蛋白a进行测定。通过生物样品的稀释,更高的相关性成为可能,但若稀释生物样品的倍率变得非常高,则相对于血清淀粉样蛋白a浓度的信号本身也下降,为了减少相对于此的信号相对于血清淀粉样蛋白a浓度的增加,优选稀释倍率抑制在200倍以下。(测定方法)本发明的测定方法可以理解为包括血清淀粉样蛋白a的存在与否的检测及血清淀粉样蛋白a的量的测定(即定量)等的最广泛范围的概念。作为本发明的测定方法的具体的实施方式可举出夹层法或竞争法,优选夹层法。<夹层法>夹层法没有特别的限定,例如能够按照以下顺序来测定血清淀粉样蛋白a。首先,预先准备与血清淀粉样蛋白a具有特异性结合性的第一结合物质及与血清淀粉样蛋白a具有特异性结合性的第三结合物质。使第一结合物质与具有标记的第一粒子结合,制作用与血清淀粉样蛋白a具有特异性结合性的第一结合物质进行了改性的第一粒子。接着,准备第三结合物质,并固定于基板上来作为反应部位(试验区)。并且,准备第四结合物质,并固定在基板上来作为控制区。另外,准备与血清淀粉样蛋白a不具有特异性结合性的第二结合物质使其与不具有标记的第二粒子结合,制作用与血清淀粉样蛋白a不具有特异性结合性的第二结合物质进行了改性的不具有标记的第二粒子。将上述第一粒子与第二粒子混合容纳于容器中并使其干燥。将有可能包含血清淀粉样蛋白a的被检试样(或其提取液)、第一粒子与第二粒子的混合物、以及表面活性剂进行混合,将该混合溶液适用于基板,使其在基板上的流路上展开并与反应部位接触。当在被检试样中存在血清淀粉样蛋白a时,在反应部位,在血清淀粉样蛋白a与和第一粒子结合的第一结合物质之间、及血清淀粉样蛋白a与反应部位上的第三结合物质之间引起反应(当使用抗原及抗体时为抗原抗体反应),与血清淀粉样蛋白a的量相对应的第一粒子固定于反应部位上。在夹层法中,固定于反应部位上的第三结合物质与血清淀粉样蛋白a的反应、及血清淀粉样蛋白a与和第一粒子结合的第一结合物质的反应结束后,也能够以去除在基板上的试验区及控制区未结合的第一粒子为目的进行清洗。接着通过检测来自于与反应部位结合的第一粒子的信号强度,能够测定准确的血清淀粉样蛋白a的浓度。另外,荧光强度与血清淀粉样蛋白a的浓度具有正向相关关系。<竞争法>竞争法没有特别的限定,例如能够按照以下顺序来测定血清淀粉样蛋白a。在该
技术领域:
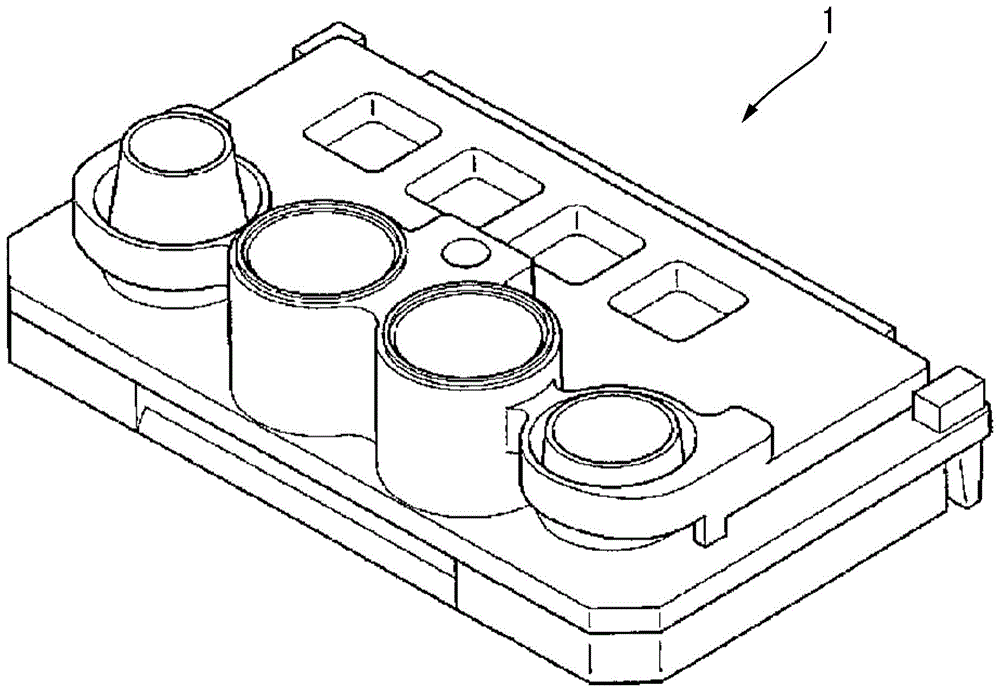
,竞争法作为检测以夹层法无法进行化验的低分子化合物的抗原的方法而被熟知。首先,预先制备与血清淀粉样蛋白a具有特异性结合性的第一结合物质、及与血清淀粉样蛋白a不具有特异性结合性的第二结合物质。接着使第一结合物质与第一粒子结合,并使第二结合物质与第二粒子结合。并且,将相对于第一结合物质具有结合性的血清淀粉样蛋白a其本身、或具有与血清淀粉样蛋白a类似的部位的与血清淀粉样蛋白a同样地相对于第一结合物质具有表位的化合物固定于基板上来作为反应部位。接着,将第一粒子与第二粒子混合容纳于容器中并使其干燥。将有可能包含血清淀粉样蛋白a的被检试样(或其提取液)、第一粒子与第二粒子的混合物、以及表面活性剂进行混合,使其在基板上的流路上展开并与反应部位接触。当在被检试样中不存在血清淀粉样蛋白a时,通过与第一粒子结合的第一结合物质、相对于在反应部位上固定的第一结合物质具有结合性的血清淀粉样蛋白a其本身、或与血清淀粉样蛋白a同样地相对于第一结合物质抗体具有表位的类似化合物,在基板上引起反应。另一方面,当存在血清淀粉样蛋白a时,第一结合物质与血清淀粉样蛋白a结合,因此相对于第一结合物质具有结合性的血清淀粉样蛋白a本身、或具有与血清淀粉样蛋白a类似的部位的与血清淀粉样蛋白a同样地相对于第一结合物质抗体具有表位的化合物在反应部位上的反应受到阻碍,具有标记的第一粒子在反应部位上的固定受到阻碍。在竞争法中,预先准备多个血清淀粉样蛋白a的浓度不同的血清淀粉样蛋白a的量已知的试样,使该试样及结合物质标记荧光粒子在反应部位上接触的同时,在不同的时刻测定来自于反应部位的荧光信号。根据该多个测定结果,求出在各血清淀粉样蛋白a浓度中荧光量的时间变化(斜率)。将该时间变化设为y轴、将血清淀粉样蛋白a浓度作为x轴来制图,使用最小二乘法等正合适的拟合方法,获取相对于荧光量的时间变化的血清淀粉样蛋白a的浓度的校准曲线。根据如此获得的校准曲线,由使用了目标被检试样的荧光量的时间变化的结果能够对被检试样中所包含的血清淀粉样蛋白a的量进行定量。(流路)在本发明的优选方式中,将有可能包含血清淀粉样蛋白a的被检试样(或其提取液)、具有标记的第一粒子、及表面活性剂进一步根据要求与第二粒子进行混合来制备混合物。能够将该混合物使用于基板上并沿流路展开。作为流路,只要是被检试样与具有标记的第一粒子(及根据要求为第二粒子)流到反应部位的通路则没有特别的限定。作为优选的流路形态,具有以下结构:越过将包含具有标记的第一粒子(及根据要求为第二粒子)的被检试样液进行滴附的滴附口、作为第三结合物质固定化的反应部位的金属薄膜、及金属薄膜而存在流路,且被检试样能够通过金属薄膜之上。优选能够相对于金属薄膜在与滴附口相反的一侧设置吸引口。(检测与标记相对应的信号的方法)在本发明中检测与标记相对应的信号。如上述优选标记发出荧光,此时能够通过检测荧光来检测与标记相对应的信号。作为荧光的检测方法,例如优选使用能够检测荧光强度的设备来检测荧光强度,上述设备具体而言为酶标仪、或用于进行基于表面等离子体激元激发的荧光检测法(spf法)的生物传感器等。荧光强度的检测通常在抗原抗体反应后的规定时间例如几分钟~几小时后结束。通过将免疫复合体的形成程度作为荧光强度来进行检测,能够根据荧光强度与血清淀粉样蛋白a的浓度的关系来对血清淀粉样蛋白a的浓度进行定量。另外,荧光测定方式可为酶标仪测定,也可为流量测定。另外,spf法能够比基于落射激发的荧光检测法(落射荧光法)更高灵敏度地进行测定。作为表面等离子体激元荧光(spf)生物传感器,例如能够使用如在日本特开2008-249361号公报中记载的具备以下部件的传感器:光导波,由使规定波长的激发光透过的材料形成;金属膜,形成于该光导波的一个表面;光源,产生光束;光学系统,使上述光束通过光导波,并相对于上述光导波和金属膜的界面以产生表面等离子体激元的入射角入射;以及荧光检测机构,检测通过衰逝波而被激发而产生的荧光,上述衰逝波为通过上述表面等离子体激元被增强的衰逝波。(血清淀粉样蛋白a的量的测定方法)作为本发明中的spf法中的血清淀粉样蛋白a的定量方法的一例,能够通过以下方法对血清淀粉样蛋白a进行定量。具体而言,准备包含已知各浓度的血清淀粉样蛋白a的试样,在检测流到检测荧光的部位的同时在不同的多个时刻测定来自荧光检测部位的荧光信号。根据该多个测定结果,求出各血清淀粉样蛋白a浓度中荧光量的时间变化(斜率)。将该时间变化设为y轴、将血清淀粉样蛋白a浓度作为x轴来制图,使用最小二乘法等正合适的拟合方法,获取相对于荧光量的时间变化的血清淀粉样蛋白a浓度的校准曲线。作为光信号系统,能够根据对应每一血清淀粉样蛋白a的校准曲线来指定目标被检试样的血清淀粉样蛋白a量。基于本发明中的表面等离子体激元激发的荧光检测(spf)系统是对来自于依赖于在基板上的金属薄膜上固定化的血清淀粉样蛋白a的量的荧光物质的荧光进行检测的化验方法,是通过溶液中的反应的进行,将光学性的透明度的变化例如作为浊度进行检测的方法,与所谓的胶乳凝集法不同。在胶乳凝集法中,胶乳试剂中的抗体敏化胶乳与被检体中的抗原通过抗体反应而结合并凝集。该凝集块随着时间而增大,根据向该凝集块照射近红外光而获得的每单位时间的吸光度变化来对抗原浓度进行定量化的方式为胶乳凝集法。在本发明中,与胶乳凝集法相比,能够提供非常简单的血清淀粉样蛋白a的检测方法。以下,举出本发明的实施例对本发明进行进一步具体的说明。另外,以下实施例所示的材料、使用量、比例、处理内容、处理顺序等只要不脱离本发明的主旨则能够适当进行变更。因此,本发明的范围并不限定性解释为以下所示的具体例。在以下化学式中et表示乙基。实施例使用了以下表面活性剂。d316:正十二烷基-β-d-麦芽糖苷(dojindolaboratories制)、在下述式(a)中r为十二烷氧基的化合物d382:正癸基-β-d-麦芽糖苷(dojindolaboratories制)、在下述式(a)中r为癸基氧基的化合物[化学式编号4]o393:正辛基-β-d-麦芽糖苷(dojindolaboratories制)[化学式编号5]月桂醇聚醚10:poe(10)月桂基醚(nihonemulsionco.,ltd.制emalex(注册商标)710)月桂醇聚醚20:poe(20)月桂基醚(nihonemulsionco.,ltd.制emalex(注册商标)720)月桂醇聚醚30:poe(30)月桂基醚(nihonemulsionco.,ltd.制emalex(注册商标)730)月桂酸聚甘油酯-5:甘油5-12烷基酯(taiyokagakuco.,ltd.制sunsofta-12e-c)肉豆蔻酸聚甘油酯-5:甘油5-14烷基酯(taiyokagakuco.,ltd.制sunsofta-14e-c)辛酸聚甘油酯-6:甘油6-8烷基酯(taiyokagakuco.,ltd.制sunsoftq-81f-c)<实施例1>(1)平均粒径150nm胶乳粒子的制造使苯乙烯(fujifilmwakopurechemicalcorporation制)30g(288mmol)和丙烯酸(fujifilmwakopurechemicalcorporation制)3g(42mmol)悬浮于超纯水440ml,升温至95℃,添加将过硫酸钾(kps)(fujifilmwakopurechemicalcorporation制)1g溶解于超纯水10ml的水溶液,以95℃、250rpm搅拌了6小时。之后,以10,000rpm、6小时离心分离进行了3次,获得了胶乳粒子。最后,使所获得的胶乳粒子再次分散于超纯水中。以固体成分浓度成为1质量%的方式添加纯水来制备了稀释液。作为使用粒径分析仪fpar-1000(otsukaelectronicsco.,ltd.制)在温度25℃下测定的中位粒径(d=50)来求出时,胶乳粒子的平均粒径为150nm。(2)荧光胶乳粒子的制作在如上述制作的平均粒径150nm的胶乳粒子的固体成分浓度2质量%的水分散液100ml中添加甲醇100ml,在室温下搅拌了10分钟。另一方面,花费60分钟将溶解于另外准备的n,n-二甲基甲酰胺(dmf)1ml、chcl39ml及乙醇16ml中的荧光色素(nk136、hayashibaraco.,ltd.制)12mg缓慢滴加到胶乳溶液中。滴加完成后,以蒸发器将有机溶剂减压蒸馏后,重复3次离心分离与磷酸缓冲生理盐水(pbs)水溶液中的再次分散来进行纯化,由此制备了荧光胶乳粒子。(3)单克隆抗体的制作抗saa单克隆抗体(anti-saa)及抗crp(c反应性蛋白质)单克隆抗体(mm50175)使用小鼠腹水法如下进行了制作。使用从hytestltd购买的saa,在对小鼠进行免疫后提取脾脏细胞,与骨髓瘤(产品名p3-x63-ag8-u1、cosmobioco.,ltd.制)进行混合,并通过聚乙二醇(peg)法实施了细胞融合。作为使用细胞,使用了在最终免疫起3日后采集的脾脏细胞。细胞比设为脾脏细胞:骨髓瘤=10:1。关于细胞接种,作为脾脏细胞以0.5~1.0×105细胞/孔接种了96孔板。所使用的培养基适当使用了rpmi-1640(roswellparkmemorialinstitutemedium,罗斯威尔帕克纪念研究所培养基)、10%fbs(胎牛血清:fetalbovineserum)及hat(次黄嘌呤·氨基喋呤·胸苷混合培养基、hypoxanthine-aminopterin-thymidinemedium)。将最终繁殖的融合细胞(杂交瘤)注射到小鼠腹腔内,经过规定时间后提取腹水,并进行离心分离、纯化工序,将由此获得的物质作为抗saa单克隆抗体(anti-saa)来采集。并且,以与抗saa单克隆抗体的制作相同的方式使用由大肠杆菌的培养液纯化的crp(orientalyeastco.,ltd.制)制作了抗crp单克隆抗体(mm50175)。(4)以抗saa抗体进行改性的荧光胶乳粒子的制备如下制备了以抗saa抗体进行改性的荧光粒子。在2质量%(固体成分浓度)荧光胶乳粒子水溶液(平均粒径150nm)275μl中添加50mmol/l的mes(2-(n-吗啉代)乙二酸)缓冲(ph6.6)溶液88μl,并添加5mg/ml的抗saa单克隆抗体(anti-saa)176μl后,在室温下搅拌了15分钟。之后,添加10mg/ml的edc(1-乙基-3-(3-二甲基氨基苯基)碳二亚胺盐酸盐、fujifilmwakopurechemicalcorporation社制)水溶液5μl,并在室温下搅拌了2小时。将2mol/l的glycine(fujifilmwakopurechemicalcorporation制)水溶液添加8.8μl并搅拌15分钟后,进行离心分离(15,000rpm、4℃、15分钟),使荧光胶乳粒子沉淀。之后,取除上清液,将pbs溶液(ph7.4)添加500μl,通过超声波清洗机使荧光胶乳粒子再分散。再次进行离心分离(15,000rpm、4℃、15分钟)来去除上清液后,添加包含1质量%bsa的pbs(ph7.4)溶液500μl,并使荧光胶乳粒子再次分散,由此制备了抗saa抗体结合荧光胶乳粒子的1质量%溶液。(5)以未进行荧光标记的抗crp抗体进行改性的胶乳粒子的制作在2质量%(固体成分浓度)胶乳粒子水溶液(平均粒径150nm)300μl中添加250mmol/l的mes缓冲(ph5.6)溶液96μl及超纯水25ml,并进一步添加了5mg/ml的抗crp单克隆抗体(mm50175)182μl。将所获得的混合物在室温下搅拌了15分钟。之后,添加10mg/ml的edc(n-乙基-n’-(3-二甲基氨基丙基)碳二亚胺)水溶液9.6μl,并将所获得的混合物在室温下搅拌了2小时。将2mol/l的甘氨酸(fujifilmwakopurechemicalcorporation制)水溶液添加30μl并将所获得的混合物搅拌30分钟后,进行离心分离(15,000rpm、4℃、15分钟),使胶乳粒子沉淀。取除上清液,在沉淀物中将pbs溶液(ph7.4)添加600μl,通过超声波清洗机使胶乳粒子再分散。再次进行离心分离(15,000rpm、4℃、15分钟)来去除上清液后,向沉淀物中添加包含1质量%bsa的pbs(ph7.4)溶液600μl,并使胶乳粒子再次分散。如此制备了抗crp抗体结合胶乳粒子的1质量%溶液。(6)干燥粒子的制作将超纯水240μl、20质量%的蔗糖水溶液417μl、20质量%的bsa水溶液229μl、包含在(4)中制备的以抗saa抗体进行改性的荧光胶乳粒子(平均粒径150nm)1质量%的分散液125μl、及包含在(5)中制备的以未进行荧光标记的抗crp抗体进行改性的胶乳粒子(平均粒径150nm)1质量%的分散液550μl进行了混合。准备将聚丙烯(primepolymerco.,ltd.制、primepolypro随机pp级)作为基体的杯,向杯内滴附了上述混合液32μl。之后,使用superdry干燥机(toyolivingco.,ltd.制,ultrasuperdry00系列),花费12小时干燥至含水量成为25%以下,之后在25℃50%rh(相对湿度)的环境下保存15天,由此制作了在实施例1中使用的干燥粒子。(7)基板的制作在将聚甲基丙烯酸甲酯(pmma、mitsubishichemicalcorporation制、acrypetvh-001)作为基体的基板的一个面上,以试验区及控制区均成为宽度4mm、厚度36nm的方式,将在试验区使用的金膜及与其相邻地在控制区使用的金膜通过磁控溅射法进行了制作。将该基板以成为宽度5mm的方式进行裁剪来制作了基板。在该基板的试验区的金膜上滴附包含抗saa单克隆抗体的溶液(浓度:在150mmol氯化钠中为10μg/ml),并在25℃中孵化1小时,使其物理吸附来进行了固定化。(8)基板的清洗及封闭在将如此制备的基板安装于传感器芯片的流路之前,将包含预先制备的清洗用溶液(0.05质量%tween(注册商标)20(聚氧乙烯(20)脱水山梨醇单月桂酸酯、fujifilmwakopurechemicalcorporation制)的pbs溶液(ph7.4)使用300μl反复清洗了3次。清洗结束后,为了进行金薄膜上的抗体的未吸附部分的封闭,将包含1质量%酪朊(thermoscientific公司制)的pbs溶液(ph7.4)添加300μl,并在室温下放置了1小时。在以上述清洗用溶液进行清洗后,作为稳定化剂添加了immunoassaystabilizer(abi公司制)300μl,在室温下放置30分钟,去除溶液并使用干燥机将水分完全去除。(9)传感器芯片的制作以成为日本特开2010-190880号公报的第2实施方式的结构的方式将已制作的基板密封于流路,制作了流路型传感器芯片。将其示意图示于图1及图2。图1为传感器芯片1的示意图,图2为传感器芯片1的分解图。传感器芯片1由上部部件2、中间部件3及基板4构成。在上部部件2中,设置有第一容器5及第二容器6。另外,将第一容器5及第二容器6的组合称作容器组7。在基板4形成有流路10,在流路10上形成有检测区域8及参照区域9。(10)被检试样的准备作为猫的血清,使用从kitayamalabesco.,ltd.购买的杂交品种的血清,准备了作为被检物质的血清淀粉样蛋白a的浓度不同的被检试样(被检体)no.1及no.2。(11)使用了荧光粒子的saa的免疫测定将在(10)中准备的被检试样(猫的血清)10μl与作为非离子性表面活性剂的d316(dojindolaboratories制)的0.33质量%的生理盐水溶液90μl充分地进行混合,从而制作了被检试样的混合液1。该混合液的表面活性剂d316的浓度为0.30质量%。接着,在滴附了(4)中制备的抗saa抗体标记荧光粒子并使其干燥的杯中添加已制作的混合液1,充分搅拌了10分钟。接着,向密封有在上述中制作的基板的流路型传感器芯片的注入口滴附与荧光粒子混合的混合液1。滴附后,一边进行泵吸引一边使混合液1以10μl/min的速度在流路流动,并连续对固定有saa抗体的金膜面上的荧光强度测定了1.5分钟。对被检试样no.1、2分别求出了在各基板中获得的荧光强度的单位时间内的荧光信号值的增加速度。<实施例2>在实施例1中,作为表面活性剂,代替d316而变更为d382,除此以外与实施例1相同地进行,对于被检试样no.1及no.2分别求出了荧光信号值的增加速度。<比较例1~7>将表面活性剂从实施例1的表面活性剂变更为表1中所记载的表面活性剂,除此以外与实施例1相同地进行,对于被检试样no.1及no.2分别求出了荧光信号值的增加速度。(12)基于对照试剂盒的测定在免疫测定中,使用被从业者使用的elisa试剂盒(phasesaaassay(cat.no.tp-802):tridelta公司制对照试剂盒),根据操作说明书对被检试样中的血清淀粉样蛋白a进行测定且对被检试样no.1及no.2的saa浓度进行了测定。被检试样no.1及no.2的saa浓度为20.0μg/ml与80.1μg/ml。相对于基于对照试剂盒的saa浓度,将在实施例及比较例中测定的荧光信号值的增加速度进行了制图。将结果示于图3,将评价示于表1。评价基准如下。评价标准a:相对于saa浓度的信号的增加非常充分地相关,saa浓度的测定可获得非常高的精度。b:可获与相对于saa浓度的信号的增加的相关性,能够实用性地测定saa浓度。c:与相对于saa浓度的信号的增加幅度具有相关性,但测定saa浓度的实用性不充分。d:无法获得与相对于saa浓度的信号增加的相关性。[表1]根据表1的结果可以确认,通过使用hlb值为17~20且分子量为1000以下的非离子性表面活性剂,显示出本发明的效果。<实施例3>(13)干燥粒子的制作在实施例1中包含(6)干燥粒子的制作已结束的干燥粒子的杯中,为了将在实施例1的(11)中的被检试样的混合液的制作中使用的d316预先添加到干燥粒子中,而添加2.7重量百分比浓度的d316水溶液10μl并充分地进行混合,之后,使用superdry干燥机(toyolivingco.,ltd.制,ultrasuperdry00系列)花费12小时来干燥至含水量成为25%以下,接着在25℃且50%rh(相对湿度)的环境下保存15天,由此制作了包含表面活性剂d316的干燥粒子。(14)使用了荧光粒子的saa粒子的免疫测定代替在上述(10)中准备的被检试样(猫的血清)10μl与在上述(11)中使用的d316的0.33质量%的生理盐水溶液90μl,充分混合去除了d316的生理盐水90μl,除此以外以与实施例2相同的方式制备了被检试样的混合液10。接着,在滴附了(13)中制备的抗saa抗体标记荧光粒子并使其干燥的杯中添加已制作的混合液10,充分搅拌了10分钟。该混合液10中所包含的表面活性剂d316的浓度为0.27质量%。接着,以与实施例1相同的方式,向流路型传感器芯片的注入口滴附包含荧光粒子的混合液10,相对于被检试样no.1、2分别求出了荧光强度在单位时间内的荧光信号值的增加速度。以与实施例1相同的评价基准求出荧光信号值的增加速度,并将结果示于表2。<实施例4~6>使用在实施例3的(13)中制备的干燥粒子,在(14)中记载的混合液10的制备中,以不进行基于生理盐水的稀释(倍率1倍;实施例4)、基于生理盐水的稀释成为5倍(实施例5)、基于生理盐水的稀释成为100倍(实施例6)的方式适当改变被检试样(猫的血清)与生理盐水的混合比来制备被检试样的混合液11~13,以与实施例3相同的方式向流路型传感器芯片的注入口进行滴附,并求出荧光强度在单位时间内的荧光信号值的增加速度,将结果示于表2。(15)校准曲线的制作接着,使用从kitayamalabesco.,ltd.购买的杂交品种的血清,准备了被检物质的浓度不同的被检试样(被检体)no.3~7。进行基于在实施例1的(12)中记载的对照试剂盒的测定来测定saa浓度时,分别为2.9μg/ml、5.5μg/ml、60.8μg/ml、111.0μg/ml、159.1μg/ml。使用该被检试样(被检体)no.3~7,利用与在实施例1中使用的流路型传感器芯片来分别测定被检试样(被检体)no.3~7的信号,并分别制作了相对于实施例3~实施例6的校准曲线。(16)多被检体相关的测定关于在动物病院中进行采血的各种猫血清500被检体,与实施例3同样地制备作为被检试样的被检体的混合液并分别测定信号,根据在(15)中制作的校准曲线分别计算saa浓度,对与通过在(12)中记载的对照试剂盒测定的已知浓度之间的相关进行评价的结果作为“多被检体相关”的结果来示于表2。<多被检体相关的评价基准>a:良好(500被检体的基于本发明的saa测定值与基于对照试剂盒的测定的saa测定值的相关绘图的线形近似线的相关系数r为0.90以上)b:比较良好(500被检体的基于本发明的saa测定值与基于对照试剂盒的测定的saa测定值的相关绘图的线形近似线的相关系数r为0.80以上且小于0.90)c:不充分(500被检体的基于本发明的saa测定值与基于对照试剂盒的测定的saa测定值的相关绘图的线形近似线的相关系数r小于0.80)将结果示于表2。[表2]稀释倍率增加速度多被检体相关实施例310倍aa实施例41倍(未稀释)ab实施例55倍aa实施例6100倍aa根据表2的结果可知,在被检试样的基于生理盐水的稀释倍率为1倍对100倍之间,能够以相对于血清淀粉样蛋白a浓度的信号增加的相关性高的方式进行测定。其中,可以确认,在使用表面活性剂d316的本发明中,在稀释倍率为5倍至100倍的实施例中,多被检体相关的结果良好,在具有各种saa浓度的被检试样中,即使信号强度强也可获得良好的saa测定结果。符号说明1传感器芯片2上部部件3中间部件4基板5第一容器6第二容器7容器组8检测区域9参照区域10流路当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1