多光谱分析系统的校准的制作方法
多光谱分析系统的校准
1.相关申请的交叉引用
2.本申请要求于2018年6月8日提交的美国临时专利申请号62/682,819的优先权,其全部内容通过引用合并于此。
背景技术:
3.多光谱分析系统可用于各种测定中,以确定有关生物样品中荧光团和生色团结合以及表达的信息。通常,在样品中有多个光谱贡献者发出或吸收辐射的情况下,来自每个光谱贡献者的贡献被分开以单独评估属性,例如每个贡献者的空间位置和浓度。这样的评估可以提供有关样品的重要信息,包括疾病状态、免疫反应、蛋白质表达和药物治疗的功效。
4.通常在进行样品评估之前先对多光谱分析系统进行校准。校准通常涉及采取各种步骤来确保此类系统可以解决来自不同光谱贡献者的单独贡献。
技术实现要素:
5.本文公开的方法和设备在单个校准板孔中使用校准染料的混合物来校准多光谱成像系统。特别地,使用校准染料的混合物来减少或消除相对紧密间隔的光谱通道之间的串扰。串扰通过使来自一个光谱贡献者的贡献污染或掩盖来自另一光谱贡献者的贡献,从而损害了来自各种测定中准确定量信息的恢复能力。
6.在本文公开的方法和设备中,通过用校准染料的混合物进行校准,可以减少或消除干扰光谱贡献者对测量的感兴趣光谱贡献者的发射或吸收的“背景”贡献。结果,减少了光谱串扰并且增强了光谱复用。换句话说,通过使用特定校准波长或波段的校准染料的混合物,可以增加样品中可以分析的不同荧光团的数量,并且具有至少部分地重叠的发射光谱的荧光团的贡献可以被区分并以准确和精确的方式进行定量分析。
7.通常,在第一方面,本公开的特征在于用于校准多光谱分析系统的方法,该方法包括校准该系统以使用校准样品来检测来自包括第一荧光实体和第二荧光实体的生物样品中的第一荧光实体的荧光发射,其中校准样品的特征在于第一荧光实体的第一浓度和第二荧光实体的第二浓度,以及其中第一浓度大于第二浓度。
8.该方法的实施例可以包括以下特征中的任何一个或多个。
9.第一荧光实体可以是cy5,第二荧光实体可以是cy5.5。校准样品可以是包括多个样品孔的校准板。
10.第一荧光实体的荧光发射光谱可以与第二荧光实体的荧光发射光谱至少部分地重叠。第一和第二荧光实体可以分别与多光谱分析系统中的光谱发射通道相关联,并且可以通过多光谱分析系统在与第二荧光实体相关联的光谱发射通道中检测来自第一荧光实体的荧光发射。
11.第一和第二荧光实体可以各自是荧光染料。第一荧光实体可以是内源性荧光部分,第二荧光实体可以是荧光染料。相对于校准样品中的第一荧光实体和第二荧光实体的总量,校准样品中的第二荧光实体的分数可以在0.02和0.08之间(例如,在0.03和0.07之
间,在0.04和0.06之间)。
12.该方法可以包括使用校准的多光谱分析系统来识别生物样品中的一个或多个基因靶。
13.该方法的实施例还可以包括本文公开的任何其他特征,包括结合不同实施例公开的单个特征的任何组合,除非另有明确说明。
14.在另一方面,本公开内容的特征在于校准样品,其包括特征在于多个样品孔的校准板,其中将校准板的尺寸确定为在多光谱分析系统中接收,以及位于一个或多个孔中的校准组合物,该组合物包括第一荧光实体和第二荧光实体,其中第一荧光实体的荧光发射光谱与第二荧光实体的荧光发射光谱至少部分地重叠。
15.校准样品的实施例可包括以下特征中的任何一个或多个。
16.相对于组合物中第一和第二荧光实体的总量,第二荧光实体在组合物中的分数可以在0.02和0.08之间(例如,在0.03和0.07之间,在0.04和0.06之间)。第一荧光实体可以是cy5,第二荧光实体可以是cy5.5。
17.校准样品的实施例还可包括本文公开的任何其他特征,包括结合不同实施例公开的单个特征的任何组合,除非另有明确说明。
18.在另一方面,本公开的特征在于一些方法,其包括校准多光谱分析系统以检测来自生物样品中多种荧光染料的荧光发射,其中针对每种不同的荧光染料在系统的不同光谱通道中检测荧光发射,以及其中,对于所述生物样品中的第一荧光染料,所述校准包括将与所述第一荧光染料相对应的校准样品引入系统,所述校准样品的特征在于生物样品中的第一数量的第一荧光染料和第二数量的第二荧光染料。
19.这些方法的实施例可以包括以下特征中的任何一个或多个。
20.第一和第二荧光染料可具有至少部分地重叠的相应的第一和第二荧光发射光谱。可以在检测系统的第一光谱通道中检测来自第一荧光染料的荧光发射,并且可以在检测系统的第二光谱通道中检测来自第二荧光染料的荧光发射,并且还可以在第二光谱通道中检测来自第一荧光染料的荧光发射的至少一部分。第一荧光染料可以是cy5,第二荧光染料可以是cy5.5。
21.这些方法的实施例还可以包括本文公开的任何其他特征,包括结合不同实施例公开的单个特征的任何组合,除非另有明确说明。
22.一个或多个实施例的细节在附图和以下描述中阐述。根据说明书、附图和权利要求书,其他特征和优点将显而易见。
附图说明
23.图1是显示生物样品中基因靶的聚合酶链反应(pcr)扩增曲线的图;
24.图2是显示生物样品中基因靶的pcr扩增曲线的图,其中cy5荧光发射串扰进入对应于cy5.5的光谱发射通道;
25.图3是显示生物样品中基因靶的pcr扩增曲线的图,该曲线是使用多光谱分析系统测量的,所述多光谱分析系统用包括cy5和cy5.5的校准制剂(formulation)校准;
26.图4是显示生物样品中基因靶的pcr扩增曲线的图,该曲线是使用多光谱分析系统测量的,该多光谱分析系统用仅包含cy5的校准制剂校准;
27.图5是显示生物样品中基因靶的pcr扩增曲线的图,该曲线是使用多光谱分析系统测量的,所述多光谱分析系统用包括5%cy5.5和95%cy5的染料混合物的校准制剂校准;
28.图6是显示生物样品中基因靶的pcr扩增曲线的图,该曲线是使用多光谱分析系统测量的,所述多光谱分析系统用包括10%cy5.5和90%cy5的染料混合物的校准制剂校准;
29.图7是显示多组分pcr扩增曲线与恒定荧光强度的偏差的图,该偏差是使用多光谱分析系统测量的,该多光谱分析系统用校准制剂校准,该校准制剂包含cy5.5和cy5的染料混合物,作为染料混合物中的cy5.5的百分比的函数;
30.图8是显示生物样品中基因靶的pcr扩增曲线的图,该曲线是使用多光谱分析系统测量的,所述多光谱分析系统用包括4%cy5.5和96%cy5的染料混合物的校准制剂校准;
31.图9是校准样品的示例的示意图;
32.图10是多光谱分析系统的示例的示意图。
33.附图中相似的参考标记指示相似的元件。
具体实施方式
34.多光谱分析系统通常包括不同的滤波器,用于定量测量生物样品中特定荧光团的贡献。当使用(或表达)多个荧光团制备样品时,每个荧光团具有不同的发射光谱,可以通过选择具有中心波长的相应滤波器和有效排除样品中除了感兴趣的荧光团以外的所有荧光团的发射的带通滤波器来分离每个荧光团的发射以进行分析。随着荧光团数量的增加,对于具有相对宽的光谱发射带宽的荧光团,越来越难以实现通过充分排除来自其他荧光团的发射来隔离来自每个荧光团的发射,同时透射来自感兴趣的荧光团的足够的发射辐射以产生可检测的信号的光谱滤波器。
35.例如,quantstudio
tm dx成像系统(可从马萨诸塞州沃尔瑟姆市的thermofisher science获得)使用指定为m5的滤波器来量化样品中cy5染料的光谱发射(在648纳米的波长下激发,在668纳米的标称波长下发荧光),以及指定为m6的滤波器来量化样品中cy5.5染料的光谱发射(在685纳米激发,在706纳米的标称波长下发荧光)。cy5和cy5.5染料都具有显著的荧光发射带宽和光谱重叠。注意,在本公开中,“花青”缩写为“cy”。
36.为了成像和诊断目的,各种测定和其他定量分析技术依赖于单个样品中多种荧光团的准确定量。一种这样的测定是qpcr测定(可从马萨诸塞州沃尔瑟姆市的perkin elmer获得),它是一种多重聚合酶链反应(pcr)测定,它在单个pcr反应中使用了染料rox
tm
、fam
tm
、hex
tm
、cy5和cy5.5。
37.此测定中使用了多光谱分析系统(例如quantstudio
tm dx)来测量、分离和定量pcr反应循环过程中每种染料的荧光发射。这些染料用于靶向样品中的以下基因:
38.表1
39.染料样品靶基因rox无(参考染料)famtrechexrpp30cy5smn1cy5.5krec
40.如表1所示,在进行测定之前的样品制备过程中,smn1靶基因用cy5荧光团标记,而krec靶基因用cy5.5荧光团标记。使用表1中列出的染料,neomdx
tm qpcr多重测定可以检测样品中是否存在基因靶trec、smn1和krec,以及rpp30参考基因的存在与否。
41.图1是示出通过对取自“正常”新生儿的样品进行neomdx
tm qpcr测定而获得的示例qpcr扩增曲线的图。在图1中,每个靶基因与rpp30对照基因一起被扩增,并且每个扩增的基因都是基于来自其相应的偶联染料的荧光发射进行分离地检测的。
42.但是,在对各种样品进行neomdx qpcr分析时发现,在某些试验中,由于cy5的荧光发射会导致cy5.5光谱通道发生串扰,这不利于smn1和krec基因靶的准确定量。例如,在某些krec阴性且还包含相对较高浓度的smn1(产生来自cy5的较高强度的荧光发射)的样品中,即使krec信号相对较低(但高于预定义的检测阈值),也测量了对应于来自cy5.5发射的扩增曲线。由于已知样品是krec阴性的,因此这些结果相当于krec靶的假阳性测试。
43.不受理论的束缚,据信源自测量的cy5.5荧光发射的假krec扩增曲线是由由于cy5进入cy5.5光谱发射通道的串扰引起的。具体而言,由于在用于执行分析的quantstudio
tm dx系统中,滤波器不能用于光谱分离cy5.5荧光发射和cy5荧光发射,因此来自cy5的一些荧光发射在cy5.5光谱通道中被错误地检测为cy5.5荧光发射。
44.图2是显示krec阴性样品的示例qpcr扩增曲线的图。在图2中,样品包含1x105个smn1靶基因份数,但表1中没有其他基因靶(特别是没有krec靶基因)。尽管如此,仍基于cy5.5光谱发射通道中测得的荧光发射(即在quantstudio
tm dx系统中安装了m6滤波器)检测到krec扩增曲线。cy5.5光谱发射通道中的荧光发射是由于cy5荧光发射没有被与cy5.5光谱发射通道相关联的滤波器充分熄灭以逃避检测。
45.根据图2中所示的扩增曲线,样品可能被诊断为属于krec阳性的患者,即“正常”婴儿。但是,患有xla(x连锁性球蛋白血症)的婴儿不会显示krec扩增。因此,图2中所示的结果代表了患者xla的假阴性评估。
46.有效地,图2中在cy5.5光谱发射通道中检测到的cy5荧光发射信号的部分用作“背景”,应针对其检测任何“真实”cy5.5荧光发射,以获取每个基因靶的准确定量结果。对于许多多光谱分析系统(包括quantstudio
tm dx系统),在分析样品之前,先用“参考”样品对系统进行校准,以便为系统提供针对正在被测量的每种染料的参考光谱信息。参考样品通常被实现为校准板,其中板中的一些(或全部)孔包含将要测量荧光发射的一种染料的参考样品。因此,为了校准quantstudio
tm dx系统以测量表1中每种染料的荧光发射,使用了一系列的多孔校准板,其中该系列中的每个校准板都包含充满表1中的燃料中的不同染料的孔。通过仅使用每个校准板的孔中的一种染料,系统可以在每个孔位置测量该染料的“纯”参考光谱。为了完成校准,将通过该系统连续处理填充有将要测量的染料中的不同燃料的校准板,以便为系统提供每种染料的纯参考光谱。
47.但是,发明人发现,通过在单个校准板的孔中将多种染料混合在一起,可将包含板中每种染料贡献的参考光谱提供给系统。这些参考光谱不是任何一种染料的纯光谱。相反,它们包含板中每种染料的贡献,并有效地“混合”了参考光谱。此外,已经观察到,即使当在另一种染料的光谱发射通道中检测到来自一种染料的大量荧光发射时,这种混合参考光谱也显著改善了来自染料的荧光发射的定量分析。
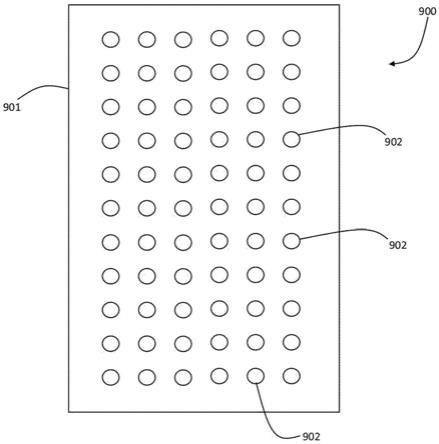
48.例如,针对上述和图2中所示的分析中使用的cy5校准板测试了许多不同的校准制
剂。特别是,每种制剂均包含不同比例的cy5和cy5.5标记的寡核苷酸,具有相同的校准缓冲液。使用每种不同的制剂中的每个对quantstudio
tm dx系统进行校准,然后,根据每种不同制剂定义的校准,分析从包含1x105个smn1靶基因份数(而表1中未显示任何其他靶基因)的样品中生成的相同数据文件。
49.通过使用包括cy5和cy5.5的校准制剂对cy5荧光发射的系统进行校准,通常可以观察到从cy5荧光发射到cy5.5光谱发射通道的荧光发射串扰减少了。在测试过程中,发现包括约95%cy5标记的寡核苷酸和约5%cy5.5标记的寡核苷酸的制剂可显著降低进入cy5.5光谱发射通道的荧光发射串扰。将cy5和cy5.5荧光团偶联至寡核苷酸的5'位置(cy5偶联物的序列agggttt,cy5.5偶联物的tctgcac)。
50.该校准剂的完整制剂如下:
51.表2
52.数量/浓度组分285nmcy5标记的寡核苷酸15nmcy5.5标记的寡核苷酸1x磷酸盐缓冲盐水,ph 7.3
‑
7.50.1%吐温20洗涤剂0.01%消泡剂b
‑
分子级水
53.图3是显示用表2所示的校准剂制剂对quantstudio
tm dx系统进行校准后分析的样品的qpcr扩增曲线的示意图。如上所述,该样品包含1x105个smn1靶基因的份数,而没有其他靶基因示于表1中。特别是在图3中,未观察到krec扩增,这与样品中没有krec一致,并且有效地消除了进入cy5.5光谱发射通道的cy5荧光发射串扰。
54.使用几种不同的校准剂制剂进行的实验导致减少了进入cy5.5光谱发射通道的cy5荧光发射串扰。通常,观察到当校准剂制剂中cy5.5的浓度相对于cy5和cy5.5的总浓度大于零(例如,0.001以上、0.002以上、0.005以上、0.01以上、0.02以上、0.03以上、0.04以上、0.05以上、0.06以上、0.07以上、0.08以上、0.09以上、0.10以上、0.12以上、0.14以上、0.16以上、0.18以上、0.20以上、0.25以上)。在一些实施例中,观察到,当校准剂制剂中cy5.5的浓度相对于cy5和cy5.5的总浓度大于0.10时,会发生cy5荧光发射串扰到cy5.5光谱发射通道中的过度校正。
55.为了确定在制备的校准剂中哪种cy5.5相对浓度可以对cy5荧光发射串扰进行最佳校正,制备了一组校准剂,其中具有不同的cy5和cy5.5偶联寡核苷酸的相对浓度,以及其他组分列出在表2中。这些校准剂中的每个校准剂均用于校准quantstudio
tm dx系统,然后由该系统分析上述相同的样品。图4、5和6示出使用分别含有0%cy5.5标记的寡核苷酸、5%cy5.5标记的寡核苷酸和10%cy5.5标记的寡核苷酸的校准剂对系统进行校正后样品的qpcr扩增曲线。对应于cy5.5标记的寡核苷酸的扩增曲线在图例中标记为“其他”。
56.为了评估每个校准剂产生的扩增曲线是否校正不足(例如仍然显示出一些串扰)、校正过度或理想校正,将多组分扩增曲线在40个pcr扩增循环中的平坦度用作指标。通常,假设多组分扩增曲线越平坦,校正越接近理想状态。
57.图7是示出在测量每条多组分扩增曲线之前,作为用于校准该系统的校准剂中
cy5.5标记的寡核苷酸的百分比的函数的多组分扩增曲线荧光强度的变化。在图7中,结果通常沿直线下降,这已通过图中所示的回归分析得到证实。回归分析预测,用约4%cy5.5标记的寡核苷酸(和约96%cy5标记的寡核苷酸)制备的校准剂可对进入cy5.5光谱发射通道的cy5荧光产生最佳补偿。图8中的曲线示出在用约4%cy5.5标记的寡核苷酸和约96%cy5标记的寡核苷酸制备的校准剂校准该系统后获得的qpcr扩增曲线(包括多组分曲线)。
58.虽然校准剂制剂的前述示例具体涉及cy5和cy5.5的混合物以减少或消除荧光发射串扰,但是相似的原理适用于校准制剂中使用的任何两种荧光团的混合物,以减少光谱发射通道中的串扰。例如,考虑更一般的情况,其中两个光谱贡献者(荧光染料、内源性荧光团、表达的荧光部分)a和b均显示荧光发射,使得由于检测系统无法完全分离a和b的发射(例如,使用滤波器),因此在b的光谱发射通道中检测到a的至少一些荧光发射。
59.为了校准多光谱分析系统以适当地校正这种串扰,可以制备包括作为混合物的相对较大部分的a和相对较小但非零的b部分的校准剂。然后将混合物用于校准该系统,以检测来自a的荧光发射。通常,校准制剂中b相对于制剂中a和b总量的分数可以为0.001以上(例如0.002以上、0.003以上、0.004以上、0.005以上、0.01以上、0.02以上、0.025以上、0.03以上、0.035以上、0.04以上、0.045以上、0.05以上、0.055以上、0.06以上、0.065以上、0.07以上、0.08以上、0.09以上、0.10以上、0.12以上、0.14以上、0.16以上、0.18以上、0.20以上、0.25以上)。
60.可以根据本文公开的方法制备多种不同的校准剂(对应于不同的成对的荧光团a和b。通常,校准剂可以包括一种或多种染料。用于校准剂的合适的染料可以包括(但不限于)一种或多种基于罗丹明的染料,例如rox
tm
、tamra
tm
和(罗丹明、羧甲基罗丹明、甲基罗丹明及其衍生物)、一种或多种基于荧光素的染料,例如fam
tm
、sima
tm
、tet
tm
和hex
tm
(荧光素、羧基荧光素、氯荧光素及其衍生物)、一种或多种基于花青的染料(例如花青及其衍生物),例如cy3、cy3.5、cy5和cy5.5,以及一种或多种基于吨(xanthene)的染料,如joe
tm
。
61.成对的荧光团a和b(除了cy5和cy5.5之外)的示例包括但不限于:tamra
tm
和hex
tm
;fam
tm
和hex
tm
、fam
tm
和sima
tm
、hex
tm
和cy3、sima和cy3、cy3和cy3.5;cy3和rox
tm
;cy3.5和cy5;以及rox
tm
和cy5。
62.在一些实施例中,在荧光团a和b的光谱发射通道之间可以发生相互串扰。换句话说,可以在b的光谱发射通道中观察到来自a的一些荧光发射,并且在a的光谱发射通道中可以观察到来自b的一些荧光发射。为了校正这种光谱串扰,可以对系统进行校准,以使用第一校准剂检测来自a的荧光发射,该第一校准剂包括a和b的浓度,且在第一校准剂中a的浓度大于b的浓度。该系统也可以被校准以使用第二校准剂检测来自b的荧光发射,该第二校准剂包括a和b的浓度,其中在第二校准剂中b的浓度大于a的浓度。
63.通常,可以根据需要选择第一和第二校准剂中a和b的相对浓度,以对光谱串扰提供足够的校正。在一些实施例中,例如,第一校准剂可以具有与上述组成相似的组成。此外,例如,在某些实施例中,第二校准剂可以具有这样的组成,其中校准制剂中的a相对于制剂中a和b的总量的分数可以为0.001以上(例如,0.002以上、0.003以上、0.004以上、0.005以上、0.01以上、0.02以上、0.025以上、0.03以上、0.035以上、0.04以上、0.045以上、0.05以上、0.055以上、0.06以上、0.065以上、0.07以上、0.08以上、0.09以上、0.10以上、0.12以上、
0.14以上、0.16以上、0.18以上、0.20以上、0.25以上)。
64.虽然前面的讨论集中在当两个不同的光谱贡献者a和b表现出荧光发射串扰时提供校正的校准剂,但也可以为两个以上光谱贡献中发生串扰时的情况准备更复杂的校准剂。例如,在光谱贡献者c的光谱发射通道中检测到来自光谱贡献者a和b的荧光发射的情况下,可以使用包括a、b和c的混合物的校准制剂对多光谱分析系统进行校准。例如,该系统可以被校准以使用包括相对较高分数的a和相对较低分数的c(类似于上述的较低分数的a和b)的校准制剂检测来自a的荧光发射,并被校准以使用包括相对较高分数的b和相对较低分数的c的校准制剂(类似于上述的低分数的a和b)检测来自b的荧光发射。各种校准制剂中的a、b和c的分数可以根据需要变化,以实现对荧光发射串扰的适当补偿。
65.类似地,在光谱贡献者b和c的光谱发射通道中观察到来自光谱贡献者a的荧光发射的地方,可以对多光谱分析系统进行校准,以使用包括相对较高分数的a和相对较低分数的b和c(类似于上述低分数的a和b)的校准制剂来检测来自a的荧光发射。
66.更一般地,本文公开的校准制剂可以包括两个、三个、四个、五个或什至五个以上光谱贡献者(荧光团,例如染料、内源荧光实体和表达的荧光部分)的组合,用于校准多光谱分析系统,以补偿由一个或多个光谱贡献者进入对应于一个或多个其他光谱贡献者的光谱发射通道的荧光发射串扰。
67.尽管上面已经描述了荧光团(或光谱贡献者)a和b的具体示例,但更一般而言,本文所述的方法和校准剂可用于其中在专用于测量来自另一光谱贡献者(例如a)的荧光发射的光谱波长带中检测到来自一个光谱贡献者(例如b)的荧光的任何情况。例如,其中样品包含光谱贡献者a和b,并且在以波长λ
a
为中心的波长带中测量了来自贡献者a的荧光,那么如果光谱贡献者b在以λ
a
为中心的波长带中的总荧光强度是例如光谱贡献者a在波长λ
a
处的荧光强度的1%以上(例如,2%以上、3%以上、5%以上、7%以上、10%以上、15%以上、20%以上、25%以上、30%以上、40%以上、50%以上),则可以在校准剂中使用a和b的混合物。类似的考虑也适用于两个以上光谱贡献者中的光谱干扰(即串扰)。
68.图9是示出校准样品900的示例的示意图。样品900包括具有多个校准区域902的基板901(例如,板、载玻片、晶片、块)。校准区域902可以以各种方式形成在基板901上。在一些实施例中,例如,校准区域902是基板901的表面上的简单定义的区域。在某些实施例中,校准区域902对应于在基板901的表面中形成的凹口(即,孔)。在一些实施例中,校准区域902可以对应于从基板901的表面向外延伸的突出部、延伸部或其他凸起结构。
69.通常,校准样品900可以包括任何数量的校准区域902。例如,校准区域902的数量可以是10以上(例如,20以上、50以上、100以上、200以上、300以上、400以上、500以上、700以上、1000以上,甚至更多)。
70.校准样品900在一个或多个校准区域902中包括校准剂,其对应于包括一种或多种荧光团的试剂的混合物。如上所述的,在一个或多个校准区域中的校准剂可以包括荧光团的混合物(例如,荧光团a和b),其具有在光谱上相对较近的发射光谱,使得在专用于另一荧光团的光谱带中检测到来自荧光团之一的发射。
71.在一些实施例中,可以提供一组校准样品以伴随以多种染料为特征的测定,每种染料充当样品中特定分子靶的光谱报告子。例如,在包括染料a、b、c、d和e的测定中,可以提供一组5个校准样品,测定中的5种染料中的每个各一个。例如,如果染料c、d和e是在不同的
光谱带中测量的,而没有来自任何其他染料的串扰,则对应于染料c、d和e的校准样品可以各自在每个校准区域仅包括一种染料(即,分别为染料c、d和e)。
72.如果在专用于测量染料b的光谱带中测量到了不可忽略的量的来自染料a的荧光,则染料b的校准样品可以包括在校准区域902的每个处的大部分染料b和相对少量的染料a的混合物,如上所述的。
73.如果在专用于测量染料a的光谱带中测量到不可忽略量的来自染料b的荧光,则用于染料a的校准样品可以包括在校准区域902中的每个处的大部分染料a和相对少量染料b的混合物,如上所述的。替代地,如果在专用于测量染料a的光谱带中没有测量到可观量的来自染料b的荧光,则用于染料a的校准样品可以在每个校准区域902处仅包括染料a。
74.通常,对于使用n个独立测量的荧光染料进行的测定,可以提供n个校准样品。对于这组n个样品中的每个特定校准样品(对应于染料m),校准区域902可以分别包括相对较大比例的名义上与该样品相对应的染料m,以及相对较小比例的任何其他染料,其在专用于染料m的测量的光谱检测带中显示出可测量的荧光,如上所述的。
75.所描述的校准样品可用于校准各种不同的多光谱分析系统。一个这样的系统的一个示例是quantstudio
tm dx系统。更一般地,图10示出了可以用所描述的校准样品进行校准的多光谱分析系统1000的示例。系统1000包括辐射源1002、发射滤波器1004、分束器906、光束光学器件1008、样品台1010、发射滤波器1012和检测器1014。源、滤波器和检测器连接至控制器1016,该控制器1016向这些组件发送控制信号,并从这些组件接收报告信号和测量信息。
76.为了校准系统1000,将校准样品900—其大小确定为可以被系统1000接收(特别是在台1010上)被定位在该台上。校准样品900对应于特定的染料m,并且控制器1016调节发射滤波器1012以选择滤波器1012中专用于测量来自染料m的荧光发射的光谱带(即“光谱通道”)。
77.辐射源1002然后将入射辐射引导通过滤波器1004、分束器1006和光束光学器件1008、并到达校准样品900上。入射辐射使校准剂在校准区域902中激发,从而使校准剂发射荧光。发射的荧光穿过光束光学器件1008,被分束器1006反射,穿过发射滤波器1012,并被检测器1014检测。
78.检测器1014测量来自每个校准区域902的荧光发射,并将荧光发射测量值发送到控制器1016。然后,控制器1016使用测量的荧光发射信息来校准每个校准区域902,以用于染料m的荧光测量。其中每个校准区域902被校准的具体方式可以广泛地变化。在一些实施例中,例如,光谱分辨的测量的荧光发射信息形成“基线(baseline)”测量信号,针对该“基线”测量信号对来自样品的荧光发射测量值进行归一化,或者从样品的荧光发射测量值中减去该“基线”测量信号。在某些实施例中,来自校准剂的光谱分辨的测得的荧光发射信息形成对应于染料m的有效本征光谱或纯光谱,然后将其用于定量来自样品中的染料m的测得的荧光信息。来自校准样品900的校准剂的所测量的荧光信息也可以用于多种其他校准技术中。
79.为了完成系统1000的校准,控制器1016依次循环通过相应测定中使用的每种染料,对于每种染料调节发射滤波器1012以选择专用于测量来自染料的荧光发射的光谱带,然后测量位于台1010上并对应于染料的校准样品900上的每个校准区域902的荧光发射。然
后,将来自校准样品900的与每种染料相对应的测得的荧光信息用于校准系统1000,以测量来自样品中该染料的荧光发射。校准信息可以存储在例如连接至控制器1016的存储单元中。
80.当系统1000已经被校准时,该系统可以用于在对样品执行的测定中测量来自每种染料的荧光发射。例如,如果用包括n种染料的测定制备样品,则依次执行与n种染料中的每一种相对应的荧光发射测量值,其中控制器1016调节发射滤波器1012以依次选择与每种染料相对应的光谱测量带,如在上述校准程序中所述的。
81.可以使用存储的校准信息来校正测定中每种染料的原始荧光发射测量值,其允许获得定量信息。例如,在使用多种染料的测定中,每种染料均充当样品中特定基因靶的光谱报告子,可以根据校正后的相应染料的荧光发射信息来识别每种基因靶。样品中每个基因靶的表达都可以定量化。
82.硬件和软件实施方式
83.通常,控制器1016可以配置为执行本文所述的任何控制、校准或数据分析功能。这些功能可以完全由控制器1016(例如,自主地)执行,或者一组功能或步骤可以部分由控制器1016以及部分由系统1000的用户执行。当完全或部分由控制器1016执行时,可以使用标准编程技术在计算机程序中实现功能。这样的程序被设计为在可编程计算机、专用控制器或专门设计的集成电路上执行,每个包括电子处理器(例如,控制器1016中的电子处理器)、数据存储系统(包括存储器和/或存储元件)、至少一个输入设备和至少一个输出设备,例如显示器。每个计算机程序都可以使用高级过程或面向对象的编程语言或汇编语言或机器语言来实现。此外,该语言可以是编译的或解释的语言。每个这样的计算机程序可以被存储在计算机可读存储介质(例如,诸如硬盘驱动器的磁存储介质,诸如cd
‑
rom或dvd的光学存储介质,诸如固态硬盘驱动器的持久固态存储介质),其在当由带有处理器的设备读取时,可能导致该设备中的处理器执行本文所述的控制和分析功能。
84.示例
85.为了调查单一测定中两种染料的混合物的校准样品的性能,进行了研究以确定与测定靶的测量极限有关的三个量。空白极限(lob)是可能不包含分析物(分析物)的空白样品可能会观察到的最高测量值(具有规定的概率[α])。它定义了背景或零样品的变化。检测极限是通过给定的测量程序获得的测量量值,对于该值,错误地声称材料中不存在被测物的概率为给定错误地声明其存在的概率α。对于与典型测量程序有所不同的分子测量程序,因为所有空白或阴性样品结果通常都报告为阴性,因此,lod是从概率回归模型中计算的,作为被测物浓度,在该浓度下,以预定的概率(通常为95%)的测量值得出肯定的分类。定量极限(loq)是材料中被测物的最低含量,其可以在规定的实验条件下以状态精度(作为总误差或作为对偏差和精度的独立要求)进行定量确定。loq可以基于功能敏感性或基于总误差来定义。
[0086]
进行了研究以确定:(1)测定所针对的所有分析物(分析物s)的lob(“lob研究”);(2)测定所针对的两种半定量分析物(sjtrec和krec)的lod(“lod”研究);(3)测定所针对的相同的两种半定量分析物sjtrec和krec的loq("loq"研究)。该测定是neomdx测定,并且未评估测定的两个种系靶(smn1和rpp30)的lod和loq。
[0087]
lob研究采用人工分析物阴性样品进行,该样品是通过将smn1阴性细胞(购自
coriell institute for medical research,camden,nj)掺入贫白细胞的人血中制成的。科里尔(coriell)细胞系自然也是sjtrec和krec阴性,以30,000个基因组份数/μl(一个新生儿的典型浓度)的靶添加。通过将coriell细胞系掺入到五种不同批次的白细胞贫血人类血中,制备了五个独立的人工分析物阴性样品(cans1
‑
5)。
[0088]
用盐溶液将五批(lots)白血球耗竭的人血(购自zen
‑
bio,research triangle park,nc)洗三遍,并将血细胞比容调节至40%至55%(表3)。将coriell sma细胞在补充有fbs和青霉素/链霉素的rpmi培养基中培养。使用cell countess仪器(thermo fisher,waltham,ma)对细胞进行计数。每微升去白细胞的人血中掺入约15000个细胞,以获得人工的分析物阴性样品。将准备好的血分配到滤纸上后,将dbs样品干燥过夜,然后在
‑
30℃至
‑
16℃的具有干燥剂的密封袋中保存直至使用。表3描述了用于确定lob的样品。
[0089]
表3
[0090]
样品名称血细胞比容(%)去白细胞的血的批次#cans149.2w36981900271000cans249.8w36981900281900cans349.5w36981900270800cans450.0w36981900281700cans549.5w36981900270500
[0091]
由于细胞系中含有正常水平的rpp30,因此,认为分析物阴性样品不适合建立rpp30靶的lob,但适用于其他三种分析物sjtrec、krec和smn1。
[0092]
对于lod和loq研究,由于scid和xla疾病的研究标本稀有,要找到恰好具有sjtrec和krec在所需水平的代表性新生dbs样品具有挑战性。因此,使用人工样品进行研究。通过用成人全血或用sjtrec和/或krec水平无法通过该测定检测到的去白细胞的人红血稀释脐带血来制备人工样品。将hl
‑
60细胞掺入成人全血或去白细胞的血中,以调节rpp30 ct值以匹配脐带血中的rpp30 ct值(相差1ct以内)。
[0093]
首先,通过对使用在去白细胞人血中含有ddpcr定量线性化的trec、krec、smn1和rpp30质粒的系列稀释液的dbs样品生成的5级(250、500、1000、3000、10000份数/μl血)标准曲线进行测试来指定每种脐带血中的sjtrec和krec(份数/μl血)的初始值。结果总结在表4中。
[0094]
表4
[0095][0096]
然后对三批成人全血进行测试,以确定每种分析物的内源性水平,从而检查它们是否适合用作稀释剂。表5总结了每个成人全血6次重复的平均ct值。
[0097]
表5
[0098]
血批次#trec ctkrec ctsmn1 ctrpp30 ct成人全血w36981900485900无ct32.4824.4725.17
成人全血w3698190029670037.3533.3524.4724.39成人全血w3698190029730034.8434.4125.7727.35
[0099]
尽管sjtrec通常在成人全血中含量较低,但是三批样品中有两批具有可检测的sjtrec水平,因此在制备trec lod/loq样品时,将它们用去白细胞人血作为稀释剂代替。所有这三批成人全血也都具有可检测的krec水平,因此在制备krec lod/loq样品时,将去白细胞人血用作稀释剂。表6列出了每种脐带血所用的稀释剂。根据研究设计,通过将hl
‑
60细胞掺入稀释剂中,调节稀释剂的rpp30 ct值以匹配脐带血rpp30 ct值(相差1ct以内)。
[0100]
表6
[0101][0102]
使用相应的稀释剂,将每个脐带血样品稀释到不同的水平,其中至少最低的三个水平的命中率应在0.10至0.90的范围内(表6)。然后将样品点到ahlstrom 226滤纸上并干燥过夜。然后将它们在
‑
30℃至
‑
16℃的具有干燥剂的密封袋中保存直至使用。表7总结了研究中使用的最终稀释液及其在预测试中观察到的相应命中率(重复10次)。
[0103]
表7
[0104]
[0105]
[0106][0107]
lob研究是使用两组neomdx
tm
测定系统进行的,在5天内运行,共运行10次。dna提取和pcr设置在janus
tm
自动化液体处理器(perkin elmer,waltham,ma)上进行。对于trec/krec/smn1 lob确定,使用了5个人工分析物阴性样品(cans),每次运行均进行6次重复测试,总共300个结果。对于rpp30 lob测定,使用空白样品(无模板dna),每次运行均进行20次重复测试,共200个结果。在每个板上,一式两份测定的试剂盒对照品ntc、c1、c2和c3用于运行验收。
[0108]
表8(trec/krec/smn1)和表9(rpp30)中示出了lob研究的总体程序的总结。
[0109]
表8
[0110][0111]
表9
[0112][0113]
对于lod和loq研究,对于每种分析物sjtrec或krec,在janus自动化液体处理机上进行dna提取和pcr设置。对于每个样品和每种稀释液,包括阴性样品(稀释剂),每次运行均进行五次重复测试,总计960个结果,每批每个稀释重复20次。每次运行均由完整的96孔板和部分96孔板组成,合并为384孔板。表10示出了lod和loq研究的总体程序的总结。
[0114]
表10
[0115][0116]
对于lob研究,针对每个试剂批次计算每个被测物的假阳性结果的百分比。如果给定试剂批次的假阳性结果百分比不超过5%,则针对该批次和该被测物确认lob=0。每个试剂批次分别进行确认。
[0117]
对于trec、krec和smn1,三种分析物中的任何一种均未报告所有重复的ct值。因此,对于两个试剂盒批次,假阳性结果的百分比都为零,该假阳性结果的百分比定义为对相应的被测物报告了有效ct值的人工分析物阴性样品的重复百分比(不包括由于rpp30>28.4而报告为“无效”的重复。
[0118]
对于rpp30,只有两个重复的ct值分别报告为34.59和36.23。因此,对于两个试剂盒批次,假阳性结果的百分比(定义为有效rpp30 ct值≤28.4的空白样品的重复百分比)也为零。
[0119]
表11中示出了所有lob研究样品的用于krec、smn1和trec的测量值的总结。任何分析物均没有假阳性结果,因此两个试剂盒批次的假阳性率均为0%。
[0120]
表11
[0121][0122]
表12中示出rpp30的所有空白样品的测量值的总结。rpp30没有假阳性结果,因此两个试剂盒批次的假阳性率均为0%。
[0123]
表12
[0124][0125]
对于lod和loq研究,lod和loq均以两个单位计算:份数/μl血和份数/105细胞。为了以份数/105细胞为单位计算lod和loq,基于脐带血样品的平均sjtrec ct值和来自同一脐带血样品的所有稀释液的平均rpp30 ct值之间的δct值和脐带血样品的平均krec ct值和来自同一脐带血样品的所有稀释的平均rpp30 ct值之间的δct值,使用以下两个公式,来计算每个脐带血样品中的初始sjtrec和krec浓度(份数/105细胞):
[0126]
trec:2
×2‑
(trec ct
‑
rpp30 ct)
×
117000
[0127]
krec:2
×2‑
(krec ct
‑
rpp30 ct)
×
254000
[0128]
然后,基于其稀释因子计算其稀释液中的sjtrec和krec浓度(份数/105细胞)。
[0129]
对每个分析物、sjtrec或krec分别评估lod和loq。从所有三个脐带血样品及其稀释液中收集的数据汇总在一起进行计算。对于每个试剂盒批次,使用95%的概率的概率分析计算lod。将loq评估为功能灵敏度,该灵敏度代表与所需实验室内精度相关的被测量浓度。loq计算中仅包含产生100%命中率的稀释液。对于每个合格的稀释液,计算ln中的浓度平均值和sd(份数/105细胞)。然后,使用幂函数模型(sd与平均浓度)拟合每种试剂盒批次的数据集。将每种试剂盒批次的loq确定为预测的最低浓度,该最低浓度应在实验室精确度内等于精度要求的90%sd(sjtrec,0.9ln(份数/105细胞)、以及krec,1.49ln(份数/105细胞))。
[0130]
从两种试剂盒批次中分别获得的较高的lod/loq值被接受为测定lod/loq。但是,如果loq恰好小于lod,则将lod报告为测定lod和测定loq,因为从理论上讲,不可能使loq小于lod。
[0131]
对于在lod研究中确定的trec,观察到的阳性结果数、测量总数和计算出的命中率百分比以及两个单位的样品浓度(份数/μl血和份数/105细胞)示出在表13中。
[0132]
表13
[0133]
[0134][0135]
进行了以份数/μl血单位为单位的概率分析,表14总结了两种具有95%置信区间的试剂盒批次的结果。来自浓度值概率分析的lod估计给出了为95%的估计命中率。
[0136]
表14
[0137][0138]
为了估计lod浓度水平(以份数/105细胞为单位)的临床意义,将新生儿样品分布的rpp30水平调节为与lod样品相同的水平。表15示出rrec30值固定为lod试剂盒批次平均值的以份数/105细胞为单位的trec lod新生儿较低的百分位值。基于新生儿分布百分位值,试剂盒批次1lod结果为nbs分布的0.7%百分位,而试剂盒批次2lod结果为nbs分布的
0.8%百分率。
[0139]
表15
[0140][0141]
对于在lod研究中确定的krec,在表16中示出观察到的阳性结果数、测量的总数和计算的命中率百分比以及两种单位的样品浓度:份数/μl血单位和份数/105细胞。
[0142]
表16
[0143]
[0144]
[0145][0146]
进行了概率分析,表17和表18总结了两种具有95%置信区间的试剂盒批次的结果。lod估计值是浓度值,对于该浓度值,概率分析给出的估计命中率为95%。
[0147]
表17
[0148][0149]
表18
[0150][0151]
为了估计lod浓度水平(以份数/105细胞为单位)的临床意义,将新生儿样品分布的rpp30水平调节为与lod样品相同的水平。表19示出当rpp30值已固定为lod试剂盒批次平均值时,以份数/105细胞为单位的krec新生儿分布较低百分位值。
[0152]
表19
[0153][0154]
基于新生儿分布的百分位值,试剂盒批次1lod结果为nbs分布的0.6%百分位,试剂盒批次2lod为nbs分布的0.4%百分位。
[0155]
对于loq研究中确定的trec,试剂盒批次1的命中率100%的trec样品数量为8,试剂盒批次2的trec样品数量为7。因此,难以执行精密剖析方法,因此通过比较每个单个样品和批次内变化要求,选择了更保守的方法。表20示出与批次内规格的trec样品精度结果。
[0156]
表20
[0157][0158]
所有样品均满足两个试剂盒批次的精度要求。因此,批次特定的loq值等于lod研究中确定的最低样品或lod的平均值,以较高者为准,因为当该值低于lod时,命中率预计低于95%,并且loq值将无法满足精度要求。表21和表22分别示出了以份数/μl血和份数/105细胞为单位的trec loq估计值。
[0159]
表21
[0160][0161]
表22
[0162][0163]
对于loq研究中确定的krec,试剂盒批次1的命中率100%的krec样品的数量为10,试剂盒2的krec样品的数量为12。通过将每个样品与批次内变化要求进行比较,选择与trec一样的保守方法。表23示出与批次内规格相比的krec样品精度结果。所有样品均满足两个试剂盒批次的精度要求。因此,批次特定的loq值等于最低样品的平均值或先前确定的lod值,以较高者为准,因为当该值低于lod值时,预期命中率低于95%,loq值将无法满足精度要求。
[0164]
表23
[0165][0166]
表24和25分别示出krec loq估计值,其单位为份数/μl血和份数/105细胞。
[0167]
表24
[0168][0169]
表25
[0170][0171]
基于上述lob、lod和loq研究的结果,对于所有分析物,neomdx
tm
测定的lob为0份数/μl血和为0份数/105细胞。neomdx
tm
测定的trec lod/loq为95份数/μl血和342份数/105细胞(rpp30 ct=24.1),neomdx
tm
测定的krec lod/loq为119份数/μl血和593份数/105细胞(rpp30 ct=24.1)。
[0172]
其他实施例
[0173]
已经描述了多个实施例。然而,将理解的是,可以在不脱离本公开的精神和范围的情况下进行各种修改。因此,其他实施例在所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1