在模拟体内条件下的治疗性蛋白质选择的制作方法
对序列表的引用
本申请以引用的方式并入以计算机可读形式提交为文件10470wo01-sequence.txt的序列表,所述序列表于2019年8月12日创建且含有1466字节。
本发明涉及生物药物,并且涉及在接近生理条件下测定治疗性生物分子,如抗体的行为。
背景技术:
体外结合平衡的正确分析必须限制在接近解离常数的浓度,通常在微摩尔量级及以下。在这些条件下,蛋白质本质上充当理想分子,并且任何非特异性相互作用都可容易地忽略。将蛋白质浓度增加到任意高的值会导致大分子拥挤,其中复合物形成不再相对于蛋白质浓度呈线性,并且从质量作用定律导出的结合方程更好地用热力学活性而不是浓度表示(neal,b.l.,d.asthagiri和a.m.lenhoff(1998)."molecularoriginsofosmoticsecondvirialcoefficientsofproteins."biophysj75(5):2469-2477)。活度系数的大小取决于整个溶液的组成;非理想性不仅是由于蛋白质本身的水平升高,而且由于非相互作用大分子和共溶质的存在。
对在非理想条件(与通常用于体外表征的那些显著偏离)下蛋白质之间的非特异性相互作用的理解对于在生物学背景下获得更完整的蛋白质功能图至关重要。因此,当前需要用于在模拟体内条件下确定生物分子的非特异性相互作用的影响的方法。
技术实现要素:
在一个方面,本发明提供了一种在模拟体内条件下确定非特异性相互作用的影响的方法,其中所述方法包括:(a)使包含生物学相关分子拥挤剂和靶分子的溶液与生物传感器接触,其中所述生物传感器的表面包含特异性地结合所述靶分子的捕获分子;(b)使所述靶分子结合至所述捕获分子;以及(c)使用生物层干涉法测定结合至捕获分子的所述靶分子的量。
在一些实施方案中,所述方法还包括将结合至所述捕获分子的靶生物分子的量与对照阈值进行比较,所述对照阈值区分与所述溶液中的其他分子具有吸引性非特异性相互作用和与所述溶液中的其他分子具有排斥性非特异性相互作用的靶生物分子。
在所述方法的各种实施方案中,所述对照阈值是针对理想溶液、稀溶液或半稀溶液中结合的量归一化的结合的量。
在所述方法的各种实施方案中,所述生物学相关分子拥挤剂包括人血清白蛋白(hsa)。
在一些实施方案中,所述人血清白蛋白以生理相关浓度存在。
在一些实施方案中,所述人血清白蛋白以介于约1g/l与约100g/l之间的浓度存在。
在一些实施方案中,所述方法还包括测定在所述生物学相关分子拥挤剂的两种或更多种浓度下结合的量。
在所述方法的各种实施方案中,所述生物学相关分子拥挤剂包括血清和/或血浆。
在一些实施方案中,所述方法还包括测定在两种或更多种ph值下结合的量,例如以确定结合的ph依赖性。
在一些实施方案中,所述方法还包括测定在两种或更多种盐浓度下结合的量,例如以确定结合的盐依赖性。
在所述方法的各种实施方案中,所述靶分子包含单克隆抗体,并且所述捕获分子包含特异性地结合至所述单克隆抗体的抗原。
在所述方法的各种实施方案中,所述靶分子包含抗原,并且所述捕获分子包含特异性地结合至所述抗原的单克隆抗体。
在所述方法的各种实施方案中,所述靶分子包含受体或其配体结合片段,并且所述捕获分子包含特异性地结合至所述受体或其配体结合片段的配体。
在所述方法的各种实施方案中,所述靶分子包含配体,并且所述捕获分子包含特异性地结合至所述配体的受体或其配体结合片段。
在所述方法的各种实施方案中,所述捕获分子通过接头偶联至所述传感器的表面。
在所述方法的各种实施方案中,所述接头包含生物素和链霉亲和素或亲和素。
在所述方法的各种实施方案中,所述靶分子包含抗体,并且所述捕获分子包含抗iggfc。
在所述方法的各种实施方案中,所述抗iggfc是抗人iggfc。
在另一个方面,本发明提供了一种在模拟体内条件下选择生物分子的方法,其中所述方法包括:(a)使模拟体内条件的溶液与生物传感器接触,其中所述生物传感器的表面包含特异性地结合来自两种或更多种目标靶生物分子的集合的靶分子的捕获分子,并且其中所述溶液还包含生物学相关分子拥挤剂和选自所述两种或更多种目标靶生物分子的集合的第一靶生物分子;(b)使所述第一靶生物分子结合至所述捕获分子;以及(c)使用生物层干涉法测定结合至所述捕获分子的所述第一靶生物分子的量。
在一些实施方案中,所述方法还包括:(a)使模拟体内条件的第二溶液与所述生物传感器接触,其中所述第二溶液还包含所述生物学相关分子拥挤剂和选自两种或更多种目标生物分子的集合的第二靶生物分子;(b)使所述第二靶生物分子结合至所述捕获分子;(c)使用生物层干涉法测定结合至所述捕获分子的所述第二靶分子的量;以及(d)将结合至所述捕获分子的所述一生物分子的量和结合至所述捕获分子的所述第二生物分子的量进行比较,以鉴定所述第一生物分子和所述第二生物分子中的哪一者具有更大量的结合。
在一些实施方案中,所述方法还包括将结合至所述捕获分子的所述第一和/或第二靶生物分子的量与对照阈值进行比较,所述对照阈值区分与所述溶液中的其他分子具有吸引性非特异性相互作用和与所述溶液中的其他分子具有排斥性非特异性相互作用的靶生物分子。
在所述方法的各种实施方案中,所述阈值是针对理想溶液、稀溶液或半稀溶液中结合的量归一化的结合的量。
在所述方法的各种实施方案中,所述生物学相关分子拥挤剂包括人血清白蛋白(hsa)。
在所述方法的各种实施方案中,所述人血清白蛋白以生理相关浓度存在。
在所述方法的各种实施方案中,所述人血清白蛋白以介于约1g/l与约100g/l之间的浓度存在。
在一些实施方案中,所述方法还包括测定在所述生物学相关分子拥挤剂的两种或更多种浓度下结合的量。
在所述方法的各种实施方案中,所述生物学相关分子拥挤剂包括血清和/或血浆。
在一些实施方案中,所述方法还包括测定在两种或更多种ph值下结合的量,以确定结合的ph依赖性。
在一些实施方案中,所述方法还包括测定在两种或更多种盐浓度下结合的量,以确定结合的盐依赖性。
在所述方法的各种实施方案中,所述靶分子包含单克隆抗体,并且所述捕获分子包含特异性地结合至所述单克隆抗体的抗原。
在所述方法的各种实施方案中,所述靶分子包含抗原,并且所述捕获分子包含特异性地结合至所述抗原的单克隆抗体。
在所述方法的各种实施方案中,所述靶分子包含受体或其配体结合片段,并且所述捕获分子包含特异性地结合至所述受体或其配体结合片段的配体。
在所述方法的各种实施方案中,所述靶分子包含配体,并且所述捕获分子包含特异性地结合至所述配体的受体或其配体结合片段。
在所述方法的各种实施方案中,所述捕获分子通过接头偶联至所述传感器的表面。
在所述方法的各种实施方案中,所述接头包含生物素和链霉亲和素或亲和素。
在所述方法的各种实施方案中,所述靶分子包含抗体,并且所述捕获分子包含抗iggfc。
在所述方法的各种实施方案中,所述抗iggfc是抗人iggfc。
附图说明
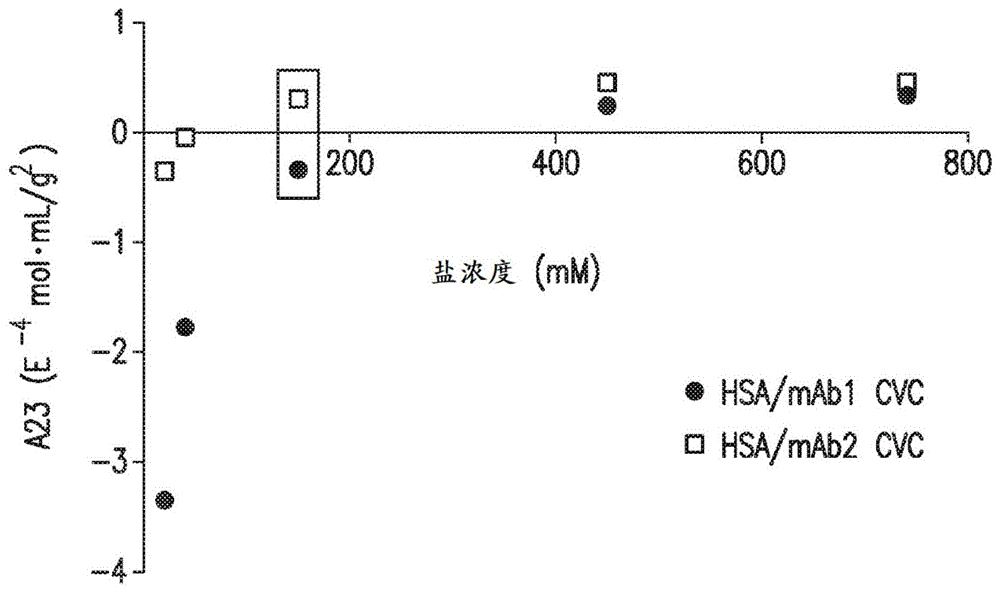
图1是示出通过cg-mals测量的mab1/hsa和mab2/hsa交叉相互作用的离子强度依赖性的图。通过cg-mals测定在磷酸盐缓冲液中增加浓度的nacl下10g/lhsa与10g/lmab1(·)或mab2(□)之间的相互作用的交叉维里系数(a23)。cvc的负值指示分子之间的吸引力,而cvc正值指示分子之间的排斥力。框指示生理离子强度,其中mab1和mab2的cvc值分别为负和正。
图2是示出mab和hsa的弱阳离子交换色谱洗脱图谱的图。通过用200mmmes、20mmnacl(ph6.5)平衡的弱阳离子交换柱上的分析型色谱法评估每种mab和hsa。梯度从20-500mmnacl施加,并用虚线表示为1mnacl溶液的百分比。示出hsa、mab1和mab2的代表性洗脱图谱。
图3a和3b是示出在不存在hsa的情况下通过bli测量的在137mmnacl下mab与生物素化抗原的结合的图。使用生物层干涉法在磷酸盐缓冲液中在生理盐浓度下观察到mab1(图3a)和mab2(图3b)与生物素化抗原的结合。将以纳米表示的波长变化(反应,nm)绘制为随时间变化,以指示由于结合事件所致的生物层厚度的变化。示出1.25nm、2.5nm、5nm、10nm、20nm和40nmmab的缔合和解离步骤。虚线迹线表示原始数据,并且实线迹线表示拟合曲线。将数据迹线在mab缔合步骤比对,并从所有样品迹线中减去参考数据。
图4a和4b是示出通过bli测量的hsa对mab与抗原的结合的影响为离子强度依赖性的图。通过生物层干涉法在磷酸盐缓冲液中在10(图4a)和137mmnacl(图4b)下观察到在不存在和存在hsa的情况下40nmmab1和mab2与生物素化抗原的结合。随时间变化的波长变化(反应,nm)指示结合事件,并且仅示出mab缔合和解离步骤。如上所述,将生物素化抗原负载到sa尖端上。在不存在和存在10g/lhsa的情况下评估mab1的结合,并且在不存在和存在10g/lhsa的情况下评估mab2结合。最少0.1g/lhsa用于防止与生物传感器尖端的非特异性结合。在以等效浓度的hsa进行基线测量后,将数据迹线在mab缔合步骤比对。针对由于溶液折射率的变化所致的从缔合转变至解离时的信号变化校正了含有10g/lhsa的样品的迹线。
图5a和5b是示出通过bli测量的hsa对mab与抗原的结合的影响为离子强度依赖性和mab特异性的图。通过生物层干涉法在10(图5a)和137(图5b)mmnacl下观察到在递增hsa浓度存在下,mab1(·)和mab2(□)与生物素化抗原的结合。归一化的反应(对0.1g/lhsa下的结合)显示为随hsa浓度变化。虚线指示1.0处的法线,以说明数据点与此线的关系。最少0.1g/lhsa用于防止与生物传感器尖端的非特异性结合。实验一式三份进行,并且示出平均值和标准偏差。在每种hsa浓度下进行单向anova,并用星号表示p值<0.05。所有数据总结于表2-4中。
图6a-6d是示出通过bli测量的ficoll70对mab与抗原的结合的影响的一组图。通过生物层干涉法在10mm(图6a)和137mm(图6b)nacl下观察到在递增ficoll70浓度存在下,mab1(·)和mab2(□)与生物素化抗原的结合。归一化的反应(对0.1g/lficoll70下的结合)绘制为随ficoll70浓度变化。图6a和6b中的虚线指示1.0处的法线,以说明数据点与此线的关系。实验一式三份进行,并且示出平均值和标准偏差。在每种hsa浓度下进行单向anova,并用星号表示p值<0.05。所有数据总结于表5-7中。缓慢结合动力学需要延长在非常高的ficoll70浓度(200g/l及以上,图6c和6d)下mab与抗原缔合的时间。通过生物层干涉法在10mm(图6c)和137mm(图6d)nacl下观察到在300g/lficoll存在下mab与生物素化抗原的结合。在不存在ficoll70的情况下,mab1和mab2的比对的反应(nm)显示为在延长的缔合时间(约3小时)内随时间变化。将300g/lficoll70添加至mab1和mab2显示相对减慢的结合动力学。
图7是示出生物传感器浸入hsa溶液在生物层干涉法实验中产生信号增加的图。在137mmnacl中mab1与负载有生物素化抗原的sa尖端的结合的代表性传感图。在基线测量(0-120s)后,在0.1g/lhsa存在下负载生物素化抗原并使其平衡(步骤a),传感器浸入10g/lhsa(步骤b),传感器浸入10g/lhsa+40nmmab1(步骤c),并且传感器浸入基线缓冲液(步骤d)。在步骤b中观察到的信号增加的幅度类似于针对使用负载生物素的sa(无抗原)的相同实验设置观察到的信号增加,从而表明信号是由于高蛋白浓度的hsa的折射率引起的,而不是由于与生物传感器尖端的特异性结合(数据未示出)。
图8a-8h是示出用抗人iggfc捕获尖端进行的亲和力测量的一组图。呈现以下各项的代表性生物层干涉法传感图:在10mm(图8a)和137mmnacl(图8b)中具有未标记抗原的mab1;在10mm(图8c)和137mmnacl(图8d)中具有生物素化抗原的mab1;在10mm(图8e)和137mmnacl(图8f)中具有未标记抗原的mab2;在10mm(图8g)和137mmnacl(图8h)中具有生物素化抗原的mab2。生物传感器尖端负载有抗体,以实现约0.6nm反应。抗原缔合步骤是100-300秒,并且解离是600-750秒。
图9是示出mab3不结合至抗原并且未观察到bli信号的变化的图。通过生物层干涉法在10(·)和137
图10是示出理想溶液、稀溶液和半稀溶液的差异的一组示意图。
图11是示出半稀溶液不等同于浓缩溶液的一组示意图。
图12是示出根据所公开的实施方案,用于测量在拥挤剂和抗原存在下抗体相互作用的通用生物层干涉法系统的示意图。
图13是示出根据所公开的实施方案,用于测量在拥挤剂和fcrn存在下抗体相互作用的通用生物层干涉法系统的示意图。
图14是示出hsa对抗体/fcrn结合的影响的图。
图15a和15b是示出在不同盐浓度下hsa的剂量-反应曲线效应的图。
图16是示出对于两种不同的抗体+/-fa,hsa的剂量-反应曲线效应的图。
图17是野生型和yte突变的序列比对。
图18是示出hsa对抗c5mab与fcrn的结合的剂量-反应曲线效应的图。
图19是示出hsa对抗寨卡mab与fcrn的结合的剂量-反应曲线作用效应的图。
图20是示出hsa对半衰期延长突变体的剂量-反应曲线效应的一组图。
具体实施方式
在描述本发明之前,应了解,本发明不限于所述的特定方法和实验条件,因为此类方法和条件可有所改变。还应理解,本文使用的术语仅出于描述特定实施方案的目的,并且并不意图是限制性的,因为本发明的范围将仅受所附权利要求限制。任何实施方案或实施方案的特征可彼此组合,并且此类组合明确地涵盖在本发明的范围内。
除非另外定义,否则本文中所使用的所有技术性和科学性术语具有与本发明所属领域的普通技术人员通常所理解相同的含义。如本文中所用,术语“约”在用于提及特定引述的数值时,是指所述值可从所引述值变化不大于1%。例如,如本文中所用,表述“约100”包括99和101以及介于之间的所有值(例如99.1、99.2、99.3、99.4等)。
虽然与本文所描述的那些方法和材料类似或等效的任何方法和材料可用于本发明的实践或测试中,但现在描述优选的方法和材料。本说明书中提及的所有专利、申请和非专利出版物均以引用的方式整体并入本文。
本文中使用的缩写
auc:分析超速离心
nmr:核磁共振
mals:多角度静态光散射
cg-mals:成分梯度多角度光散射
hsa:人血清白蛋白
mab:单克隆抗体
bli:生物层干涉法
sa:链霉亲和素
cvc:交叉维里系数
mbp:麦芽糖结合蛋白
fcrn:新生儿fc受体
feld1:主要猫过敏原
定义
如本文所用,术语“抗体”意图指包含四条多肽链,即通过二硫键互连的两条重(h)链和两条轻(l)链(即,“全抗体分子”)的免疫球蛋白分子,以及其多聚体(例如igm)或其抗原结合片段。每条重链包含重链可变区(“hcvr”或“vh”)和重链恒定区(包含结构域ch1、ch2和ch3)。在各种实施方案中,重链可以是igg同种型。在一些情况下,重链选自igg1、igg2、igg3或igg4。在一些实施方案中,重链具有同种型igg1或igg4,任选地包括同种型igg1/igg2或igg4/igg2的嵌合铰链区。每条轻链包含轻链可变区(“lcvr”或“vl”)和轻链恒定区(cl)。vh和vl区可进一步细分为具有高变性的区,称为互补决定区(cdr),其间散布有更保守的区,称为框架区(fr)。每个vh和vl由按以下顺序从氨基末端至羧基末端排列的三个cdr和四个fr组成:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。术语“抗体”包括提及任何同种型或亚类的糖基化和非糖基化的免疫球蛋白。术语“抗体”包括通过重组方式制备、表达、产生或分离的抗体分子,如从转染以表达所述抗体的宿主细胞中分离的抗体。有关抗体结构的综述,参见lefranc等人,imgtuniquenumberingforimmunoglobulinandtcellreceptorvariabledomainsandigsuperfamilyv-likedomains,27(1)devcompimmunol.55-77(2003);和mpotter,structuralcorrelatesofimmunoglobulindiversity,2(1)surv.immunol.res.27-42(1983)。
术语抗体还涵盖“双特异性抗体”,所述双特异性抗体包括可结合至多于一种不同表位的异四聚体免疫球蛋白。包含单一重链和单一轻链以及六个cdr的双特异性抗体的一半结合至一种抗原或表位,并且所述抗体的另一半结合至不同的抗原或表位。在一些情况下,所述双特异性抗体可结合同一抗原,但结合在不同的表位或非重叠表位处。在一些情况下,双特异性抗体的两半具有相同的轻链,同时保留双重特异性。双特异性抗体总体上描述于美国专利申请公布号2010/0331527(2010年12月30日)中。
术语抗体的“抗原结合部分”(或“抗体片段”)是指抗体的保留特异性地结合至抗原的能力的一个或多个片段。涵盖于术语抗体的“抗原结合部分”内的结合片段的实例包括:(i)fab片段,其为由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab’)2片段,其为包含由在铰链区的二硫桥键连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体的单臂的vl和vh结构域组成的fv片段;(v)由vh结构域组成的dab片段(ward等人(1989)nature241:544-546);(vi)分离的cdr;以及(vii)scfv,其由通过合成接头连接以形成单一蛋白链的fv片段的两个结构域vl和vh组成,其中所述vl和vh区配对以形成单价分子。术语“抗体”还涵盖其他形式的单链抗体,如双抗体(参见例如,holliger等人(1993)90pnasu.s.a.6444-6448;和poljak等人(1994)2structure1121-1123)。
此外,可使用本领域公知的标准重组dna技术获得抗体及其抗原结合片段(参见sambrook等人,1989)。
“fc融合蛋白”包含否则在自然界中不会一起发现的两种或更多种蛋白质的部分或全部,所述两种或更多种蛋白质中的一种是免疫球蛋白分子的fc部分。已例如由ashkenazi等人,(1991)88proc.natl.acad.sci.u.s.a.10535;byrn等人,(1990)344nature677;以及hollenbaugh等人,(1992)"constructionofimmunoglobulinfusionproteins",incurrentprotocolsinimmunology,增刊4,第10.19.1-10.19.11页描述包含某些融合于抗体源性多肽的各种部分(包括fc结构域)的异源多肽的融合蛋白的制备。“受体fc融合蛋白”包含与fc部分偶联的受体的一个或多个细胞外结构域,在一些实施方案中所述fc部分包含铰链区,随后是免疫球蛋白的ch2和ch3结构域。在一些实施方案中,fc融合蛋白含有结合至一种或多种配体的两个或更多个不同的受体链。例如,fc融合蛋白是trap,如例如il-1trap(例如,利纳西普,其含有与融合至higg1的fc的il-1r1细胞外区域融合的il-1racp配体结合区;参见美国专利号6,927,004),或vegftrap(例如,阿柏西普,其含有与融合至higg1的fc的vegf受体fik1的ig结构域3融合的vegf受体fit1的ig结构域2;参见美国专利号7,087,411(2006年8月8日发布)和美国专利号7,279,159(2007年10月9日发布))。
术语“人抗体”意图包括具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。本发明的人mab可包括未由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过在体外随机或位点特异性诱变或通过在体内体细胞突变来引入的突变),例如在cdr中并且尤其在cdr3中。然而,如本文所用,术语“人抗体”不意图包括来源于另一种哺乳动物物种(例如,小鼠)的种系的cdr序列移植至人fr序列上的mab。所述术语包括在非人哺乳动物或非人哺乳动物的细胞中重组产生的抗体。所述术语不意图包括从人受试者分离或在人受试者中产生的抗体。
“生物层干涉法”或“bli”是用于测量生物分子相互作用的无标记技术(参见例如,currentbiosensortechnologiesindrugdiscovery.cooper,m.a.drugdiscoveryworld,2006,68-82和higher-throughput,label-free,real-timemolecularinteractionanalysis.rich,r.l.;myszka,d.g.analyticalbiochemistry,2007,361,1-6)。bli是一种光学分析技术,所述技术分析从两个表面反射的光的干涉图案:例如生物传感器尖端上的固定化生物分子层和内反射层。结合至生物传感器尖端的靶生物分子的数量的变化引起干涉图案的位移,所述位移可被实时测量。
固定在生物传感器尖端表面上的捕获分子与溶液中的靶生物分子之间的结合产生生物传感器尖端处厚度的增加,从而导致波长偏移。用于bli的示例性仪器可例如从fortebio,fremontcalifornia商购获得。
如本文所用,术语“接触”是指呈直接物理缔合形式的放置。接触可与例如样品(如含有靶生物分子,如抗体的生物样品)在体外进行。
总体说明
就生物环境而言,血液是由数百种不同分子组成的复杂的拥挤溶液。对在此类非理想条件下蛋白质之间的非特异性相互作用的了解对于在生物学背景下获得更完整的蛋白质功能图至关重要。因此,在拥挤的环境中测量蛋白质活性至关重要,并且先前已使用诸如分析超速离心(auc)和核磁共振(nmr)的方法来检查拥挤溶液中的分子行为(heddi,b.和phan,a.t.structureofhumantelomericdnaincrowdedsolution.jamchemsoc133,9824-9833,doi:10.1021/ja200786q(2011);martorell,g.,adrover,m.,kelly,g.,temussi,p.a.和pastore,a.anaturalandreadilyavailablecrowdingagent:nmrstudiesofproteinsinheneggwhite.proteins79,1408-1415,doi:10.1002/prot.22967(2011);rivas,g.,fernandez,j.a.和minton,a.p.directobservationoftheself-associationofdiluteproteinsinthepresenceofinertmacromoleculesathighconcentrationviatracersedimentationequilibrium:theory,experiment,andbiologicalsignificance.biochemistry38,9379-9388,doi:10.1021/bi990355z(1999);rivas,g.和minton,a.p.non-idealtracersedimentationequilibrium:apowerfultoolforthecharacterizationofmacromolecularinteractionsincrowdedsolutions.journalofmolecularrecognition:jmr17,362-367,doi:10.1002/jmr.708(2004);pielak,g.j.等人proteinnuclearmagneticresonanceunderphysiologicalconditions.biochemistry48,226-234,doi:10.1021/bi8018948(2009);wright,r.t.,hayes,d.b.,stafford,w.f.,sherwood,p.j.和correia,j.j.characterizationoftherapeuticantibodiesinthepresenceofhumanserumproteinsbyau-fdsanalyticalultracentrifugation.analyticalbiochemistry550,72-83,doi:10.1016/j.ab.2018.04.002(2018))。然而,这些方法存在一些缺点;auc是可能需要数天时间的耗时的实验方法,而nmr在样品的离子强度和材料消耗方面存在局限性。
大分子拥挤对蛋白质的热力学和动力学性质的影响非常复杂且难以预测(elcock,a.h.predictionoffunctionallyimportantresiduesbasedsolelyonthecomputedenergeticsofproteinstructurejmolbiol312,885-896,doi:10.1006/jmbi.2001.5009(2001);candotti,m.和orozco,m.thedifferentialresponseofproteinstomacromolecularcrowding.ploscomputbiol12,e1005040,doi:10.1371/journal.pcbi.1005040(2016);minton,a.p.theinfluenceofmacromolecularcrowdingandmacromolecularconfinementonbiochemicalreactionsinphysiologicalmedia.thejournalofbiologicalchemistry276,10577-10580,doi:10.1074/jbc.r100005200(2001);zimmerman,s.b.和minton,a.p.macromolecularcrowding:biochemical,biophysical,andphysiologicalconsequences.annurevbiophysbiomolstruct22,27-65,doi:10.1146/annurev.bb.22.060193.000331(1993))。主要且不可避免的结果是空间排阻,也称为排除体积效应,其通常导致大分子缔合的更大潜力,从而增加所有分子的可用体积。蛋白质的各种物理化学属性(包括大小、形状、表面和固有电荷性质以及溶剂化状态)有助于净非特异性相互作用。此外,静电相互作用、范德华力、电荷各向异性(局部偶极矩)和疏水相互作用可能以相反的方式调节总体效应。最后,非特异性相互作用在很大程度上取决于溶液条件(例如,ph和离子强度;惰性共溶质),并且在某些情况下可能从净排斥相互作用变为吸引相互作用(zhang,z.,witham,s.和alexov,e.ontheroleofelectrostaticsinprotein-proteininteractions.physbiol8,035001,doi:10.1088/1478-3975/8/3/035001(2011);elcock,a.h.和mccammon,j.a.calculationofweakprotein-proteininteractions:thephdependenceofthesecondvirialcoefficient.biophysj80,613-625,doi:10.1016/s0006-3495(01)76042-0(2001);blanco,m.a.,perevozchikova,t.,martorana,v.,manno,m.和roberts,c.j.protein-proteininteractionsindilutetoconcentratedsolutions:alpha-chymotrypsinogeninacidicconditions.jphyschemb118,5817-5831,doi:10.1021/jp412301h(2014))。因此,在含有原本非相互作用的蛋白质的溶液中,源于高蛋白质浓度的非理想性可导致相当水平的异缔合或可使溶质保持处于更分散的分布。
热力学非理想性的后果是多种多样的。从抗体制造和配制的角度来看,其中分子的最终呈递常常超过100g/l,非理想性已显示改变多种蛋白质溶液现象,包括粘度、溶解度、相分离和自缔合(salinas,b.a.等人understandingandmodulatingopalescenceandviscosityinamonoclonalantibodyformulation.jpharmsci99,82-93,doi:10.1002/jps.21797(2010);connolly,b.d.等人weakinteractionsgoverntheviscosityofconcentratedantibodysolutions:high-throughputanalysisusingthediffusioninteractionparameter.biophysj103,69-78,doi:10.1016/j.bpj.2012.04.047(2012);liu,j.,nguyen,m.d,andya,j.d.和shire,s.j.reversibleself-associationincreasestheviscosityofaconcentratedmonoclonalantibodyinaqueoussolution.jpharmsci94,1928-1940,doi:10.1002/jps.20347(2005);raut,a.s.和kalonia,d.s.pharmaceuticalperspectiveonopalescenceandliquid-liquidphaseseparationinproteinsolutions.molpharm13,1431-1444,doi:10.1021/acs.molpharmaceut.5b00937(2016))。对于包括细胞内环境、细胞外基质和循环血液的生物系统的特定环境,大分子拥挤不仅影响结合平衡,而且影响反应速率、蛋白质折叠和异构化、蛋白质-蛋白质相互作用以及总体细胞稳态(spitzer,j.fromwaterandionstocrowdedbiomacromolecules:invivostructuringofaprokaryoticcell.microbiolmolbiolrev75,491-506,目录的第二页,doi:10.1128/mmbr.00010-11(2011);vandenberg,j.,boersma,a.j.和poolman,b.microorganismsmaintaincrowdinghomeostasis.natrevmicrobiol15,309-318,doi:10.1038/nrmicro.2017.17(2017);zhou,h.x.,rivas,g.和minton,a.p.macromolecularcrowdingandconfinement:biochemical,biophysical,andpotentialphysiologicalconsequences.annurevbiophys37,375-397,doi:10.1146/annurevbiophys.37.032807.125817(2008)。例如,由于拥挤的细胞环境,影响渗透转运进出细胞的细胞渗透平衡的理论模型需要考虑非理想的细胞内热力学(ross-rodriguez,l.u.,elliott,j.a.和mcgann,l.e.non-idealsolutionthermodynamicsofcytoplasm.biopreservbiobank10,462-471,doi:10.1089/bio.2012.0027(2012))。另外,大分子拥挤可能影响细胞病理学;已证明加速的淀粉样蛋白形成在拥挤环境中发生(hatters,d.m.,minton,a.p.和howlett,g.j.macromolecularcrowdingacceleratesamyloidformationbyhumanapolipoproteinc-il.thejournalofbiologicalchemistry277,7824-7830,doi:10.1074/jbc.m110429200(2002);lashuel,h.a.,hartley,d.,petre,b.m.,walz,t.和lansbury,p.t.,jr.neurodegenerativedisease:amyloidporesfrompathogenicmutations.nature418,291,doi:10.1038/418291a(2002);munishkina,l.a.,cooper,e.m.,uversky,v.n.和fink,a.l.theeffectofmacromolecularcrowdingonproteinaggregationandamyloidfibrilformation.journalofmolecularrecognition:jmr17,456-464,doi:10.1002/jmr699(2004))。生理环境的组成经常干扰通常用于表征维里系数的分析方法。因此,热力学非理想性现象及其后果具有实际和生物学意义。
通常将生物治疗性蛋白质(如单克隆抗体)以高浓度给药至血液中,血液是具有大量蛋白质含量的固有复杂且拥挤的溶液。大分子拥挤的影响以及由此产生的蛋白质非理想性可能导致在这种生理环境中相当水平的非特异性异缔合(参见图11和12)。因此,开发用于了解在此类非理想的拥挤条件(其与通常用于体外表征的那些显著偏离)下蛋白质之间的非特异性相互作用的方法对于在生物学背景下获得更完整的蛋白质功能图是重要的。为此,本公开涉及模型系统的开发,所述模型系统用于研究分子拥挤对生物活性分子(例如,抗体、双特异性抗体、融合蛋白、fc-受体融合蛋白)及其同源结合配偶体的相互作用(例如抗体-抗原或受体-配体相互作用)的影响。如本文所公开,通过测定在模拟体内环境的溶液中这些分子的相互作用(例如结合),可在开始昂贵的体内和/或临床试验之前收集关于这些分子的行为的信息。这种信息可用于做出关于寻求什么分子或化合物作为最终治疗剂的线索的明智决定。
人血清白蛋白(hsa)是人循环系统中最丰富的蛋白质之一,约占血浆中蛋白质含量的一半。hsa的相对丰富及其在多种生物学过程中的作用促使检查其与生物治疗药物的潜在相互作用,并且更重要地,这些相互作用可如何影响这些生物治疗药物在受试者中的生物活性。另外,由于白蛋白在生理ph下带负电荷,因此这增加了hsa与带净正电荷的生物治疗药物或大的溶剂暴露正表面之间非特异性静电相互作用的可能性。
本文证明了人血清白蛋白(hsa)与两种重组单克隆抗体(mab)之间的非特异性相互作用,以及这些相互作用对mab:抗原结合的影响。使用生物层干涉法(bli),评估了在生理hsa浓度下hsa对mab的抗原结合的影响以表明这些非特异性相互作用对mab:抗原相互作用具有功能性影响。重要地,用ficoll70(许多分子拥挤实验中使用的剂)取代hsa未产生相似的结果,从而证明hsa具有超出分子拥挤的作用,例如由于静电相互作用。当前公开的体外数据证明,血清中高浓度的hsa可能在体内导致与mab的非特异性相互作用,对其对抗原以及与其他功能相关蛋白质(包括fc受体)的亲和力具有潜在影响。综上所述,这些结果证明,本文公开的基于bli的方法可用于确定非特异性蛋白质-蛋白质相互作用对特定生物学相关相互作用的影响,从而提供用于在拥挤条件下评估结合事件的直接方法。
本公开的方面涉及一种在模拟体内条件的条件下确定非特异性相互作用对生物分子行为(如抗体与抗原和/或其表位的特异性结合)的影响的方法。例如,本文公开的方法可用于预测潜在治疗性生物分子(如单克隆抗体)是否将在体内经受非特异性相互作用,所述非特异性相互作用可如通过降低潜在治疗性生物分子的有效浓度并且因此降低功效而抑制其功能。因此,本文公开了一种在模拟体内条件下评估非特异性相互作用的影响的方法(关于示例性系统,参见图12)。在实施方案中,所述方法包括使包含生物学相关分子拥挤剂和靶生物分子的溶液与生物传感器接触。所述生物传感器的表面包括特异性地结合靶分子的捕获分子,以使得可评估和/或测定所述靶生物分子与所述生物传感器的结合(通过所述捕获分子介导)。在各种实施方案中,使生物传感器在溶液中孵育足以使靶生物分子结合至捕获分子(例如在达到平衡时)的时间。然后使用例如生物层干涉法(参见例如,图4a和4b)来测定与捕获分子结合的靶生物分子的量。在实施方案中,将结合至捕获分子的靶生物分子的量与对照进行比较,所述对照如区分与所述溶液中的其他分子具有吸引性非特异性相互作用的靶生物分子和与所述溶液中的其他分子具有排斥性非特异性相互作用的靶生物分子的阈值。低于所述阈值,即具有非特异性吸引力的靶生物分子可能比高于所述阈值的靶生物分子(其不表现出(或其表现出更少)的此类非特异性相互作用)更不令人希望。因此,所述方法可用于鉴定更适合于体内条件的靶生物分子,所述体内条件可在施用了所鉴定的靶生物分子的受试者体内发现。在一些实施方案中,所述阈值是归一化的反应,例如针对不具有或具有非常少分子拥挤剂的溶液和/或理想溶液、稀溶液或半稀溶液归一化。在一些实施方案中,生物学相关分子拥挤剂包括人血清白蛋白(hsa),并且将结合的量针对在低hsa浓度(如介于约0.0001g/lhsa与0.1g/lhsa之间),例如接近或模拟理想溶液、稀溶液或半稀溶液的条件下观察到的结合进行归一化。在此实例中,阈值将被设置为1,其对应于没有净吸引力或排斥力。归一化反应小于1的分子可被认为与生物学相关分子拥挤剂(如与hsa)具有非特异性相互作用,并且可重新考虑评价治疗潜力的其他研究。相反,归一化反应大于1的分子可被认为与生物学相关分子拥挤剂(如与hsa)没有显著非特异性相互作用,并且可被认为具有更大的治疗潜力,有必要进行另外的评价。在实施方案中,hsa以生理相关浓度存在于溶液中。在其他实施方案中(如上文或本文结合hsa讨论的那些),分子拥挤剂选自igg、转铁蛋白、纤维蛋白原、iga、α2-巨球蛋白、igm、α1-抗胰蛋白酶、触珠蛋白、α1-酸性糖蛋白、载脂蛋白a-1、载脂蛋白a-11、血浆、血清或者血液或血清样品中发现的任何其他蛋白质组分。
在某些实施方案中,hsa以介于约1g/l与约100g/l之间的浓度存在,如约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100g/lhsa,例如介于约35-50、25-40或10-80g/lhsa之间。在一些实施方案中,以各种浓度的生物学相关分子拥挤剂(例如,介于约1g/l与约100g/lhsa之间)进行所述方法,例如以测定靶分子对递增浓度的hsa的反应(参见例如,图5a和5b)。在实施方案中,所述方法包括测定在分子拥挤剂的两种或更多种浓度下结合的量,例如以产生剂量反应曲线。
在实施方案中,hsa负载有脂肪酸(fa),例如以确定fa的作用。在一些实施方案中,所述溶液包含生理组分(或另外的生理组分),如igg、转铁蛋白、纤维蛋白原、iga、α2-巨球蛋白、igm、α1-抗胰蛋白酶、触珠蛋白、α1-酸性糖蛋白、载脂蛋白a-1、载脂蛋白a-11,或者血液或血清样品中发现的任何其他蛋白质组分。在实施方案中,生物学相关分子拥挤剂包括血清和/或血浆。
在实施方案中,所述溶液处于生理ph,如中性ph附近的单个生理ph。然而,可设想所述方法可在多种ph下进行。在某些实施方案中,所述方法还包括测定在两种或更多种ph值下结合的量,以确定结合的ph依赖性。
在实施方案中,所述溶液处于生理盐浓度。在某些实施方案中,所述方法还包括测定在两种或更多种盐浓度下结合的量,以确定结合的盐依赖性。
所公开的方法可用于在模拟体内环境的非特异性相互作用的条件下测定一对生物学相关分子的结合。在实施方案中,所述靶分子包含单克隆抗体,并且所述捕获分子包含抗原,所述抗原特异性地(例如以高亲和力)结合至所述单克隆抗体。在实施方案中,所述靶分子包含抗原,如基于蛋白质的免疫原,并且所述捕获分子包含特异性地结合至所述抗原的单克隆抗体。在某些实施方案中,所述生物靶分子是一组突变型半衰期延长单克隆抗体。在某些实施方案中,所述靶分子包含受体或其配体结合片段,并且所述捕获分子包含特异性地结合至所述受体或其配体结合片段的配体。在某些实施方案中,所述靶分子包含配体,并且所述捕获分子包含特异性地结合至所述配体的受体或其配体结合片段。
本公开的方面进一步涉及在模拟体内条件下选择生物分子的方法。所公开的方法可用于筛选一组生物分子,如一组潜在候选治疗性单克隆抗体,以用于例如临床前或临床试验中的另外研究。在实施方案中,所述方法包括使包含生物学相关分子拥挤剂和靶生物分子(如第一靶生物分子)的溶液与生物传感器接触。所述生物传感器的表面包括特异性地结合靶分子的捕获分子,以使得可评估和/或测定所述靶生物分子与所述生物传感器的结合(通过所述捕获分子介导)。在实施方案中,所述第一靶生物分子选自两种或更多种目标靶生物分子的集合。使生物传感器在溶液中孵育足以使靶生物分子结合至捕获分子(例如在达到平衡时)的时间。然后使用生物层干涉法测定结合至捕获分子的靶生物分子的量。
在实施方案中,所述方法还包括使溶液,如模拟体内条件的第二溶液与所述生物传感器接触,其中所述第二溶液包含选自两种或更多种目标生物分子的集合的第二靶生物分子。使生物传感器在所述溶液中孵育足以使第二靶生物分子结合至捕获分子(例如在达到平衡时)的时间。然后使用生物层干涉法测定结合至捕获分子的第二靶生物分子的量。在实施方案中,将结合至捕获分子的第二生物分子的量与结合至捕获分子的第一生物分子的量进行比较,以鉴定所述第一生物分子和所述第二生物分子中的哪一者具有更大量的结合,例如以将生物分子(例如,抗体、双特异性抗体或融合蛋白)关于它们在生物学相关拥挤剂中与捕获分子的相应结合进行排序。可预期的是,这一过程可针对目标生物分子集合中的任何数量的生物分子,如目标单克隆抗体的集合重复进行。排序可用于从集合中选择单克隆抗体以进行进一步分析。在某些实施方案中,基于体内相容性选择生物分子。在实施方案中,第二溶液或第三、第四溶液等与第一溶液相同,除了存在一种或多种单独靶生物分子。因此,本文公开的方法可用于比较两种或更多种靶生物分子(如两种或更多种选自对捕获分子具有特异性的单克隆抗体的集合的单克隆抗体)的结合。在实施方案中,可将结合至捕获分子的第一和/或第二靶生物分子的量与如上所述的对照进行比较。
在某些实施方案中,生物学相关拥挤剂(例如,hsa)以介于约1g/l与约100g/l之间的浓度存在,如约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100g/l,例如介于约35-50、25-40或10-80g/l之间。在一些实施方案中,以各种浓度的生物学相关分子拥挤剂(例如,介于约1g/l与约100g/l之间)进行所述方法,例如以测定靶分子对递增浓度的拥挤剂的反应。在实施方案中,所述方法包括测定在分子拥挤剂的两种或更多种浓度下结合的量,例如以产生剂量反应曲线。
在实施方案中,拥挤剂是hsa或负载有脂肪酸(fa)的hsa,例如以确定fa的作用。在实施方案中,所述溶液包含生理组分或另外的生理组分,如igg、转铁蛋白、纤维蛋白原、iga、α2-巨球蛋白、igm、α1-抗胰蛋白酶、触珠蛋白、α1-酸性糖蛋白、载脂蛋白a-1、载脂蛋白a-11,或者血液或血清样品中发现的任何其他蛋白质组分。在实施方案中,生物学相关分子拥挤剂包括血清和/或血浆。
在实施方案中,所述溶液处于生理ph,如中性ph附近的单个生理ph。然而,可设想所述方法可在多种ph下进行。在某些实施方案中,所述方法还包括测定在两种或更多种ph值下结合的量,以确定结合的ph依赖性。
在实施方案中,所述溶液处于生理盐浓度。在某些实施方案中,所述方法还包括测定在两种或更多种盐浓度下结合的量,以确定结合的盐依赖性。
捕获分子可通过包括共价连接和/或化学交联的任何数量的方式附着于生物传感器。然后可通过与捕获探针的特异性结合使靶生物分子附着于生物传感器。生物传感器、试剂和反应容器的操作可用机器人进行。生物传感器对靶生物分子的捕获依赖于靶分子的特异性识别,包括例如对抗原的特异性抗体亲和力。通过本领域技术人员可利用的任何方法将选择的捕获分子固定在合适的基底上。例如,捕获分子可直接连接至基底上的选定官能团。或者,捕获分子可经由接头或间隔基间接连接至基底。如图12所示,链霉亲和素偶联至生物传感器的表面,并且通过链霉亲和素与生物素(图12中所示的实施例中的生物素化抗原)的结合将捕获分子募集到生物传感器上。在一些情况下,可经由与链霉亲和素(或生物素)的键联来固定选择的捕获分子,然后经由与基底共价连接的生物素(或链霉亲和素)部分使所述捕获分子附着于基底。在某些实施方案中,捕获分子通过接头偶联至传感器的表面。在某些实施方案中,接头包含生物素和链霉亲和素或亲和素。在一个实例中,靶分子是抗体,如人源化抗体,并且捕获分子是抗iggfc,如抗人iggfc。
实施例
提出以下实施例以为本领域普通技术人员提供如何制造并使用本发明的方法的完整公开内容和描述,但不意图限制发明人所认为的发明范围。虽然已尽力确保关于所用数字(例如量、温度等)的准确性,但仍应考虑一些实验误差和偏差。除非另外指出,否则份数是重量份,分子量是平均分子量,温度是摄氏度,室温是约25℃,并且压力是大气压或接近大气压。
实施例1:用生物层干涉法测量大分子拥挤对蛋白质功能的影响
尽管在分子水平上非常复杂,但是可方便地用第二渗透维里系数表达从适度高水平的蛋白质浓度(约10g/l)观察到的与理想性的偏差(neal,b.l.,asthagiri,d.和lenhoff,a.m.molecularoriginsofosmoticsecondvirialcoefficientsofproteins.biophysj75:2469-2477,doi:10.1016/s0006-3495(98)77691-x(1998))。自身(b22)和交叉(b23)维里系数表征分别含有单一和多种蛋白质种类的溶液中的弱非特异性蛋白质-蛋白质相互作用。多角度静态光散射(mals)是允许测定理想限制内各种大分子(包括蛋白质)的摩尔质量的第一原理分析方法。因此,通常使用静态光散射法来确定第二维里系数,所述第二维里系数反映净相互作用(蛋白质-蛋白质和蛋白质-溶质),并从摩尔质量的浓度依赖性中排除溶液中所有物质的体积效应(alford,j.r.,kendrick,b.s.,carpenter,j.f.和randolph,t.w.measurementofthesecondosmoticvirialcoefficientforproteinsolutionsexhibitingmonomer-dimerequilibrium.analyticalbiochemistry377,128-133,doi:10.1016/j.ab.2008.03.032(2008))。在成分梯度多角度光散射(cg-mals)中,光散射检测器被放置在自动注射泵系统的下游,所述自动注射泵系统能够根据需要同时注射多达三种不同溶液,每种溶液含有不同的分子(some,d.,kenrick,s.inproteininteractions(jianfengcai编)(intech,2012))。在这种分批模式下,测定溶液中所有溶质的重均摩尔质量,并且可利用有限的先前知识提供结合相互作用的定量分析。已经开发了几种cg-mals实现方案来表征蛋白质与其他大分子之间的特异性和非特异性相互作用。对于非特异性蛋白质-蛋白质相互作用,cg-mals系统具有从单个实验中提取自身维里系数以及交叉维里项的优势。除了所使用的公认的分析算法之外,所述技术的稳健性还使得能够在一系列浓度范围内高效且相对简单地表征蛋白质溶液中的相互作用(some,d.,pollastrini,j.和cao,s.characterizingreversibleproteinassociationatmoderatelyhighconcentrationviacomposition-gradientstaticlightscattering.jpharmsci105,2310-2318,doi10.1016/j.xphs2016.05.018(2016))。
cg-mals方法对于确定两种物质之间的非特异性相互作用的程度和性质非常方便;然而,当浓度超过10g/l时,此类系统的数据分析将变得更加繁琐和不精确。这导致寻求替代方法,所述替代方法可将浓度范围扩展至生理相关浓度,以及扩大研究范围以包括非特异性相互作用对特定功能性结合事件的影响。生物层干涉法(bli)是用于测量特异性大分子相互作用(包括测定动力学和结合亲和力)的没有标记的光学技术(abdiche,y.,malashock,d.,pinkerton,a.和pons,j.determiningkineticsandaffinitiesofproteininteractionsusingaparallelreal-timelabel-freebiosensor,theoctet.analyticalbiochemistry377,209-217,doi:10.1016/j.ab.2008.03.035(2008);fang,y.,li,g.和ferrie,a.m.non-invasiveopticalbiosensorforassayingendogenousgprotein-coupledreceptorsinadherentcells.journalofpharmacologicalandtoxicologicalmethods55,314-322,doi:10.1016/j.vascn.2006.11.001(2007),rich,r.l.和myszka,d.g.surveyoftheyear2006commercialopticalbiosensorliterature.journalofmolecularrecognition:jmr20,300-366,doi:10.1002/jmr.862(2007))。bli分析从内部参考层以及生物传感器尖端上的固定蛋白质层(即生物层)反射的白光的干涉图案。结合事件增加生物层上分子的数量,从而产生可实时监测的干涉图案的位移。这种方法已用于评估蛋白质-蛋白质相互作用(shah,n.b.和duncan,t.m.bio-layerinterferometryformeasuringkineticsofprotein-proteininteractionsandallostericligandeffects.journalofvisualizedexperiments:jove,e51383,doi:103791/51383(2014))、蛋白质-配体相互作用(frenzel,d.和willbold,d.kinetictitrationserieswithbiolayerinterferometry.plosone9,e106882,doi:10.1371/journal.pone0106882(2014))、蛋白质-核酸相互作用(park,s.等人structuralbasisforinteractionofthetandemzincfingerdomainsofhumanmuscleblindwithcognaternafromhumancardiactroponint.biochemistry56,4154-4168,doi:10.1021/acs.biochem.7b00484(2017);sultana,a.和lee,j.e.measuringprotein-proteinandprotein-nucleicacidinteractionsbybiolayerinterferometry.currentprotocolsinproteinscience79,192511-26,doi:10.1002/0471140864.ps1925s79(2015))以及小分子和肽筛选(wartchow,c.a.等人biosensor-basedsmallmoleculefragmentscreeningwithbiolayerinterferometry.journalofcomputer-aidedmoleculardesign25,669-676,doi:10.1007/s10822-011-9439-8(2011))等。
本文公开了使用人血清白蛋白(hsa)来测量拥挤溶液中非特异性相互作用对mab:抗原相互作用的影响以在简化的系统中证明这些原理的方法。在35-50g/l的生理浓度范围下,白蛋白占血清体积分数的绝大部分,并且在生理ph下带负电荷,这可能导致与带有净正(或负)电荷的生物治疗药物或溶剂暴露表面的静电缔合(或排斥)。为此,首先在使用cg-mals的二元(hsa和mab)系统中、然后在使用生物层干涉法(bli)的三元相互作用(hsa、mab、抗原)系统中,研究hsa与结合相同抗原的两种重组完全人igg4单克隆抗体(mab1和mab2)之间的非特异性相互作用。除了靶向抗原上的不同表位的互补决定区(cdr),这些mab的序列高度相似。所述二元系统通过公认的光散射方法论证明,在亚生理蛋白浓度下,hsa与mab之间的非特异性相互作用是离子强度依赖性以及mab特异性的。为了进一步阐明这些相互作用对mab的功能特性的影响,以非标准方式使用bli来评估从低至生理hsa浓度mab的抗原结合。bli结果与cg-mals数据相关,从而证明在高hsa浓度存在下,bli的这种新颖使用可直接评估由于拥挤所致的非特异性相互作用对高度特异性、功能性相互作用如抗体:抗原结合的影响。本文提供的结果证明,血清中高浓度的hsa会导致与mab的非特异性相互作用,对抗体功能具有潜在影响。虽然在低离子强度下影响尤为明显,但对于这组特定的mab,在生理离子强度下影响减轻,然而,这种趋势并不一定扩展至所有其他mab:抗原系统。通过在生物治疗药物开发的早期阶段利用这种方法,可很容易地检测非特异性相互作用的影响;相反,这种类型的研究也可减轻对体内意外后果的担忧。在简单、受控的系统中使用bli平台与适应分析,发明人证明可确定非特异性相互作用的功能影响,从而为探索后果的广度奠定了基础,大分子拥挤和蛋白质非理想性可在更复杂的溶液中表现出来。
材料和试剂制备:本研究中使用的所有单克隆抗体均为研究级,并且由regeneronpharmaceuticals,inc.在临床前制造和工艺开发部(tarrytown,ny)生产。所有抗体均为完全人igg4分子,并切在铰链区中含有s108p突变,以便重组lgg1铰链序列来使lgg4二聚体形成稳定,并在从中国仓鼠卵巢细胞克隆的regeneron的专有细胞系中产生。冻干的人血清白蛋白(hsa)、ficoll70和溶液组分均获自sigma-aldrich(stlouis,mo)或vwr(radnor,pa),并且是可获得的最高等级。
通过将冻干的hsa溶解于补充有10mmnacl的磷酸盐缓冲液(1.8mmkh2po4、10mmna2hpo4、2.7mmkcl,ph7.4)中来制备单体hsa,并用在相同缓冲液中平衡的hiload26/100superdex200尺寸排阻柱(gehealthcarelittlechalfont,uk)进行纯化。在纯化后,使用具有10kda截留值的离心过滤器(amicon,billerica,ma)将hsa浓缩至约100-130g/l。以类似于cg-mals实验的方式制备抗体。使用35,700m-1cm-1的消光系数用solovpe分光光度计在uvλ=280nm下测定hsa浓度。对于bli测量,通过将高浓度mab制剂(>50g/l)稀释到补充有10mmnacl的磷酸盐缓冲液中来制备mab的储备溶液(1g/l),并以40nm的最终浓度使用平衡实验。对于mab1使用103,555m-1cm-1的消光系数并且对于mab2使用100,700m-1cm-1的消光系数来在uvλ=280nm下测定蛋白质浓度。通过将冻干的ficoll70溶解到补充有10mmnacl的磷酸盐缓冲液中来制备ficoll70的储备溶液(600mm),并轻轻旋转过夜以促进溶解。按照制造商的标记方案,将抗原用生物素-酰肼(thermofisher,waltham,ma)生物素化。
按照制造商的标记方案,将糖蛋白抗原在单一聚糖上用生物素-酰肼(thermofisher,waltham,ma)生物素化。简言之,使用0.1m乙酸钠ph4.7制备8g/l偏高碘酸钠(sigma-aldrich)溶液,并与抗原混合,在室温下在箔中旋转15分钟,然后用1%(v/v)甘油淬灭。将氧化的抗原通过superdex75increase10/300柱(gehealthcarelittlechalfont,uk)在0.1m磷酸钠ph6.0中洗脱。合并含有抗原的级分并浓缩,然后与10倍摩尔过量的生物素-酰肼一起在室温下孵育2小时。通过用补充有10mmnacl的ph7.4的磷酸盐缓冲液平衡的同一柱洗脱标记的抗原。
弱阳离子交换色谱法:在用200mmmes、20mmnacl(ph6.5)平衡的propacwcx-10(4mmx250mm)液相色谱柱(thermofisher)上进行弱阳离子交换色谱。将蛋白质纯净地注入,并将10μg的每种样品以0.5ml/min的流速施加至acquityuplc系统(waters,milford,ma)上的柱上。20至500mmnacl范围内的梯度用于蛋白质洗脱。
成分梯度多角度光散射(cg-mals):将所有蛋白质针对适当的缓冲液透析过夜;所有缓冲液均通过0.02μm过滤器,并且所有蛋白质样品均通过0.1μmanotop25plus注射器式过滤器(whatman,maidstone,uk),并在使用前在约25托下真空脱气10分钟。在过滤之前,将初始蛋白质储备溶液手动稀释至大约10g/l。采用calypso成分梯度系统,结合minidawntreosmals光度计和optilabt-rex在线差示折光计(calypso系统和来自wyatttechnology,santabarbara,ca的两个检测器)来使用交叉梯度方案收集has、mab及其混合物的静态光散射测量值。简言之,对calypso泵系统进行编程,以便以1g/l增量从1至10g/l浓度自动稀释和注入hsa(10个注入或步骤)。在注入未稀释的(10g/l)hsa后,在一系列十次注入中,随着mab的浓度增加10%,hsa的浓度降低10%(交叉时期)。在注入未稀释的mab(10g/l)后,通过一系列九次注入,其浓度以1g/l增量降低。尽管这种浓度不反映生理条件,但它是推荐用于确定交叉维里系数的最大最佳浓度。在每个步骤,注入2ml适当稀释/混合的样品,以使检测器流动池完全饱和;在创建和注入随后的浓度/混合步骤之前,在静态条件下采集90秒的数据。在梯度程序之前和之后立即获得基线测量值。在确认没有显著角度依赖性光散射后,仅将来自90°光散射检测器的数据用于分析。仪器控制、数据采集和数据分析(some,d.,kenrick,s.inproteininteractions(jianfengcai编)(intech,2012);some,d.light-scattering-basedanalysisofbiomolecularinteractions.biophysrev5,147-158,doi:10.1007/s12551-013-0107-1(2013))都用calypso软件(wyatttechnology)进行。
生物层干涉法:使用具有链霉亲和素的octetred96(sa,目录号18-5019)或抗人iggfc捕获(ahc,目录号18-5064)包被的生物传感器尖端(fortebio,menlopark,ca)进行生物层干涉法测试。将96孔板填充200μl的溶液(缓冲液、抗原、hsa或mab),并以1,000rpm搅拌,并且所有实验均温度控制在25℃下。由于溶液的蒸发而避免了更高的温度。对于所有测试,将sa或抗人fc尖端在补充有低(10mmnacl)或生理(137mmnacl)盐浓度的磷酸盐缓冲液(ph7.4)中在室温下水合20分钟。除非另有说明,否则所有描述的缓冲液和样品溶液均含有0.1g/lhsa。在没有分析物的情况下,将尖端浸入缓冲液中进行基线扣除。
使用ahc尖端进行测量抗原与负载抗体的尖端的结合的标准实验。在补充有0.1g/lhsa的含有低或生理盐浓度的磷酸盐缓冲液中进行ahc尖端的基线测量2分钟后,将尖端在2.5μg/ml抗体中孵育以实现约0.6nm反应。然后将负载抗体的尖端浸入缓冲液中2分钟以除去过量的mab,然后进行100-300秒与各种浓度的未标记抗原(通常2.5-50nm)的缔合步骤。将尖端浸入缓冲液中750秒以进行解离步骤。对于两种mab,在10mm和137mmnacl下对生物素化的抗原进行相同的程序。
使用sa尖端进行测量抗体与负载抗原的尖端的结合的标准结合测试。在含有0.1g/lhsa的低或生理盐磷酸盐缓冲溶液中进行sa尖端的基线测量2分钟后,将尖端在5μg/ml生物素化抗原中孵育,以实现约0.6nm反应。然后将负载抗原的尖端浸入缓冲液中2分钟以除去过量抗原,然后进行900秒与各种浓度的未标记抗原(通常2.5-50nm)的缔合步骤。将尖端浸入缓冲液中1800-3600秒以进行解离步骤。对于两种mab,针对10mm和137mmnacl进行相同的程序。
为了在高达50g/lhsa存在下进行mab与抗原的结合的稳态分析,需要在hsa中的额外孵育步骤。在抗原负载后,将传感器浸入含有0.1-50g/lhsa的孔中以平衡约15分钟,然后在具有相同组成的新鲜溶液中孵育2分钟以建立新的基线,这是由于hsa孵育后信号略有增加(参见图7,步骤b)。然后将传感器浸入含有40nmmab加0.1-50g/lhsa的孔中20分钟,作为第二缔合步骤。对于所有平衡实验,将mab与抗原结合的缔合步骤完成时的信号反应(nm)用作度量。在hsa>0.1g/l存在下,对于任何测量mab:抗原结合的实验均未进行动力学分析。通过将针对每种hsa浓度获得的原始反应(nm)除以0.1g/lhsa中mab:抗原结合的原始反应,将数据针对1.0归一化。所有实验一式三份进行。在每种条件下,使用jmp软件(sasinstitute,cary,nc)进行单向方差分析(anova),以通过确定p值来评估mab1和mab2之间的差异是否具有统计学显著性。
以相似的方式进行含有ficoll70的实验,用ficoll70取代hsa。对于含有200g/lficoll70或更高的实验,由于粘度增加而需要更长的mab与抗原结合时间(约1.7-3小时),以达到平衡。
mab1/hsa和mab2/hsa非特异性相互作用的离子强度依赖性:使用成分梯度多角度光散射(cg-mals)检查在不同离子强度下hsa与每种mab之间的非特异性相互作用,成分梯度多角度光散射是一种测定交叉维里系数(cvc)的公认方法。为了最好地解释数据,在通过bli进行分析之前,应用这种方法来测定hsa与mab之间非特异性相互作用的程度和性质。几位研究人员根据严格的热力学原理指出,由静态光散射测定的维里系数不是纯的自身或交叉相互作用参数,而是与蛋白质:共溶质(即缓冲液或电解质)相互作用卷积(alford,j.r.,kendrick,b.s.,carpenter,j.f.和randolph,t.w.measurementofthesecondosmoticvirialcoefficientforproteinsolutionsexhibitingmonomer-dimerequilibrium.analyticalbiochemistry377,128-133,doi:10.1016/j.ab.2008.03.032(2008);deszczynski,m.,harding,s.e.和winzor,d.j.negativesecondvirialcoefficientsaspredictorsofproteincrystalgrowth:evidencefromsedimentationequilibriumstudiesthatrefutesthedesignationofthoselightscatteringparametersasosmoticvirialcoefficients.biophyschem120,106-113,doi:10.1016/j.bpc.2005.10.003(2006);winzor,d.j.,deszczynski,m.,harding,s.e.和wills,p.r.nonequivalenceofsecondvirialcoefficientsfromsedimentationequilibriumandstaticlightscatteringstudiesofproteinsolutions.biophyschem128,46-55,doi:10.1016/j.bpc.2007.03.001(2007))。因此,优选的惯例是将来自光散射分析的维里系数称为a2,以便将其与摩尔浓度条件(b22)区分开。如果蛋白质不带高电荷,且共溶质是简单的缓冲液和电解质,则a2(此处使用)与b22之间的数值差异最小。类似地,来自光散射测量的cvc或a23是两种物质之间非特异性相互作用的性质和程度的指标,并且在含有10-750mmnacl的缓冲溶液中测量了mab1/hsa和mab2/hsa相互作用(图1)。a23的负值表示两种物质之间的吸引力,而正值表示排斥力。在10mmnacl的浓度下,mab1/hsa和mab2/hsa均表现出吸引力,与mab2/hsa相比,在mab1/hsa之间观察到的力更强。随着离子强度增加,这种现象减轻。在生理离子强度(约137mmnacl)下,mab1与hsa之间的非特异性相互作用是略微吸引性的,而mab2与hsa之间的非特异性相互作用是略微排斥性的。这显示了与hsa的非特异性相互作用的离子强度依赖性和mab依赖性。为了确定静电在这些相互作用中的作用,通过离子交换色谱法对分子进行了评估。
色谱方法显示mab1和mab2具有不同的表面性质:检查了mab1和mab2的表面性质,以确定是否能够通过分子之间的长程电荷-电荷相互作用来驱动与hsa的非特异性相互作用的不同程度。随后,进行弱阳离子交换色谱法,以更具体地评估两种mab的表面性质。这些实验表明,mab1的保留时间(约13分钟)比mab2(约6分钟)长得多,从而表明与带电柱树脂的相互作用更强(图2)。类似地,评估了hsa的色谱图,与两种mab相比,hsa在非常低的保留时间(约2分钟)洗脱,从而表明更酸性表面电荷。用疏水相互作用色谱法评估mab显示洗脱体积的最小差异(数据未显示),从而表明mab与hsa之间非特异性相互作用的差异本质上可能是静电的,而不是由于疏水相互作用所致。总之,这些数据证明,每种mab的表面性质都可在与hsa的非特异性相互作用的程度和性质中发挥重要作用。为了进一步评估这些相互作用以及它们对mab功能性质的影响,在不存在和存在hsa的情况下,生物层干涉法用于检查mab对抗原的结合亲和力。
使用生物层干涉法,两种mab以相似的结合亲和力结合至生物素化抗原:为了评估hsa的生理相关水平对两种mab的结合性质的影响,利用生物层干涉法(bli)来监测mab与它们的共同抗原的缔合。为了测试系统和试剂,使用抗人iggfc捕获(ahc)生物传感器尖端进行了标准亲和力测量实验,将mab1或mab2负载到尖端上,并在低盐和生理盐条件下测量了与未修饰的抗原或生物素化抗原的抗原结合(图8a-8h)。来自这些实验的数据汇总在表1中,并且显示就kon、koff和kd而言,与先前生成的biacore表面等离子体共振(spr)数据(数据未示出)的强相似性。
表1.通过bli来自用抗人fc捕获生物传感器尖端进行的动力学测定的结合动力学参数
使用负载抗原的生物传感器尖端进行标准亲和力测量实验,以检测抗体结合。为此,将抗原进行位点特异性生物素化并负载到链霉亲和素包被的生物传感器尖端上。通过固定较小的抗原而不是mab,由抗体结合产生的反应变化(nm)给出了更明显的信号,并且因此改善了信噪比。图3示出来自在理想溶液条件下进行以测定每种mab的结合亲和力的标准bli测试的结果。缓慢的解离动力学无法准确估计表观kd,但紧密结合表明亚纳摩尔功能结合亲合力,这与biacorespr数据(未示出)一致。
已经确定在理想溶液条件和实验条件下进行的动力学结合测试产生与先前进行的biacorespr研究(数据未示出)一致的结果,并且所制备的试剂具有完全活性,在高生理相关浓度的hsa存在下检查mab与生物素化抗原的结合。由于在40nmmab浓度下与抗原结合的反应水平,其允许监测信号的减少和增加并且远低于约550nm的近似生理给药浓度,所以选择此浓度用于所有后续结合实验。
hsa对mab与抗原结合的总体影响是离子强度依赖性的且mab特异性的:为了研究hsa对mab-抗原结合的影响,在非理想溶液条件下采用了bli测试,并分析了稳态终点数据。通过在与每种mab长时间(20分钟)缔合步骤后监测稳态反应(nm)水平,确定在平衡或接近平衡下在hsa存在下所实现的与抗原结合的水平。由于亲合力形式和hsa浓度增加而赋予的增加的复杂性,因此未进行动力学(缔合和解离速率)分析。还在不存在抗体的情况下仅用hsa进行了对照(数据未示出),以证明hsa不与抗原相互作用。图4示出在10mm或137mmnacl下在存在和不存在10g/lhsa的情况下mab1和mab2的传感图。这些数据定性地示出hsa在两种离子强度条件下对于两种mab所具有的影响的差异,从而证明离子强度依赖性以及与hsa的mab相互作用的差异。在低盐下,hsa对mab1的影响大于对mab2的影响,反映在添加hsa后的反应差异中。在生理盐下,10g/lhsa对任一mab与抗原的相互作用的影响最小。这些结果与上述cg-mals数据相关,并且揭示对mab的功能性质的潜在影响。
在低盐和生理盐条件下进一步说明了增加hsa浓度的影响(图5),其中将各种hsa浓度平衡时的反应水平针对0.1g/lhsa水平进行归一化。在10mmnacl下,mab2随hsa浓度增加而具有反应的适度降低(即抗原结合降低)(约20%),而mab1表现出更显著降低(约40%;图5a,表2)。在137mmnacl下,两种单克隆抗体均在20g/lhsa浓度下,显示抗原结合的适度增加;在更高hsa浓度下,与mab2相比,hsa对抗原结合的影响对于mab1更大(图5b,表3)。与hsa不存在下mab结合的反应相比(由图5b中的虚线表示),在生理hsa范围(35-50g/l,表4)内,mab1的信号降低约10%,而mab2的信号增强约6%。所观察到的结合事件对抗原结合具有特异性;在0.1至50g/lhsa存在下,不结合此抗原的对照mab(mab3)未显示信号或结合的增加(图9)。
表2.在10mmnacl中在hsa存在下结合反应的归一化值。
表3.在137mmnacl中在hsa存在下结合反应的归一化值。
表4.在hsa中mab1和mab2的anova结果的总结。
*表示p值<0.05
拥挤剂ficoll70未产生对mab与抗原的结合的相同影响:为了确定所观察到的hsa对mab/抗原结合的影响是可归因于mab与hsa之间的非特异性相互作用还是归因于更普遍的大分子拥挤效应,在存在等效浓度的ficoll70(一种经常用作拥挤剂的高度可溶性多糖)的情况下评估了mab与抗原的结合(zhou,h.x.,rivas,g.和minton,a.p.macromolecularcrowdingandconfinement:biochemical,biophysical,andpotentialphysiologicalconsequences.annurevbiophys37,375-397,doi:10.1146/annurev.biophys.37.032807.125817(2008))。ficoll70是不与蛋白质特异性相互作用的无色的约70kda聚合物。在10和137mmnacl下在与hsa实验中使用的浓度相等的ficoll70浓度情况下(0-50g/l,图6),几乎未观察到mab1和mab2与抗原结合的归一化反应中的变化。还在更代表拥挤研究中使用的浓度的ficoll70浓度(100-300g/l,图6)下评估了结合。如所预期,在这些浓度的ficoll70中,尤其是对于mab1,mab与抗原结合的缓慢动力学需要延长缔合期来实现接近平衡的反应水平(总时间限制在约3小时以防止孔溶液的任何蒸发;图6c和6d)对于低盐浓度和生理盐浓度两者,对于所有ficoll浓度均观察到对抗原结合的最小且高度相似的影响。这些数据表明,在hsa情况下观察到的对抗原结合的影响可能是由于hsa与mab之间的静电相互作用,而不是更普遍的排除体积效应的现象。
表5.在10mmnacl中在ficoll70存在下结合反应的归一化值。
表6.在137mmnacl中在ficoll70存在下结合反应的归一化值。
表7.在ficoll中mab1和mab2的anova结果的总结。
*表示p值<0.05
大分子拥挤在生物学中普遍存在。在拥挤溶液中所产生的蛋白质之间的非理想相互作用预计深刻影响蛋白质行为和功能(minton,a.p.theinfluenceofmacromolecularcrowdingandmacromolecularconfinementonbiochemicalreactionsinphysiologicalmedia.thejournalofbiologicalchemistry276:10577-10580,doi:10.1074/jbc.r100005200(2001);hu,z.,jiang,j.和rajagopalan,r.effectsofmacromolecularcrowdingonbiochemicalreactionequilibria:amolecularthermodynamicperspective.biophysj93:1464-1473,doi:10.1529/biophysj.107.104646(2007);wei,j.,dobnikar,j.,curk,t.和song,f.theeffectofattractiveinteractionsandmacromolecularcrowdingoncrystallinsassociation.plosone11e0151159,doi:10.1371/journal.pone.0151159(2016))。这些高度非线性效应的具体性质通常很难预测,如若干报告中的不同结论所证明(kuznetsova,i.m.,turoverov,k.k.和uversky,v.n.whatmacromolecularcrowdingcandotoaprotein.intjmolsci15,23090-23140,doi:10.3390/ijms151223090(2014);minton,a.p.implicationsofmacromolecularcrowdingforproteinassembly.curropinstructbiol10,34-39(2000))。使用不同大分子拥挤剂的有限数量的研究对平衡常数和反应速率显示显著影响,通常若干对数数量级(minton,a.p.theinfluenceofmacromolecularcrowdingandmacromolecularconfinementonbiochemicalreactionsinphysiologicalmedia.thejournalofbiologicalchemistry276:10577-10580,doi:10.1074/jbc.r100005200(2001);kuznetsova,i.m.,turoverov,k.k.和uversky,v.n.whatmacromolecularcrowdingcandotoaprotein.intjmolsci15,23090-23140,doi:10.3390/ijms151223090(2014);minton,a.p.molecularcrowding:analysisofeffectsofhighconcentrationsofinertcosolutesonbiochemicalequilibriaandratesintermsofvolumeexclusion.methodsenzymol295,127-149(1998);kim,j.s.和yethiraj,a.effectofmacromolecularcrowdingonreactionrates:acomputationalandtheoreticalstudy.biophysj96,1333-1340,doi:10.1016/j.bpj.2008.11.030(2009);jiao,m.,li,h.t.,chen,j.,minton,a.p.和liang,y.attractiveprotein-polymerinteractionsmarkedlyaltertheeffectofmacromolecularcrowdingonproteinassociationequilibria.biophysj99,914-923,doi:10.1016/j.bpj.2010.05.013(2010))。总之,这突出了对于能够在紧密复制生理环境的条件下容易提供有关非理想性的影响的信息的技术的需求。在此,通过两种互补技术cg-mals和bli检查了白蛋白的生理浓度如何影响单克隆抗体的功能。cg-mals(能够测量两种物质之间的交叉维里系数的一种功能强大且公认的工具)用于获得系统中的非特异性相互作用的初始了解。然后使用bli方法与适于非理想溶液条件的稳态分析来首先复制cg-mals结果,然后通过在生理浓度的hsa下进行抗原结合的平衡测量来扩展这些观察结果。虽然正交方法(如带有荧光检测的auc)可测量非理想条件下的特异性相互作用(wright,r.t.,hayes,d.b.,stafford,w.f.,sherwood,p.j.和correia,j.j.characterizationoftherapeuticantibodiesinthepresenceofhumanserumproteinsbyau-fdsanalyticalultracentrifugation.analyticalbiochemistry550,72-83,doi:10.1016/j.ab.2018.04.002(2018);wright,r.t.,hayes,d.,sherwood,p.j.,stafford,w.f.和correia,j.j.aucmeasurementsofdiffusioncoefficientsofmonoclonalantibodiesinthepresenceofhumanserumproteins.eurbiophysj,doi:10.1007/s00249-018-1319-x(2018)),但bli有利地作为方便且高通量的方法来评估具有固有灵活性的结合相互作用,以在高浓度的拥挤剂下测试许多不同的条件,并且因此可在一小组实验中提供有关在各种环境中结合的信息。这种方法是在发现研究早期在筛选过程中从考虑中消除mab或其他分子的简便且有效的方法。
由不同蛋白质呈现的溶剂可及表面区域的物理化学复杂性在非特异性大分子相互作用的多样性中起着基本作用。在中等蛋白质浓度(≤10g/l)下,其中排除体积效应不突出,静电可能是主要的分子间力(elcock:a.h.和mccammon,j.a.calculationofweakprotein-proteininteractions:thephdependenceofthesecondvirialcoefficient.biophysj80:613-625,doi:10.1016/s0006-3495(01)76042-0(2001))。与此概念一致,使用cg-mals,具有不同实验方式观察到的基本等电点(相差约0.65个ph单位)的mab1和mab2均显示与具有酸性等电点的hsa相互作用。这些不是特异性相互作用,而是hsa与每种抗体之间的非特异性相互作用。对于两种抗体,与hsa相互作用的幅度均显示随着离子强度增加而减轻,从而进一步表明分子之间的主要力是静电的,因为静电相互作用可通过增加离子强度来有效地筛选(roberts,d.等人specificionandbuffereffectsonprotein-proteininteractionsofamonoclonalantibody.molpharm12,179-193,doi:10.1021/mp500533c(2015);roberts,d.等人theroleofelectrostaticsinprotein-proteininteractionsofamonoclonalantibody.molpharm11,2475-2489,doi:10.1021/mp5002334(2014)。令人感兴趣地,在接近生理离子强度情况下,mab1继续表现出与hsa的吸引性相互作用,而mab2表现出与hsa的略微排斥性相互作用。尽管由于技术原因,在cg-mals中使用的双组分系统不能完全反映生理条件的复杂性并且利用低于生理水平的浓度,但分析表明蛋白质之间非特异性相互作用的程度和性质可影响生物学功能。由于抗体仅在cdr上有所不同,因此有可能在此区域发生与hsa的弱相互作用的差异。此外,这些非特异性相互作用是蛋白质依赖性的,从而表明在生理环境中具有广泛功能和结构行为的潜力,并且可能解释在体外结果与药代动力学和临床结果之间观察到的偶然差异。合成和蛋白质拥挤剂的分子动力学模拟表明,拥挤对生物网络内蛋白质的结构、动力学和相互作用的影响可促进可能影响功能性的瞬时相互作用(candotti,m.和orozco,m.thedifferentialresponseofproteinstomacromolecularcrowding.ploscomputbiol12,e1005040,doi:10.1371/journal.pcbi.1005040(2016))。确实,已经有假设,进化压力使非特异性蛋白质-蛋白质相互作用最小化,以降低复杂性和蛋白质混杂性的可能性(johnson,m.e.和hummer,g.nonspecificbindinglimitsthenumberofproteinsinacellandshapestheirinteractionnetworks.procnatlacadsciusa108,603-608,doi:10.1073/pnas.1010954108(2011);deeds,e.j.,ashenberg,o.,gerardin,j.和shakhnovich,e.i.robustproteinproteininteractionsincrowdedcellularenvironments.procnatlacadsciusa104,14952-14957,doi:10.1073/pnas.0702766104(2007))。此外,一些无关的研究表明,静电是非特异性相互作用的主要驱动力(elcock,a.h.predictionoffunctionallyimportantresiduesbasedsolelyonthecomputedenergeticsofproteinstructure.jmolbiol312,885-896,doi:10.1006/jmbi.2001.5009(2001);zhang,z.,witham,s.和alexov,e.ontheroleofelectrostaticsinprotein-proteininteractions.physbiol8,035001,doi:10.1088/1478-3975/8/3/035001(2011);gunasekaran,k.等人enhancingantibodyfcheterodimerformationthroughelectrostaticsteeringeffects:applicationstobispecificmoleculesandmonovalentigg.thejournalofbiologicalchemistry285,19637-19646,doi:10.1074/jbc.m110.117382(2010);persson,b.a.,jonsson,b.和lund,m.enhancedproteinsteering:cooperativeelectrostaticandvanderwaalsforcesinantigen-antibodycomplexes.jphyschemb113,10459-10464,doi:10.1021/jp904541g(2009);wlodek,s.t.,shen,t.和mccammon,j.a.electrostaticsteeringofsubstratetoacetylcholinesterase:analysisoffieldfluctuations.biopolymers53,265-271,doi:10.1002/(sici)1097-0282(200003)53:3<265::aid-bip6>3.0.co;2-n(2000))。此处提供的cg-mals和色谱数据进一步扩展了这些研究,并强调了解蛋白质的表面电荷性质和由那些电荷产生的静电相互作用的潜在影响的重要性,本文证明了非特异性相互作用可影响功能相互作用如抗体:抗原结合事件。
利用浸入即读(dipandread)设计而不是微流体技术,生物层干涉法更有助于研究由高溶质浓度诱导的非特异性相互作用对高度特异性功能相互作用(如抗体:抗原结合)的影响。通过固定抗原并使用含有递增浓度的hsa的mab溶液,发明人能够扩展用于cg-mals的条件,以检查增加的hsa浓度并使用所述方法来建立三元相互作用系统,尽管以基于亲合力的格式。重要地,在低离子强度下,与对于mab2相比,生理hsa浓度对抗原结合的影响显示对于mab1更大,而在生理盐水平下,hsa的影响大大降低。尽管在生理离子强度下mab之间的差异幅度远小于在10mm盐中所观察到的差异,但在20g/l或更高的情况下,鉴于重复样品内的精确度,在统计学上有意义。虽然溶液蒸发的当前技术问题需要在环境温度下而不是在生理温度下(其正在开发中)进行bli测试,但这显然表明此处描述的bli方法能够复制和扩展来自光散射方法的数据,光散射方法由于技术问题也在环境温度下进行。此外,在低离子强度下使用cg-mals观察到的非特异性相互作用确实对抗体:抗原相互作用具有功能性影响,并且在中等hsa浓度下,这种影响似乎趋于平稳;例如,与35g/l相比,50g/lhsa对结合并不具有明显更大的影响。目前尚不清楚这是否是大多数治疗性mab或其他生物治疗药物的普遍趋势,并且需要继续研究。使用生物传感器平台kinexa进行的一项研究(所述研究测试mab与血清中其天然未纯化的抗原的缔合)(bee,c.,abdiche,y.n.,pons,j.和rajpal,a.determiningthebindingaffinityoftherapeuticmonoclonalantibodiestowardstheirnativeunpurifiedantigensinhumanserum.plosone8,e80501,doi:10.1371/journal.pone.0080501(2013))证明,一些mab在缓冲液或血清中显示出相同的表观亲和力,而其他显示表观亲和力的差异。这些结果使我们进一步了解由蛋白质共溶质介导的大分子拥挤。包括溶菌酶、rna酶a、白蛋白和重构的大肠杆菌细胞溶质的几种蛋白质已被用作大分子拥挤剂,通常具有相反的结果。例如,发现脱辅基肌红蛋白的自缔合在拥挤的rna酶a溶液中得到增强,但在拥挤的hsa溶液中没有增强(zorrilla,s.,rivas,g.,acuna,a.u.和lillo,m.p.proteinself-associationincrowdedproteinsolutions:atime-resolvedfluorescencepolarizationstudy.proteinsci13,2960-2969,doi:10.1110/ps.04809404(2004))。相反,gb1的a34f突变体的二聚化在100g/lbsa情况下增强,并在50g/l溶菌酶中减弱(kyne,c.和crowley,p.b.shortargininemotifsdriveproteinstickinessintheescherichiacolicytoplasm.biochemistry56,5026-5032,doi:10.1021/acs.biochem.7b00731(2017))。作者指向相对于a34f的电荷状态的差异作为所观察到的解离常数的差异的主要驱动力。此外,浓bsa/sh3结构域溶液中的弱异质相互作用减慢了两种蛋白质的翻译扩散,远超出针对溶液粘度所预期(rothe,m.等人transientbindingaccountsforapparentviolationofthegeneralizedstokes-einsteinrelationincrowdedproteinsolutions.physchemchemphys18,18006-18014,doi:10.1039/c6cp01056c(2016))。这可能源于瞬时结合事件在比翻译扩散可比或更快的时间尺度上。结合此处呈现的结果,很明显,瞬时相互作用可对高亲和力(nm-pm)相互作用,如抗体:抗原结合事件具有影响。
诸如peg、葡聚糖或ficoll的合成聚合物经常用作拥挤剂;然而,研究的目的通常是蛋白质折叠或稳定性(candotti,m.和orozco,m.thedifferentialresponseofproteinstomacromolecularcrowding.ploscomputbioi12,e1005040,doi:10.1371/journal.pcbi.1005040(2016);mcguffee,s.r.和elcock,a.h.diffusion,crowding&proteinstabilityinadynamicmolecularmodelofthebacterialcytoplasm.ploscomputbiol6,e1000694,doi:10.1371/journal.pcbi.1000694(2010);mittal,s和singh,l.r.denaturedstatestructuralpropertydeterminesproteinstabilizationbymacromolecularcrowding:athermodynamicandstructuralapproach.plosone8,e78936,doi:101371/journal.pone.0078936(2013);zhou,h.x.polymercrowdersandproteincrowdersactsimilarlyonproteinfoldingstability.febslett587,394-397,doi:10.1016/j.febslet.2013.01.030(2013);batra,j.,xu,k.,qin,s.和zhou,h.x.effectofmacromolecularcrowdingonproteinbindingstability:modeststabilizationandsignificantbiologicalconsequences.biophysj97,906-911,doi:10.1016/j.bpj.2009.05.032(2009);senske,m.等人proteinstabilizationbymacromolecularcrowdingthroughenthalpyratherthanentropy.jamchemsoc136,9036-9041,doi:10.1021/ja503205y(2014);hong,j.和gierasch,l.m.macromolecularcrowdingremodelstheenergylandscapeofaproteinbyfavoringamorecompactunfoldedstate.jamchemsoc132,10445-10452,doi:10.1021/ja103166y(2010)。已公开的关于聚合物对异质蛋白质-蛋白质相互作用的影响的研究相对较少(candotti,m.和orozco,m.thedifferentialresponseofproteinstomacromolecularcrowding.ploscomputbiol12,e1005040,doi:10.1371/journal.pcbi.1005040(2016);jiao,m.,li,h.t.,chen,j.,minton,a.p.和liang,y.attractiveprotein-polymerinteractionsmarkedlyaltertheeffectofmacromolecularcrowdingonproteinassociationequilibria.biophysj99,914-923,doi:10.1016/j.bpj.2010.05.013(2010);phillip,y.和schreiber,g.formationofproteincomplexesincrowdedenvironments-frominvitrotoinvivo.febslett587,1046-1052,doi:10.1016/j.febslet.2013.01.007(2013);kozer,n.,kuttner,y.y.,haran,g.和schreiber,g.protein-proteinassociationinpolymersolutions:fromdilutetosemidilutetoconcentrated.biophysj92,2139-2149,doi:10.1529/biophysj.106.097717(2007))。在此再次,关于合成聚合物的真实影响没有明确共识,并且似乎净结果对目标系统具有特异性。schreiber和同事显示peg和葡聚糖对芽孢杆菌rna酶(barnase)与芽孢杆菌rna酶抑制剂(barstar)或β-内酰胺酶与其蛋白质抑制剂之间的相互作用的影响最小,而liang和同事显示聚合物拥挤对过氧化氢酶-超氧化物歧化酶缔合的显著影响(jiao,m.,li,h.t.,chen,j.,minton,a.p.和liang,y.attractiveprotein-polymerinteractionsmarkedlyaltertheeffectofmacromolecularcrowdingonproteinassociationequilibria.biophysj99,914-923,doi:10.1016/j.bpj.2010.05.013(2010);phillip,y.,sherman,e.,haran,g.和schreiber,g.commoncrowdingagentshaveonlyasmalleffectonprotein-proteininteractions.biophysj97,875-885,doi:10.1016/j.bpj.2009.05.026(2009))。尽管高hsa浓度对抗体:抗原结合的影响可能仅仅是由于排除体积效应,但在多糖ficoll70而非hsa存在下进行的等效实验产生了不同的结果,显示即使在高浓度下对结合的影响也很小至甚至没有影响。这种差异在低离子强度下尤为明显,这表明在存在hsa的情况下,结合活性的显著mab特异性降低。在ficoll拥挤溶液中,对于两种mab,影响最小且相似。这表明hsa的影响不能仅通过对排除体积的效应来解释;生物系统的复杂性(即,蛋白质的表面性质)在生物过程中起着重要作用。使用其他目标系统进行的研究可能有助于改进蛋白质大分子拥挤模型。
不足为奇,高ficoll浓度(100g/l及以上)减慢两种抗体的表观结合,如通过达到稳态条件所需的时间评估的;然而,对mab1的影响要比对mab2的影响更为明显。这表明,除了高溶液粘度外,在类似于用于典型拥挤研究的浓度的ficoll浓度下,对系统的结合性质的另外蛋白质特异性影响。高ficoll浓度对两种mab的不同影响的具体原因尚不清楚,但可能归因于优先相互作用(结合或排斥)的差异(arakawa,t.和timasheff,s.n.preferentialinteractionsofproteinswithsolventcomponentsinaqueousaminoacidsolutions.archbiochembiophys224,169-177(1983);timasheff,s.n.protein-solventpreferentialinteractions,proteinhydration,andthemodulationofbiochemicalreactionsbysolventcomponents.procnatlacadsciusa99,9721-9726,doi:10.1073/pnas.122225399(2002))。值得注意的是,在低离子强度与高离子强度之间,ficoll对每种mab的影响都相当一致。先前的研究表明,ficoll能够可变地影响分子的热稳定性和构象动力学(qu,y.和bolen,d.w.efficacyofmacromolecularcrowdinginforcingproteinstofold.biophyschem101-102,155-165(2002);sasahara,k.,mcphie,p.和minton,a.p.effectofdextranonproteinstabilityandconformationattributedtomacromolecularcrowding.jmolbiol326,1227-1237(2003);stagg,l.,zhang,s.q.,cheung,m.s.和wittung-stafshede,p.molecularcrowdingenhancesnativestructureandstabilityofalpha/betaproteinflavodoxin.procnatlacadsciusa104,18976-18981,doi:10.1073/pnas.0705127104(2007);tokuriki,n.等人proteinfoldingbytheeffectsofmacromolecularcrowding.proteinsci13,125-133,doi:10.1110/ps.03288104(2004)),并且两种mab之间的cdr差异可能导致对结构或动力学的变化的ficoll诱导的影响,具有对结合的伴随影响。使用麦芽糖结合蛋白(mbp)进行的研究表明,ficoll可结合至所述蛋白质并竞争结合天然配体麦芽糖(miklos,a.c.,sumpter,m.和zhou,h.x.competitiveinteractionsofligandsandmacromolecularcrowderswithmaltosebindingprotein.plosone8,e74969,doi:10.1371/journal.pone.0074969(2013))。这证明了拥挤剂对蛋白质-配体相互作用的直接影响以及与其他大分子竞争的潜在后果。然而,使用ficoll观察到的影响是基于达到平衡所需的时间,而不是基于平衡反应本身,这证明聚合物(ficoll)和蛋白质(hsa)拥挤剂不一定产生相同的结果。这些潜在差异可能取决于与所检查的分子相关的固有物理化学性质。有必要进行另外的调查,以更好地了解这一复杂现象;此外,蛋白质水合或优先排除/相互作用研究可阐明这种差异背后的机制。聚合物拥挤剂不会一贯地对配体结合产生影响。用蛋白质拥挤剂取代此系统中的聚合物可能对热力学产生深远的不同影响,因为这会引入静电相互作用和其他非理想行为的额外复杂性。
生物溶液的复杂性和体积占用对组成分子造成与理想行为的显著偏离。对在此类条件下蛋白质的非理想行为和非特异性相互作用的了解对于获得更完整和准确的蛋白质功能图至关重要。在此,发明人已经证明了使用生物层干涉法来表征非特异性蛋白质-蛋白质相互作用的功能影响的高通量方法,所述方法允许使用最少的材料在相对短的时间内筛选大量测试物品。具体地说,本发明人研究了白蛋白的生理浓度对抗体-抗原结合的影响。结合同一抗原的两种不同抗体受到白蛋白存在的不同影响,从而表明生物治疗药物可能在限定系统中表现出与白蛋白的一系列非特异性相互作用。在存在hsa的情况下,评估mab与其他生物学相关分子(如新生儿fc受体(fcrn))的结合至关重要。fcrn以ph依赖性方式促进igg和hsa从酸性核内体再循环至血流(vaughn,d.e.和bjorkman,p.j.structuralbasisofph-dependentantibodybindingbytheneonatalfcreceptor.structure6,63-73(1998)),并且尽管这一过程已充分了解,但所观察到的igg与hsa之间的潜在相互影响表明更复杂的过程(wang,w.等人monoclonalantibodieswithidenticalfcsequencescanbindtofcrndifferentiallywithpharmacokineticconsequences.drugmetabdispos39,1469-1477,doi:10.1124/dmd.111.039453(2011))。最后,作为生物治疗药物发展的主要尚未探索的领域,表征与适应症和施用途径有关的非特异性相互作用可作为先导候选分子库中的重要鉴别物。生物层干涉法技术在各种生物学和药物发现问题中的应用正在扩展(verzijl,d.,riedl,t.,parren,p.和gerritsen,a.f.anovellabel-freecell-basedassaytechnologyusingbiolayerinterferometry.biosensbioelectron87,388-395,doi:10.1016/j.bios.2016.08.095(2017);kaminski,t.,gunnarsson,a.和geschwindner,s.harnessingtheversatilityofopticalbiosensorsfortarget-basedsmall-moleculedrugdiscovery.acssens2,10-15,doi:10.1021/acssensors.6b00735(2017);yang,d.,singh,a.,wu,h.和kroe-barrett,r.determinationofhigh-affinityantibody-antigenbindingkineticsusingfourbiosensorplatforms.journalofvisualizedexperiments:jove,doi:10.3791/55659(2017))。作为早期发现研究筛选工具,bli可用于更快地从管线中剔除候选物,并且在使发现研究中使用的测定类型多样化方面可能是有益的。此处描述的方法是可与其他生物物理方法(如nmr和auc)结合使用以更好地研究拥挤溶液现象的重要工具。
实施例2:从fcrn介导的再循环途径中选择抗体
fcrn通过降低内皮细胞中的溶酶体降解来延长igg和血清白蛋白的半衰期。igg、血清白蛋白和其他血清蛋白通过胞饮作用持续内化。一般来说,血清蛋白从内体转运至溶酶体,在溶酶体中它们被降解。igg和血清白蛋白在弱酸性ph(<6.5)下由fcrn结合,并再循环至细胞表面,在细胞表面它们在血液的中性ph(>7.0)下释放。以这种方式,igg和血清白蛋白避免溶酶体降解。这种机制为igg和血清白蛋白的更长血清循环半衰期提供了解释。因此,在模拟体内条件下具有增加的fcrn结合的那些抗体将预期具有更长的半衰期,并且因此可代表优异的治疗剂。用于测定hsa对抗体fcrn结合的影响的测试系统在图13中示出。图14示出,hsa和mab/hsa缔合步骤在ph6.0下产生特异性fcrn结合反应,其在ph7.4下是完全可逆的。图15a和15b示出,mab1和mab2与fcrn的结合同样受到hsa的影响。在低离子强度和生理离子强度下影响是相同的。hsa在低hsa浓度和生理hsa浓度下降低mab与fcrn的结合。通常如实施例1中所述进行下文描述的试验。
负载fa的hsa对fcrn抗体结合的影响:先前据报告,c18:1消除了并且c16:0强烈降低了hfcrn结合,而c12:0具有较小影响,从而揭示fa结合的hsa的再循环效率可能低于不含配体的hsa的再循环效率。在此,实验表明(参见图16),相较于与纯hsa的结合,在存在fa:hsa的情况下,两种不同的mab(mab1和mab2)与fcrn的结合更高。这一结果表明,纯hsa以比‘污hsa’更高的亲和力结合fcrn,从而干扰mab与fcrn的相互作用。负载有fa的hsa可能需要继续循环,而不含配体的hsa需要再循环到细胞质中。fa结合的hsa的电荷状态的变化可导致fcrn亲和力降低。
hsa对抗c5mab与fcrn的结合的差异影响:mab3是抗c5mab。这种mab(mab4)的半衰期延长型式含有yte突变(m252y、s254t、t256e)(参见图17)。mab5和mab6分别含有hle突变kff(h433k、n434f、y436f)和ls(m428l、n434s)。与针对mab1和mab2的观察结果相反,hsa不同地影响各种抗c5分子与fcrn的结合(参见图18)。尽管在hsa存在下所有分子均显示与fcrn的结合减弱,但hle突变体(mab4、mab5和mab6)受影响程度较小。与其他hle突变体相比,mab5表现出最小的hsa对fcrn结合的影响。
对抗寨卡mab与fcrn的结合的差异hsa影响:mab7是无fcγ受体结合活性的抗寨卡mab。mab8=mab7+yte突变。mab9是具有降低的fcγ受体结合活性的抗寨卡病毒抗体。只有yte突变影响与fcrn的相互作用。如图19所示,mab9与fcrn的结合在生理水平的hsa下降低;然而,与hsa存在下的mab7和mab8相比,mab9维持更高程度的与fcrn的相互作用。在20mg/mlhsa及更高浓度下,mab7和mab9与fcrn的结合被hsa信号(负值)略微掩盖。
在hsa存在下,半衰期延长突变体展现比亲本mab更高的对fcrn的结合反应:hle突变体被设计为对fcrn具有更高的结合亲和力,并且如图20所示,在存在hsa的情况下,这种排序保持不变。在接近生理浓度的hsa下,kff突变体显示出最高的结合反应。
fcrn结合实验证明将这种平台用作评估生理环境中的mab功能的工具的潜力:典型的bli结合实验表明,在两种盐浓度下,mab1和mab2对fcrn具有相似的结合亲和力。在10和137mmnacl下,hsa对mab1和mab2的fcrn结合具有相似的影响。hsa的存在降低了mab与fcrn的结合。来自抗c5和抗寨卡抗体的yte突变体展现与“野生型”相比,与fcrn的结合亲和力增加以及hsa的影响降低。这种方法学可提供了解在接近生理环境中的mab功能的平台,从而填补了生物物理可开发性评估与pk研究之间的空白。
本发明的范围不受本文所述的具体实施方案限制。实际上,除了本文描述的那些,根据前面的描述和附图,本发明的多种修改对于本领域技术人员是显而易见的。此类修改意图属于所附权利要求书的范围之内。
序列表
<110>再生元制药有限公司(regeneronpharmaceuticals,inc.)
<120>在模拟体内条件下的治疗性蛋白质选择
<130>10470us01
<150>62/718,307
<151>2018-08-13
<150>62/865,446
<151>2019-06-24
<160>2
<170>patentinversion3.5
<210>1
<211>50
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>野生型igg1或igg4的部分肽序列
<400>1
pheleupheproprolysprolysaspthrleumetileserargthr
151015
progluvalthrcysvalvalvalaspvalserglngluaspproglu
202530
valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys
354045
thrlys
50
<210>2
<211>50
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>具有yte突变的igg1或igg4的部分肽序列
<400>2
pheleupheproprolysprolysaspthrleutyrilethrargglu
151015
progluvalthrcysvalvalvalaspvalserglngluaspproglu
202530
valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys
354045
thrlys
50
- 还没有人留言评论。精彩留言会获得点赞!