凝血测定装置及其方法与流程
凝血测定装置及其方法
1.发明背景
1.技术领域
2.本发明一般涉及一种用于测定稀释的毛细血管全血、柠檬酸化全血和柠檬酸化血浆中凝血因子活性的方法和装置。
3.2.现有技术描述
4.测定稀释的毛细血管全血、柠檬酸化全血和柠檬酸化血浆中凝血因子活性的方法和装置通常涉及医生在凝血酶原时间-国际标准化比值(inr)检测中测量患者的国际标准化比值(inr)水平。这种类型的生物分析旨在测量患者的血液凝固所需的时间。该检测确保患者接受的药物剂量和类型能够防止血栓的形成并防止导致深静脉血栓(dvt)、肺栓塞(pe)、中风、心脏病发作等。这类药物通过阻断维生素k依赖性凝血因子的形成而发挥作用,凝血因子是血液中导致凝血的物质。如果inr分数太低,患者可能有血栓的风险。然而,如果inr过高,患者也可能会出血。一个典型的inr分数在2到3之间。“理想的”inr分数可能因患者而异。
5.患者应该多久检测一次,这取决于他们的inr在一段时间内的稳定程度。根据美国心脏协会(aha)的说法,患者应该至少每月检测一次,在某些情况下,每周可检测多达两次。这种检测通常涉及到抽血以及用体外诊断分析仪进行分析。
6.体外诊断分析仪已经问世几十年了。这些类型的分析仪通常是在中央实验室使用。中央实验室能够对患者的血液和/或血浆中的各种生物医学物质进行检测。最近,这种检测似乎正在从中心实验室检测向医院内的护理点转移。这种转移提供了更快的检测数据结果,这对某些疾病的诊断和治疗非常重要。
7.护理点检测在危重患者的管理中发挥着重要作用,并被广泛用于手术室、急诊室和重症监护室。这些检测不再完全由熟练的医疗技术人员执行,也可由包括护士、呼吸治疗师、急救人员、医生和其他医务人员在内的多技能人员执行。为了满足这一需求,制造商不得不缩小分析仪的尺寸并简化检测程序,以便在执行检测程序方面只需进行最低限度的培训。
8.所有护理点分析仪的一个共同的关键特征是,它们必须是便携式和/或可运输的。这种护理点分析仪的例子包括但不限于罗氏诊断公司(霍夫曼-罗氏公司的一个分部)的opti cca和omni 9重症监护分析仪、诺瓦生物医学公司的stat profile ultra c、诺瓦生物医学公司的crt以及德灵诊断产品有限公司(西门子医疗诊断公司的一个分部)的dimension rxl。
9.最近,正在发生进一步的转变,即在医生的办公室或位于医生办公室内的实验室进行检测。随着检测远离中心实验室,已开发出新的一次性使用的医疗设备以满足这一需求。
10.在医生的办公室环境中,有诸多设备可利用毛细管来收集指棒样本进行分析。毛细管可以是玻璃或塑料的。典型的分析是针对诸如hba1c、脂质等物质。样本采集后,将这些
基于毛细管的采集设备装入一个分析盒中,然后装入一个仪器中进行分析。现在将参照它们的原始专利文件,讨论两种用于诊断目的的已知生物测定法。
11.首先,美国专利文献us 2011/0196085a1公开了一种稳定珠,其包括具有羧基的乳胶粒子,以及与乳胶粒子功能耦合的稳定剂,其中稳定剂能够完全或基本防止与稳定剂接近的诊断剂的降解或失活。稳定珠可进一步包括人血清白蛋白(hsa)、牛血清白蛋白(bsa)或与乳胶粒子耦合的连接基中的至少一种。
12.第二,欧洲专利文献ep0655627公开了一种方法和检测套件,用于对纤维蛋白分解产物d-二聚体进行简单的检测,该方法利用纯化的人纤维蛋白原片段e附着在固相上,直接对生物样本中的d-二聚体进行化学结合。片段e可与乳胶载体粒子共轭,并进行凝集测定。
技术实现要素:
13.本发明相对于已知现有技术的优点和不同之处
14.事实证明,现有技术的上述部分并不能完全满足行业的所有要求。已发现不准确性与脱水细胞中平均细胞血红蛋白浓度的自动测量有关。在凝血过程中,额外的混合和水化时间等会诱发不受控制的促凝血剂的激活。与现有技术中的方法相比,根据本发明,利用干燥的、液体的或干燥和液体的试剂的方法为粒子和试剂检测提供了巨大的能力。
15.本发明采用碳水化合物基质来保持特定微粒子的功能,以提高免疫诊断的能力,在本发明之前,免疫诊断已经取得了不同程度的成功。具体来说,本发明采用了未与蛋白质反应、接触或耦合的乳胶微粒子。当在碳水化合物基质中干燥或在液体试剂系统中使用时,这些未反应的粒子保持其生物活性吸附特性。使用时,这些粒子能够吸附生物分子。这种作用促进并加强了粒子表面对全血和血浆中所含促凝血剂的反应性,特别是在稀释的样本/稀释液环境中使用时。在这个过程中包括反应性蛋白和粒子混合物的呈现,以及对凝血测定中使用的各种激活剂的呈现。乳胶微粒子用于本发明的浊度生物测定中,其中样本溶液的典型光学特性是清澈而不浑浊的。
16.本发明通过将新的改进的方法学应用于稀释的、裂解的全血样本或血浆基质来解决现有技术的失败之处,其中乳胶粒子提供凝血检测的方法。所述方法允许结合吸附应用于临床检测点,减少了生产时间、成本、最终用户阶段的孵化反应时间以及仪器的占地面积或尺寸。未经处理的乳胶微粒子和带有表面基团如硫酸盐或脒的粒子均对本发明有效。每种微粒子类型也需要适当的缓冲液和热条件才能在稀释血液测定方案中工作。
17.生物分子、微粒子、专门的缓冲液和检测温度共同作用,使蛋白质快速吸收,用于快速临床检测。此外,粒子的分散性也起到重要作用。溶液中的均匀分散性允许快速反应和一致的凝集分析定量。因此,对于开发任何可靠的检测组件而言,保留这两种特性都是强制性的。
18.本发明提供了一种用于干燥聚苯乙烯上带有普通物质或表面功能化基团的无涂层、无结合、无蛋白质的乳胶微粒子的工艺方法。分散的粒子允许吸附可量化的分析性蛋白质生物标志物,然后可用于配体附着。特别是,由碳水化合物组成的基质有利于生物标志物蛋白质的吸附,同时允许粒子的快速溶解和均匀分散。
19.本发明的一个目的是提供一种液体微粒子试剂,以便在某些生物测定中使用。本发明的另一个目的是提供一种在诊断性凝血产品中使用干燥的或液体的乳胶微粒子的方
法。本发明的另一个目的是提供一种同时进行血红蛋白检测和凝血时间值定量校正的方法。
20.本发明的再一个目的是提供一种评估外源性凝血途径和监测口服抗凝血剂治疗(oat)的新方法。
21.本发明的方法提供了一种检测全血或血浆的凝血时间的方法,对全血样本进行血红蛋白测量和校正。在各个实施方案中,通过调整稀释水平、温度、粒子类型和缓冲液成分来改变整个生物测定时间。这些实施方案采用灵活的干燥的、液体的或干燥和液体的基质以及特定的微粒子。然而,应该理解的是,所有的检测组件都可以调整,以便根据本发明的方法为凝血生物测定提供最具代表性的时间方案。一般来说,对于在33℃和38℃之间进行的凝血测定,最终的全血或血浆样本稀释比例应在50到75分之一的范围内。
22.本发明通过提供一种用于监测抗凝血剂活性的一次性生物测定诊断试剂盒来实现这些及其他目标。所述一次性试剂盒可设有容纳一定量基质的第一孔,所述基质可以是干燥基质或液体基质;容纳微粒子的第二孔,所述微粒子可以是具有至少一种表面类型的无涂层的乳胶:未反应的普通物质、硫酸盐、羧酸盐和保留活性的脒类化学结构。所述试剂盒还可以设有具有一定量的激活剂的第三孔,激活剂可以是凝血致活酶、凝血酶、鞣花酸、活化部分凝血活酶、因子ii、因子vii、因子i、因子x、因子xii、活化蛋白c、蛇毒、带负电荷的磷脂、钙离子、组织因子、二氧化硅、高岭土、硅藻土。
23.所述基质可以是液体碳水化合物基质,或含有氯化钠、聚乙二醇、吐温和氯化钙中至少一种的干燥基质。一次性试剂盒可设有一个集成的比色皿,能够促进双重光学检测读数。一体化比色皿可具有第一壁和第二壁,所述第一壁能够通过第一530nm led促进第一次光学检测读数;所述第二壁能够通过第二660nm led促进第二次光学检测读数。
24.本发明通过提供一种全包式凝血生物测定诊断套件来实现其他目标,所述试剂盒除了分析仪本身,还具有所有必要的组件。所述套件可包括指棒、移液管、生物测定组件和光学比色皿。为了确保卫生地交付给用户,指棒、移液管、生物测定组件和光学比色皿可以装在一个卫生且密封的容器中,所述容器设有一个标识符,如可由分析仪扫描的条形码。生物测定组件可具有一种基质和微粒子,其中微粒子可以是具有至少一种表面类型的无涂层的乳胶,所述至少一种表面类型选自由未反应的普通物质、硫酸盐、羧酸盐和保留活性的脒类化学结构组成的组。
25.根据本发明的另一种凝血生物测定可具有一种碳水化合物基质和碳水化合物基质中的微粒子。这种生物测定还可具有一定量的激活剂,如凝血致活酶、凝血酶、鞣花酸、活化部分凝血活酶、因子ii、因子vii、因子i、因子x、因子xii、活化蛋白c、蛇毒、带负电荷的磷脂、钙离子、组织因子、二氧化硅、高岭土和硅藻土。所述生物测定的基质可以是干燥基质或液体基质,碳水化合物基质可含有麦芽糖250、蔗糖、或异麦芽糖。这种类型的生物测定的微粒子的直径可以从10nm到150nm,且所述微粒子可能在容重为1%的溶液中,容重为2%的溶液中,容重为4%的溶液中,容重为8%的溶液中,或容重为10%的溶液中。
26.通过采用上述生物测定法,本发明试图提供一种方法,以获得稀释的、裂解的全血、全血(直接来自于指棒)、血浆、柠檬酸化血和/或混合血和血浆中的任何一种的血液样本类型的凝血时间测量值。所述方法包括以下步骤:选择具有碳水化合物基质的微粒子基质和碳水化合物基质中的多个微粒子。所述微粒子最好是无涂层的乳胶,所述无涂层的乳
胶在干燥或液体的碳水化合物基质中至少有一种表面类型,所述至少一种表面类型优选地选自由未反应的普通物质、硫酸盐、羧酸盐和保留活性的脒类化学结构组成的组。然后,这种微粒子基质可作为试剂与血液样本一起使用;然后通过光学检测inr获得稀释的、裂解的全血或血浆中的一种的凝血时间测量值。另外,也可以在反应混合物中加入单独的试剂,以激活血液样本中的天然凝血底物。独立的试剂优选是一种激活剂,如凝血致活酶、凝血酶、鞣花酸、活化部分凝血活酶、因子ii、因子vii、因子i、因子x、因子xii、活化蛋白c、蛇毒、带负电荷的磷脂、钙离子、组织因子、二氧化硅、高岭土、硅藻土。
27.然后可以通过同时获得两个不同波长的光密度读数来校正样本的血红蛋白浓度的凝血时间测量值。
附图说明
28.图1示出了本发明的方法;
29.图1a是用户已选择本发明的生物测定试剂盒套件与所示的扫描仪一起使用的图示;
30.图2是用户扫描本发明中试剂盒的标识符的图示;
31.图3是根据本发明的方法用户使用指棒获取血液样本的图示;
32.图4是一个用户从本发明的试剂盒中取回采样器的图示;
33.图5是用户向本发明试剂盒中的采样器填充血液样本的图示;
34.图6是用户用血液样本将装满的采样器替换回本发明试剂盒的图示;
35.图7是用户将装有采样器的本发明的试剂盒放入分析仪的图示;
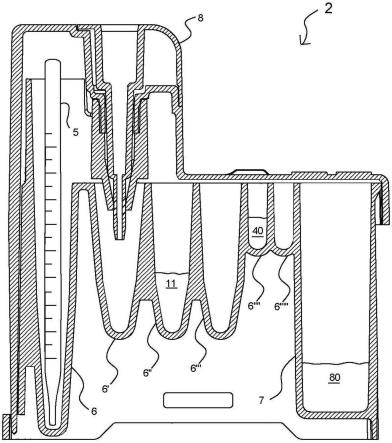
36.图8是根据本发明一个实施方案的试剂盒的横截面图;
37.图9是根据本发明另一个实施方案的试剂盒的横截面图;
38.图10是根据本发明一个实施方案的方法的自动化步骤的图示;
39.图11是对图1所示方法的一个步骤进一步观察的图示;
40.图12是对图11所示方法的步骤进一步观察的图示;
41.图13是对图1所示方法的另一步骤进一步观察的图示;
42.图14示出了根据本方法在进行校正和未进行校正的情况下血红蛋白对凝血酶原时间与inr比值的影响;
43.图15示出了根据本方法在进行校正和未进行校正的情况下血红蛋白对变量增量凝血酶原时间与inr比值的影响。
44.含有bsa的凝血酶原与正常情况比对
45.图16是使用带有和不带有牛血清白蛋白(bsa)表面基团的微粒子对正常样本进行生物测定的图示;
46.图17是使用带有和不带有牛血清白蛋白(bsa)表面基团的微粒子对异常样本进行生物测定的图示。
47.含有脒的凝血酶原与硫酸盐类和普通物质比对
48.图18是通过测量在660nm时的光密度与时间的关系曲线图,示出了采用第一种脒类粒子稀释液和第一种基质的第一种实施方案的凝血酶原时间测定结果;
49.图19是通过测量在660nm时的光密度与时间的关系曲线图,示出了采用第一种硫
酸盐粒子稀释液和第一种基质的第二种实施方案的凝血酶原时间测定结果;
50.图20是通过测量在660nm时的光密度与时间的关系曲线图,示出了采用第一种表面自由微粒子稀释液和第一种基质的第二实施方案的凝血酶原时间测定结果;
51.图21是通过测量在660nm时的光密度与时间的关系曲线图,示出了采用第二种脒类粒子稀释液和第二种基质的第四个实施方案的凝血酶原时间测定结果;
52.图22是通过测量在660nm时的光密度与时间的关系曲线图,示出了采用第二种硫酸盐粒子稀释液和第二种基质的第五个实施方案的凝血酶原时间测定结果;
53.图23是通过测量在660nm时的光密度与时间的关系曲线图,示出了采用第二种表面自由微粒子稀释液和第二种基质的第六个实施方案的凝血酶原时间测定结果。
54.含有二甲基硅油的凝血酶原
55.图24是通过测量在660nm时的光密度与时间的关系曲线图,示出了采用根据本发明的硫酸盐微粒子稀释液对正常全血进行生物测定的结果;
56.图25是通过测量在660nm时的光密度与时间的关系曲线图,示出了采用根据本发明的硫酸盐微粒子稀释液对异常全血进行生物测定的结果;
57.图26示出了根据本发明通过测量在520nm时的光密度来确定图25的生物测定中存在的血红蛋白值;
58.图27是对图25中计算的原始凝血酶原时间进行修正的图,是由图26中确定的血红蛋白值调整的结果;
59.图28示出了根据图27中提供的调整后的凝血酶原时间确定图25中的生物测定的inr值。
60.含有羧基的凝血酶原
61.图29是通过测量在660nm时的光密度与时间的关系,示出了采用根据本发明的羧基微粒子稀释液对正常全血进行生物测定的结果;
62.图30是通过测量在660nm时的光密度与时间的关系,示出了采用根据本发明的羧基微粒子稀释液对异常全血进行生物测定的结果。
63.不同温度下的凝血酶原
64.图31是通过测量在660nm时的光密度与时间的关系,示出了采用不同温度的本发明两个实施方案的凝血酶原时间测定结果;
65.图32是通过测量在660nm时的光密度与时间的关系,示出了采用不同温度的本发明的两个实施方案的凝血酶原时间测定结果。
66.含有香豆素的凝血酶原
67.图33是通过测量在660nm时的光密度与时间的关系,示出并比较正常血液的生物测定结果与存在香豆素的血液的生物测定结果。
68.凝血酶
69.图34是通过测量在660nm时的光密度与时间的关系,示出并比较凝血酶时间生物测定正常柠檬酸化血浆与凝血酶时间生物测定正常柠檬酸化血液的结果。
70.活化部分凝血酶
71.图35是活化部分凝血活酶时间生物测定正常对照结果的图示;
72.图36示出了活化部分凝血活酶时间生物测定与异常对照的结果,以供比较;
73.图37示出了活化部分凝血活酶时间的生物测定结果,其中通过测量在660nm时的光密度与时间的关系,用正常血浆对因子viii进行一阶段因子测定;
74.图38示出并比较活化部分凝血活酶时间的生物测定结果与因子viii的一阶段因子测定结果,其中通过测量在660nm时的光密度与时间的关系,比较aptt异常血浆和aptt一阶段混合物。
具体实施方式
75.参照图1-38讨论了本发明的优选实施方案。如上所述,本发明提供了一种与测定稀释的毛细血管全血、柠檬酸化全血和柠檬酸化血浆中凝血因子活性的方法和装置有关的过程、方法、系统和装置。
76.一般概述
77.现在将参照图1-12,从不同的角度讨论整个方法100、系统试剂盒2和生物测定的手动和自动部分的一般概况。
78.从用户的角度对方法的一般概述
79.现在参照图1-7来讨论用户角度的一般概况。如图所示,最初,用户102选择一个生物测定试剂盒或试剂盒套件。在手动选择一个生物测定试剂盒102后,所述试剂盒可由分析仪扫描以识别所选的生物测定103。然后,获取血液样本104可能涉及到一个简单的指棒105,以提供所需的血液样本大小。在这一步骤中容易获得血液样本,这示出了本发明系统相比其他需要静脉穿刺或其他大尺寸血液样本采集的现有技术系统和方法的优势之一。
80.如果最初识别生物测定,毛细管采样器可以从试剂盒106中取出,填充血液样本107,并替换到指定的试剂盒108中,所有这些都是在操作指棒105的五秒钟内完成的。将填充满的采样器108换回试剂盒后,可由分析仪扫描103标识符,并将试剂盒插入分析仪109中。将试剂盒装入分析仪后,自动过程110开始。根据所选择的生物测定,根据生物测定组件的指定顺序,自动过程将涉及添加112、混合114、测量116、孵化117、校正118以及向用户或其他指定人员报告119结果的自动步骤。
81.根据所涉及的系统以及生物测定的目的,自动化过程110还可以包括自动调整120规定的药物量和/或由内置药物输送系统(未示出)提供的药物的量的步骤。
82.图1a是用户选择102后的试剂盒套件的图示。所述试剂盒套件包括一个生物测定试剂盒2和预先包装好的指棒4,可与分析仪系统1一起单独使用。所述试剂盒套件优选地还包括消毒过的移液管5、采样器8和比色皿7,下面将结合图8-9更详细地进行讨论。能够进行本文所述的生物测定的示范性分析仪系统1是诺瓦生物医学公司的allegro
tm
分析仪。诺瓦生物医学公司的美国专利10,117,615对能够与本文所述的试剂盒2一起使用的示范性采样器和试剂盒底座进行了更全面的描述。
83.接下来转到图2-7,其从用户的角度进一步说明了试剂盒套件的具体组件的用法。具体来说,图2示出了用户让分析仪1通过扫描本发明选定的试剂盒2来识别生物测定方法。然后,图3示出了用户通过使用试剂盒套件提供的指棒4获得血液样本60。然后,图4示出了用户从试剂盒2中取出采样器8。接下来,图5示出了用户用从指棒4获取的血液样本60填充所述采样器8。之后,图6示出了用户用从指棒4获取的血液样本60将填充满的采样器8替换回本发明的试剂盒2中。最后,图7示出了用户将带有填充采样器8的试剂盒2放入分析仪1
中,从而初始化所选择和识别的生物测定。通过将这些组件作为一个统一的套件设置在一个单一的包装9中,本发明既减少了整体程序时间,又减少了用户的错误。
84.生物测定试剂盒的一般概述
85.可用于本发明系统和方法的示范性试剂盒套件可包括一个独立的一次性集成生物测定试剂盒2,如现在将进一步参考图8、9来描述。
86.根据本发明的一种实施方案,图8中所示的第一试剂盒2实施方案制备有仅用于单一类型的生物测定的生物测定组件。另外,图9所示的第二种试剂盒实施方案是一种多用途试剂盒2',根据本发明的进一步实施方案,所述多用途试剂盒预装了至少两种类型的生物测定的多种组件。
87.图8和图9均示出了具有标识符3的试剂盒2,如条形码,其能够向分析仪1识别特定类型的试剂盒(因此也是生物测定)。所述标识符3可以沿着试剂盒2的可见外表面可见,或沿着主包装9的外表面可见。所述包装9可以包含试剂盒2、指棒4、灭菌移液管5、采样器8和比色皿7。图8和图9均示出了试剂盒2,其中毛细管采样器8是试剂盒2本身的一个可拆卸部件。图8和图9还示出了一个具有集成比色皿7的试剂盒2,其侧壁能够促进光学测量。但是,也可以预计到,包装9可能包含一个需要在试剂盒之外提供一个单独的不同比色皿7的试剂盒。
88.图8、9还示出了具有一系列孔6的试剂盒2,这些孔预先装入了根据本发明方法的检测组件。对于这两种类型的试剂盒,选择阶段102(以上参照图1-7讨论)涉及选择所需的生物测定试剂盒。在选择了所需的试剂盒/检测方法102后,对试剂盒进行扫描103、填充107,然后插入系统109中。
89.从用户的角度来看,使用第一种和第二种试剂盒的唯一区别从现在开始。有了第一种试剂盒,用户就可以通过分析仪上的访问控制面板,通过手动用户输入,选择几种生物测定选项中的一种,从而手动选择自动过程选项110。而对于第二种试剂盒类型,仅插入试剂盒109就足以触发自动过程110。对于这第二种试剂盒类型,从用户的角度来看,仅“选择”生物测定试剂盒。然而,在用户选择生物测定选项之前,必须先准备好生物测定盒,而在准备之前,必须先选择生物测定组件本身。下面将参照最初的图1,并进一步参照图10-13,进一步讨论几个生物测定试剂盒组件选项。
90.现在更具体地查看采样器2的那些元件,一旦采样器8被填满107并返回到试剂盒2中,用户不一定能观察到。从图8、图9中可以看出(尽管没有编号),采样器8具有一个毛细管元件,所述毛细管元件通过一次性检测试剂盒2的盖子延伸部分的阶梯式延伸部分的延伸部分顶面的相应毛细管接收孔插入,然后安放在阶梯式延伸部分中。
91.在插入和设置过程中,采样器8的毛细管通过位于毛细管擦拭器顶端的下部孔插入。因为下部孔的横截面积小于毛细管的横截面积,所以下部孔的作用就像刮刀一样抵住毛细管的外表面,防止无意中放置在毛细管外表面的任何样本进入并沉积到试剂盒2的腔体6中。
92.另外,这些试剂盒2的毛细管擦拭器还能清除毛细管外表面的任何样本60,从而提高准确性。因此,错误的结果可以避免在试剂盒2的适当孔6'中“过度填充”样本60。同样,由于用户未擦拭毛细管,所以毛细管内的任何样本60不经意地被移走的可能性不存在或极少,这可能会导致样本60对检测试剂盒2中的孔6'“填充不足”而导致错误结果。
93.自动化过程的一般概述
94.然后将试剂盒2插入护理点分析仪1中,对血液样本60进行自动检测110,现在将进一步参照图10进行讨论。一旦进入分析仪1,分析仪的自动臂通过解锁可释放的标签断开试剂盒2的盖子,盖子上的毛细管采样器8和样本60仍然被包在里面。
95.然后,分析仪用试剂盒盒盖上的一个小尖头来刺穿每个孔6、6'、6"等的封条。本试剂盒2的封条可以是铝箔封条,也可以是其他封条,只要它们能够防止运输过程中孔中内容物的交叉污染。这些封条还应该能够减少不受管控的水蒸气稀释和蒸发。
96.然后,自动臂从第一孔6中取回移液管吸头5。然后,分析仪1使用移液管吸头5将样本和其他生物测定组件移到适当的孔中,以便根据本文所述的生物测定方法进行混合。
97.如果采用干的微粒子基质11,那么移液管5从第四孔6"'中吸出额外的稀释液90,并根据协议将其添加到第三孔6"内的微粒子11中,在此进行混合和搅拌,形成稀释的粒子11。然后,无论采用哪种类型的基质,移液管吸头5均从第三孔6"中吸出选定数量的(现已稀释的)微粒子11到第二孔6'中。
98.然后将试剂盒2的盖子重新装在试剂盒上,并且移液管接合毛细管采样器8,从而将样本60添加112到第二孔6'中,稀释的选定微粒子11在该孔中等待。然后,分析仪1的机械臂再次取下试剂盒2的盖子,然后通过上下移液将样本60和稀释的选定粒子11混合114,在第一个预定的时间内形成微粒子11和样本60的混合物121。
99.然后移液管吸头5从第五孔6""中吸出指定数量的选定的成型基质40,然后在第二个添加步骤112中,将基质40添加到第二孔6'中,该孔已经包括样本60和稀释的微粒子11的混合物121。然后,混合114基质40和混合物121,例如,通过在第二孔6'内上下吸移第二预定时间,形成溶液122(具有基质40、样本60和微粒子11)。
100.之后,移液管5从第二孔6'中吸出预定量的溶液122(包括基质40、样本60和微粒子11),并将该溶液122加入112到试剂盒2中的第七孔7中,其中包括选定的试剂80。然后将溶液122(微粒子、基质、样本)和试剂80混合第三次预定时间,形成混合液123(现在含有基质40、样本60、微粒子11和试剂80)。
101.如果使用图8和图9所示的优选试剂盒2,所述第七个孔7也是一个集成的光学检测比色皿7,其壁具有足够的透明度、粘度和厚度,以确保现在可以进行光学检测而无需进一步移位混合物123。正如下文将进一步详细讨论的那样,混合物123的光密度将至少被测量112、112'两次。
102.在启动第一次测量112时,打开分析仪1的第一个发光装置(led),来自第一led的光以660nm的波长传输通过集成比色皿7的第一壁。然后,所述光通过混合物123,并通过集成比色皿7的第二壁,直到该光被分析仪的光检测器检测到。在预定的时间内收集连续读数,以提供第一个凝血数据124。
103.对于第二次测量112'而言,打开分析仪1的第二个发光装置(led),来自第二led的光以530nm的第二波长通过集成比色皿7的第一壁。然后光通过混合物123传输,并通过集成比色皿7的第二壁返回,直到光被分析仪的光检测器收集。提供血红蛋白水平数据125只需要一个读数。应该认识到,虽然这些测量被称为第一次和第二次测量,但是顺序可以颠倒。或者,也可以不按顺序提供测量结果,而是同时提供,甚至部分同时提供。
104.正如下文将进一步讨论的那样,来自光学检测116、116'的结果然后用于校正118
凝血时间结果126。然后向用户报告这些校正后的结果126。
105.生物测定组件的一般概述
106.本发明提供了一种生物测定试剂盒2,它至少有几种微粒子基质10中的一种,现在将讨论这些微粒子基质。在一些实施方案中,微粒子基质10在试剂盒形成之前形成,在其他实施方案中,微粒子基质10在生物测定过程110中加入112血液样本60后形成。
107.微粒子基质10具有微粒子11,这些微粒子可以是无涂层的、未结合的、无蛋白的乳胶或普通物质,或者在聚苯乙烯微粒子上具有表面功能化的基团。基质40通常由碳水化合物46组成,有利于吸附生物标记蛋白,同时允许微粒子11的快速溶解和均匀分散。微粒子11在基质40中的分散性允许吸附可量化的分析性蛋白质生物标志物,然后可用于配体附着。
108.本发明中使用的微粒子11包括带有表面活性基团如脒22和硫酸盐24的聚苯乙烯微粒子18。本发明的微粒子11的直径大小26为从20nm到800nm或更大。粒子直径26的优选范围为40nm到150nm,最优选的直径26的范围为75到125nm。
109.脒类微粒子
110.本发明的一个实施方案是在容重28为0.080%的稀释液11中采用直径26为95nm的脒类粒子22。在660nm时测量稀释液11的光密度31,光密度值为0.19。
111.本发明的脒类微粒子22的直径26的范围为20nm至800nm或更大。粒子直径26的优选范围是40nm到150nm,更优选的直径26的范围在75到125nm之间;最优选的直径的范围在90nm到98nm之间。脒类微粒子22在容重28范围为0.006-8%的稀释液11中,更优选在容重范围为0.010-0.20%的稀释液11中,最优选在容重为0.080%的稀释液11中。
112.使用脒类胶乳粒子22的本生物测定方法需要稀释液11,其中微粒子22与一氧化二氢的总稀释比30在1:10至1:400的范围内;并且更优选地在1:20至1:150的范围内。
113.可满足本发明生物测定方法的目标的脒类乳胶粒子22可包括根据本文讨论的本发明方法制备时invitrogen
tm
公司提供的高活性乳胶珠。
114.硫酸盐微粒子
115.本发明的另一个实施方案采用了直径为110nm的硫酸盐微粒子24,所述硫酸盐微粒子在容重为0.044%的稀释液中。在660nm时测量稀释液11的光密度,光密度值为0.21。
116.本发明的其他硫酸盐微粒子24的直径大小26为从20nm到800nm或更大。硫酸盐粒子24的直径26的优选范围是40nm到150nm,更优选的直径26在75到125nm之间;最优选的直径26在90nm到110nm之间。
117.根据一些实施方案,硫酸盐微粒子24在容重范围为0.001%-12%的稀释液11中,更优选在容重范围为0.01%-8%的稀释液11中,最优选在容重为0.016%的稀释液11中。
118.使用硫酸盐微粒子24的本生物测定方法要求稀释比30具有1:50至1:2000范围内的微粒子24与一氧化二氢的比率;更优选的比例范围为1:100至1:1000;最优选的比例为1:500。
119.当按照本文讨论的本发明的方法制备时,可满足本发明目标的硫酸乳胶粒子24可包括由invitrogen
tm
公司提供的高活性乳胶珠。
120.表面游离微粒子
121.本发明的另一个实施方案是在容重28为0.067%的稀释液11中采用直径26为96nm的表面游离微粒子20。该稀释液的稀释比30为1比150。在660nm时测量稀释液11的光密度
31,光密度值为0.21。
122.本发明的其他表面游离微粒子20的直径26的范围为从20nm到800nm或更大。表面游离微粒子20的直径26的优选范围是40nm到150nm,更优选的直径26在75到125nm之间;最优选的直径26在90nm到110nm之间。根据一些实施方案,表面游离微粒子20在容重范围为0.001%-2%的稀释液11中,更优选在容重范围为0.01%-0.2%的稀释液11中,最优选在容重为0.016%的稀释液11中。
123.使用表面游离微粒子20的本生物测定方法需要稀释液11,其中微粒子20与一氧化二氢33的稀释比30在1:50至1:2000的范围内;并且更优选地在1:100至1:1000的范围内。
124.当按照本文讨论的本发明方法制备时,可满足本发明的微粒子要求的表面游离粒子可包括由varian实验室
tm
提供的普通微粒子。
125.羧基微粒子
126.本发明的其他实施方案是在容重为0.016%的溶液中采用直径为103nm的羧基乳胶微粒子。在660nm时测量稀释液11的光密度,光密度值为0.08。
127.本发明的其他羧基微粒子25的直径26的范围为从20nm到800nm或更大。羧基微粒25的直径26的优选范围是40nm到150nm,更优选的直径26在75nm到125nm之间;最优选的直径在90nm到110nm之间。
128.根据一些实施方案,羧基微粒子24在容重范围为0.001%-2%的溶液28中,更优选在容重范围为0.005%至1%的溶液28中,最优选在容重为0.016%的稀释液11中。
129.本生物测定方法使用羧基微粒子25需要稀释液11,其中微粒子25与稀释液33的稀释比30在1:50至1:2000的范围内;并且更优选地在1:100至1:1000的范围内。
130.当按照本文讨论的本发明方法制备时,可满足本发明的羧基乳胶粒子24可包括由invitrogen
tm
公司提供的高活性乳胶珠。
131.干燥基质
132.一般来说,本发明的生物测定方法可以利用大多数普通的或具有功能化表面的乳胶粒子悬浮液。一些实施方案采用具有试剂衰减剂的基质,如表面活性剂。两种被检测的试剂衰减剂包括聚山梨酯型非离子表面活性剂和辛基酚乙氧基化物表面活性剂。当根据本文讨论的本发明的方法制备时,可满足本发明目标的聚山梨酯型非离子表面活性剂和辛基酚乙氧基化物表面活性剂可包括由tween
tm
和triton
tm
家族提供的表面活性剂。
133.根据本发明的一些干燥基质包括碳水化合物、碳水化合物衍生物和混合物,它们创造了一种环境,从而保护粒子不受不利温度的影响,并允许在加入缓冲液、稀释样本或其他液体试剂等流体时快速再水化和均匀分散。
134.碳水化合物及其衍生物是用于干燥粒子并在干燥过程中为本文讨论的生物测定方法提供稳定性的优选化合物。这些试剂是在水中制备的。然而,在其他实施方案中也使用了低摩尔率的缓冲液,这些实例包括甘氨酸和二甘氨酸。稳定剂的百分比浓度范围为2-25%,优选范围为5-10%。
135.用于干燥基质的化合物包括:甘氨酸,二甘氨酸,氯化钠,辛烯基琥珀酸酐,聚乙烯醇-聚乙二醇接枝共聚物,麦芽糊精,α-(1,6)-连接麦芽三糖,α-d-吡喃葡萄糖-(1
→
1)-α-d-吡喃葡萄糖苷,在有水的情况下用酸和/或酶水解淀粉得到的水溶性葡萄糖聚合物,多糖聚合物,聚乙二醇,聚乙二醇(15)-羟基硬脂酸酯,聚维酮,蔗糖,山梨醇,12-羟基硬脂酸的
聚氧乙烯酯,以及1-o-α-d-吡喃葡萄糖基-d-甘露醇。
136.可满足本发明目标的这些化合物产品的公开版本可包括hicap 100
tm
、kollicoat ir
tm
、maltrin 250
tm
、pullulan、trehalose、solutol
tm plus和solutol
tm
。优选的实施方案是lab 9101
tm
、maltrin 250、trehalose
tm
和蔗糖,最优选的基质是maltrin
tm
、蔗糖和异麦芽。而对于使用干燥的硫酸盐微粒子的实施方案而言,优选的碳水化合物是蔗糖或异麦芽。
137.液体基质
138.上述每种干基质的相同粒子悬浮液也可以用所谓的“液体”基质制成更稀薄的形式,以便于配药和吸液。例如,当干基质配方由25ul的1:18硫酸盐胶乳与10%的蔗糖组成时,类似的液体基质的试剂范围为50ul的1:9硫酸盐胶乳与5%的蔗糖。在其他实施方案中,液体基质是由裂解的稀释液形成的。
139.本实施方案的液体基质中使用的化合物包括:甘氨酸,二甘氨酸,氯化钠,辛烯基琥珀酸酐,聚乙烯醇-聚乙二醇接枝共聚物,麦芽糊精,α-(1,6)-连接麦芽三糖,α-d-吡喃葡萄糖基-(1
→
1)-α-d-吡喃葡萄糖苷,在有水的情况下用酸和/或酶水解淀粉而得到的水溶性葡萄糖聚合物,多糖聚合物,聚乙二醇,聚乙二醇(15)-羟基硬脂酸酯,聚维酮,蔗糖,山梨醇,12-羟基硬脂酸的聚氧乙烯酯,1-o-α-d-吡喃葡萄糖基-d-甘露醇,聚乙二醇(peg),peg 6k,peg 12k和peg 20k,聚山梨酯型非离子表面活性剂,辛基酚乙氧基化物表面活性剂和/或二甲基硅油,用注射用水级纯水稀释到支持usp测定中小于15秒的消泡性能的浓度。
140.可满足本发明目标的这些化合物产品的公开版本包括hicap 100
tm
,kollicoat ir
tm
,lab 9101
tm
,maltrin 250
tm
,pullulan
tm
,trehalose
tm
,solutol plus tm
,solutol
tm
,foamaway
tm
和sorbital
tm
。
141.试剂
142.本发明的生物测定方法采用各种试剂80或激活剂。用作本发明实施方案的激活剂的化合物包括:促凝血酶、凝血致活酶、组织凝血致活酶因子iii、血小板组织因子、促凝血酶、凝血酶原激酶、组织因子、凝血活素、鞣花酸、活化部分凝血活酶、凝血酶、因子ii、因子vii、因子i、因子x、因子xii、活化蛋白c、带负电荷的磷脂、钙离子、硅酸铝粘土、氧化硅、二氧化硅、硅藻土和聚维酮。
143.当适当制备时,可满足本发明目标的这些化合物和产品中选择的少数的市售形式可包括高岭土
tm
、innovin
tm
促凝血酶原激酶82、aptt-xl 84和siemens
tm
、凝血酶86。
144.在实际的生物测定之前,这些试剂或激活剂在储存装运时可处于干燥状态,以确保额外的稳定性。然后在测定过程中,这些试剂80可以用稀释液90,如dh2o等,在20ul到400ul的范围内,更优选在50ul到300ul的范围内,以及在50ul到100ul的范围内,以各种浓度96和各种量94进行稀释。还有一些实施方案采用了氯化钙或其他稀释液,这将在下面的具体实施方案中加以讨论。
145.光密度和校正
146.正如最初就图10所讨论的那样,本发明和系统中使用了凝血(比浊)检测原理来测量116、116'并记录血浆或全血样本60凝血所需的时间。这种技术通过测量随时间检测的光密度130的变化135来评估凝血起始132和凝血终点134。
147.凝血的形成124是根据以下原理推断和'检测'的:在纤维蛋白原转化为纤维蛋白的介质中,任何通过所述介质的光都会被纤维蛋白链吸收。因此,随着时间的推移,在纤维
蛋白凝血的形成过程中,光的吸收增加,导致光密度130的变化135。
148.对于本文讨论的每一种生物测定而言,如上所述,在采集样本并混合后,光从源头通过混合体123进行传输。然后,传输的光被引导到光检测器上,所述光检测器与光源呈180
°
角入射。第一次测量116'的光电探测器输出的第一个相应的电信号使用光学检测来确定血红蛋白125的水平。
149.在预定的时间内,通过混合体123的光的透射率再次由光电探测器测量116,由此产生了第二个相应的电信号输出。光电探测器的第一个和第二个相应的电信号输出均根据检测到的光线而变化。
150.信号输出通过软件且通过一系列的算法处理,以确定相关的凝血点、凝血起始132和形成134。简而言之,乳胶微粒子混合物123信号的光密度130的变化135用来指示凝血起始132和形成134。
151.减少的操作程序的运行时间
152.本发明旨在解决凝血检测程序的几个实验室误差来源。由于凝血的形成取决于时间的流逝,凝血检测程序的最大实验室误差来源之一是取样104和测量116之间的时间的流逝。
153.本发明的原则之一是解决现有技术未能解决的因取样104和检测(测量)116之间的时间流逝而导致的错误增多的问题。通过在一个全包式试剂盒2中预先包装测定组件,并为测定方法提供预先选择的组件,本发明加速了预检测阶段。
154.本发明实现这一目标的另一种方式是提供一种生物测定法,这种测定法能够通过使用全血样本获得准确的结果,无需在检测前将红细胞与血浆分离。目前可用的护理点分析仪需要使用血浆作为样本。这需要在获得检测结果之前将血液样本中的红细胞从血浆中分离出来,并进一步延长了取样和检测之间的时间。
155.目前的分析仪需要血浆的原因之一是由于现有技术的自动系统和检测方法无法提供自我修正的分析。血液样本中的血红蛋白水平将对凝血的起始速度产生影响。本发明人发现,如果不调整光密度的信号输出以考虑个人血红蛋白数量的变化,就会在正确识别凝血起始和形成方面造成错误。
156.为了解决现有技术的错误,关于这个潜在的错误来源,本发明提供了一种自动校正血红蛋白的生物测定方法。对于所述的使用全血的凝血测定实施方案而言,在可见波长下测量混合体的光密度。随后,通过在另一个可见光波长下测量样本的光密度来确定血红蛋白水平。然后用血红蛋白测量值对凝血时间进行校正,以获得调整后的样本的真实血浆值。为了说明这种自动校正所提供的优势的好处,血红蛋白对凝血酶原时间inr值的影响(有校正和无校正)在图14中作了说明。
157.具体来说,图14中示出了不同水平的血红蛋白(血细胞比容效应)对正常样本的inr的影响。如图所示,血红蛋白的范围为从0到23gm/dl。正常inr的范围是0.8到1.3个inr单位。中度口服抗凝治疗导致inr从1.8到2.8个inr单位。随着血红蛋白的增加,由于全血样本中的血浆部分减少,inr也会增加。有了可见范围内的额外led,inr可以根据检测到的血红蛋白进行校正。该图还示出了用于比较的血红蛋白的校正inr。
158.本发明有利于扩展仪器的功能,包括多个信号测量装置,例如但不限于多个波长的发光二极管(led)。测量混合物的光密度以读取检测结果最好是在可见光波长下进行,所
述可见光波长的范围在620nm至700nm之间,更优选在650至680nm之间,甚至更优选在658nm至668nm之间,最优选为660nm。测量样本的光密度以读取血红蛋白水平,最好在可见光波长下进行,所述可见光波长的范围在500nm和550nm之间,更优选在510nm和545nm之间,甚至更优选在520nm和540nm之间,最优选为530nm。
159.表1示出了图14中的数据,确定了样本id、血红蛋白水平和校正前的初始inr。
[0160][0161]
表2示出的数据在图14中也有图示,确定了样本id、血红蛋白水平和校正后的初始inr。
[0162][0163]
接下来,如图15所示,根据本方法,在对血红蛋白进行校正和未进行校正的情况下,在预先批准的pt/inr分析仪上获得的血浆inr值之间的差异以图示方式进行说明。同样,血红蛋白值的范围是0到23g/dl。
[0164]
表3示出了图15中的数据,确定了样本id、血浆inr、血红蛋白校正前后与血浆inr
值的差异(delta inr)。
[0165][0166]
标准化凝血酶原时间/inr
[0167]
应该理解的是,在本发明的生物测定的各种实施方案中都采用了标准化inr。标准化凝血酶原时间inr用于解决所使用的凝血致活酶的差异,这些差异造成了输出的变化。这种inr校正测量(或标准化)是由凝血酶原时间、凝血致活酶的敏感性指数和平均凝血酶原时间制定的。
[0168]
具体来说,在数学公式中,这种标准化可以写成以下公式:
[0169]
inr=(pt/mt)
isi
[0170]
其中,在上述表述中,inr代表标准化值;pt代表凝血酶原检测时间;isi代表凝血致活酶的敏感性指数;mt代表从20个正常样本中得出的平均凝血酶原时间。
[0171]
本发明的特定生物测定
[0172]
现在来看图16-24,图中示出了根据本发明的实施方案进行的特定生物测定的结果。除非特别说明,这些生物测定结果说明了在660nm时使用动力学模式随时间变化的光密度读数(单位:秒)。
[0173]
采用组织凝血致活酶的生物测定法
[0174]
根据本发明的方法,使用用于各种微粒子稀释液的不同基质的不同生物测定b1-b20的结果在图16-33中示出,并在下文中进行了讨论。这些生物测定b1-b20中的每一个均采用了组织凝血致活酶试剂。具体来说,这些生物测定所选择的试剂80是组织凝血致活酶和氯化钙,其用量列在下面的每个协议中。
[0175]
用涂有bsa的乳胶和普通微粒子进行b1-b4生物测定
[0176]
现在来看图16和图17,它们以图示方式示出了根据本发明的四个生物测定b1-b4的结果。
[0177]
第一个生物测定b1采用了微粒子稀释液11,其中的微粒子27具有牛血清白蛋白(bsa)表面基团。微粒子用0.02%的叠氮钠在水中按1比500的比例稀释,总的微粒子浓度为0.016%。稀释后在660nm时测量稀释液11的光密度,其光密度值为0.08。所述生物测定b1进一步采用了基质40,所述基质具有ph为10.0的0.17m甘氨酸、1.0m氯化钠以及用水稀释的1%二甲基硅油。该生物测定b1是用标准的柠檬酸化全血样本60进行的。
[0178]
相比之下,第二个生物测定b2的方案与上述生物测定b20相同,只是b2是用含有微
粒子20(不含bsa表面基团)的微粒子稀释液11进行的。所述生物测定所选择的试剂80是组织凝血致活酶和氯化钙。
[0179]
如图16所示,对于b1测定而言,其尝试使用根据上文讨论的现有技术已知的bsa微粒子,未检测到光密度随时间的一致变化,因此,b1测定未检测到凝血起始时间、凝血结束时间或凝血的变化。
[0180]
同样如图16所示,对于根据本文讨论的新方法采用本发明概念的b2测定而言,可以看到凝血在大约4秒时开始132,od值为0.1342,也可以看到凝血在大约10秒时结束134,od值为0.1907,吸收135随时间的变化是光密度值的变化,od值差为0.0565。
[0181]
为了证实这一差异,再次重复了这些生物测定b1和b2,这次使用了异常的血液样本,为了清楚起见,分别命名为第三和第四生物测定b3和b4。
[0182]
如图17所示,对于b3测定而言,其再次尝试使用根据上文讨论的现有技术已知的bsa微粒子,未检测到光密度随时间的一致变化,因此,b3测定未检测到凝血起始时间、凝血结束时间或凝血的变化。
[0183]
同样如图17所示,对于采用本发明方法的b4测定而言,可以看到凝血在大约31秒时开始132,od值为0.1164,也可以看到凝血在大约59秒时结束134,od值为0.2180,吸收135随时间的变化是光密度值的变化,od值差为0.1016。
[0184]
下文表16中提供了b1-b4生物测定协议:
[0185][0186]
下面的表5示出了根据本发明的上述生物测定b1-b4在一段时间内在660nm时使用动力学模式的光密度结果数据:
[0187]
[0188]
[0189][0190]
使用聚乙二醇基质进行b5-b10生物测定
[0191]
现在来看图18-23,它们以图示方式示出了根据本发明的各种实施方案的六种生物测定b5-b10的结果。
[0192]
具体来说,图18以图示方式示出了根据本发明的第一生物测定b5的结果,其使用微粒子稀释物11,所述微粒子稀释物11中具有微粒子22,所述微粒子22具有直径26为95nm且容重28为0.080%的脒表面基团。所述生物测定b5进一步采用了基质40,所述基质40具有
ph为7.0的0.17m甘氨酸、1.29m氯化钠以及10%聚乙二醇(peg)20k。
[0193]
在660nm时测量b5的稀释液的光密度,其光密度值31为0.19。如图18所示,对于b5测定而言,可以看到凝血在大约5秒时开始132,od值为1.153,也可以看到凝血在大约50秒时结束134,od值为1.164,吸收135随时间的变化是光密度值的变化,od值差为0.011。
[0194]
图19以图示方式示出了第二个生物测定实施方案b6的结果,该实施方案采用了微粒子稀释液11,所述微粒子稀释液11具有微粒子,所述微粒子具有直径26为110nm且容重28为0.044的硫酸盐表面基团24。本实施方案b6进一步采用了基质40,所述基质40具有ph为7.0的0.17m甘氨酸、1.29m氯化钠和10%聚乙二醇(peg)20k。
[0195]
在660nm时测量稀释液的光密度,其光密度值为0.21。如图19所示,对于b6测定而言,可以看到凝血在大约5秒时开始132,od值为0.564,也可以看到凝血在大约70秒时结束134,od值为1.000,吸收135随时间的变化是光密度值的变化,od值差为0.436。
[0196]
接下来看图20,其以图示方式示出了第三生物测定实施方案b7的结果,所述实施方案采用了微粒子稀释液11,所述微粒子稀释液11具有不含表面基团20且直径26为96nm容重为0.067%的微粒子。所述稀释液的微粒子与稀释液的稀释比为1比150。所述实施方案b7进一步采用了基质,所述基质具有ph为7.0的0.17m甘氨酸、1.29m氯化钠和10%聚乙二醇(peg)20k。
[0197]
在660nm时测量稀释液的光密度,其光密度值为0.21。如图20所示,对于b7测定而言,可以看到凝血在大约5秒时开始132,od值为0.514,也可以看到凝血在大约85秒时结束134,od值为1.215,吸收135随时间的变化是光密度值的变化,od值差为0.701。
[0198]
图21然后提供了第四生物测定实施方案b8的结果,所述实施方案采用了微粒子稀释液11,所述微粒子稀释液11具有含有脒类表面基团22且直径26为95nm的微粒子。所述微粒子稀释液的容重28为0.080%。在660nm时测量稀释液11的光密度31,其光密度值为0.19。
[0199]
本实施方案b8采用了基质40,所述基质40具有ph为7.0的0.17m甘氨酸47和1.29m氯化钠。所述基质40进一步包括10%聚乙二醇(peg)20k和1%吐温20形式的碳水化合物衍生物。
[0200]
如图21所示,对于b8测定而言,可以看到凝血在大约15秒时开始132,od值为0.633,也可以看到凝血在大约65秒时结束134,od值为1.081,吸收135随时间的变化是光密度值的变化,od值差为0.448。
[0201]
接下来,图22示出了第五个生物测定实施方案b9的结果,所述实施方案采用了微粒子稀释液11。所述稀释液11具有含有硫酸盐表面基团24且直径26为110nm的微粒子。稀释液11内的微粒子24以0.044%的容重存在于稀释液中。具体来说,所述稀释液11用水稀释,粒子与水的比率为1比180。稀释后在660nm时测量稀释液的光密度,光密度值为0.21。所述实施方案b5进一步采用了基质40,所述基质40具有ph为7.0的0.17m甘氨酸、1.29m氯化钠和10%聚乙二醇(peg)20k。
[0202]
如图22所示,对于b9测定而言,只有在对数据进行分析和增强时才能检测到凝血(完整的数据在下面的表7中提供)。然而,当增强后,可以看到凝血在大约25秒时开始132,od值为0.3780,也可以看到凝血在大约85秒时结束134,od值为0.3830,吸收135随时间的变化是光密度值的变化,od值差为0.005。
[0203]
然后,图23提供了第六生物测定实施方案b10的结果图,所述实施方案采用了微粒
子稀释液11,所述微粒子稀释液11具有不含表面基团20且直径为96nm容重为0.067%的微粒子。在最终的稀释液中,微粒子与水的稀释比为1比150。
[0204]
稀释后在660nm时测量稀释液11的光密度31,其光密度值31为0.21。本实施方案进一步采用了基质40,所述基质40具有ph为7.0的0.17m甘氨酸、1.29m氯化钠和10%聚乙二醇(peg)20k。
[0205]
如图23所示,对于b10测定而言,只有在对数据进行分析和增强时才能检测到凝血(完整的数据在下面的表7中提供)。然而,当增强后,可以看到凝血立即开始132,od值为0.3780,也可以看到凝血在大约85秒时结束134,od值为0.3860,吸收135随时间的变化是光密度值的变化,od值差为0.008。
[0206]
上面列出的所有六个实施方案b5-b10的协议显示在下面的表4中:
[0207][0208]
这些生物测定b1-b6的一般方法是相同的,一般是按照上面提到的图10来准备。
[0209]
表5示出了根据本发明的上述六个描述的生物测定实施方案中的每一个,在660nm时使用动力学模式在一分半钟内的校正光密度结果的数据:
[0210]
[0211][0212]
使用二甲基硅油进行b11-b12生物测定
[0213]
现在来看图24,其以图示方式示出了根据本发明的第一种生物测定b11的结果,所述生物测定采用了微粒子稀释液11,所述微粒子稀释液11具有含有硫酸盐表面基团且直径为100nm的微粒子24。微粒子用0.02%的叠氮钠在水中按1比500的比率稀释,微粒子的总浓度为0.016%。
[0214]
稀释后在660nm时测量稀释液11的光密度,其光密度值为0.08。所述生物测定b11进一步采用了基质40,所述基质40具有ph为10.0的0.17m甘氨酸、1.29m氯化钠和1%二甲基硅油,用注射用水级纯水稀释到支持usp测定中小于15秒的消泡性能的浓度,其商业标识为foamaway
tm
。所述生物测定b11是用正常样本60进行的。
[0215]
如图24所示,对于b11测定而言,可以看到凝血在大约3秒时开始132,od值为0.1516,也可以看到凝血在大约65秒时结束134,od值为0.2356,吸收135随时间的变化是光密度值的变化,od值差为0.084。
[0216]
相比之下,图25以图示方式示出了生物测定b12的结果,其协议与上述生物测定b11相同,只是现在用一个异常样本进行测定。如图25所示,对于b12测定而言,现在可以看到凝血在大约30秒时开始132,od值为0.1528,也可以看到凝血在大约65秒时结束134,od值为0.3215,吸收135随时间的变化是光密度值的变化,od值差为0.1687。
[0217]
下文表16提供了生物测定b11、b12的协议:
[0218][0219]
下面的表9示出了根据本发明对上述生物测定b11-b12在660nm时使用动力学模式的光密度结果的数据,对生物测定b12来说超过一分钟,对b11来说超过20秒:
[0220]
[0221]
[0222][0223]
应该理解的是,虽然此处显示的是这些光密度值,但这些值通常不会呈现给用户。相反,根据上面讨论的方法,凝血时间是用血红蛋白的测量值对样本的调整后的真实血浆值进行校正。然后用这个校正后的凝血时间来报告上文讨论的标准化inr。
[0224]
例如,对于上述异常血液生物测定b12而言,为了确定血红蛋白的含量,进行了第一次光密度测量116'。在530nm时检测到的光密度为1.5135,将所述光密度值140与预先确定的od值和已知血红蛋白值的关系141进行比较,以确定被分析样本中存在的特定血红蛋白水平142。同样,尽管这一水平通常不向客户或用户报告,但这一分析在图26中作了说明。生物测定b11的具体血红蛋白水平142随后被储存在系统内存中,直到第二组光密度测量116完成。
[0225]
正如上文参照图25所讨论的,对于该血红蛋白水平的b12测定而言,凝血在第一时间(30秒)开始132,od值为0.1528,凝血在第二时间(65秒)结束134,od值为0.3215。在增量时间(35秒)内,吸收135的变化是第一od值差,其值为0.1687。在本发明方法的各种生物测定中,吸收135随时间变化而产生的od值差异在0.005-1.0的范围内。更优选的是,od值差至少为0.2,必要时,od值差至少为0.08。这种吸收135的变化可用于计算pt值136(47秒,它与吸收od值0.23715有关)。
[0226]
然后系统使用这个初始pt值136,并检索参照图24确定的具体hgb水平142。然后用一个预定的关系137来确定调整或校正的pt值138。具体来说,图27示出了通过与样本60的血红蛋白水平142(12.3)相对应的预定关系137对未校正的pt值136进行校正。然后用这个关系137来提供一个校正的pt值138。其中对于血红蛋白水平142而言,关系137在数学上表示为:
[0227]
cpt=pt*sqrt(c/hgb)
[0228]
其中cpt是校正的凝血酶原时间138;pt是未校正的凝血酶原时间136;c是血红蛋白常数;hgb是与特定样本60有关的特定血红蛋白水平142。
[0229]
然后,图28示出了从校正的pt 138计算inr的情况。具体来说,这种计算是:
[0230]
inr=(pt/mt)
isi
[0231]
将上述公式应用于b12获得的数据,pt代表凝血酶原校正测试时间138(50.1秒);isi代表所用凝血致活酶的敏感性指数(0.98无相关单位);mt代表从20个正常样本中得出的平均凝血酶原时间(10.2秒);inr代表标准化值144(4.8无相关单位)。在一般情况下,只将校正后的pt值(50.1秒)和inr值(4.8无相关单位)报告给用户。
[0232]
使用羧基微粒子的b13-b14生物测定
[0233]
现在来看图29,其以图示方式示出了根据本发明的生物测定方法b13的结果,所述方法采用了含有微粒子25的微粒子稀释液11,所述微粒子25具有直径为103nm且在容重为0.016%的稀释液中的羧基表面基团。使用羧基微粒子25的本生物测定方法要求稀释液11具有微粒子25与一氧化二氢33的稀释比30的范围为1:50至1:2000;更优选的范围为1:100至1:1000。
[0234]
在660nm时测量稀释后的溶液的光密度,光密度值为0.08。所述生物测定b13还采用了一种基质,所述基质具有ph值为10.0的0.17m甘氨酸,1m氯化钠和1%二甲基硅油,用注射用水级纯水稀释到支持usp测定中小于15秒的消泡性能的浓度,其商业标识为foamaway
tm
。所述生物测定b13是用正常样本60进行的。
[0235]
如图29所示,对于b13测定而言,可以看到凝血在大约5秒时开始132,od值为0.1304,也可以看到凝血在大约20秒时结束134,od值为0.1826,吸收135随时间的变化是光密度值的变化,od值差为0.0522。
[0236]
相比之下,图30以图形方式示出了生物测定b14的结果,该测定具有与上述生物测定b13相同的协议,只是现在用异常样本进行。如图30所示,对于b14测定而言,可以看到凝血在大约40秒时开始132,od值为0.1218,也可以看到凝血在大约68秒时结束134,od值为0.2027,吸收135随时间的变化是光密度值的变化,od值差为0.0811。
[0237]
表10提供了b13、b14生物测定协议:
[0238][0239][0240]
下面的表11示出了根据本发明对上述生物测定b13-b14在660nm时使用动力学模式的光密度结果的数据,对生物测定b13来说超过一分钟,对b14来说超过20秒:
[0241]
[0242]
[0243][0244]
不同操作温度下的b15-b18生物测定
[0245]
通常情况下,根据本发明的许多生物测定是在生理温度下进行的,但并非总是如此。应该理解的是,一般来说,大多数温度可以适用于本发明的方法。然而,用上面讨论的生物测定法调整这个变量将引发潜在的变化,使得生物测定的结果一般会发生改变。因此,在不考虑这些变化的情况下,不应引入温度变化,特别是在准确的时间可以影响临床结果凝血测定中。
[0246]
图31和32以图示方式示出了本发明的四个生物测定实施方案b15-b18在两个不同温度下采用两种不同的微粒子基质的结果。所有四个生物测定实施方案的协议都在下面的表12中提供:
[0247][0248]
[0249]
具体来说,生物测定b15采用了微粒子稀释液11,所述微粒子稀释液11具有微粒子,所述微粒子含有直径为95nm的脒类表面基团22。当容重为0.080%时,所述稀释液11具有用水以1比50的比率稀释的微粒子22。在660nm时测量稀释后的溶液的光密度,光密度值为0.19。所述生物测定b15采用基质40,所述基质40具有ph值为7.0的0.17m甘氨酸、0.29m氯化钠和10%聚乙二醇(peg)20k。所述生物测定b15是在22℃的温度下进行的。
[0250]
如图31所示,对于b15测定而言,可以看到凝血几乎立即开始132,在大约4秒时,od值为1.079,也可以看到凝血在大约100秒时结束134,od值为1.748,吸收135随时间的变化是光密度值的变化,od值差为0.669。
[0251]
在图31中还可以看到类似的生物测定b16的结果的图示。所述生物测定b16也采用了微粒子稀释液11,所述微粒子稀释液11具有微粒子,所述微粒子含有直径为95nm的脒类表面基团22。当容重为0.080%时,所述微粒子22用水以1比50的稀释比率30稀释。在660nm时测量稀释后的光密度31,光密度值31为0.19。所述生物测定b16也采用了基质40,所述基质40具有ph值为7.0的0.17m甘氨酸、0.29m氯化钠和10%聚乙二醇(peg)20k。然而,与生物测定b15不同,本生物测定b16是在37℃的操作温度下进行的。
[0252]
如图31所示,对于b16测定而言,凝血值更难区分,尽管可以看到凝血在大约4秒时几乎立即开始132',od值为1.023。与b15测定不同,b16测定似乎很快完成凝血,因为凝血似乎在大约40秒时结束134',od值为1.110,吸收135'随时间的变化是光密度值的变化,od值差仅为0.087。
[0253]
接下来转向图32,其以图示方式示出了根据本发明的另一对生物测定b17和b18的结果。在第一生物测定b17中,微粒子稀释液11采用了具有脒类表面基团且直径26为0.95nm的微粒子22。以1比50的比率用水稀释,所述生物测定b17中的微粒子22以0.080%的容重存在于稀释液11中。
[0254]
在660nm时测量稀释液11的光密度31,其光密度值为0.19。本生物测定b17采用基质40,所述基质40具有ph值为7.0的0.17m甘氨酸、0.29m氯化钠、10%聚乙二醇(peg)20k和1%吐温20。生物测定b17是在22℃的操作温度下进行的。
[0255]
如图32所示,对于b17测定而言,可以看到凝血在大约12秒时开始132,od值为0.997,也可以看到凝血在大约58秒时结束134,od值为1.772,吸收135随时间的变化是光密度值的变化,od值差为0.775。
[0256]
根据本发明的第二生物测定b18使用了微粒子稀释液,所述微粒子稀释液采用了微粒子22,所述微粒子22具有直径为0.95nm且容重为0.080%的脒类表面基团。稀释液11的稀释比为1比50。在660nm时测量稀释后的溶液的光密度,光密度值为0.19。本生物测定b18也采用了一个基质,所述基质具有ph值为7.0的0.17m甘氨酸、0.29m氯化钠、10%聚乙二醇(peg)20k和1%吐温20。然而,与生物测定b17不同,生物测定b18是在37℃的操作温度下进行的。
[0257]
如图32所示,对于b18测定而言,凝血值更难区分,尽管可以看到凝血在大约20秒时再次开始132',od值为0.653。b18测定似乎在大约60秒时结束凝血134',od值为1.054,吸收135'随时间的变化是光密度值的变化,od值差仅为0.401。
[0258]
这些生物测定b15-b18的一般方法是相同的,一般都是按照上面提到的图10来准备。
[0259]
下面的表13示出了根据本发明的上述生物测定b15-b18中的每一个,在660nm处使用动力学模式在几分钟内的校正光密度结果的数据:
[0260]
[0261][0262]
用于监测抗凝血剂使用的b19-b20生物测定
[0263]
现在来看图33,其以图示方式示出了凝血酶原时间生物测定b19、b20的结果,并用
于测定凝血的多步执行的外源性途径并监测口服抗凝剂的使用。这些生物测定b11、b12是凝血酶原时间测定,说明了正常全血样本的本发明方法的第一种测定b19与服用口服抗凝剂coumadin
tm
的患者样本的本发明方法的第二种测定b20的光密度与时间(单位为秒)的测量结果。
[0264]
coumadin
tm
(也被称为华法林)抑制维生素k的合成,因此抑制了因子vii的半衰期。如本文所述,本图中使用凝血酶原时间测试和双波长校正对因子vii的水平进行测定和校正。
[0265]
如图33所示,正常的凝血时间132通常在大约15至20秒后开始,如上所述,凝血的形成是通过因子vii激活的外源性凝血途径启动的。具体来说,如图33所示,正常血液样本的测定方法b19在大约15秒后开始凝血132,coumadin样本的测定方法b20在大约100秒后开始凝血132’。
[0266]
对于b19和b20这两种测定而言,微粒子稀释液11采用了微粒子22,所述微粒子22具有直径26为95nm且容重为0.080%的脒类表面基团。微粒子稀释液11以1比50的比率用水稀释。在660nm时测量稀释液的光密度,其光密度值为0.19。
[0267]
如图33所示,对于b19测定而言,可以看到凝血在大约15秒时开始132,od值为0.989,也可以看到凝血在大约90秒时结束134,od值为1.700,吸收135随时间的变化是光密度值的变化,od值差为0.711。
[0268]
同样如图33所示,对于b20测定而言,可以看到凝血在大约50秒时开始132',od值为0.919,也可以看到凝血在大约180秒时结束134',od值为1.6290,吸收135'随时间的变化是光密度值的变化,od值差为0.7100。
[0269]
b19、b20生物测定协议见下表14:
[0270][0271]
这些生物测定b19-b20的一般方法是相同的,一般都是按照上面提到的图10来准备。表15示出了第一生物测定b19用正常柠檬酸化血和第二生物测定b20用香豆素柠檬酸化血在两分钟内在660nm时使用动力学模式测定的光密度数据:
[0272]
[0273][0274]
采用凝血酶的生物测定
[0275]
根据本发明的方法,采用不同基质的不同微粒子稀释度的不同生物测定b21-b22的结果在图34中作了说明,并在下文中对每个生物测定进行了讨论。这些生物测定b21-b22中的每一个均采用了凝血酶试剂。具体来说,这些生物测定所选择的试剂80是组织凝血致活酶和氯化钙,其用量列在下面的每个协议中。
[0276]
用于测量纤维蛋白原水平的b21-b22生物测定
[0277]
现在来看图34,其示出了凝血酶时间(tt)测定b21、b22的结果,它直接测量纤维蛋白原的水平和功能,也将确定样本中是否存在凝血酶抑制剂。图34说明了根据本发明方法,用30ul凝血酶试剂对柠檬酸化血浆进行第一次tt测定b21与用20ul凝血酶试剂和柠檬酸化血液进行第二次tt测定b22的光密度与时间(单位为秒)的测量结果。
[0278]
下文表16提供了生物测定b15、b16的协议:
[0279][0280]
具体来说,这些生物测定b21、b22采用了微粒子稀释液11,所述微粒子稀释液11具有微粒子24,所述微粒子24具有直径26为110nm且容重为0.2%的硫酸盐表面基团。两个生物测定b21、b22均采用了基质40,所述基质40具有ph值为10.0的0.17m甘氨酸和1.0m氯化钠。第一生物测定b21采用了30ul西门子
tm
凝血酶时间(tt)试剂,第二生物测定b22采用了20ul西门子
tm
凝血酶时间(tt)试剂。
[0281]
一些可与本发明方法一起使用的凝血酶抑制剂是未分级肝素、低分子量肝素和直接抗凝血酶的口服抗凝剂,包括但不限于水蛭素、利伐沙班、阿哌沙班、达比加群和阿加曲班。这些生物测定b21-b22的一般方法是相同的,一般都是按照上面讨论的图10来准备的。
[0282]
如图34所示,对于b21测定而言,可以看到凝血在大约5秒时开始132,od值为0.1829,也可以看到凝血在大约100秒时结束134,od值为0.3481,吸收135随时间的变化是光密度值的变化,od值差为0.1652。
[0283]
同样如图34所示,对于b22测定而言,可以看到凝血在大约5秒时开始132',od值为0.1357,也可以看到凝血在大约80秒时结束134',od值为0.2491,吸收135'随时间的变化是光密度值的变化,od值差为0.1134。
[0284]
表17示出了第一生物测定b21用30ul凝血酶试剂和第二生物测定b22用20ul凝血酶试剂在三分钟内在660nm时使用动力学模式测定的光密度数据:
[0285]
[0286][0287]
采用活化部分凝血活酶的生物测定
[0288]
根据本发明的方法,采用不同基质的不同微粒子稀释度的不同生物测定b23-b27的结果在图35-38中作了说明,并在下文中对每个生物测定进行了讨论。这些生物测定b23-b27中的每一个均采用了活化部分凝血活酶试剂。具体来说,这些生物测定所选择的试剂80是活化的部分凝血活酶和氯化钙,其用量列在下面的每个协议中。
[0289]
用于内源性途径的b23-b24生物测定
[0290]
现在来看图35和36,其示出了活化部分凝血活酶时间(appt)生物测定b23、b24的结果,这些生物测定用于测定凝血的单步执行的内源性途径。具体来说,图35示出了本发明
方法中正常对照的第一种aptt生物测定b23的光密度与时间(单位为秒)的测量结果。然后,图36示出了根据本发明方法对异常对照的第二种aptt生物测定b24的光密度与时间(单位为秒)的测量结果。
[0291]
b23、b24两种生物测定均采用了微粒子稀释液11,所述微粒子稀释液11具有容重为0.392%的微粒子24,所述微粒子24具有直径为110nm的表面基团。采用如上所述的干燥基质,其具有20ul的0.005m氯化钙。在另一个孔中,100ul的aptt-xl试剂用150ul的蒸馏水稀释。这些生物测定b23-b24的一般方法是相同的,一般是按照上面提到的图10来准备。
[0292]
如图35所示,对于b23测定而言,可以看到凝血在大约13秒时开始132,od值为0.5524,也可以看到凝血在大约150秒时结束134,od值为0.9315,吸收135随时间的变化是光密度值的变化,od值差为0.3791。
[0293]
如图36所示,对于b24测定而言,可以看到凝血在大约65秒时开始132,od值为0.5111,也可以看到凝血在大约240秒时结束134,od值为0.9097,吸收135随时间的变化是光密度值的变化,od值差为0.3986。
[0294]
下文表19提供了生物测定b23、b24的协议:
[0295][0296]
表19示出了第一生物测定b23用正常对照和第二生物测定b24用异常对照在三分钟内在660nm时使用动力学模式测定的光密度数据:
[0297]
[0298][0299]
用于基于一阶段aptt因子的b25-b27生物测定
[0300]
具体来说,图37和38以图示方式示出了基于一阶段aptt因子的三种生物测定b25、
b26和b27的结果,以测量凝血内源性途径的活性和活性水平。第一生物测定b25使用正常血浆的aptt,第二生物测定b26使用99.9%因子viii缺陷的异常血浆的aptt,第三生物测定b27是使用正常/异常混合血浆的aptt一阶段因子测定。
[0301]
具体来说,图37和38以图示方式示出了生物测定b25、b26、b27的结果,所述测定采用了微粒子稀释液11,所述微粒子稀释液11具有0.044%粒子浓度的微粒子24,所述微粒子24具有直径为110nm的表面基团。所述稀释液11的微粒子以1比180的比率用水稀释。在660nm时测量稀释液11的光密度,其光密度值为0.21。这些生物测定都进一步采用了基质40,所述基质40具有ph值为10.0的0.17m甘氨酸和1.0m氯化钠。
[0302]
使用这些测定方法可直接测量因子xii、xi、ix和viii。此外,也测量了因子x、v、ii,因为它们参与了导致最终凝血的共同途径级联。部分凝血致活酶是通过添加钙和磷脂等常见的因子xii的表面激活剂从样本中形成的。活化剂包括但不限于高岭土、硅藻土、鞣花酸。根据本发明方法进行的单阶段因子测定,通过将该水平与从已知因子缺乏的样本和正常样本的稀释液中得到的标准曲线进行比较,来滴定样本的个体因子水平。
[0303]
生物测定b25、b26的一般方法一般如上面参考图10讨论的那样进行制备。一阶段因子生物测定b27使用与图10中讨论的相同的一般方法,但另外在一个额外的孔6"'中干燥了已知量的单一已知因子缺陷的血浆,以减弱样本60的反应。使用软件中提供的标准曲线,根据本文公开的方法,测量116、校正118并报告119样本60中的实际反应水平。
[0304]
如图37所示,对于b25测定而言,可以看到凝血在大约30秒时开始132,od值为0.0340,也可以看到凝血在大约100秒时结束134,od值为0.3530,吸收135随时间的变化是光密度值的变化,od值差为0.3190。
[0305]
如图38所示,对于b26测定而言,可以看到在大约100秒时开始凝血132,od值为0.3140,在大约200秒时凝血结束134,od值为0.8440,吸收135随时间的变化是光密度值的变化,od值差为0.3986。
[0306]
同样如图38所示,对于b27测定而言,可以看到凝血在大约50秒时开始132',od值为0.1820,也可以看到凝血在大约110秒时结束134',od值为0.5480,吸收135'随时间的变化是光密度值的变化,od值差为0.3660。
[0307]
下文表20提供了所有三个生物测定b25-b27的协议:
[0308][0309]
下面的表21示出了根据本发明对上述各生物测定b25-b27在5分钟内在660nm时使
用动力学模式的校正光密度结果的数据:
[0310]
[0311][0312]
附图标记列表
[0313]
说明书中使用以下参考编号,以指代本技术附图中的那些参考元素。
[0314]
1分析仪
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9主要包装
[0315]
2试剂盒
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10微粒子基质
[0316]
3条形码
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
11微粒子稀释液
[0317]
4指棒
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
18功能基团类型
[0318]
5经过消毒的移液管
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
20普通物质
[0319]
6孔
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
22脒
[0320]
7比色皿
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
24硫酸盐
[0321]
8采样器
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
26尺寸
[0322]
28容重
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
102选择试剂盒/生物测定
[0323]
30稀释比
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
103带分析仪的扫描试剂盒
[0324]
31光密度值
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
104获取血液样本
[0325]
32数量
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
105操作指棒
[0326]
33稀释液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
106取出带有试剂盒的毛细管采样器
[0327]
40基质
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
107将采样器接触血液,向采样器中注
[0328]
42湿式基质
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
入样本
[0329]
44干燥基质
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
108更换试剂盒的采样器
[0330]
46碳水化合物
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
109将试剂盒插入分析仪内
[0331]
47甘氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
110自动化生物测定过程步骤
[0332]
48数量
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
112添加组件
[0333]
50酸度
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
114混合/搅拌部件
[0334]
52氯化钠
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
115孵化
[0335]
54聚乙二醇
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
116测量
[0336]
56吐温
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
118校正
[0337]
60血液样本
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
119报告结果
[0338]
61柠檬酸化血液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
120调整
[0339]
62全血
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
121混合体
[0340]
63血浆
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
122溶液
[0341]
64混合
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
123混合物
[0342]
65数量
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
124光学检测到的血栓形成
[0343]
68微粒子混合体
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
125光学检测的血红蛋白水平
[0344]
70温度
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
126校正的凝血时间
[0345]
80试剂/激活剂
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
130光密度
[0346]
82凝血致活酶
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
132凝血开始
[0347]
84活化部分凝血活酶时间
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
134凝血结束
[0348]
86凝血酶
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
135吸收的变化=随时间变化的光密度
[0349]
88鞣花酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
136未校正的凝血酶原时间
[0350]
90稀释液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
137 hgb关系
[0351]
92氯化钙
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
138校正的pt
[0352]
100方法
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
140在530nm时测定的od值
[0353]
141 od值与血红蛋白的预定关系
ꢀꢀ
142 具体的血红蛋白水平
[0354]
结论
[0355]
尽管本文已经描述了本发明的优选实施方案,但上述描述只是说明性的。各领域技术人员可对本文所公开的本发明进行进一步修改,所有这些修改均属于所附权利要求书所定义的本发明的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1