图像式细胞仪的制作方法
本申请是申请号为201480031377.1、申请日为2014年5月28日并且于2015年11月30日进入中国国家阶段的pct专利申请的分案申请。本发明涉及通常在低光学放大倍率下,用于图像式细胞术分析的方法和系统,其中分析是基于生物颗粒的检测。
背景技术:
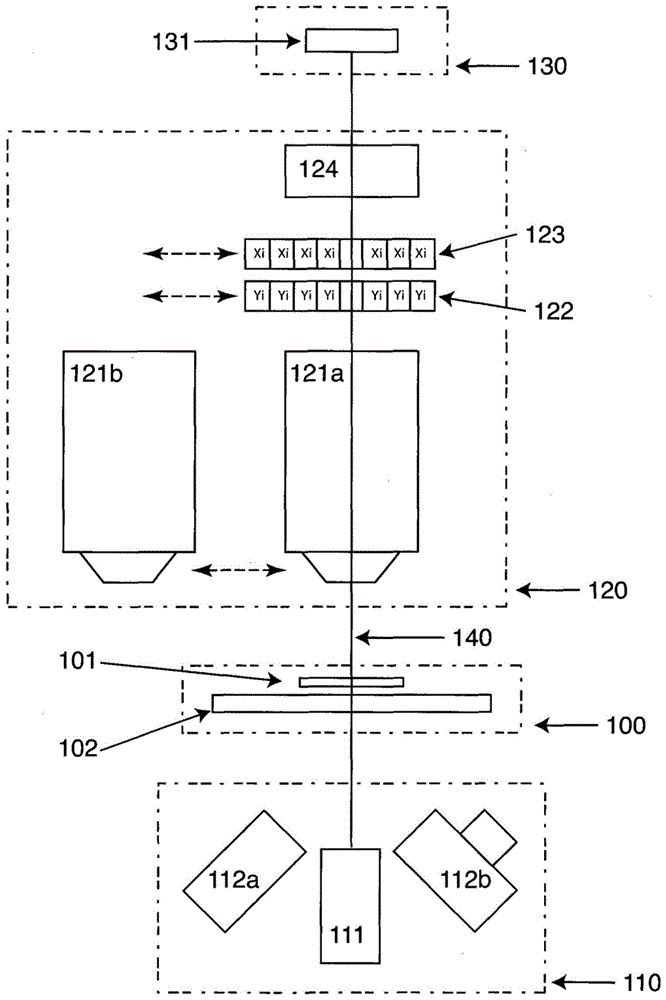
:显微镜用于生物材料的分析已经很长时间。为了在显微镜下看到物体,必要的是该物体显示出不同于背景的光学特性的光学特性并且该差异被称为对比度。生物颗粒通常主要是由包含在细胞膜中的水组成,这使得它们固有地与其周围环境相似。细胞内部通常与周围液体在某些化学组成如蛋白质、dna和rna上有差异,它们中的一些形成其尺寸可能被可视化的“结构”,例如包装到细胞核中的dna。生物颗粒,例如哺乳动物细胞、酵母和细菌都相对较小,通常直径小于约20μm,这会使得难以在显微镜下观看它们,除非应用一些高级技术。这样的技术有高放大倍率、相差和uv显微镜并且随着引入数字技术,已引入了几种图像增强技术。高放大倍率显微镜通常使用50倍以上的放大倍率,这使得能够分离微小结构,而有助于生物颗粒的可视化和鉴定。相差显微镜利用折射率的小差异,产生具有高对比度的图像。uv显微镜利用蛋白质和dna的吸收特性,它们分别在约260和280nm吸收光。光的吸光度在显微镜中被看作对比度。进一步地,相比利用更长波长的光可能分离的结构,短波长的光使得能够分离更小的结构,这是因为显微镜的最大分辨率是取决于光的波长。在生物颗粒中的这种小结构典型地是细胞的内部结构,例如核。在通过图像式细胞仪来评估生物颗粒中,最重要的是知晓生物颗粒在图像中的位置。这在分析生物颗粒的任务是计算(enumeration)在样品中的颗粒时当然是显而易见的,而这在关注样品和/或细胞的其它特性的几乎所有评估的情况下亦是如此。在图像中鉴定任何物体的必要条件是能够建立使物体的图像与周围背景的图像有显著差异的条件。典型的显微镜方法是基于不会改变光的波长的光学特性,例如折射率、反射率或衰减的差异,而诸如荧光显微镜的方法是基于光的波长的偏移,典型地由物质的量子力学特性所带来。在显微镜中,这种差异一般被称为“对比度”。有几种方法在显微镜中产生对比度,两种基本方法是暗场(df)和明场(bf)显微镜,这里的“场”信号的强度指的是背景的强度,所述背景也就是分离可能存在的任何物体的图像的区域。因此,在df中,背景是暗的并且物体具有较高的强度,这与背景是发光的且物体的图像表示光减少的bf相反。当考虑生物颗粒如生物细胞的显微镜分析时,df和bf显微镜方法两者都造成对比度相当差的图像。因此存在着广泛用于生物颗粒分析的额外技术,因为它们通常提供图像的更大对比度,例如相差和荧光显微镜。这两种方法当实施用于鉴定生物颗粒时各有优缺点。相差显微镜需要专门的光学部件,而荧光显微镜受到因所用荧光团体系而限定的选择性的限制,该荧光团或者必须存在于颗粒中或者结合到颗粒上。技术实现要素:本发明提供一种简单、有效且可靠的方法,以相当大的对比度记录生物颗粒的图像,这使得根据本发明的方法和系统特别适合于在图像式细胞仪(imagecytometry)中鉴定颗粒。本发明提供一种图像式细胞仪,包括:-第一光源,配置为向样品区发射光;-聚焦装置,用于形成准直光并引导来自第一光源的、沿所述细胞仪的光轴的准直光;-第二光源,包括用于向样品区发射激发光的第一激发光源;和-图像形成装置,用于在检测元件阵列上形成至少一部分的样品区的图像,其中样品区位于聚焦装置和检测元件阵列之间,并且其中细胞仪能够配置成在明场模式、暗场模式和荧光模式之间进行交换,和/或其中第一光源配置为发射波长小于400nm的光,和/或其中激发光相对于光轴具有一入射角以提供荧光模式。本发明进一步提供一种用于图像式细胞仪的照明系统,包括:-配置为发射光的第一光源;-聚焦装置,用于引导来自第一光源的、沿着图像式细胞仪的光轴并进入样品区的光;和-第二光源,包括配置为发射激发光并进入样品区的第一激发光源,其中来自第一光源的光配置为发射波长小于400nm的光。更进一步地,本发明提供一种用于评估生物样品的至少一个数量参数和/或一个质量参数的方法,包括:-将一定体积的生物样品施加到具有限定曝光区域的平行壁部的样品室中,所述壁部允许来自根据权利要求1-51的图像式细胞仪的光穿过样品室的壁部,-用来自第一光源的光照明样品室,并将穿过样品室的光曝光到有源检测元件的2维阵列上,从而记录空间光强度信息的图像,-用来自第二光源的激发光照明样品室,并将穿过样品室的荧光曝光到有源检测元件的2维阵列上,从而记录荧光空间光强度信息的图像,-以使得来自个体生物颗粒的光强度信息被鉴定为与来自背景的光强度信息不同的方式来处理两个图像,-以及将处理结果与生物样品中的生物颗粒的至少一个数量参数和/或质量参数相关联。附图说明图1绘示出根据本发明的图像式细胞仪的实施方式。图2a示出图表,绘示出观察到的对比度。图2b-g绘示出使用不同波长的光所记录的明场图像。图3绘示出倾斜光源的布置以及掩蔽光的效果。图4示出曲线图,绘示出荧光聚合物珠的强度。图5绘示出在明场图像中无源光调制的构造。具体实施方式根据一个实施方式的图像式细胞仪的一个第一作用是,该图像式细胞仪能够被构造成在明场模式、暗场模式和荧光模式之间进行交换。在本发明的优选实施方式中,第一光源可提供明场光源和暗场光源,使得对于明场模式和暗场模式只需要单一光源。因此,可以通过交换装置来获得两种模式之间的交换而不用改变光源或光学装置。优选地,第一光源被配置用于发射波长小于400nm的光。在这方面,第一光源可被视为紫外(uv)明场光源。业已发现,使用uv明场光源的作用是,相比于用来自发射波长大于400nm的光的光源的光所记录的图像,这样的照明提供了有关颗粒的更多细节,和/或更高的图像对比度。根据本发明,第二光源可提供荧光模式,并且本发明的作用是,可以无需移动第二光源或可引导来自第二光源的荧光的部件来提供荧光模式。换言之,可以快速提供荧光模式,因为荧光光源可能不移动或可引导荧光光源的部件可能不移动。优选地,激发光相对于光轴具有一入射角,图像式细胞仪的光轴由样品区和检测元件阵列之间的轴所限定,从而提供荧光模式。业已发现,这样的设置的一个作用是可以显著降低在检测元件上暴露的激发光的强度。衰减装置和调制装置在本发明的优选实施方式中,图像式细胞仪进一步包括衰减装置,例如光学滤光器以衰减一个或多个预定波带的光强度,优选其中衰减装置放置在沿着光轴的预定平面。甚至进一步地,图像式细胞仪可进一步包括调制装置,例如空间调制装置,优选其中调制装置放置在沿着光轴的预定平面。在本发明的一些实施方式中,衰减装置和/或调制装置是放置在第一光源和样品区之间的光路中。优选地,衰减装置和/或调制装置是放置在样品区和检测元件阵列之间的光路中。更优选地,调制装置放置在准直光沿着光轴朝检测元件透射通过样品区的焦平面中或接近该焦平面。业已发现,将调制装置放置在准直光透射通过样品区的焦平面中或接近该焦平面有很多作用。首先,对比度,例如在高空间频率时的对比度,相对于在这个位置没有调制装置的布置得以改进。其次,由于准直光的焦平面可以是图像形成器件的孔径光阑,该调制装置可以产生扩大的景深。第三,调制装置可以允许样品区中仅被样品颗粒折射或分散的光到达检测元件,并消除从光源直接发射的光。通过调制装置放置在准直光透射通过样品区的焦平面或接近该焦平面的布置,可能简单地通过放置或移除适当的调制器而实现具有记录高对比度明场或暗场图像或这两者组合的灵活性的图像式细胞仪。在本发明的一些实施方式中,两个或更多个衰减装置和/或调制装置是安装在交换装置中,其允许移除或交换衰减装置和/或调制装置。交换装置可以例如包括旋转单元,例如滤光轮。两个或更多个交换装置可以是使得衰减和/或调制装置中没有一个、一个、两个或更多个可以在同一时间沿光轴定位。具有两个或更多个交换装置的作用可以是这些允许调制装置、衰减装置或两种装置的组合效应。另一个作用可以是相比具有相同数量的衰减装置和/或调制装置的单交换装置,两个或更多个交换装置可以更迅速地交换衰减装置和/或调制装置,例如,因为这种交换装置可以更小,并能比单交换装置旋转更快。在本发明的一些实施方式中,至少一个调制装置可以是部分不透明的或部分透明的。衰减和/或调制装置同样可以是在一些部分是部分不透明的而在与之不同的部分是部分透明的,优选地,其中所述部分中一个或多个是圆形的。因此,至少有一个调制装置的一部分可以是部分不透明的并且该调制装置的另一部分可以是部分透明的。优选地,衰减装置可使光衰减预定的系数,例如小于10-3,例如小于10-4,例如小于10-5或例如小于10-6。在本发明的优选实施方式中,调制装置包括配置用于暗场模式的障碍物,优选基本上衰减穿过样品区的准直光。在本发明的另一优选实施方式中,调制装置包括配置用于明场模式的孔,优选基本上衰减从样品区发射的非准直光。通过交换障碍物和孔,能实现明场模式和暗场模式之间的交换的可能性。明场模式和暗场模式之间的交换可因此通过调制装置来实现,优选地通过插入和/或交换位于样品区和检测元件阵列之间的调制装置。在本发明的另一优选实施方式中,调制装置包括相差显微镜调制装置。因此,调制装置可以构成相差显微镜调制装置并且由第一光源发射的光的实质波长为窄波段,优选其中的波段宽度小于50nm。第一和第二光源在光学设置中,可以接受的是不总能够获得完全准直,并且来自第一光源的准直光可以与准直光偏离小于10度,更优选小于5度的偏离角。在本发明的实施方式中,来自第一光源的波长是介于200nm和700nm之间。优选地,来自第一光源的波长可以是介于300nm和395nm之间。甚至更优选地,来自第一光源的波长可以是介于320nm和380nm之间。最优选地,来自第一光源的波长可以是介于350nm和380nm之间。来自第二光源的激发光可以具有与来自第一光源的光的波长实质上不同的波长。优选地,激发光的入射角可介于10和80度之间,优选介于20和60度之间,并且更优选介于30至50度之间。可替代地,激发光的入射角可以是90度。在本发明的另一替代的实施方式中,入射角是介于110至180度之间,优选介于120和160度之间,并且更优选介于130和150度之间。聚焦装置在本发明的优选实施方式中,聚焦装置包括透镜,而在本发明的另一同样优选的实施方式中,聚焦装置包括曲面镜。额外的光源在本发明的一些实施方式中,图像式细胞仪进一步包括额外的光源,例如第三或第四或第五或第六光源,优选地所述额外的光源是激发光源。所述光源可以是发光二极管和/或二极管激光器和/或激光器,例如可调谐式固态光源和/或可调谐式发光二极管。可调谐式固态光源可以是可调谐式激光二极管。光学装置和检测元件在本发明的优选实施方式中,光源是光学连接到光学装置,所述光学装置配置成在整个样品区和/或在整个由检测元件阵列所成像的区域提供具有基本上均匀强度的光。光学装置可包括微透镜阵列。可替代地,光学装置可包括柱面微透镜阵列,优选地可包括与柱面透镜大致垂直取向的两个柱面微透镜阵列。检测元件阵列可以是ccd或cmos传感器元件的阵列。曝光根据本发明,光源是配置为发射光的持续时间小于1秒,优选地为小于0.1秒。优选地,光源是配置为发射光的持续时间介于0.0001和0.1000秒之间,优选介于0.0001和0.0500秒之间。然而,在某些情况下,例如当在荧光成像时需要高灵敏度时,光源可配置为发射光的持续时间超过1秒,例如超过2秒,例如超过3秒,例如超过4秒,例如超过5秒,例如超过6秒,例如超过7秒,例如超过8秒,例如超过9秒或例如超过10秒。遮光在本发明的一个实施方式中,可以通过选择性地移除来自激发光的光束的光线,基本上消除来自激发光源的、到达图像形成装置的入口的光。光线可以通过在激发光的光束中放置一个或多个障碍物来选择性地移除,优选地其中激发光的光束在障碍物所放置的平面中基本上是准直的。图像形成装置在本发明的优选实施方式中,图像形成装置配置为提供超过5μm的景深,例如介于10μm和150μm之间。以这种方式,样品区可在景深中呈焦点对准使得可以不需要为了在样品区中获取清晰的样品图像而移动图像形成装置和/或检测元件阵列,例如当样品中的颗粒定位在不同深度时。然而,在本发明的一些实施方式中,图像形成装置和/或检测元件阵列和/或样品室可以配置为使得图像形成装置和/或检测元件阵列可相对于样品被放置在最佳位置而移动。一个样品或样品的一部分可以是,例如在一种配置中是呈焦点对准的,但当改变到另一个样品或样品的不同部分时,该另一个样品或样品的不同部分则可以不是焦点对准的,并且因此需要或者移动样品和/或图像形成装置和/或检测元件阵列。在本发明的优选实施方式中,图像形成装置配置为透射在介于200nm和1000nm之间的波长区域的光,更优选在介于350nm和1000nm之间的波长区域,更优选在介于350nm和850nm之间的波长区域。在本发明的几个优选实施方式中,图像形成装置包括显微镜物镜。图像形成装置可配置为提供样品的线性放大。优选地,线性放大小于20:1。线性放大也可以在从1:20至1:1的范围内,优选在从1:1至10:1的范围内,更优选在从1:1到4:1的范围内。在本发明的几个优选实施方式中,图像式细胞仪配置有允许两个或更多个图像形成装置在记录图像之间进行交换的装置。交换成像装置的目的优选在于改变图像式细胞仪的光学特性,例如改变图像的线性放大倍率和/或改变观看的景深。通常,成像装置的选择是基于先验知晓的样品的特性来进行,但在本发明的几个优选实施方式中,成像装置的选择是基于被分析的样品的评估结果来进行。样品样品区可包括样品,例如生物样品。样品可以是在样品室中。照明系统根据本发明,照明系统可用于向图像式细胞仪提供所需的光源,所述光源为明场光源,和荧光光源。在本发明的优选实施方式中,与照明系统相关的聚焦装置是用于形成来自第一光源的准直光。另外,激发光可以具有相对于光轴的一入射角。照明系统可额外具有如前所述的图像式细胞仪的任何特征。细胞仪方法在本发明的一个方面,提供了一种用于评估生物样品的至少一个数量参数和/或至少一个质量参数的方法,包括将一定体积的生物样品施加到具有限定曝光区域的平行壁部的样品室中,所述壁部允许来自第一光源的光穿过样品室的壁部,将穿过样品室的光曝光到有源检测元件阵列上,从而记录空间光强度信息的图像,以使得来自个体生物颗粒的光强度信息被鉴定为与来自背景的光强度信息不同的方式来处理图像,以及将处理结果与液体样品中的生物颗粒的至少一个数量参数和/或至少一个质量参数相关联。本发明涉及用于评估生物样品的数量和/或质量参数的方法和系统,包括与样品的光学相互作用。与样品的光学相互作用优选造成光的强度和/或方向因与生物样品或在所述生物样品中的颗粒的相互作用而改变,一些优选的相互作用是下述一种或多种;反射、折射、衍射、相互作用、散射或吸收。在本发明的优选实施方式中,被评估的生物样品包含在样品室中。样品室的优选特性是定义样品的边界。本发明的另一优选的实施方式是其中样品室的壁部是开放式容器的底部。在几个实施方式中,样品室的边界由限定样品的底部或顶部的透明壁部所形成,而在其他同样优选的实施方式中,样品室由两个透明壁部形成,其中样品置于壁部之间,限定被评估的样品的厚度。在本发明的一个优选实施方式中,被评估的生物样品是生物颗粒的悬浮液。这种生物颗粒的悬浮液可以是更大的样品量的一部分,其中评估目的可以是确定或预估更大样品量的特性。在另一同样优选的实施方式中,生物样品是在基材上生长的和/或正在生长的细胞的样品。可替代地,样品可以是液体样品。在一些优选的实施方式中,基材是悬浮液,而在其他同样优选的实施方式中,这样的基材是,或者可以成为,样品室的一个集成部分。通常优选的是,放置在样品室中的基材是基本上透明的,而且在许多优选的实施方式中,透明的基材板是样品室的壁部。在本发明的优选实施方式中,生物样品的至少一个数量参数和/或至少一个质量参数的评估是个体细胞的分析。这样的个体细胞常常被分离,或者是在悬浮液中或者是在基板上,但这样的个体细胞也可以是在细胞团块中,这些细胞彼此贴附。在本发明的其它优选的实施方式中,生物样品的至少一个数量参数和/或至少一个质量参数的评估是大量细胞(bulkofcell),例如组织样品的分析。在本发明的几个最优选的实施方式中,第一光源是发光二极管(led)和/或二极管激光器和/或激光器。led的和激光二极管的几个特性在根据本发明的系统的设计和操作方面提供了实质的优点,例如小的物理尺寸和功率效率。在本发明的许多优选的实施方式中,来自第一光源的光的波长小于400nm。经常优选的是,来自第一光源的光的波长是介于200nm和400nm之间,例如介于300nm和395nm之间。令人惊奇地发现,使用短波长的光在根据本发明的生物颗粒的评估中提供了实质的改进,并且波带例如200nm至250nm,200nm至300nm,250nm至350nm,以及320nm和380nm的光都是优选的。通常,被评估的生物颗粒对光敏感,至可以改变颗粒特性的程度,并且一种降低光的影响的优选方法是限制样品暴露于光的时间长度,以限制光源发射光到样品的时间,优选其中来自光源的光的照明持续时间小于1秒,更优选小于0.1秒。在其他同样优选的实施方式中,照明周期介于0.0001和0.1000秒之间,例如介于0.0001和0.0500秒之间。以能量表示,优选的是在曝光期间,以200nj/mm2或更小,例如100nj/mm2或更小,优选50nj/mm2或更小,例如20nj/mm2或更小来照明样品。根据本发明,一个用于生物颗粒的评估的优选方法是基于来自一定体积的样品的空间光强度信息的图像的记录,其中来自个体生物颗粒的信号相对于来自背景的光强度衰减光强度信号。衰减可以由下述中的一种或几种带来:反射、折射、衍射、干涉、吸收、散射。在这些实施方式中,涉及生物颗粒的光的强度比来自背景的信号的要低,并且在此基础上,可以通过将来自个体细胞的信号与来自背景的信号彼此区分的方式来处理图像,优选其中来自颗粒的信号比来自背景的信号基本上要小,所述背景的信号优选来自与颗粒在空间上紧密接近的背景的信号。在几个优选的实施方式中,光的衰减是由光的散射引起的,这种散射源自例如光的折射和/或反射过程。此外,在这些以及其它优选的实施方式中,衰减是由光的吸收引起的,这种吸收是由被评估的生物颗粒的化学组成和/或有意地加入到样品中的其他化学组成所引起的。因此,吸收可通过添加到样品中的试剂引起。在根据本发明的实施方式中,相比于来自背景的信号的强度,实现了与生物颗粒相关联的5%至70%的光衰减。在其他同样优选的实施方式中,与生物颗粒相关联的光相比于来自背景的光的衰减是介于50%和90%之间。在本发明其他同样优选的实施方式中,来自个体生物颗粒的信号增强,如:相对于来自背景的光强度,观察到的光强度信号的增加。这可以通过例如散射、干涉、反射和折射过程引起,通常与光信号的聚焦或其他改变组合,增强是光的空间重新分配的结果。在这些实施方式中,涉及生物颗粒的光的强度比来自背景的信号更高,并且在此基础上,可以通过将来自个体细胞的信号与来自背景的信号彼此区分的方式来处理图像,优选其中来自颗粒的信号比来自背景的信号基本上要高,所述背景的信号优选来自与颗粒在空间上紧密接近的背景的信号。在本发明的再其它高度优选的实施方式中,记录的来自生物颗粒的光强度的图像包括与生物颗粒相关的信号,这样的图像包括光强度信息的改变,这是光强度相对于来自背景的光强度的衰减和增强的组合。本发明的通常优选方法是调制透射或散射通过样品的光,该方法一般具有在记录光强度信息期间提高对比度的效果。优选地,这样的调制对应于在从光源到有源检测元件阵列的光路中的预定面处光特性的空间差异。这样的调制典型地通过使用调制装置(例如不透明或基本上不透明、或者透明的装置,优选地是透明度例如衰减是预定特性的装置)产生。优选地,这样的调制装置被实现为不透明装置和透明装置的组合,因而调制装置在预定位置或区域处是不透明的,而在其它预定位置或区域处是透明的。调制装置的两个优选实施中,第一个是在其中心具有孔的不透明盘,第二个是直径显著小于平行光束的直径的不透明盘。当这两个调制装置被组合使用时,于是在第一装置中的中心孔的直径与第二装置中的盘的尺寸类似或相同。优选地,不透明和/或透明区域的预定位置对应于在调制装置的位置附近的光学面处光源的图像。优选地,这样的调制装置在透过样品的光、透过生物颗粒的光方面具有不同的效果。调制装置的典型的优选位置靠近进入成像系统的聚光物镜的平行光的焦平面。调制装置的典型的优选特性是那些改变穿过调制装置的光的特性;例如:改变相位、改变强度如衰减、光遮蔽如阻挡光。调制装置优选包括这些特性中的一个或几个。在可优选的实施方式中,调制装置沿着光轴放置在光源和样品之间的位置,而同样优选的是将调制装置沿着光轴放置在样品和有源检测元件阵列之间的位置。仍然可以优选的实施方式包括调制装置沿着光轴在样品的两侧。在仅沿着光轴在样品和有源检测元件阵列之间的位置包括调制装置的实施方式中,来自光源的光在横穿样品时基本上平行,也优选这种平行光的光强度在整个由有源检测元件阵列所成像的样品部分是基本上均匀的。当光学部件例如透镜被用于将来自样品室的光聚焦到有源检测元件阵列时,透射通过样品室的平行光通常是聚焦在沿着光轴的平面上。在这些条件下,通常优选将调制装置放置在该焦平面,或接近该焦平面。在优选的实施方式中,与生物颗粒相互作用导致它例如被偏转、折射和/或散射的光,进入成像系统的聚光物镜。进一步通常优选的是调制装置的特性,例如不透明和透明特性,被布置为基本上遵循光源在此焦平面的图像的形状。经常优选的调制器的特性和形式是对透射通过样品室的光和透射通过生物样品的光的净效应的差异。在包括调制装置的实施方式中,通常优选使用能产生由预定波段的光组成的光的光源,优选其中的波段是基本上窄的,例如不超过50nm,优选甚至小于30nm的宽度,如小于20nm。此外,通常优选使用预定波长的光,优选地,其中光的波长主要是小于400nm,例如介于250nm和400nm之间,更优选介于300nm和390nm之间。本发明的优选的实施方式包括这样布置的调制装置,其产生相位对比图像,但是条件是在透射通过样品室的光的波长小于400nm。本发明的几种优选的实施方式包括可以放置在光路中或从光路移除的调制装置,通常优选包括两个或更多个不同的调制装置。因此,在应用两个或更多个实质上不同的调制装置时,可以记录空间光强度的两个或更多个图像。在这样的实施方式中,其中有可能通过包括或省略调制装置来改变光路,优选的是记录来自透射通过样品室的光的光强度信息的两个或更多个图像。因此,可以在光强度信息的处理时使用由第一光源记录的空间光强度信息的两个或更多个图像。在优选的实施方式中,来自光源、穿过样品室的壁部的光具有基本上垂直于壁部的表面的一般取向。在本发明的另一优选的实施方式中,来自光源的光在穿过样品时是基本上平行的。在本发明的另一优选的实施方式中,已经穿过样品的准直光基本上聚焦到位于聚焦装置和检测元件阵列之间的平面上,其中调制装置基本上放置在焦平面上。因为来自光源的光优选通过使用一个或多个光学部件如透镜和/或镜被引导,该取向可以被视为光源的光轴并且在这种情境下,光源的光轴基本上垂直于壁部的表面。此外,在几个实施方式中,通常优选样品室的壁部基本上垂直于有源检测元件阵列的观看方向。同样,由于光通过使用光学元件如透镜和/或镜通常聚焦到有源检测元件阵列,这对应的是检测元件阵列的光轴垂直于壁部。因此,本发明的几个优选实施方式包括光源、样品室和有源检测元件阵列,它们都基本上位于一个轴上,使得光源的光轴和检测元件阵列基本上在一个轴上,该轴穿过样品室,使得其壁部基本上垂直于该公共轴。本发明的许多高度优选的实施方式包括用于样品照明的两个或更多个光源。所述两个或更多个光源典型地特性不同,例如光轴或波长的布置。本发明包括两个或更多个光源的一个优选的实施方式是其中来自第二光源的光穿过样品室的壁部,其中第二光源布置为使得光的主要方向以一定角度进入限定样品室的曝光区的壁部,优选相对于垂线介于10和80度之间的角度。这样的布置在两个或更多个光源安装于基本上永久的位置时提供典型的优点,特别是当安装多于两个光源时。此外,已经发现,这样的角度布置可以降低背景光信号的强度。另外,本发明的几个优选实施方式包括三个或更多个,例如四个照明和/或穿过样品室的壁部的光的光源。其他同样优选的实施方式包括多于四个光源,例如五个光源。由于越来越多的光源提供执行生物颗粒评估的可能性,其中处理是基于多个光强度信息,优选包括六、七、八或甚至大于八,例如十个个体光源的实施方式。这里以及在本讨论的其他地方,术语“光的主方向”可以与术语“光轴”交换,其通常是通过布置光源,或另一种有源部件如有源检测元件阵列,结合光学装置如一个或多个和/或镜而形成的,而不考虑透镜和/镜的功能,无论是用于准直、聚焦或分散。这种系统的光轴通常具有对称轴。在本发明的优选实施方式中,两个或更多个个体光源发射基本上相同的光,例如针对于波长,优选在这样的情况例如这样的两个或更多个光源基本上同步操作,从而提高发射的总光能,和/或延伸样品室的照明面积,和/或确保样品室的至少一部分的更加均匀的光强度照明。在这些以及在本发明的其他同样优选的实施方式中,两个或更多个个体光源发射基本上不同的光,例如针对于波长,优选在这样的情况例如这样的两个或更多个光源独立地操作,例如一次仅导通一个这样的光源,或使得一次仅有一个这样的光源的光照射样品室。这种发射不同光的两个或更多个光源的一个优选的特性是,这样的光源中的至少一个产生荧光,优选其中这样的荧光强度信息用于与衰减的光强度信息组合,用于评估生物样品中的至少一个数量参数和/或至少一个质量参数的目的。在几个优选实施方式,所有的光源都位于样品室的同一侧。在这种实施方式中,通常优选的是这样的光源位于样品室中与有源检测元件阵列相对的侧。通常优选的是两个或更多个光源布置为使得产生荧光的光源与样品室的壁部成一角度放置,以至于光源的光轴基本上不垂直于样品室的壁部。这样的布置的一个优选的优点是增加了从生物颗粒发射的荧光的强度相比于来自背景的光强度的比率,通常被称为信号背景比(s/b)。来自背景的光可以起源于多种来源和/或现象,其中有些是直接涉及光源的特性,例如光源相对于检测元件阵列的光轴的朝向,其中背景典型地是在光强度信息的图像中任何目的生物颗粒以外的区域。将光源与样品室的壁部成一角度布置的另一同样优选的优点是的可以将大量光源相对于样品室定位在固定位置,从而允许用来自两个或更多个光源的光照明样品室,而不使用机械装置。这些特性的优选优点是当任务是用两个或更多个不同波长来顺序地照明在样品室中的样品时,更简单的系统构造和/或更快地操作系统的能力。此外,已经发现激发光源的这种布置减少了发射到光源的平表面上的光的内部反射,该光本来可被反射回到有源检测元件阵列中。本发明的一个优选的实施方式是使用光源用于记录光衰减,例如通过折射和/或反射。常常优选的是来自这样的光源的光以基本上准直的方式透射通过样品室,使得光的主要部分是平行或基本上平行的。出人意料地发现,这种基本上平行的光可以增强衰减的对比度,即被生物颗粒衰减的光与背景区域的透射光的强度的比率。在本发明的这些以及其它优选的实施方式中,一部分透射通过样品的光不是完全平行的,而优选相对于平行成小于45°的角度,例如小于30°,例如15°。甚至更少发散通常是优选的,例如10°或更小,例如相对于光轴的光发散不超过5°。已发现,在一些优选的实施方式中,可以基本上维持在准直条件下记录的高对比度,而适度的发散往往积极地有助于均衡透射通过样品室和曝光到有源检测元件阵列上的光的强度。通常这些实施方式中许多都使得通过光学部件如透镜或镜带来的光源的聚焦点,基本上在样品室外部。在本发明的其他同样优选的实施方式中,为记录光的衰减,将用于记录光衰减的、来自光源的穿过样品室的光基本上聚焦在样品室上。优选其中透射通过样品室的光的相当大的部分可以被有源检测元件阵列记录。本发明的非常优选的一个特征是,透射通过样品室和/或到样品室上光基本上在整个有源检测元件阵列的视野场中的强度是均匀的。优选地,与均匀照明的偏离,例如表示为强度的变化与平均强度的比率,是小于25%,更优选小于10%,甚至更优选小于5%。这样的属性通常具有降低在有源检测元件阵列上记录的样品的光学特性的变化的作用,这往往造成特性表述的较低变化,它基本上取决于照明光的强度。这例如对光衰减和荧光发射两者都是显而易见的。光学装置,由布置成阵列的许多透镜组成,可以被布置成将光源的发光元件的多个图像基本上聚焦到样品室和/或通过样品室聚焦。这样的微透镜阵列在本发明的几个实施方式中是优选的,用于有效地照明样品室的部分,优选基本上只照明来自光被暴露到有源检测元件阵列的那部分。微透镜的一个通常优选的布置包括柱面微透镜阵列。这样的微透镜阵列在优选时,是与第二或更多柱面微透镜阵列结合使用,它们典型地彼此垂直取向。这样的布置包括在本发明的几个优选的实施方式中,其中主要是通过在一部分样品室产生均匀照明和/或通过将从光源发射的光的高部分(fraction)透射到一部分样品室来提高照明效率。在几个优选的实施方式中,这样的两个或更多个柱面微透镜阵列的特性是基本上相同的,而在其它经常优选的实施方式中,该特性是基本上不同的,以便产生在形状上适于有源检测元件阵列的形状的照明。为了产生这种形状而改变的微透镜特性例如是透镜的节距(pitch)和/或焦距。通常优选包括光学装置来聚焦曝光到检测元件阵列的光,所述检测元件阵列例如一个或多个透镜或镜,其中这样的光学装置具有聚焦曝光的光信号的能力,其表示为焦点在物面中的深度。在本发明的几个优选实施方式中,这种聚焦装置具有大于5μm的焦深,优选在从10μm至150μm的范围内。为了使用一个光学装置用于记录衰减的透射光和发射的荧光两者,通常优选的是用于聚焦曝光到检测元件阵列上的光的一个或多个透镜对在介于200nm和1,000nm之间的波长区域的光是基本上透明的,优选在介于300nm和1,000nm之间的波长区域是透明的,更优选在介于350nm和850nm之间的波长区域是透明的。优选地,用于聚焦的一个或多个透镜在该范围内被光学像差校正。优选地,所述一个或多个透镜的透明度是使得光在该区域中的衰减小于3od,更优选小于1od。虽然发射光(如荧光)通常强度较弱,透射光(如用于测定衰减的光)常常具有相当大的强度。在许多实施方式中,因此通常优选通过使用光学衰减滤光器来衰减光,优选其中发射到样品室的光被衰减。优选所使用的衰减滤光器具有降低透射光强度超过1od的特性,优选降低透射光的强度多达3od。在本发明的实施方式中的有源检测元件阵列典型地是ccd或cmos传感器。在本发明的几个优选实施方式中,其中除了光衰减图像以外,还记录两个或更多个荧光强度图像,荧光是使用波长限制装置来过滤,例如滤光器和/或干涉滤光器,优选的是这些滤光器可以在记录图像之间交换。这些滤光器可以安装在移动的夹具上,例如通过线性平移或通过旋转。在本发明的优选实施中,暴露到有源检测元件阵列上的光的光学放大倍率小于20:1,定义为样品室中的任何尺寸的物体的投影大小与物体大小的比率。其他同样优选的实施方式具有介于1:1和20:1之间的光学放大倍率,优选介于1:1和1:10之间。在几个实施方式中,其中大的样品室进行成像,优选的是光学放大倍率小于4:1,例如在从1:1至4:1的范围内。虽然本发明的几个实施方式包括具有固定光学放大倍率的装置,几个同样优选的实施方式包括允许记录两个或更多个光学放大倍率的图像的装置,其例如可以用于帮助以较低放大倍率检测细胞及以高放大倍率进行随后的细胞详细分析。一些优选的实施方式包括用于可变光学放大倍率(例如变焦)的装置。因为本发明的优选实施方式中的多个包括曝光多个光强度图像以便评估生物特性,所以优选地是样品或样品中的颗粒的任何移动保持在受控之下,更优选地是,这样的移动应保持最小。因此,优选地,所述一定体积的液体样品在曝光期间静置,其中静置被定义为在一个曝光期间,生物颗粒的图像的至少一部分不再移动,从而基本上被包括在相同检测元件的边界内。此外,当对检测元件的阵列多于一次曝光使,为了产生两个或更多光强度信息图像,优选地是保持静置状况,其中静置被定义为在两个曝光期间,生物颗粒的图像的至少一部分不再移动,从而基本上被包括在相同检测元件的边界内,优选地是使得在多于两个的曝光期间(例如,在三个、四个、五个或甚至六个曝光期间)基本上被包括在相同检测元件的边界内。更优选地是,在为评估生物颗粒的特性而处理的所有光强度信息图像的曝光期间,保持静置状况。在本发明的优选方法中,一定体积的液体样品在曝光期间静置,更优选地是,在曝光之前、期间、之后和在曝光期间静置。静置状况是其中没有任何移动的状况,但是这样的状况可能难以在液体系统中(例如,当生物颗粒悬浮在液体中时)获得,因为可能存在诸如重力、动力的力起作用,使得包括颗粒的部分样品例如通过沉降或振动而移动,这样的力无意地作用于样品上,即没有主动激活和/或控制。因此通常优选的是定义静置为不向样品、样品室或检测装置施加可造成移动的故意的力的状况。另一优选的定义是将静置定义为在用光源曝光期间,生物颗粒的图像的至少一部分不再移动,从而基本上被包括在相同检测元件的边界内,例如在用第一或第二光源曝光时间,优选移动的原因是无意的。静置的另一个同样优选的定义是在收集光强度信息期间,优选在两次或更多次曝光期间,样品相对于有源检测元件阵列不再移动,以致样品中的生物颗粒的图像不再移动,从而其基本上包含在相同检测元件的边界内的状况,优选移动的原因是无意的。静置的又一个同样优选的定义是在两次或更多次曝光期间,样品相对于有源检测元件阵列不再移动,以致样品中的生物颗粒的图像不再移动,从而其基本上包含在相同检测元件的边界内的状况,优选移动的原因是无意的。一种通常优选的获得静置状况的方法是允许具有悬浮生物颗粒的样品在移动样品和/或样品室之后启动测量前静置足够长的时间,以便在悬浮液中的生物颗粒沉淀和/或漂浮到样品室的内部下部和/或上部边界,从而获得生物颗粒相对于样品室的静置状况。优选地,生物颗粒的沉淀和/或漂浮是在相对短的时间实现,例如小于240秒,优选小于100秒,例如45秒。更优选地,沉降时间大于10秒,优选介于10和240秒之间的范围内,更优选介于30和120秒之间的范围内。静置可以被定义为其中样品相对于样品室不移动的情况。在本发明的优选实施方式中,静置被定义为在一段时间,例如至少10秒,这样至少9秒,这样至少8秒,这样至少7秒,这样至少6秒,这样至少5秒,例如至少4秒,例如至少3秒,例如至少2秒,或例如至少1秒。优选地,该时段可以是在曝光之前、期间和/或之后。被分析的样品体积通常涉及生物颗粒评估的统计质量,由于体积的大小通常与被分析的个体颗粒的数目直接关联。例如当生物颗粒的评估涉及个体颗粒的计数时,所计数的颗粒的总数决定结果的精度。一个影响被分析的样品体积的参数是样品室通过其壁部所限定的厚度,并因此优选样品室的内部具有介于20μm和1,000μm之间的平均厚度的本发明的几个实施方式。在这些以及其他优选的实施中,具有平均厚度介于20μm和100μm之间。理想的是,样品室的厚度是均匀的,但出人意料地发现,与均匀厚度的大幅偏差不会损害评估的结果,只要被分析的样品室的部分的平均厚度是已知的。此外,在生物颗粒的评估是在基本上一次性的样品室中进行的实施方式中,例如旨在用于样品的一次分析的样品室,优选的是每个样品室的平均厚度是已知的或优选通过系统的装置来确定。在本发明的优选实施方式中,电磁辐射从其中被曝光到检测元件阵列的液体样品的体积是在介于0.01μl和20μl之间的范围内,例如介于0.05μl和5μl之间。因为被评估的样品(其曝光到检测元件阵列)的总体积取决于几个因素,包括样品厚度和曝光到检测元件阵列的样品室部分的面积,有可能结合本发明的若干特征以便确定该体积但许多优选实施方式得出在单次曝光中被分析的体积是介于0.05μl和1.0μl之间。评估的总体积可以优选进一步通过曝光样品的额外部分而增加,这或者通过用不同的部分替换样品室中的样品部分或者通过移动样品室从而将样品室的不同部分暴露到样品室的阵列。放置或替换样品或样品的一部分可通过将样品或样品的一部分用泵送装置(例如泵,例如柱塞)泵送到样品室中和/或通过力的手段例如毛细管作用力和/或例如重力来实现装置。在放置或替换样品或样品的一部分后,样品或样品的一部分在样品室的内部是静止的,优选由于没有任何故意动作(如将力应用到样品或样品的一部分)而静止,并且样品室可以四处移动,以便分析和/或评估根据本发明的样品或样品的一部分。典型地对确定暴露于检测元件阵列的样品体积有显著贡献的一个通常优选的实施方式是,暴露光强度信息的光学布置的观看区域,包括观看区域基本上固定的实施方式,或在同样优选的实施方式中,观看区域可以基于调节光学部件来确定。用于确定在单次曝光所分析的体积的一个优选的方法是结合关于样品室厚度的信息与关于曝光系统的有效(active)观看区域的信息。根据本发明的实施方式中,样品室的厚度是对使用中的样品室单独确定。另外,样品室可被用于样品的一次分析,并且在许多优选实施方式中,样品室只能用于单个样品的分析。生物颗粒的类型和特性是多种多样的,但在本发明的几个实施方式中通常优选颗粒的大小(待评估的一个或多个参数)是介于0.1μm和100μm之间的大小。这样的颗粒大小通常是颗粒的平均直径,并且在几个同样优选的实施方式中,生物颗粒的这一平均大小是介于0.1μm和20μm之间。在本发明的其他优选的实施方式中,大小介于5μm和15μm之间。在本发明的一些实施方式中,大小介于1μm和15μm之间,例如至少15μm,至少14μm,至少13μm,至少12μm,至少11μm,至少10μm,至少9μm,至少8μm,至少7μm,至少6μm,至少5μm,至少4μm,至少3μm,至少2μm或者例如至少1。因为生物颗粒的多样性很大并且以及这种颗粒的特性,本发明的实施方式可以用于评估生物样品和/或生物样品的颗粒的大量的数量和/或质量参数。几个这样的优选参数是;每体积液体样品中生物颗粒的数目,生物颗粒的直径、面积、周长、不对称性、圆形度,生物颗粒的粘附和/或结块程度的测定,优选其中结块程度允许大量测定细胞团块中个体细胞的数目。其他同样优选的参数是;生物颗粒的种类,生物颗粒的代谢状态,细胞内特性,例如核的数量、尺寸、形状。样品中的生物颗粒的另外一个特性是生物颗粒在空间光强度图像中的大致位置,通常在评估包括对空间光强度信息的两个或更多图像的记录时是优选的,其中一个图像表示光的衰减。颗粒的这个位置优选用于将其他光强度信息与颗粒关联,例如荧光。这比如在多个个体颗粒时通常是优选的,可以预期,一些颗粒反映出这种其他的光强度信息,而其它颗粒基本上不反映此光强度信息。这样的光强度信息的大量缺失会使得难以仅基于光强度的信息来确定这种颗粒的存在,因为它有时没有显示出可以与背景进行区分的信息。在这些情况下,通常优选该颗粒的位置可基于其他图像的空间图像强度来获取。本发明的优选的实施方式包括生物样品和/或生物颗粒的评估方法,其中记录空间光衰减信息的图像。许多这些实施方式优选还包括在处理图像信息时所包括的记录额外的空间光强度信息的图像的步骤,其中该额外的空间光强度信息是关于荧光的信息。在几个实施方式中,此额外的荧光图像信息是通过来自光源、穿过样品室的壁部的激发光来产生的并用于产生衰减图像信息,其中采用发射滤光器由此产生荧光。在其他同样优选的实施方式中,这样的额外的荧光信息图像是由来自额外的光源的激发光产生的。因为通过记录空间光强度信息的多于一个或两个图像而总体记录更多信息,通常优选除了衰减信息的图像以外,在图像的处理时还包括两个额外的荧光信息图像,并且通常更优选使用三个、四个或五个额外的荧光信息图像。根据本发明的一个实施方式,记录空间光强度信息的图像,其中空间光强度信息是关于荧光的信息,所述荧光是由来自第二光源、穿过样品隔室的壁部的激发光引起的。在其它优选的实施方式中,第二空间荧光光强度信息是由来自第三光源的激发光引起的。在本发明的另一实施方式中,记录第三空间光强度信息的第三图像,其中第三空间光强度信息是关于荧光的信息,该荧光是由来自第二或第三光源、穿过样品室的壁部的激发光引起的,优选通过来自第四或后续光源的激发光引起的。在本发明的第三实施方式中,记录第四空间光强度信息的第四图像,其中第四空间光强度信息是关于荧光的信息。在本发明的实施方式中,其中生物样品和/或生物颗粒的参数包括在处理时包含的多个图像时,通常优选使用两个或更多个光源,以获得所需的图像信息。光源通常是两个、三个、四个或五个独立的光源,光源的数量和性质反映了诸如光的波长和强度,衰减和散射的特性,并且在荧光背景抑制的情况下。在这种多图像处理的几个高度优选的实施方式中,优选的是关于生物颗粒的位置的空间信息是空间光强度信息的图像处理的综合特征(integratedfeature)。在包括处理多图像信息的实施方式中,可以被评估的生物颗粒的参数可优选为以下一种或几种;物种生物颗粒的评估,生物颗粒状况,优选其中的生物颗粒的状况是代谢状况,如细胞周期、存活力、活力、细胞凋亡、运动性。在本发明的优选实施方式中,在第一空间光强度图像中的生物颗粒的位置被用来确定在与生物颗粒相关的光强度信息的另一记录的图像中的光强度信息的存在,优选其中另一光强度信息是荧光。在本发明的另一优选实施方式中,生物颗粒的位置由组合在空间光强度信息的第一和第二图像中的信息来确定,其中所述图像是使用来自第一光源的照明并对图像应用大致不同的调制装置来记录,优选其中的图像是暗场和明场图像。在本发明的又一优选实施方式中,生物颗粒的位置由组合空间光强度信息的三个或更多个图像的信息来确定,其中所述图像是使用来自第一光源的照明及对图像应用大致不同的调制装置来记录。与生物颗粒相关联的第二或额外的光强度信息强度的测定可用于评估物种和/或生物颗粒的状况。可替代地,与生物颗粒相关联的第二或额外的光强度信息的测定也可以用于包括生物标志物的物种和/或生物颗粒的状况的评估。在本发明的许多优选的实施方式中使用的光源是可调谐式固态光源。可调谐光源的存在,可显著简化根据本发明的系统的设计,并且也将允许更大的灵活性,例如当可调谐式固态光源用于荧光的激发时。优选地,这种可调谐式固态光源可以是发光二极管(led)或激光二极管。实施例1图像式细胞仪图1绘示出包括本发明的几个优选实施方式的图像式细胞仪的可能构造。图示概括了4个主要部件组,样品架(100),照明装置(110),成像装置(120)和检测装置(130)。最后,绘示了图像式细胞仪的主光轴(140),大部分光学部件沿该主光轴布置。样品架可以沿光轴相对于成像装置移动,以确保样品与成像装置呈焦点对准。样品室(101)在样品台(102)上放置于光路中。样品室通常是接合到样品台,但它可以从样品台释放,使得可以从图像式细胞仪移除样品室,并通过手动或自动工艺再次替换它。样品台可以在垂直于光轴的两个方向上移动。这允许评估在样品室内部的样品的不同部分。照明装置可以沿光轴移动以保持所需的样品室的照明。照明装置通常包含2个或更多个光源(示出3个)。图示显示出位于光轴上的光源(111),从而在朝向检测器方向照明样品,这通常仅在目的是要产生无源光衰减和/或散射特性的图像时才是优选的,例如如明场或暗场图像。此外,图示显示出两个荧光光源(112),它们相对于光轴倾斜地照明样品室,已发现这在来自颗粒的信号被鉴定为与来自背景的信号不同时改善条件。进一步图示了发射单一波长的光源(112a),以及通过将两个发光二极管放置在一个布置中来发射两种波长的光源(112b)。成像装置包括聚光物镜(121),其布置使得能够使具有基本上不同特性(如标称放大倍率)的两个或更多个聚光物镜(121a和121b)交换。所述两个或更多个聚光物镜或者通过线性或者通过圆周运动来交换。光调制装置优选是两个或更多个,并包含分别被标记为yi(122)和xi(123)的多个光学有源部件,如滤光器、孔、障碍物或相差元件。光调制装置可以垂直于光轴移动使得每个光学部件可以放置在从聚光物镜发射的光束中,移动可以或者是线性的或者是圆周的。每个光调制装置优选具有无光学部件的位置,这样,如果将所有的光调制装置布置为使得这个空位置位于光束中,那么将不会发生调制。成像装置包含聚焦装置(124),其将来自聚光物镜的光聚焦到检测器上。检测装置可以沿光轴移动以便记录聚焦图像的光强度信息。该信息是使用有源检测元件阵列(131),即光敏感照相机来聚集。图像式细胞仪的操作和数据的收集由计算机装置(未示出)控制。计算机装置优选地配备有可以用于生物颗粒的自动鉴定和评估的图像处理装置。实施例2低波长显微镜的特性通过测量jurkat细胞(人白血病细胞株,亚克隆a3,atcccrl-2570)的样品,来调查根据本发明的明场显微镜的对比度。测量是使用不同波长的四个光源进行的。三个光源是单色的窄波段发光二极管(led)并且第四光源是宽波段白色led。所有光源均是在其中所发射的光在经过样品时被准直的光学布置中。来自窄波段led的输出不经修改而使用,但来自白色led的输出经修改后使用,以及使用窄带滤光器修改。来自白色led的宽波段的光表示可视化显微镜的典型条件。测量中使用的窄波段光的主波长列于下表2-1中。表2-1光源列表光源主波长led365nm365nmled400nm400nmled453nm453nm白光+滤光器555nm白光+滤光器720nm将在悬浮液中含有jurkat细胞的样品装载到约100μm厚的样品室中。将样品室放置在光学系统中并使用2倍线性放大倍率将明场信息聚焦到有源检测元件阵列上。将每个图像的焦点和光强度调节为产生可比较的结果。通过按细胞的积分强度与背景的强度的比率这一光的相对衰减的量度来测定单个细胞的总强度对比度,分析图像中的信息。对比度测定的结果在图2a的表中示出,其示出作为光源的波段的函数所观察到的对比度。在图表中,实线绘制从400nm至750nm的波长范围,这代表了使用白色led的宽波段光时,观察到的总强度对比度。图2b-2g示出所记录的图像的例子。图2b是使用365nm的光记录的图像,图2c是使用400nm的光,2d是使用白色光而图2e是使用710nm的光。这些图像表明,图像的对比度对为准确识别细胞的存在以及空间位置的生物颗粒的图像表示具有深刻的影响。图2f和2g示出在更高的分辨率下收集到的图像的切片。图2f是使用365nm的光的图像,而图2g是使用710nm的光的图像。这些图像表明,利用低于400nm的波长的光得到的图像比使用长波长的光收集的图像显示更多细节,虽然图像是在相似的条件下收集的。365nm的光的图像比长波长的图像显示出关于形状、尺寸和相对位置的相当大量的信息。实施例3信号背景比的增强当执行生物样品的荧光分析时,重要的是管理激发和发射光以获得适当的图像的对比度。基本上有两种方法来改善对比度,首先是使用激发滤光器来减少波长比用于荧光激发更长的光以及其次是使用发射滤光器来减少波长比到达有源检测元件的荧光更短的光。为了执行高灵敏度的荧光分析,其中信号对比度的一个重要方面,有必要考虑影响所收集的强度信息的光学系统的各个方面。这包括诸如系统的任何组件的激发强度,自体荧光和光学滤光器衰减等方面。在改善收集生物样品的荧光空间强度信息的对比度的任务中,重要的是首先优化荧光信号的强度,其次最小化背景信号。荧光信号的强度主要是由激发光的强度来确定。背景信号的强度取决于几个方面,例如激发光在有源检测元件阵列上的暴露和光学部件的自发荧光的强度。理想地,激发光在有源检测元件阵列上的曝光可以通过使用具有无限衰减或阻断的发射滤光器来消除。难以实现这样的理想滤光器并且滤光器通常衰减光至给定波长的一小部分,例如10-6至10-7(介于六和七个数量级之间的衰减),所以除了高品质滤光器以外,有必要考虑影响激发光的曝光的其他方面。激发光源相对于有源检测元件阵列的视场的取向可以对激发光在检测元件上的曝光有很大影响,其中直接沿着检测元件的视场的轴的总取向通常会引起暴露的激发光的最高强度。离开视场轴的激发光的一般取向会减少在检测元件上暴露的激发光的强度。在本发明的优选实施方式中,激发光朝向样品室中的样品与样品室和有源检测元件阵列之间的轴呈一个角度被导向。这种实施方式示于图3a,其中激发光的总轴与样品室和有源检测元件阵列之间的轴呈约40度。在图3a中,示出聚光物镜(301),其收集来自样品室的光,该样品室由限定样品室底部的透明壁部(303)和另一个限定样品室顶部的透明壁部(304)所限定。物镜通过发射滤光器(302)透射来自样品室的光并将它成像到有源检测元件阵列(未示出)上。激发光由发光二极管(305)产生,来自它的光被激发光模块(306)中的第一透镜收集,该激发光模块(306)由一个或多个透镜(示出两个)和一个或多个光调制元件(示出两个)如激发滤光器和光色散元件组成。来自激发光模块的光聚焦到样品室,如由激发光的光束(307)的边界所示。在如该图中给出的条件下,可能的是激发光中的一部分可以进入聚光物镜的视场,这或者是通过散射(未示出)或者是通过直接照明(这可以在一部分激发光的光束以低于受光角的角度进入聚光物镜(307a)的开口时发生)。这种光的一大部分是在到达检测元件(309)之前被发射滤光器移除,而允许荧光到达(310)。虽然发射滤光器具有很大的衰减,它限于,例如,10-7的量级,这意味着该部分的光,虽然小,但可以到达检测元件。进一步地,聚光物镜的元件可以产生荧光(自体荧光),其将穿过发射滤光器并在检测元件上产生背景图像。图3b给出了在聚光物镜的入口处对应于激发光(307a)的光束的部分的光强度的视图。通过激发模块的部件的布置,有可能通过限制激发光模块的孔来减少这种光,但这样会大大减少曝光到样品室的激发光的总量,从而类似地降低荧光强度。本发明的优选实施方式示于图3c中,其中障碍物(311)是放置在激发光模块中,从而改变激发光(312)的光束,其大大消除了将进入聚焦物镜的视场的光线。图3d示出了修改后的激发光的光束的强度分布谱,其中一部分被障碍物除去。图3e示出所得到的进入聚光物镜的光强度,与之相比,图3b示出了光的扩展已被大大移除,但进一步在本实施例中,重要的是注意两个图像的缩放是使得图3e放大了大约×200的倍数,表明激发光的强度已被有效地减少。下面的表3-1示出了障碍物的尺寸对激发照明的强度以及进入聚焦物镜的激发光的强度的影响。该表显示出暴露到样品室的激发光的相对量,以及进入聚焦物镜的激发光的光束的相对量。障碍物通过将线性屏幕放置到激发光模块内部的光的柱形光束中而形成并且报道的数值是障碍物相对于光束的直径的插入。表3-1激发光和聚光物镜中的光障碍物激发光物镜中的光0%100%11%6%98%8%13%93%3%19%85%0.8%22%81%0.18%25%77%0.005%使用典型条件,在下面证明了弱荧光颗粒(例如含有相对少的荧光团的颗粒)的分析的影响。在本发明的实施方式中,假定使用具有0.20的数值孔径(na)的聚光物镜。此外,假设颗粒的荧光转换效率是2×10-6且类似地样品室的荧光转换效率为2×10-7,这一荧光来自于透明壁部和/或其他材料中的杂质。发射滤光器衰减大部分进入聚光物镜的激发光,但在进入聚光物镜时,光可以产生很大的背景荧光,这是由聚光物镜中的光学部件以及其他材料的杂质所造成,并且此荧光的大部分将穿过发射滤光器。因此存在通过进入聚光物镜的激发光造成的,透射通过发射滤光器到检测元件上的净光强度,并且可以假设穿过发射滤光器的散射、曝光和荧光达到5x10-7的净强度。这些条件描述了一种系统,其中由于背景的总强度是从颗粒中观察到的荧光强度的约3倍,因此评估来自生物颗粒的荧光强度非常困难。通过在激发光模块中插入激发光的光束的障碍物,能够减小进入聚光物镜的光量并因此显著抑制背景信号。在表3-1中,已经示出了在同一时间,进入样品室的激发光的总量也减少到少得多的程度。其效果在下面的表3-2中示出,其示出标准化的荧光和背景信号。表3-2标准化化荧光和背景信号障碍物荧光样品背景物镜中的光背景信号/背景0%1.000.102.672.770.36(1)6%0.980.101.982.080.47(1.3)13%0.930.090.740.831.1(3.1)19%0.850.090.160.243.5(10)22%0.810.080.040.126.8(19)25%0.770.080.000.089.6(27)表3-2示出了总的背景信号减少显著快于荧光强度,这由信号/背景(s/b)值示出(在括号中是荧光信号与背景信号比的相对变化)。表3-2的结果表明,在这些条件下,通过在激发光的光束中放置障碍物来覆盖光束直径的约25%,s/b比增加了近30倍。在这些条件下,荧光的强度仅下降了23%。实施例4颗粒标准的检测使用根据本发明的系统来鉴定并量化校准珠,其通常被用于校准流式细胞仪设备。珠是rainbowcalibrationparticles(p/nrcp-30-5a),spherotech,美国,一组直径为3μm的珠,包括8组产生不同的荧光强度。本发明的图像式细胞仪被设定为用在约475nm的窄带激发光照明,并用约536nm的波段检测荧光发射。使用具有na0.20的4倍聚光物镜收集来自样品室的光并聚焦到有源检测元件阵列。根据由供应商提供的说明来处理珠,并将其放置在大约100μm厚的样品室中。通过有源检测元件阵列收集空间光强度信息的一系列图像,首先为了获取涉及颗粒位置的信息的目的而收集空间明场光强度信息的曝光,而其次使用300ms的积分时间收集空间荧光强度的曝光。通过移动样品室从样品的不同部分共收集35对明场和荧光图像,得到共70个光强度图像。每个明场图像被用来确定颗粒的位置,并且此信息被用于询问在该位置的荧光图像,将每个颗粒的荧光的总强度积分。分析总共12,750个颗粒,结果如在图4所示,其示出了观察到的荧光强度的直方图。该图示出了8个不同的强度组的明显区别,与由校准珠的供应商给定的规格一致。这表明,根据本发明的图像式细胞仪的灵敏度与当今典型的流式细胞仪相似。实施例5明场/暗场配置将贴壁wehi-s细胞(鼠纤维肉瘤细胞系)的样品置于5a中示意性地描绘的本发明的图像式细胞仪中,并用在约365nm的窄波段发射光的光源(503)照明。光源是位于从有源检测元件(509)阵列延伸到样品室的光轴上,朝向检测元件暴露光,所述样品室由两个透明壁部(502和503)限定。暴露的光穿过光学装置(507),使得其形成基本上平行于聚光物镜(501)的光轴的光束(504)。所用的聚光物镜的特性是使得从光源发射的平行光大致聚焦到沿光轴在物镜和有源检测元件阵列之间的定位的平面(506)上,使得该光的主要部分被聚光物镜(508)引导离开,该聚光物镜(508)将光聚焦到检测元件上。使用这种布置,从光发射并穿过聚焦物镜的一部分光进入检测元件形成均匀的背景强度,除非光被样品中的颗粒偏转然后来自样品的该位置的光衰减光强度从而形成颗粒的空间明场图像。被颗粒偏转的光受到该颗粒的元素影响。这样偏转的光改变方向并且在几个方向发射,在不同方向上的光的强度由颗粒的特性决定。某些偏转光进入聚光物镜,并形成从颗粒始发的不同方向的光束(505)。进入聚光物镜的偏转光在到达聚光物镜时形成大致平行的光束,该光束将聚焦到聚光元件。此偏转光形成与样品的明场图像混合的光强度信息的空间图像,其一个例子在图5d中示出。图5b示出了放置在位于聚光物镜和检测元件之间、从光源发射的基本上平行的光的焦平面中的障碍物(510)。这种障碍物是由在盘中的孔洞形成的孔,孔洞的尺寸是基本上只允许来自光源的光到达检测元件,消除由颗粒散射的光。所得到的图像(一个例子示于图5e)是明场光信息的空间图像,其中对比度相比于没有前面所讨论的所述孔障碍物的布置大大提高。这种布置的一个附加的特性是这样的明场图像对聚光物镜的聚焦明显较不敏感,从而有利于具有基本上大的焦深的图像,这是因为这一明场图像的聚焦在很大程度上依赖于穿过样品室的光的准直程度和障碍物的孔的尺寸。图5c示出了放置在位于聚光物镜和检测元件之间的、从光源发射的基本上平行的光的焦平面中的障碍物(511)。此障碍物的尺寸和定位使得它基本上只允许被颗粒散射的光到达检测元件,消除直接从光源发射的光。所得到的图像(一个例子示于图5f)是在样品中的颗粒的暗场光信息的空间图像。图5g示出与球面物体相互作用的光线,该球面物体关于折射率的特性与生物颗粒的特性类似。显示出当准直光(520)照明颗粒(521)时,光线由于折射率差异折射,折射程度由颗粒的光学特性确定。绕开颗粒的光(522)进入聚焦物镜(未示出),仍然准直。一些光以大角度被散射(523),使得它们将在入口外照明聚光物镜的入射面,因而不会到达检测元件阵列(未示出)。其它光线以小角度被折射(524),使得它们将进入聚光物镜,从而在检测元件上成像。考虑到绕开颗粒的准直光线,这些将在检测元件上形成图像,该图像在颗粒的图像外部具有相当大的光强度,而在颗粒内部没有或有小的光强度,从而形成颗粒的阴影。与颗粒相互作用的光线以不同程度折射,其中一些具有零角度折射,因为它们垂直穿过颗粒边界,而其他的具有变化的色散角。考虑到散射的光线,这些将形成颗粒的图像,该图像在某种程度上类似于如果颗粒发光时观察到的图像,但具有不与颗粒位置重合的不同的暗场焦点(525),焦点由颗粒的大小和光学特性确定。图5h至5j示出采用不同的照明条件所记录的cho细胞悬浮液的图像。图5h是细胞的明场图像,而图5i是其中折射光已被在平行光的焦平面上放置孔(参照图5b)所阻断的明场图像以及图5j是准直光被阻断的暗场图像(见图5c),所有图像都单独聚焦。最后图5k是示出特异性染色的颗粒的荧光图像。组合使用在图5h、5i和5j的图像以确定个体细胞的位置和轮廓、用于计数细胞的数目和估计个体细胞的荧光强度的信息,这些是用于分类细胞特性。通过这种在聚光物镜的焦平面中的障碍物是可交换的布置,能够简单地通过放置或移除适当的障碍物,实现具有记录高对比度明场或暗场,或者是两者的结合的灵活性的图像式细胞仪系统。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1