一种测定谷胱甘肽含量的方法与流程
本专利受到技术研发课题2018yfc1603702的资助。
本发明属于医药化学技术领域,更具体地,涉及一种测定谷胱甘肽含量的方法。
背景技术:
谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸组成含巯基的小分子肽,具有还原型和氧化型两种形态,在生理条件下主要以还原型为主。谷胱甘肽是人体内重要的抗氧化剂和自由基清除剂,能参与生物转化作用,与自由基、重金属、致癌物质等结合,从而把机体内有毒有害物质转化为无害物质,排泄出体外。除此之外,谷胱甘肽还能对肝脏起到保护作用,改善某些疾病的病程和症状,提高人体免疫力,养颜美容护肤,抗衰老等。谷胱甘肽含量的变化与许多疾病的发展息息相关,如生长迟缓、组织损伤、心血管疾病、阿尔茨海默氏病和癌症的发生。因此,检测gsh的含量在生物和临床测试中是非常有意义的。
目前,gsh的检测方法主要有比色法、荧光法、电化学法、酶联免疫法、表面增强拉曼散射法、高效液相色谱法等,然而这些方法大多局限于实验室检测,且仪器笨重,成本较高,需要专业人员维护和操作,检测时间较长,选择性差等,不适用于临床多通量快速灵敏检测。近年来,智能手机因具有多种功能强大的软件、方便携带、高分辨率的摄像头、能够实时信息共享等特点被研究人员广泛应用到检测领域,包括比色、荧光、电化学发光领域等,实现对目标物快速灵敏检测。但是,目前没有结合智能手机实现对gsh的检测方法。
技术实现要素:
本发明的目的是提供一种以氮硫掺杂型碳量子点为探针,利用智能手机检测血清中谷胱甘肽含量的方法,该方法避免使用大型仪器,可用于现场检测,成本低,灵敏度高,具有良好的应用前景。
为了实现上述目的,本发明提供了一种测定谷胱甘肽含量的方法,该方法包括:
(1)在醋酸-醋酸盐缓冲溶液和双掺杂氮硫碳量子点的存在下,使过氧化氢与3,3',5,5'-四甲基联苯胺发生氧化反应,得到所述检测溶液;通过安卓手机软件colorgrab获取所述检测溶液的颜色强度值r0g0b0;然后将不同浓度的gsh标准溶液分别与所述检测溶液混合,进行还原反应,得到多个褪色溶液;通过安卓手机软件colorgrab获取所述多个褪色溶液的颜色强度值rbgbbb;
(2)基于r0g0b0和多个rbgbbb的r通道数值与所述不同浓度的gsh标准溶液的浓度建立r通道数值变化与谷胱甘肽浓度的线性关系,进而获得谷胱甘肽浓度与颜色强度变化的标准工作曲线;
(3)将待测样品与所述检测溶液混合,进行还原反应,得到褪色待检溶液,然后通过安卓手机软件colorgrab获取所述褪色待检溶液的颜色强度值rcgcbc;将所述rcgcbc的r通道数值代入谷胱甘肽浓度与颜色强度变化的标准工作曲线中,获得待测样品中谷胱甘肽的浓度。
本发明的技术方案具有如下有益效果:
(1)本发明通过开发一种智能手机结合掺杂型碳量子点比色测定谷胱甘肽的方法,将智能手机作为信号读出器,取代了传统的紫外分光光度计,不仅简化了操作过程,而且成本低,便携,适用于现场检测,同时,碳量子点原料易得、绿色环保、易合成和修饰,使得整个方法简单绿色,而且,该方法重现性好,稳定性高,具有较好的灵敏度和选择性。
(2)本发明的方法操作简单,成本低,能够高效灵敏的检测痕量谷胱甘肽,具有良好的选择性。
本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显,其中,在本发明示例性实施方式中,相同的参考标号通常代表相同部件。
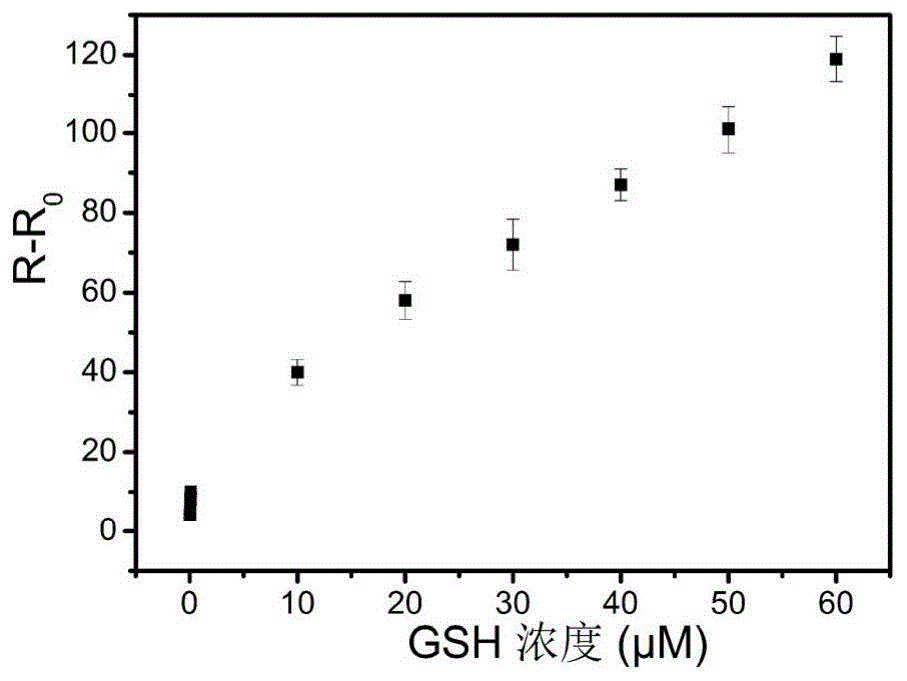
图1示出了根据本发明的一个实施例的谷胱甘肽浓度与颜色强度yr的标准曲线图。
图2示出了根据本发明的一个筛选条件的智能手机测定的|r0-rblank|值与ph的关系图。
图3示出了根据本发明的一个筛选条件的紫外分光光度计测定的紫外吸收光谱与ph的关系图。
图4示出了根据本发明的一个筛选条件的智能手机测定的|r0-rblank|值与体系中3,3′,5,5′-四甲基联苯胺(tmb)终浓度的关系图。
图5示出了根据本发明的一个筛选条件的紫外分光光度计测定的紫外吸收光谱与体系中3,3′,5,5′-四甲基联苯胺(tmb)终浓度的关系图。
图6示出了根据本发明的一个实施例的手机拍摄盒的结构示意图。其中,图中三个距离数值分别为1.0cm、10cm和12.5cm,具体指所述led灯光源与反应器3(离心管)水平间距为1.0cm,与反应器3(离心管)底部垂直间距为10.0cm;手机摄像头与反应器3(离心管)水平距离为12.5cm。
附图标记说明:
1、测试暗盒2、led灯光源3、反应器4、安卓智能手机5、摄像头
具体实施方式
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了使本发明更加透彻和完整,并且能够将本发明的范围完整地传达给本领域的技术人员。
本发明提供了一种测定谷胱甘肽含量的方法,该方法包括:
(1)在醋酸-醋酸盐缓冲溶液和双掺杂氮硫碳量子点的存在下,使过氧化氢与3,3',5,5'-四甲基联苯胺发生氧化反应,得到所述检测溶液;通过安卓手机软件colorgrab获取所述检测溶液的颜色强度值r0g0b0;然后将不同浓度的gsh标准溶液分别与所述检测溶液混合,进行还原反应,得到多个褪色溶液;通过安卓手机软件colorgrab获取所述多个褪色溶液的颜色强度值rbgbbb;
(2)基于r0g0b0和多个rbgbbb的r通道数值与所述不同浓度的gsh标准溶液的浓度建立r通道数值变化与谷胱甘肽浓度的线性关系,进而获得谷胱甘肽浓度与颜色强度变化的标准工作曲线;
(3)将待测样品与所述检测溶液混合,进行还原反应,得到褪色待检溶液,然后通过安卓手机软件colorgrab获取所述褪色待检溶液的颜色强度值rcgcbc;将所述rcgcbc的r通道数值代入谷胱甘肽浓度与颜色强度变化的标准工作曲线中,获得待测样品中谷胱甘肽的浓度。
本发明中,所述双掺杂氮硫碳量子点为催化剂。
根据本发明,优选地,步骤(1)中,将盛装所述检测溶液的反应器放入手机拍摄盒中,然后通过安装于智能手机中的安卓手机软件colorgrab拍摄所述检测溶液的颜色图片,进而获取所述检测溶液的颜色强度值r0g0b0;
将多个盛装所述褪色溶液的反应器分别放入手机拍摄盒中,然后通过安装于智能手机中的安卓手机软件colorgrab拍摄所述褪色溶液的颜色图片,进而获取所述多个褪色溶液的颜色强度值rbgbbb;
步骤(3)中,将盛装所述褪色待检溶液的反应器放入手机拍摄盒中,然后通过安装于智能手机中的安卓手机软件colorgrab拍摄所述褪色待检溶液的颜色图片,进而获取所述褪色待检溶液的颜色强度值rcgcbc。
本发明中,可以采用本领域任何满足本发明的拍摄颜色图片需要的手机拍摄盒进行颜色图片的获取进而得到反应体系的颜色强度值,例如可以为如下实施方式:手机拍摄盒如图6所示,包括测试暗盒1,测试暗盒的上部设置有led灯光源2,led灯光源自上而下垂直摄入测试暗盒;测试暗盒的上部设置有反应器(离心管)固定区域,使用时,反应器3(离心管)安放于固定区域内,且反应器3(离心管)底部伸入测试暗盒内;在测试暗盒内侧壁设置有安卓智能手机固定区域,且手机固定区域外侧透明;安卓智能手机4安放于其中后使其摄像头5正对反应器3(离心管)底部。所述led灯光源与反应器3(离心管)水平间距为1.0cm,与反应器3(离心管)底部垂直间距为10.0cm;手机摄像头与反应器3(离心管)水平距离为12.5cm。
根据本发明,优选地,当待测试样的谷胱甘肽的浓度为0.03-0.1μmol/l时,所述谷胱甘肽浓度与颜色强度变化的标准工作曲线如公式1所示:yr=1.78+82.17c;
当待测试样的谷胱甘肽的浓度为10-60μmol/l时,所述谷胱甘肽浓度与颜色强度变化的标准工作曲线如公式2所示:yr=25.81+1.54c;
其中,yr表示反应体系中加入谷胱甘肽后与未加入谷胱甘肽前测试的r通道颜色强度值的差值;c为谷胱甘肽浓度。
本发明中,选取r通道数值变化yr建立与谷胱甘肽浓度的线性关系,其中,yr=r-r0
yr—表示反应体系中加入谷胱甘肽后与未加入谷胱甘肽前测试的r通道颜色强度值的差值;
r0—表示未加入谷胱甘肽时反应体系(氧化反应体系)的r通道颜色强度值;
r—表示加入谷胱甘肽后反应体系(还原反应体系)的r通道颜色强度值;
本发明通过优化数据建模确定谷胱甘肽浓度与颜色强度变化的最佳标准曲线,即公式1和公式2所示曲线;其中,公示1的最低检测限lod为0.0053μm;公示2的最低检测限lod为0.26μm;本发明所用的优化数据建模方法可以为本领域常规的数据建模筛选优化方法。
根据本发明,优选地,所述醋酸-醋酸盐缓冲溶液的ph为2.0~5.0;所述氧化反应的温度为25-45℃,时间为25-45min;
控制所述氧化反应的反应体系中,3,3',5,5'-四甲基联苯胺的浓度为2mmol/l,过氧化氢的浓度为100μmol/l。
本发明中,3,3',5,5'-四甲基联苯胺优选以3,3',5,5'-四甲基联苯胺的乙醇溶液形式加入。本发明中,tmb和h2o2的摩尔比为:20:1;控制氧化反应的反应体系中双掺杂氮硫碳量子点的最终浓度为20μg/ml。
根据本发明,优选地,所述ph为3.5,所述氧化反应的温度为35℃。
本发明中,为使得测试结果更准确,使得获得的标准工作曲线更精确,本发明进行了检测条件的筛选优化;具体如下:
(1)反应体系最佳ph的确定:
准确移取0.6ml100μg/mlns-cds(双掺杂氮硫碳量子点)、0.25ml6mmtmb的乙醇溶液,0.15ml1mmh2o2溶液于10ml玻璃离心管中,重复8组,同时做试剂空白溶液,即不加h2o2溶液,其他试剂用量如上,分别向每个离心管中加入1ml不同ph值的醋酸-醋酸钠缓冲溶液,其ph调节范围为2.5-6.0,最后用去离子水将每个离心管中的混合溶液定容到3ml,在35℃下反应35min,利用智能手机软件colorgrab分别获取不同ph溶液的rgb颜色强度值,其中试剂空白的颜色强度值为rblankgblankbblank,反应体系的颜色强度值为r0g0b0。通过分析r通道强度值与ph的关系可知,如图2所示,当ph=3.5时,体系的|r0-rblank|值最大,此时溶液的颜色最深,表明ns-cds在ph为3.5时催化效率最高,而ph小于或大于3.5时,体系的|r0-rblank|值相对较低,不利于ns-cds催化氧化tmb。为了验证该方法的可行性,本实验又采用紫外分光光度计测定了不同ph条件下的紫外吸收光谱。由于tmb的氧化产物ox-tmb在654nm处有最大紫外吸收,故通过比较不同ph条件下的654nm处吸光度值大小,从而可以得出最佳ph值。如图3所示,当ph=3.5时,在654nm处的吸光度值最大,说明此ph条件下,ns-cds具有最佳催化效率,且结果与用智能手机拍照获得的结论一致,表明该方法具有良好的灵敏度和可行性。
(2)3,3',5,5'-四甲基联苯胺(tmb)溶液最适浓度的确定:
为了进一步提高反应的灵敏度,对tmb的用量进行了优化。具体过程如下:分别取0.6ml100μg/mlns-cds、不同体积的10mmtmb的乙醇溶液、30μl5mmh2o2、1mlph=3.5醋酸-醋酸钠缓冲溶液于10ml玻璃离心管中,重复6组,同时做试剂空白,即不加tmb溶液,其他试剂用量如上,然后用去离子水将每个离心管中的混合溶液定容至3ml。其中,tmb在混合溶液中的最终浓度分别为0.5mm、1.0mm、1.5mm、2.0mm、2.5mm、3.0mm。在35℃下反应35min后,利用智能手机软件colorgrab分别获取不同tmb用量的溶液rgb颜色强度值,其中试剂空白的颜色强度为rblankgblankbblank,反应体系的颜色强度值为r0g0b0,并作|r0-rblank|值与tmb用量的关系曲线,如图4所示,当tmb终浓度为2.0mm时,体系的|r0-rblank|值最大,此时溶液的颜色最深,表明ns-cds在tmb浓度为2.0mm时催化效率最高。同时,也采用紫外分光光度计测定了不同tmb浓度下的紫外吸收光谱,如图5所示,当tmb浓度为2.0mm时,在654nm处具有最大的吸光度值。此结果与智能手机测定结果一致。
根据本发明,优选地,所述还原反应的温度为25-45℃,时间为2-3min。
根据本发明,优选地,所述还原反应的温度为35℃。
根据本发明,优选地,所述醋酸-醋酸盐缓冲溶液为醋酸-醋酸钠缓冲溶液。
本发明的测试方法利用合成的双掺杂氮硫碳量子点具有良好的过氧化氢酶模拟活性,在过氧化氢存在下,能够迅速催化氧化显色底物3,3',5,5'-四甲基联苯胺生成蓝色氧化物(ox-tmb),加入还原型谷胱甘肽后,ox-tmb与谷胱甘肽发生氧化还原反应,使得蓝色的ox-tmb逐渐被还原,溶液颜色逐渐变浅,溶液变浅的程度与谷胱甘肽的浓度有关。传统的测定方法是利用紫外分光光度计测定652nm处的吸光度值从而来测定谷胱甘肽。但是这种测定方法有一定的局限性,比如只适用于实验室操作,需要专业操作人员等。本发明的方法通过开发一种智能手机结合掺杂型碳量子点比色测定谷胱甘肽的方法,将智能手机作为信号读出器,取代了传统的紫外分光光度计,不仅简化了操作过程,而且成本低,便携,适用于现场检测,同时,碳量子点原料易得、绿色环保、易合成和修饰,使得整个方法简单绿色,而且,该方法重现性好,稳定性高,具有较好的灵敏度和选择性。
以下通过实施例进一步说明本发明:
以下各实施例中,所用的ns-cds通过如下方法制得:准确称取4.5g柠檬酸和2gl-半胱氨基酸于10ml去离子水中,超声并搅拌直至全部溶解,然后将混合溶液转移至25ml高压反应釜的聚四氟乙烯的内衬里,在180℃下水热反应12h,反应结束后,冷却至室温,取出反应后的溶液,在10000r/min下离心15分钟,取出上清液并用0.22μm水系过滤膜过滤,然后将滤液转移至圆底烧瓶中,在65℃旋转蒸发,转速为45-50r/min,最后将浓缩后的溶液冷冻干燥,得到棕黄色粉末(ns-cds)。
以下各实施例中,所用的手机拍摄盒如图6所示,包括测试暗盒1,测试暗盒的上部设置有led灯光源2,led灯光源自上而下垂直摄入测试暗盒;测试暗盒的上部设置有反应器(离心管)固定区域,使用时,反应器3(离心管)安放于固定区域内,且反应器3(离心管)底部伸入测试暗盒内;在测试暗盒内侧壁设置有安卓智能手机固定区域,且手机固定区域外侧透明;安卓智能手机4安放于其中后使其摄像头5正对反应器3(离心管)底部。所述led灯光源与反应器3(离心管)水平间距为1.0cm,与反应器3(离心管)底部垂直间距为10.0cm;手机摄像头与反应器3(离心管)水平距离为12.5cm。
实施例1
(1)向10ml玻璃离心管中依次加入0.6ml100μg/mlns-cds,0.6ml10mmtmb的乙醇溶液,0.05ml6mmh2o2,1.5mlph=3.5醋酸-醋酸钠缓冲溶液,然后用去离子水定容至3ml;将定容后的混合溶液振荡均匀后在35℃下反应30min使溶液显色,得到检测溶液;然后将离心管放入手机拍摄盒中,通过安装于智能手机中的安卓手机软件colorgrab拍摄所述检测溶液的颜色图片,进而获得所述离心管内检测溶液的颜色强度值r0g0b0为33(r0)、180、180。将不同浓度的gsh标准溶液分别加入到上述检测溶液中,使得gsh在溶液中的最终浓度为0μm、0.03μm、0.05μm、0.07μm、0.09μm、0.10μm;在35℃下进行还原反应2min后,得到多个褪色溶液;然后将上述盛放褪色溶液的多个离心管分别放入手机拍摄盒中,通过安装于智能手机中的安卓手机软件colorgrab拍摄所述褪色溶液的颜色图片,进而获得多个离心管内褪色溶液的颜色强度值rbgbbb。
(2)选取r通道数值变化yr建立与谷胱甘肽浓度的线性关系,其中
yr=r-r0rb表示加入谷胱甘肽后反应体系(还原反应体系)的r通道颜色强度值;通过优化数据建模确定谷胱甘肽浓度与颜色强度变化的最佳标准曲线,在0.03-0.1μm的范围呈线性关系,线性方程为yr=1.78+82.17c(yr表示反应体系中加入谷胱甘肽后与未加入谷胱甘肽前测试的r通道颜色强度值的差值;c为谷胱甘肽浓度),检测限lod为0.0053μm。
(3)将待测样品与所述检测溶液混合,在35℃下进行还原反应2min后,得到褪色待检溶液,将盛装所述褪色待检溶液的反应器放入手机拍摄盒中,然后通过安装于智能手机中的安卓手机软件colorgrab拍摄所述褪色待检溶液的颜色图片,进而获取所述褪色待检溶液的颜色强度值rcgcbc;将所述rcgcbc的r通道数值代入谷胱甘肽浓度与颜色强度变化的标准工作曲线中,获得待测样品中谷胱甘肽的浓度。
实施例2
(1)向10ml玻璃离心管中依次加入0.6ml100μg/mlns-cds,0.6ml10mmtmb的乙醇溶液,0.05ml6mmh2o2,1.5mlph=3.5醋酸-醋酸钠缓冲溶液,然后用去离子水定容至3ml;将定容后的混合溶液振荡均匀后在35℃下反应30min使溶液显色,得到检测溶液;然后将离心管放入手机拍摄盒中,通过安装于智能手机中的安卓手机软件colorgrab拍摄所述检测溶液的颜色图片,进而获得所述离心管内检测溶液的颜色强度值r0g0b0为33(r0)、180、180。将不同浓度的gsh标准溶液分别加入到上述检测溶液中,使得gsh在溶液中的最终浓度为0μm、10μm、20μm、30μm、40μm、50μm和60μm;在35℃下进行还原反应2min后,得到多个褪色溶液;然后将上述盛放褪色溶液的多个离心管分别放入手机拍摄盒中,通过安装于智能手机中的安卓手机软件colorgrab拍摄所述褪色溶液的颜色图片,进而获得多个离心管内褪色溶液的颜色强度值rbgbbb。
(2)选取r通道数值变化yr建立与谷胱甘肽浓度的线性关系,其中
yr=r-r0rb表示加入谷胱甘肽后反应体系(还原反应体系)的r通道颜色强度值;通过优化数据建模确定谷胱甘肽浓度与颜色强度变化的最佳标准曲线,如图1所示,在10-60μm的范围呈线性关系,线性方程为yr=25.81+1.54c(yr表示反应体系中加入谷胱甘肽后与未加入谷胱甘肽前测试的r通道颜色强度值的差值;c为谷胱甘肽浓度),检测限lod为0.26μm。
(3)将三份新鲜小鼠血清分别在3000rpm/min下离心15min,取上清液进行测定,得到三个待测试样分别为小鼠血清1、小鼠血清2和小鼠血清3。将三个10μl的待测试样分别与上述检测溶液混合,在35℃下进行还原反应2min,得到褪色待检溶液;将盛装所述褪色待检溶液的离心管放入手机拍摄盒中,然后通过安装于智能手机中的安卓手机软件colorgrab拍摄所述褪色待检溶液的颜色图片,进而获取所述褪色待检溶液的颜色强度值rcgcbc。然后将测得的3个小鼠血清rcgcbc的r通道值分别与步骤(1)获得的r0g0b0的r0作差,将差值yr代入到上述线性关系中,可得小鼠血清中含有的gsh浓度分别为12.2μm、16.7μm、11.3μm(见表1)。为检测该方法的准确性和实用性,通过elisa方法进行验证,其结果与手机测定方法基本一致,结果如表1。同时,采用加标回收方法测定了不同浓度gsh(5μm、10μm、15μm)下的血清样品,其加标回收率在90.0%-114.0%(表1所示)。其中,表1中,gsh加入量列中的小鼠血清1、小鼠血清2和小鼠血清3分别为0时表示未进行加标回收验证的小鼠血清样品。
表1样品中谷胱甘肽(gsh)的测定结果
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!