一种利用色素蛋白的氧化损伤检测抗氧化剂抗氧化效力的方法与流程
本发明涉及一种检测抗氧化剂抗氧化效力的方法,属于抗氧化剂抗氧化效力测定技术领域。
背景技术:
活性氧自由基(ros)是一类半衰期短、稳定性差且化学性质活泼的物质,包括超氧自由基(o2·-)、羟基自由基(·oh)和过氧化氢(h2o2)等。ros对生物体具有双重影响:一方面在生物体中,适量的自由基对维持机体正常生理功能及重要生命过程至关重要,如调节机体的新陈代谢与免疫功能,参与细胞的增殖分化、细胞调亡、细胞吸附、神经传导、基因表达等等;另一方面当体内蓄积的自由基过量时就会对机体造成危害,导致生物体正常细胞和组织损伤,过量的自由基会攻击细胞膜上的大分子物质,破坏细胞正常组分,使生物体内正常生理生命功能发生紊乱。
活性氧对蛋白质的作用主要包括修饰氨基酸、使肽链断裂、形成蛋白质的交联聚合物、改变构像和免疫原性等五个方面。由活性氧引起的蛋白质氧化性损伤与衰老、肿瘤、糖尿病及许多神经退行性疾病的发生相关。
目前检测蛋白质氧化损伤的方法主要是通过检测蛋白质氧化损伤标志物,如测定蛋白质羰基的含量来间接反映蛋白质氧化损伤的程度,原因主要是大部分蛋白质在受到自由基攻击后理化性质的变化不直观。然而色素蛋白不同与一般的蛋白不同,除了在280nm处存在蛋白质特征吸收峰以外,他们还具有其它特征吸收波长,如藻蓝蛋白的紫外-可见吸收光谱显示在620nm处有特征吸收峰。牛血红蛋白的紫外-可见吸收光谱显示在405nm处有特征吸收峰,而且该特征吸收波长对于蛋白质的结构变化比280nm更加敏感。
目前评估抗氧化剂活性的体外方法主要有dpph法、abts法、邻苯三酚法、orac法等,这些抗氧化剂活力评估方法的显色底物都是化学物质,他们并不能真实反映抗氧化剂在生理条件下的抗氧化活性,因而得到的实验结果往往也具有较大差异。
本发明针对上述实验问题进行了新方法的探索,利用色素蛋白作为自由基攻击的底物,通过检测蛋白质在其特征吸收峰处的吸光值变化来直观反映自由基对蛋白质造成氧化损伤的程度,由于显色底物是色素蛋白这样的生物大分子,因此相较传统的化学显色法,本发明更能真实反映抗氧化剂在生理条件下的抗氧化活性。
技术实现要素:
本发明的首要目的是针对现有技术的不足,提供一种利用色素蛋白快速检测抗氧化剂抗氧化效力的新方法。本发明可用于评估抗氧化剂对生物大分子的保护作用,进而评估抗氧化剂的抗氧化效力,准确度更高,更接近于生理的真实水平。
本发明的目的是通过以下方式实现的。
一种利用色素蛋白的氧化损伤检测抗氧化剂及其抗氧化效力的方法,对色素蛋白进行全波长扫描得出蛋白特征吸收峰;找到合适的自由基及其最佳的反应浓度;在含有色素蛋白和自由基的体系中分别加入阳性抗氧化剂和待测抗氧化剂,根据色素蛋白在特征吸收峰处的吸光值变化,利用抗氧化能力公式计算出待测抗氧化剂相当于阳性抗氧化剂的抗氧化当量。
所述的方法,具体包括以下步骤:
(1)对色素蛋白进行全波长扫描得出蛋白特征吸收峰;
(2)以自由基的浓度梯度,设置多个反应体系,每个反应体系中均加入浓度和体积固定的色素蛋白,反应总体积固定,在色素蛋白的特征吸收峰波长处连续测定od值;
(3)以阳性抗氧化剂的浓度梯度,设置多个反应体系,每个反应体系中均加入浓度和体积固定的色素蛋白、自由基,以不加抗氧化剂的一组为对照组,反应总体积固定,在色素蛋白的特征吸收峰波长处连续测定od值;
(4)在步骤(3)的体系中将阳性抗氧化剂换成待测抗氧化剂,检测待测抗氧化剂的抗氧化效力;根据抗氧化能力公式(1.1)计算待测抗氧化剂的抗氧化能力;
其中,aucsample,auccontrol和auctrolox分别代表样品组、对照组和阳性对照组曲线与x轴的积分面积,ctrolox代表阳性对照的浓度,wsample代表样品的质量浓度。
步骤(2)的目的是找到合适的自由基及其最佳的反应浓度。首先,自由基本身不能有颜色,否则会干扰色素蛋白的吸光值;其次,自由基浓度不能过高或太低,过高会导致反应过快,需要的抗氧化剂的浓度也会偏高,抬高抗氧化剂的最低检测浓度,降低反应的灵敏度,过低则会导致反应所需的时间过长,因此选择在反应60min左右攻击完所有色素蛋白(即反应达到平台期)的自由基浓度开展下游实验。
步骤(3)的目的是找到合适的能对色素蛋白起到保护作用的阳性抗氧化剂及其最高最低浓度检测限。
进一步的,所述的阳性抗氧化剂包括:trolox(水溶性维生素e),还可以使用维生素c等。
进一步的,所述的色素蛋白包括:藻蓝蛋白或牛血红蛋白,还可使用藻红蛋白、绿色荧光蛋白等色素蛋白。
进一步的,所述的自由基是由包括:aaph在内的自由基引发剂引发产生,还可以利用fenton反应所产生的羟自由基等。
本发明保护范围不限于以下反应条件中的优选情况,还可以根据实际情况进行调整,只要能够依据上述步骤测定出结果即可。
进一步的,所述的测定方法,藻蓝蛋白为色素蛋白、aaph为自由基引发剂的反应体系包括:100μl终浓度为0.25mg/ml的藻蓝蛋白和80μl不同浓度的aaph,剩余体积用无菌超纯水补齐,反应总体积200μl。反应试剂都用无菌超纯水配制,反应温度45℃;检测波长为620nm,每间隔30s读一次蛋白od值,连续测定60min。注:所有反应试剂在开始反应前需先于45℃下水浴20min后10000×g离心10min。
进一步的,所述的测定方法,以trolox为阳性抗氧化剂,藻蓝蛋白为色素蛋白、aaph为自由基引发剂的反应体系包括:100μl终浓度为0.25mg/ml的藻蓝蛋白,80μl终浓度为75mm的aaph和20μl不同浓度的trolox,反应总体积200μl。反应试剂都用无菌超纯水配制,反应温度45℃;检测波长为620nm,每间隔30s读一次蛋白od值,连续测定至所有反应均到达平台期(90min左右)。注:所有反应试剂在开始反应前需先于45℃下水浴20min后10000×g离心10min。
进一步的,以trolox为阳性抗氧化剂,藻蓝蛋白为色素蛋白、aaph为自由基引发剂的反应体系:trolox的浓度在0.001-0.004mm之间时,trolox组与对照组积分面积差值(auctrolox-auccontrol)成良好的线性关系,y=1678.34x-0.02,r2=0.993。
进一步的,所述的测定方法,以植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy以及合成多肽fcvlrp为待测抗氧化剂,藻蓝蛋白为色素蛋白、aaph为自由基引发剂的反应体系包括:100μl终浓度为0.25mg/ml的藻蓝蛋白,80μl终浓度为75mm的aaph和20μl不同浓度的待测抗氧化剂,反应总体积200μl。反应试剂都用无菌超纯水配制,反应温度45℃;检测波长为620nm,每间隔30s读一次蛋白od值,连续测定至所有反应均到达平台期(90min左右)。注:所有反应试剂在开始反应前需先于45℃下水浴20min后10000×g离心10min。
进一步的,所述的测定方法,牛血红蛋白为色素蛋白、aaph为自由基引发剂的反应体系包括:100μl终浓度为0.15mg/ml的牛血红蛋白和80μl不同浓度的aaph,剩余体积用0.9%的氯化钠溶液补齐,反应总体积200μl。反应试剂都用质量分数为0.9%的氯化钠溶液配制,反应温度50℃;检测波长为405nm,每间隔30s读一次蛋白od值,连续测定60min。注:所有反应试剂在开始反应前需先于50℃下水浴20min后10000×g离心10min。
进一步的,所述的测定方法,以trolox为阳性抗氧化剂,牛血红蛋白为色素蛋白、aaph为自由基引发剂的反应体系包括:100μl终浓度为0.15mg/ml的牛血红蛋白,80μl终浓度为40mm的aaph和20μl不同浓度的trolox,反应总体积200μl。反应试剂都用质量分数为0.9%的氯化钠溶液配制,反应温度50℃;检测波长为405nm,每间隔30s读一次蛋白od值,连续测定至所有反应均到达平台期(60min左右)。注:所有反应试剂在开始反应前需先于50℃下水浴20min后10000×g离心10min。
进一步的,以trolox为阳性抗氧化剂,牛血红蛋白为色素蛋白、aaph为自由基引发剂的反应体系:trolox的浓度在0.004-0.024mm之间时,trolox组与对照组积分面积差值(auctrolox-auccontrol)成良好的线性关系,y=221.08x+0.28,r2=0.994。
进一步的,所述的测定方法,以植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy以及合成多肽fcvlrp为待测抗氧化剂,牛血红蛋白为色素蛋白、aaph为自由基引发剂的反应体系包括:100μl终浓度为0.15mg/ml的牛血红蛋白,80μl终浓度为40mm的aaph和不同浓度的待测抗氧化剂,反应总体积200μl。反应试剂都用质量分数为0.9%的氯化钠溶液配制,反应温度50℃;检测波长为405nm,每间隔30s读一次蛋白od值,连续测定至所有反应均到达平台期(60min左右)。注:所有反应试剂在开始反应前需先于50℃下水浴20min后10000×g离心10min。
上述试剂中,aaph需现配现用。酶标仪在开始检测反应前需先预热至反应温度,加入aaph后即刻开始检测。
另:本实验所使用的植物乳杆菌793发酵产物为植物乳杆菌793厌氧发酵后,发酵上清液冻干后所得。植物乳杆菌793由北京化工大学李灏老师惠赠,通过序列鉴定和进化分析,命名为lactobacillusplantarum793(植物乳杆菌793)(genbank登录号:mt116787)。发酵条件:将2ml培养至生长对数期的菌液(od600=1左右)接种于100ml置于100ml的蓝口瓶内的发酵培养基中,37℃培养箱静止培养12h。发酵培养基配方:5%的米糠,0.1%的磷酸氢二钠,0.03%的磷酸二氢钾,0.1%的氯化钙,0.1%的碳酸钠以及超纯水。
藻蓝蛋白酶解产物是pseudoalteromonassp.js4-1发酵后收集发酵液(即js4-1胞外蛋白酶粗提液),直接酶解藻蓝蛋白粗提取液,酶解产物冻干后所得。菌株js4-1分离自中国南海近海环境,通过序列鉴定和进化分析,命名为pseudoalteromonassp.js4-1(假交替单胞菌js4-1)(genbank登录号:mt116988)。发酵条件:将2ml培养至生长对数期的菌液(od600=0.8左右)接种于50ml置于500ml的锥形瓶内的发酵培养基中,在18℃,200rpm的摇床内发酵5d。发酵培养基配方:2%的玉米粉,2%的豆粕,0.1%的磷酸氢二钠,0.03%的磷酸二氢钾,0.1%的氯化钙,0.1%的碳酸钠以及人工海水。酶解条件:酶与藻蓝蛋白的比例为v:v=1:10,酶解温度为50℃,酶解时间为4h。
鱼胶原酶解产物为pseudoalteromonassp.h2胞外蛋白酶酶解鲑鱼皮肤胶原蛋白所得。(详情见参考文献liud,huangjf,wucl,liucl,huanr,wangm,yintt,yanxt,hehl*,chenll*.purification,characterization,andapplicationforpreparationofantioxidantpeptidesofextracellularproteasefrompseudoalteromonassp.h2.molecules,2019,24(18):3373.)。
合成多肽pmrggyhy、fcvlrp均购于上海强耀生物科技有限公司。
本发明的优点在于:
①使用生物蛋白更能体现生理条件下抗氧化剂的抗氧化性(对生物蛋白的保护效果),化学方法检测出来的有抗氧化活性的抗氧化剂不一定对生物大分子能显现出抗氧化活性或者不能显现出预期的抗氧化活性,本发明能真正检测出对生物蛋白有保护作用的抗氧化剂;
②色素蛋白由于其显色基团的存在所以具有其独特的吸收光谱,除了在280nm处存在蛋白质特征吸收峰以外,还具有其它特征吸收波长,而且该特征吸收波长对于蛋白质的结构变化比280nm更加敏感,如藻蓝蛋白,在可见光区550-650nm波段有较强的吸收,在620nm处有特征吸收峰,可直接利用酶标仪检测其在620nm处的吸光值来对蛋白含量进行定量分析,十分直观且方便;
③色素蛋白的来源十分广泛,例如藻蓝蛋白,在所有的蓝藻和红藻中都有,且在螺旋藻中含量异常丰富;血红蛋白在动物血液中含量十分丰富且易于分离提取。
这几个优势的存在有益于本发明的推广和普及。
附图说明
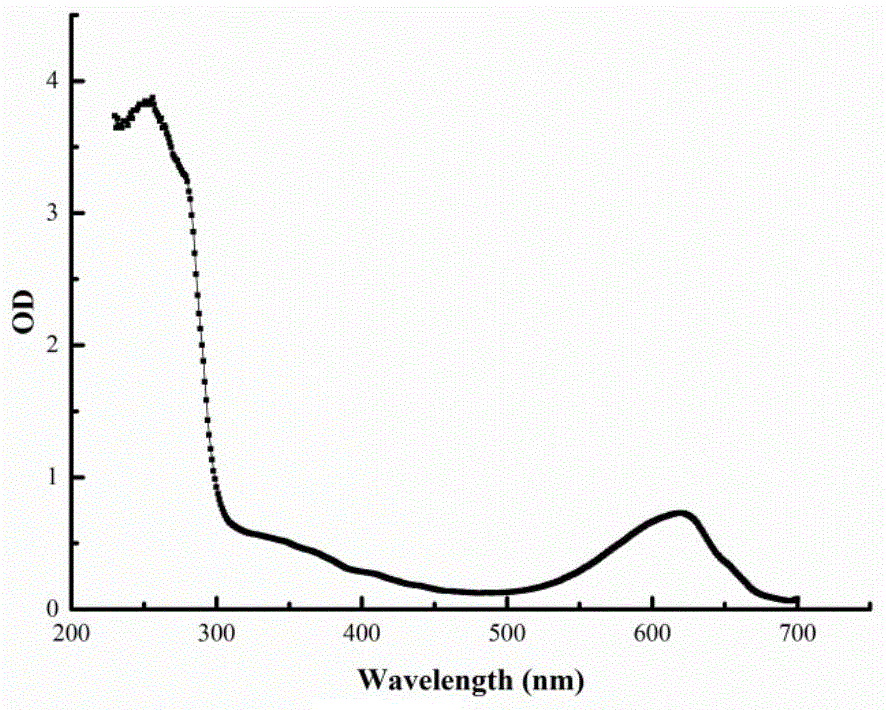
图1是实施例1中藻蓝蛋白全波长吸收光谱图,横坐标是波长(nm),纵坐标是对应波长下藻蓝蛋白的吸光值;特征吸收峰在620nm处。
图2是实施例1中45℃下0.25mg/ml的藻蓝蛋白和不同浓度的aaph混合后od620随时间变化图。
图3是实施例1中加入trolox作抗氧化剂时,0.25mg/ml的藻蓝蛋白、75mm的aaph与不同浓度trolox混合后od620随时间的变化图,未加trolox的组为对照组。
图4是实施例1中不同trolox浓度处理下第90mintrolox组与对照组积分面积差值(auctrolox-auccontrol)的线性拟合曲线;trolox的浓度在0.001-0.004mm之间时,trolox组与对照组积分面积差值(auctrolox-auccontrol)成良好的线性关系,y=1678.34x-0.02,
r2=0.993。
图5是实施例1中加入植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy、flvlrp做抗氧化剂时,与0.25mg/ml的藻蓝蛋白、75mm的aaph混合后od620随时间的变化图,其中trolox组为阳性对照组,未加抗氧化剂组(即加h2o)为对照组。
图6是实施例1中植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy、flvlrp的氧自由基清除(orac)实验,其中trolox组为阳性对照组,未加抗氧化剂组(即加pbs)为对照组;实验温度为45℃,荧光素钠浓度为48nm,aaph浓度为75mm。
图7是实施例2中牛血红蛋白全波长吸收光谱图,横坐标是波长(nm),纵坐标是对应波长下牛血红蛋白的吸光值;其特征吸收峰在405nm处。
图8是实施例2中50℃下0.15mg/ml的牛血红蛋白和不同浓度aaph混合后od405随时间变化图。
图9是实施例2中加入trolox作抗氧化剂时,0.15mg/ml的牛血红蛋白、40mm的aaph与不同浓度trolox混合后od405随时间的变化图。
图10是实施例2中不同trolox浓度处理第60mintrolox组与对照组积分面积差值(auctrolox-auccontrol)的线性拟合曲线;trolox的浓度在0.004-0.024mm之间时,trolox组与对照组积分面积差值(auctrolox-auccontrol)成良好的线性关系,y=221.08x+0.28,r2=0.994。
图11是实施例2中加入植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy、flvlrp做抗氧化剂时,与0.15mg/ml的血红蛋白、40mm的aaph混合后od405随时间的变化图,其中trolox组为阳性对照组,未加抗氧化剂组(即加0.9%nacl)为对照组。
图12是实施例2中植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy、flvlrp的氧自由基清除(orac)实验,其中trolox组为阳性对照组,未加抗氧化剂组(即加pbs)为对照组;实验温度为45℃,荧光素钠浓度为48nm,aaph浓度为40mm。
具体实施方式
下面结合实施例对本发明的技术方案作进一步说明,但本发明所保护范围不限于此。
本发明使用的试剂:牛血红蛋白(worthtington公司),2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2'-azobis-2-methyl-propanimidamide,aaph,aldrich公司),trolox(国产),其他试剂均为普通市售产品。
实施例1:利用藻蓝蛋白的氧化损伤检测抗氧化剂及其抗氧化效力
(1)色素蛋白的提取
使用反复冻融法提取藻蓝蛋白:
a.用分析天平称取1g的螺旋藻粉粉末,用100ml的无菌超纯水溶解;
b.将之放入-20℃冰箱里冷冻至完全结冰状态,然后将之取出放入37℃的恒温水浴锅中融化10min左右;
c.重复步骤b四到五次;
d.使用低温高速离心机,设置转速12000×g,离心20min;
e.取上清,即为藻蓝蛋白溶液(粗提液),放入-20℃冰箱中保存备用。
(2)对藻蓝蛋白进行全波长扫描
取一块洁净的石英板,在对应孔内分别加入200μl的藻蓝蛋白溶液(浓度无特殊要求)。使用酶标仪扫描藻蓝蛋白在波长280-700nm范围内的吸收值,如图1。由图1可知,藻蓝蛋白的特征吸收峰在620nm处。
(3)藻蓝蛋白与aaph反应
反应体系包括:藻蓝蛋白为色素蛋白、aaph为自由基引发剂的反应体系包括:100μl终浓度为0.25mg/ml的藻蓝蛋白和80μl不同浓度的aaph(终浓度已在表1中标注),剩余体积用无菌超纯水补齐,反应总体积200μl。反应试剂都用无菌超纯水配制,现配现用。实验为温度45℃;检测波长为620nm,每间隔30s读一次蛋白od值,连续测定60min。注:所有反应试剂在开始反应前需先于45℃下水浴20min后10000×g离心10min。酶标仪在开始检测反应前需先预热至45℃,加入aaph后即刻开始检测。结果见图2。
具体如下表1:
表1
(4)阳性抗氧化剂trolox与藻蓝蛋白、aaph反应
反应体系包括:100μl终浓度为0.25mg/ml的藻蓝蛋白,80μl终浓度为75mm的aaph和20μl不同浓度的trolox,反应总体积200μl。反应试剂都用无菌超纯水配制,现配现用。实验温度45℃;酶标仪的检测波长为620nm,每间隔30s读一次蛋白od值,每间隔30s读一次蛋白od值,连续测定至所有反应均到达平台期(90min左右)。注:所有反应试剂在开始反应前需先于45℃下水浴20min后10000×g离心10min。酶标仪在开始检测反应前需先预热至45℃,加入aaph后即刻开始检测。
具体如下表2:
表2
从图3可知,trolox浓度越高,对藻蓝蛋白的保护时间越久,效果越强。
如图4,trolox组与对照组(未加trolox组)积分面积差(auctrolox-auccontrol)从trolox浓度0.001mm-0.004mm间呈现良好的线性关系,y=1678.34x-0.02,r2=0.993。
(5)检测未知抗氧化剂及其抗氧化效力
现使用上述方法检测一批活性物质植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy以及合成多肽fcvlrp是否具有抗氧化活性。反应体系包括:100μl终浓度为0.25mg/ml的藻蓝蛋白,80μl终浓度为75mm的aaph和20μl不同浓度的待测活性物质(终浓度已在表3中标注),反应总体积200μl。上述试剂都用无菌超纯水配制,现配现用。实验温度45℃;酶标仪的检测波长为620nm,每间隔30s读一次蛋白od值,连续测定至所有反应均到达平台期(90min左右)。注:所有反应试剂在开始反应前需先于45℃下水浴20min后10000×g离心10min。酶标仪在开始检测反应前需先预热至45℃,加入aaph后即刻开始检测。
具体如下表3:
表3
将orac实验条件(实验方法详见参考文献alberto,d.,carmen,g.c.,&begona,b.(2004).extendingapplicabilityoftheoxygenradicalabsorbancecapacity(orac-fluorescein)assay.journalofagriculturalfoodchemistry,52,48–54.)进行适当调整:实验温度为45℃,荧光素钠浓度为48nm,aaph浓度为75mm。
根据公式(1.1)分别计算其抗氧化能力,结果如图5、图6和表4所示,植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物对藻蓝蛋白只表现出极其微弱的抗氧化能力。合成多肽pmrggyhy和fcvlrp展现出了较强的抗氧化能力,抗氧化能力分别为2.22±0.16mmolte/g和0.14±0.03mmolte/g。氧自由基清除(orac)实验可得,植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy以及合成多肽fcvlrp均具有一定的抗氧化能力,分别为0.16±0.05mmolte/g、0.15±0.03mmolte/g、0.11±0.01mmolte/g、3.40±0.27mmolte/g以及0.28±0.02mmolte/g。综上,我们可以得出:本方法得出的抗氧化能力比orac实验得出的抗氧化能力稍弱,说明化学方法得出的抗氧化能力并不一定能够真实反映对生物大分子展现出来的抗氧化能力;且与orac实验得出的相近的倍数关系能够验证本方法的准确性。例如,本方法得出的合成多肽pmrggyhy的抗氧化能力约为合成多肽fcvlrp的16倍,而orac方法得出的约为17倍。
表4藻蓝蛋白方法与orac方法抗氧化能力比较
实施例2:利用牛血红蛋白检测自由基造成的氧化损伤
(1)对血红蛋白进行全波长扫描
各操作步骤同实施例1,所不同的是牛血红蛋白的特征吸收峰在405nm处,如图7。
(2)牛血红蛋白与aaph反应
牛血红蛋白和aaph反应的反应体系包括:100μl终浓度为0.15mg/ml的牛血红蛋白和80μl不同浓度的aaph(终浓度已在表5中标注),反应总体积200μl,体系内剩余量用质量分数为0.9%的氯化钠溶液补齐。上述试剂都用质量分数为0.9%的氯化钠溶液配制,现配现用。实验温度50℃,酶标仪的检测波长为405nm,每间隔30s读一次蛋白od值,连续测定60min。注:所有反应试剂在开始反应前需先于50℃下水浴20min后10000×g离心10min。酶标仪在开始检测反应前需先预热至50℃,加入aaph后即刻开始检测。结果见图8。
具体如下表5:
表5
(3)阳性抗氧化剂trolox与牛血红蛋白、aaph反应
使用trolox作为阳性抗氧化剂。trolox与牛血红蛋白、aaph反应体系包括:100μl终浓度为0.15mg/ml的牛血红蛋白,80μl终浓度为40mm的aaph和20μl不同浓度的trolox(终浓度已在表6中标注),反应总体积200μl。上述试剂都用质量分数为0.9%的氯化钠溶液配制,现配现用。实验温度50℃;酶标仪的检测波长为405nm,每间隔30s读一次蛋白od值,连续测定至所有反应均到达平台期(60min左右)。注:所有反应试剂在开始反应前需先于50℃下水浴20min后10000×g离心10min。酶标仪在开始检测反应前需先预热至50℃,加入aaph后即刻开始检测。
具体如下表6:
表6
从图9可知,trolox浓度越高,对牛血红蛋白的保护时间越久,效果越强。
如图10,trolox组与对照组(未加trolox组)积分面积差(auctrolox-auccontrol)从trolox浓度0.004mm-0.024mm间呈现良好的线性关系,y=221.08x+0.28,r2=0.994。
(5)检测未知抗氧化剂及其抗氧化效力
现使用上述方法检测一批活性物质植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy以及合成多肽fcvlrp是否具有抗氧化活性。反应体系包括:100μl终浓度为0.15mg/ml的牛血红蛋白,80μl终浓度为40mm的aaph和20μl不同浓度的待测活性物质(终浓度已在表7中标注),反应总体积200μl。上述试剂都用质量分数为0.9%的氯化钠溶液配制,现配现用。实验温度50℃;酶标仪的检测波长为405nm,每间隔30s读一次蛋白od值,连续测定至所有反应均到达平台期(60min左右)。注:所有反应试剂在开始反应前需先于50℃下水浴20min后10000×g离心10min。酶标仪在开始检测反应前需先预热至50℃,加入aaph后即刻开始检测。
具体如下表7:
表7
根据公式(1.1)分别计算其抗氧化能力。
结果如图11、图12和表8所示,植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物对血红蛋白展现出了一定的抗氧化能力,分别为0.13±0.04mmolte/g、0.12±0.02mmolte/g和0.04±0.003mmolte/g,而对藻蓝蛋白基本不展现;合成多肽pmrggyhy对血红蛋白展现出强抗氧化能力,为2.52±0.12mmolte/g;高浓度的合成多肽fcvlrp对血红蛋白有毒害作用,低浓度的fcvlrp则没有抗氧化能力。orac方法检测出来的植物乳杆菌793发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物、合成多肽pmrggyhy和fcvlrp的抗氧化活性分别为0.17±0.07mmolte/g、0.15±0.09mmolte/g、0.13±0.05mmolte/g、3.67±0.13mmolte/g和0.36±0.04mmolte/g。
表8血红蛋白方法与orac方法抗氧化能力比较
综合上述两个实例,因此我们可以得出:
1.同一抗氧化剂对不同底物分子可能显示不一样抗氧化能力,例如793植物乳杆菌发酵产物、藻蓝蛋白酶解产物、鱼胶原酶解产物对血红蛋白展现出了一定的抗氧化能力,而对藻蓝蛋白基本不展现;合成多肽fcvlrp对藻蓝蛋白展现出了抗氧化能力,而对血红蛋白有毒害作用,因此抗氧化剂发挥抗氧化效果与保护的底物和所处环境有关;因此本方法可以用来筛选对生物大分子有毒害作用的抗氧化肽。
2.本方法得出的抗氧化能力比orac实验得出的能力稍弱,抗氧化剂对化学物质(如荧光素钠)展现出来的抗氧化能力并不一定能对生物大分子展现出来或者不能显现出预期的抗氧化活性,本发明能真正检测出对生物蛋白有保护作用的抗氧化剂;且与orac实验得出的相近的倍数关系能够验证本方法的准确性。
- 还没有人留言评论。精彩留言会获得点赞!