一种用于评价离体血样品质的标志物组合及其应用的制作方法
本发明属于分子生物技术领域,具体地,涉及一种用于评价离体血样品质的标志物组合及其应用。
背景技术:
血液是流动在人的血管和心脏中的一种红色不透明,组成成分复杂的粘稠液体。血液中含种类繁多的蛋白质,可以直接反映病理,生理状态,是各种疾病诊断、生物标志物发现的最有价值的标本。在正常情况下,血液中各种蛋白质含量均受到严格的控制,从而能有效平衡机体的生理功能。当人患有某种疾病时,即失去这种稳态,并且某些蛋白的动态变化与疾病发生和发展密切相关。血液主要由血浆和红细胞组成。血清是指血浆中除去纤维蛋白原和部分凝血因子,但增添了一些由血小板释放的化学物质。血清中含有60~80g/l的蛋白质,大概有10000多种,含量相差108~1012个数量以上,其中大多数为低丰度蛋白。这些低丰度蛋白则是来源于组织蛋白释放、细胞死亡或破坏、肿瘤细胞的异常分泌,与疾病有很大的相关性。因此我们可以通过检测血清中这些蛋白质的变化,对疾病进行早期诊断和治疗后病情的观察。
然而,研究发现,不同的凝集条件、不同的温度和不同的时间均会对血浆或血清样品中蛋白质的稳定性产生影响。yi等利用基质辅助激光解吸电离飞行时间质谱(maldi-tof-ms)技术研究发现,在室温条件下,不同的时间点,血清和血浆中的蛋白均会发生的一定的降解。但在血清或血浆中添加蛋白酶抑制剂可以有效抑制其中蛋白质的降解。baumann等以磁珠富集后的血浆或血清为研究对象,系统研究了3种抗凝剂处理的血浆和不同凝集时间的血清。maldi-tofms结果表明,不同抗凝剂处理血浆和不同血清凝集时间质谱图有显著差异。hsieh等研究了在4℃和室温下血清凝集时间和血浆孵育时间分别为1、12和24h的血清、血浆,结果表明,无论在室温还是4℃,随着血清凝集时间的延长,质谱峰都会发生不同程度的变化,主要集中在相对分子质量小于2500的质谱峰;血浆在室温或4℃随着孵育时间的延长,也得到了与血清相似的结果。研究发现,样品在室温下存放4或6h变化不大;但8h后,特别是24h后,在荷质比小于3000范围内有明显变化,在4℃的结果与室温的结果差异不大,但至48或96h,变化非常显著;长期存放在-20℃、-80℃或液氮中无明显的变化,但反复冻融次数增加却有很大影响。villanueva等的观察显示,反复冻融2次与4次的质谱图有明显变化,这种影响可能是肽聚集或沉淀或表面吸附造成的。综上研究发现表明,血清中蛋白受外部因素影响很大。
由于在血液收集或储存过程中不当操作常引起蛋白发生降解,致使临床检测结果发生偏差,从而影响患者的早期诊断和预后观察。因此急需一种检测血清中蛋白是否发生降解的方法,才能从根本上解决临床血清检测结果准确性的问题。但是,目前并没有很好的方法监测血清中的蛋白是否发生降解或降解的程度。
技术实现要素:
本发明的目的在于提供一种用于评价离体血样品质的标志物组合及其应用,以提高离体血样在临床血检测和基础科研中结果的准确性和可靠性。
根据本发明的一个方面,提供一种用于评价离体血样品质的标志物组合:标志物组合包括随血样离体后在血样中自然分解代谢的血清蛋白,血样选自全血、血浆或血清中的一种。本发明所涉及的“自然分解代谢”指的是,在20–25℃下,针对血样的离体时长对血清蛋白在血样中的浓度进行回归分析,由此获取的回归系数为负值。
优选地,血清蛋白满足:针对血样的离体时长对血清蛋白在血样中的浓度进行回归分析,由此获得的p值不超过0.05。
优选地,标志物组合由血清蛋白组成。
优选地,血清蛋白包括细胞因子、脂肪因子、血管生成因子、生成因子、可溶受体、蛋白酶和凋亡因子中的至少一种。
优选地,血清蛋白选自以下蛋白因子中的至少2种:4-1bb、6ckine、adam8、adam9、afgf、afp、agrp、amica、ang-1、ang-2、angiotensinogen、april、ar、b2m、b7-h1、b7-h3、bfgf、blame、blc、bmp-2、bmp-5、bmp-7、bmp-9、bmpr-ib、b-ngf、btc、ca19-9、ca9、cadherin-11、cadherin-13、cadherin-4、ccl28、cd200、cd229、cd27、cd30、cd48、cd58、cd6、cd84、cd97、ceacam-5、cfxiv、chemerin、ckbeta8-1、clusterin、commonbetachain、ctla4、cxcl16、cystatina、dcr3、desmoglein2、desmoglein-3、dkk-4、dr3、dtk、eda-a2、egfr、eg-vegf、ena-78、endoglin、eotaxin、eotaxin-3、ephb6、epor、esam、fabp2、fgf-17、fgf-19、fgf-21、fgf-4、fgf-6、fgf-7、flrg、follistatin、folr1、fractalkine、furin、galectin-1、galectin-2、galectin-3、galectin-8、gcp-2、g-csfr、gitrl、glypican1、glypican5、gp130、gro、hai-2、hcc-1、hgf、i-309、icos、ifnabr2、igf-2r、il-1f10、il-1f8、il-1r3、il-1r4、il-1r6、il-1rii、il-10ra、il-10rb、il-11、il-12p40、il-17、il-17b、il-17e、il-18、il-18bpa、il-1b、il-2ra、il-2rb、il-2rg、il-21、il-22ralpha1、il-23r、il-24、il-28a、il-29、il-3、il-32alpha、il-33、il-5ra、il-9、integrinalpha5、i-tac、jam-a、jam-b、kallikrein14、kallikrein5、lap(tgfb1)、leptin、lif、light、lox-1、lrp-6、l-selectin、lymphotactin、lyve-1、marapsin、mcp-2、mcp-3、mcp-4、mdm2、mer、midkine、mip-3a、mmp-7、mpif-1、msp、nectin-1、neprilysin、ngfr、nidogen-1、nkp30、notch-1、nse、nt-4、opg、pai-1、pd-1、pecam-1、pentraxin3、persephin、pref-1、prolactin、renin、rgm-b、s100a8、scf、sdf-1a、semaphorin7a、sfrp-3、siglec-10、slam、syndecan-3、taci、teck、testican2、tf、tgfb1、tgfb2、tgfb3、thrombomodulin、thrombospondin-5、tim-3、tlr2、tlr4、trail、trailr1、trailr4、transferrin、troponini、tsh、ulbp-1、ve-cadherin、vegf、vegfr3、wif-1。
优选地,血清蛋白选自蛋白因子中的至少113种。
优选地,血清蛋白由201种蛋白因子组成。
根据本发明的另一个方面,提供上述用于评价离体血样品质的标志物在评判血样中的蛋白质降解程度上的应用。
优选地,血样为血清。
根据本发明的另一个方面,提供一种评判离体血清的蛋白质降解程度的方法,其特征在于,包括以下步骤:s1.分别检测如权利要求6或7标志物组合中的各种血清蛋白在离体血清中的浓度,计算各种血清蛋白的降解率;s2.以降解率<20%的检测对象的数量为x,统计x,若x≥113,则品质评级为合格,若x<113,则品质评级为不合格。
本发明提供的用于评价离体血样品质的标志物组合能够可靠地反映血样的蛋白质降解情况。无论在临床检验及基础研究领域,通过检测这些生物标记物的降解程度,能够评判血样是否发生变质。而以品质可靠性较高的血样作为检测样品是检测结果真实性和可靠性的前提条件。检测结果可以作为选取待测血样以及确定检测时机的重要数据支持,从而,减少临床检测结果发生的偏差,有利于患者的早期诊断和预后观察。
附图说明
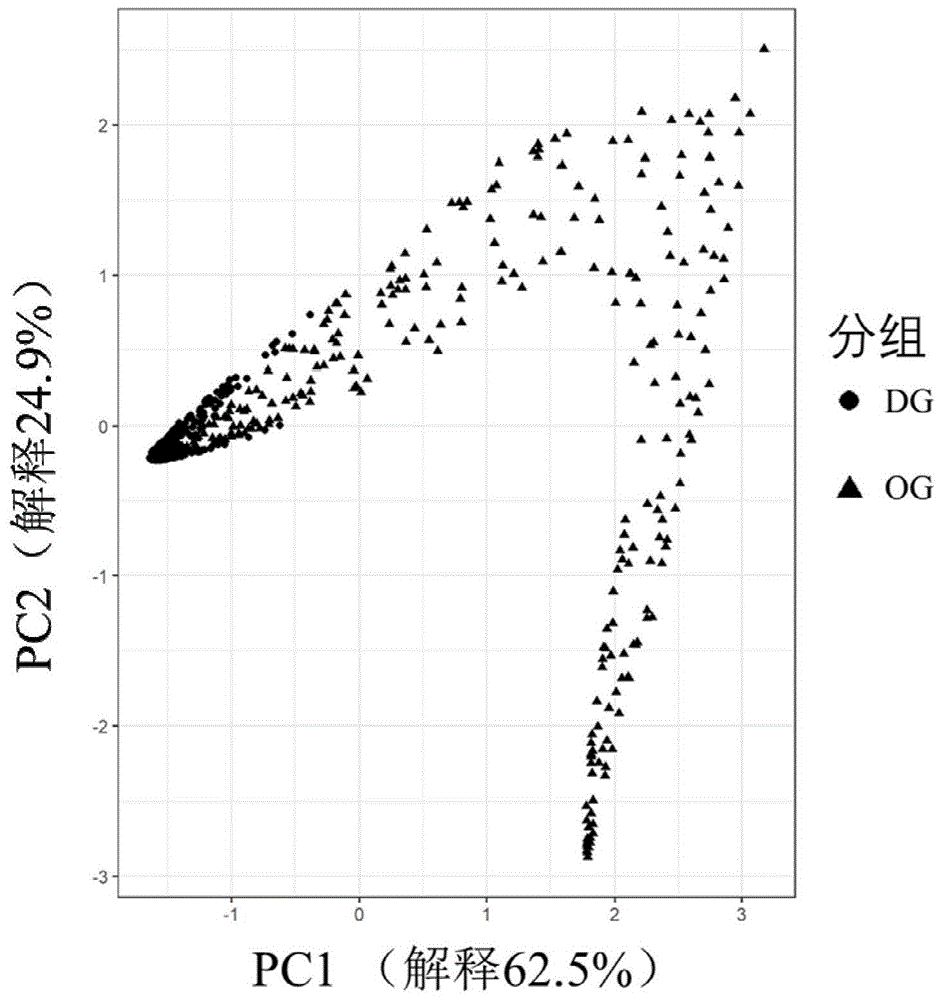
图1为pca分析的统计结果图;
图2为在不同时间点测得dg组蛋白因子的降解率≥20%的统计条形图;
图3为dg组和og组的脂溶性指数测试统计结果图;
图4为dg组和og组的浓度测试统计结果图;
图5为dg组和og组的亲水性系数测试统计结果图;
图6为dg组和og组的稳定指数测试统计结果图;
图7为dg组和og组的分子量测试统计结果图;
图8为dg组和og组的等电点测试统计结果图;
图9为dg组蛋白因子的结构分析结果;
图10为利用go分析得出的dg组蛋白因子的生物学过程分析结果;
图11为利用go分析得出的dg组蛋白因子的分子功能分析结果;
图12为利用go分析得出的dg组蛋白因子的细胞组成分析结果;
图13为dg组蛋白因子的kegg信号通路分析结果图;
图14为dg组蛋白因子的相互作用关系示意图。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。
实施例1
1.实施步骤
(1)首先选取了10例健康人血清(男性和女性各5例样),在恒温22度条件下,分别放置0h、6h、12h、24h、48h后,利用高通量定量抗体芯片qah-cca-480(raybiotech)检测血清中480种蛋白因子表达的变化。
(2)数据整理和分析
高通量抗体芯片得到的数据首先通过内参信号强度来进行归一化处理。进一步通过统计学分析,筛选出能够监测蛋白发生降解的标志物。
(3)生物标志物的验证及应用参数建立
对所得到的标志物进行大样本量的检测,进一步修正和优化标志物组合。同时将检测的数据进行统计学分析,以确立最优化的应用参数。
2.数据分析
随着血清放置时间的延长,目标蛋白在血清中的浓度可能有四种变化规律,分别为浓度降低、浓度相对稳定、浓度增加和浓度变化无规律。进一步采用回归分析的方法对蛋白水平变化的类型进行了划分。具体而言,对各个蛋白在不同时点的数据进行标准化之后,针对放置时长进行回归分析,获取回归系数和p值,其中,p值是回归分析中的拒绝原假设的值,在本实施例中,当p≤0.05,即回归系数显著,即反映的总体回归,拒绝原假设。上述回归分析的结果显示p值≤0.05,且回归系数为负值的蛋白因子共有201个,具体见表1,我们把这组蛋白定义降解组(degradationgroup,dg)即随时间增加蛋白因子在血清中的浓度逐渐降低。剩余蛋白为一组(othersgroup,og)。
表1dg组的蛋白因子
随后以回归系数(r)和p值建立矩阵,进行主成分分析(principalcomponentanalysis,pca)。结果如图1所示:第一主成分(pc1)贡献率为62.5%,表示两组间差异中可以解释全面分析结果的62.5%;第二主成(pc2)贡献率为24.9%,表示两组间差异中可以解释全面分析结果的24.9%;pc1和pc2的总贡献率为87.4%,表示pc1和pc2可以解释全面分析两组间差异的87.4%。pca图中的点与点之间距离越小越相似,反之差异越大,从图中可以看出两组蛋白之间差异明显。
检测dg组的蛋白因子在不同时间点的降解率,统计蛋白质降解率>20%的蛋白因子个数,结果如图2所示,黑色代表dg组中蛋白降解<20%的蛋白因子个数,灰色代表dg组中蛋白降解大于20%的蛋白个数,计算不同时间点dg组中降解率>20%的蛋白因子个数占所有dg组蛋白个数的百分率,结果如表2所示。据报道,血样在室温下存放4小时或6小时变化不大,表2的结果显示,在血样放置时长达到6小时时,dg组蛋白中有89个蛋白因子的降解率大于20%,将这89个蛋白因子标记为易降解蛋白,将dg组中剩余的112个蛋白因子标记为难降解蛋白。若从dg组蛋白中选取一定数量的蛋白因子组成检测血样品质的标志物组合,当标志物组合所包括的蛋白因子种类多于112种,则标志物组合中至少含有1种易降解蛋白。在检测血样的蛋白质降解率时,抽取标志物组合中的n(n≥113)种蛋白因子进行检测,这些被抽中的蛋白因子的组成情况有:(1)112种难降解蛋白+(n-112)种易降解蛋白;(2)(n-89)种难降解蛋白+89种易降解蛋白;(3)m种难降解蛋白+n种易降解蛋白,m和n满足,m>0,n>0,m+n=n。若标志物组合中有至少113种蛋白的降解率小于20%,则证明标志物组合中有至少一种易降解蛋白的降解率小于20%,推定标志物组合中所有的难降解蛋白的降解率皆小于20%,从而得出该血样中的大部分蛋白质还没发生明显降解,血样的品质合格。
表2dg组蛋白因子在不同时间点的降解率统计结果
进一步对dg组蛋白进行理化特性分析,包括脂溶性指数、浓度、亲水性系数、稳定指数、分子量和等电点,分别针对不同的理化特性统计dg组和og组蛋白的分布数量。分析结果如图3–8所示。同时对dg组和og组的蛋白进行卡方检验,结果(表3)显示dg组蛋白因子和og组蛋白因子的分子量有显著差异(p=0.011),其中在og组中分子量大于100kda的蛋白因子的个数是dg组的2.85倍。
表3蛋白因子降解与其理化特性之间的关系
随后对dg组的201个蛋白进行蛋白结构域分析,以及go分析和kegg信号通路分析,相应的分析结果在图9–13中展示。如图9所示,对dg组所有蛋白因子的结构进行分析,结果发现dg组的蛋白因子主要包括免疫球蛋白样折叠、免疫球蛋白样超家族区域、免疫球蛋白区域等。go分析包括对蛋白因子进行生物学过程、分子功能、和细胞组成的分析,具体而言:图10为生物学过程分析,dg组的蛋白因子主要包括受体配体活性、细胞因子活性、细胞因子受体结合等;图11为分子功能分析,dg组的蛋白因子主要参与白细胞迁移、细胞迁移的正调节、外部刺激反应的正向调节等;图12为细胞组成分析,dg组的蛋白因子主要包括质膜外侧、细胞外基质、细胞与细胞之间链接、囊腔等。另外,kegg信号通路分析(图13)表明,dg组的蛋白因子参与的信号通路主要包括细胞因子和其受体之间的相互作用信号通路、pi3k-akt信号通路、jak-stat信号等。通过分析dg组蛋白因子的相互作用,结果如图14所示,这些蛋白因子之间有着复杂的相互作用关系。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对其限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解,技术人员阅读本申请说明书后依然可以对本发明的具体实施方式进行修改或者等同替换,但这些修改或变更均未脱离本发明申请待批权利要求保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!