测量细胞体积和成份的制作方法
本申请是申请日为2012年04月13日,申请号为201710217495.7,发明名称为“测量细胞体积和成份”的中国发明专利申请的分案申请。相关申请的交叉参考本申请根据35u.s.c.§119(e)的规定要求享有以下美国临时专利申请的优先权:61/476,170,2011年4月15日申请;61/476,179,2011年4月15日申请;61/510,614,2011年7月22日的申请;61/510,710,2011年7月22日申请;和61/589,672,2012年1月23日申请。前述申请的全部内容引入本文作为参考。本公开涉及测量血细胞的体积和成份,所述血细胞包括但不限于红细胞、血小板和白细胞。
背景技术:
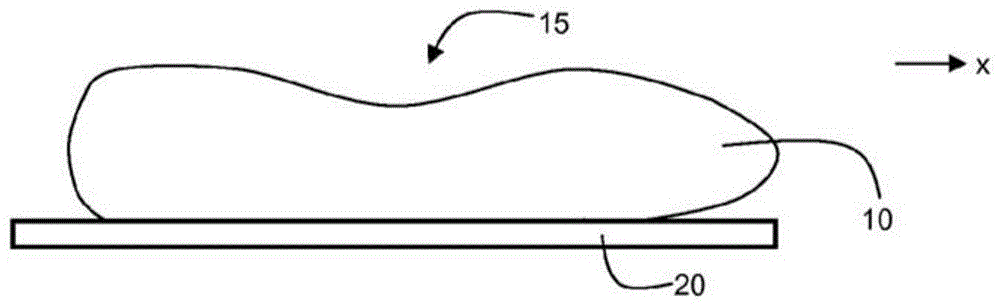
:血细胞如红细胞(rbcs)或血小板的体积是可以用来确定其他生理和治疗相关量的重要度量。例如,患者红细胞的平均细胞体积测量可以用来评估患者是否患有贫血。血细胞成份的测量是可以用于多种诊断目的的另一重要度量。例如,患者红细胞的平均细胞血红蛋白含量也可以用来评估患者是否患有贫血。这种细胞体积和成份如血红蛋白的相关量然后可以用于多种诊断目的,包括鉴定患者中存在的病况以及评价可能采取的治疗过程。技术实现要素:一般而言,在第一方面中,本公开涉及确定红细胞的血红蛋白含量值,该方法包括:(a)使用在多个照射波长上的入射光照射细胞;(b)对应于每个照射波长获得该细胞的至少一个二维图像;(c)对于每个照射波长,确定细胞的平均光密度和最大光密度;(d)确定细胞面积;(e)对于每个照射波长,基于该细胞对应于该照射波长的平均光密度和最大光密度和细胞面积确定该细胞的体积;(f)对于每个照射波长,基于该细胞对应于该照射波长的平均光密度和细胞面积确定该细胞的积分光密度;和(g)基于该细胞对应于照射波长中每一个的体积,该细胞对应于照射波长中每一个的积分光密度,和细胞面积的加权组合确定该细胞的血红蛋白含量值。在另一方面中,本公开涉及确定血小板体积的方法,该方法包括:(a)使用在多个照射波长上的入射光照射血小板;(b)对应于每一个照射波长获得该血小板的至少一个二维图像;(c)对应于每个照射波长,确定血小板的平均光密度和最大光密度;(d)确定血小板的面积;(e)对于每个照射波长,基于该血小板对应于照射波长的平均光密度和最大光密度和血小板的面积确定血小板的体积;(f)对于每个照射波长,基于该血小板对应于该照射波长的平均光密度和血小板的面积确定该血小板的积分光密度;和(g)基于该血小板对应于照射波长中每一个的体积,该血小板对应于照射波长中每一个的积分光密度,和血小板的面积的加权组合确定该血小板的体积。在再一方面中,本公开涉及确定细胞体积的方法,该方法包括:(a)使用在多个照射波长上的入射光照射细胞;(b)对应于每个照射波长获得该细胞的至少一个二维图像;(c)对于每个照射波长,确定细胞的平均光密度和最大光密度;(d)确定细胞面积;(e)对于每个照射波长,基于该细胞对应于该照射波长的平均光密度和最大光密度和细胞面积确定该细胞的体积;(f)对于每个照射波长,基于该细胞对应于该照射波长的平均光密度和细胞面积确定该细胞的积分光密度;和(g)基于该细胞对应于照射波长中每一个的体积,该细胞对应于照射波长中每一个的积分光密度,和细胞面积的加权组合确定该细胞的体积。在另一方面中,本公开涉及用于确定红细胞的血红蛋白含量值的系统,该系统包括:照射源,其配置为使用在多个照射波长上的入射光照射细胞,检测器,其配置为对应于每一个照射波长获得该细胞的至少一个二维图像,以及电子处理器,其配置为:(a)确定该细胞在每个照射波长上的平均光密度和最大光密度;(b)确定该细胞的面积;(c)对于每个照射波长,基于该细胞对应于该照射波长的平均光密度和最大光密度和细胞面积确定该细胞的体积;(d)对于每个照射波长,基于该细胞对应于该照射波长的平均光密度和细胞面积确定该细胞的积分光密度;和(e)基于该细胞对应于照射波长中每一个的体积,该细胞对应于照射波长中每一个的积分光密度,和细胞面积的加权组合确定该细胞的血红蛋白含量值。在再一方面中,本公开涉及用于确定血小板体积的系统,该系统包括:照射源,其配置为使用在多个照射波长上的入射光照射血小板,检测器,其配置为对应于每一个照射波长获得该血小板的至少一个二维图像,以及电子处理器,其配置为:(a)在每一个照射波长上确定该血小板的平均光密度和最大光密度;(b)确定该血小板的面积;(c)对于每个照射波长,基于该血小板对应于照射波长的平均光密度和最大光密度和血小板的面积确定该血小板的体积;(d)对于每个照射波长,基于该血小板对应于该照射波长的平均光密度和血小板的面积确定该血小板的积分光密度;和(e)基于该血小板对应于照射波长中每一个的体积,该血小板对应于照射波长中每一个的积分光密度,和血小板面积的加权组合确定该血小板的体积。在另一方面中,本公开涉及用于确定细胞体积的系统,该系统包括:照射源,其配置为使用在多个照射波长上的入射光照射细胞,检测器,其配置为对应于每一个照射波长获得该细胞的至少一个二维图像,以及电子处理器,其配置为:(a)确定该细胞在每个照射波长上的平均光密度和最大光密度;(b)确定细胞面积;(c)对于每个照射波长,基于该细胞对应于该照射波长的平均光密度和最大光密度和细胞面积确定该细胞的体积;(d)对于每个照射波长,基于该细胞对应于该照射波长的平均光密度和细胞面积确定该细胞的积分光密度;和(e)基于该细胞对应于照射波长中每一个的体积,该细胞对应于照射波长中每一个的积分光密度,和细胞面积的加权组合确定该细胞的体积。在再一方面中,本公开涉及用于确定血样的平均细胞体积的方法,该方法包括:使用在多个照射波长上的入射光照射样品,并且获得该样品在所述多个照射波长中每一个上的二维图像;鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,确定对应于所述多个照射波长中每一个的积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞体积;和由所述多个细胞中每一个的细胞体积确定血样的平均细胞体积。在另一方面中,本公开涉及用于确定血样平均血小板体积的方法,该方法包括:使用在多个照射波长上的入射光照射样品,并且获得该样品在所述多个照射波长中每一个上的二维图像;鉴定在每一个图像中出现的多个血小板;对于所述多个血小板中的每一个,确定对应于所述多个照射波长中每一个的积分光密度;对于所述多个血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定血小板体积;和对于所述多个细胞中的每一个,由细胞体积确定该血样的平均血小板体积。在再一方面中,本公开涉及用于确定血样的平均细胞血红蛋白值的方法,该方法包括:使用在多个照射波长上的入射光照射样品,并且获得该样品在所述多个照射波长中每一个上的二维图像;鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,确定对应于所述多个照射波长中每一个的积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞血红蛋白值;和由所述多个细胞中的每一个的血红蛋白值确定该血样的平均细胞血红蛋白值。在另一方面中,本公开涉及用于确定血样的平均细胞体积的系统,该系统包括:照射源,其配置为将多个照射波长上的入射光导向该样品,检测器,其配置为获得该样品在所述多个照射波长中每一个上的二维图像,以及电子处理器,其配置为:鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞体积;和由所述多个细胞中的每一个的细胞体积确定血样的平均细胞体积。在再一方面中,本公开涉及用于确定血样的平均血小板体积的系统,该系统包括:照射源,其配置为将多个照射波长上的入射光导向该样品,检测器,其配置为获得该样品在所述多个照射波长中每一个上的二维图像,以及电子处理器,其配置为:鉴定在每一个图像中出现的多个血小板;对于所述多个血小板中的每一个,对应于所述多个照射波长中每一个确定积分光密度;对于所述多个血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定血小板体积;和由所述多个细胞中的每一个的血小板体积确定该血样的平均血小板体积。在另一方面中,本公开涉及用于确定血样的平均细胞血红蛋白值的系统,该系统包括:照射源,其配置为将多个照射波长上的入射光导向该样品,检测器,其配置为获得该样品在所述多个照射波长中每一个上的二维图像,以及电子处理器,其配置为:鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞血红蛋白值;和由所述多个细胞中的每一个的细胞体积确定该血样的平均细胞血红蛋白值。在再一方面中,本公开涉及计算机可读的存储装置,其具有编码在其上的计算机可读指令,该指令当由处理器执行时,导致该处理器:接收多个血样图像,所述多个图像中的每一个对应于入射在所述样品上的照射光的不同波长;鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞体积;和由所述多个细胞中的每一个的细胞体积确定血样的平均细胞体积。在另一方面中,本公开涉及计算机可读的存储装置,其具有编码在其上的计算机可读指令,该指令当由处理器执行时,导致该处理器:接收多个血样图像,所述多个图像中的每一个对应于入射在所述样品上的照射光的不同波长;鉴定在每个图像中出现的多个血小板;对于所述多个血小板中的每一个,对应于所述多个照射波长中每一个确定积分光密度;对于所述多个血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定血小板体积;和由所述多个细胞中的每一个的细胞体积确定所述血样的平均血小板体积。在再一方面中,本公开涉及计算机可读的存储装置,其具有编码在其上的计算机可读指令,该指令当由处理器执行时,导致该处理器:接收多个血样图像,所述多个图像中的每一个对应于入射在所述样品上的照射光的不同波长;鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞血红蛋白值;和由所述多个细胞中的每一个的细胞体积确定所述血样的平均细胞血红蛋白值。所述方法、系统和装置的实施方案可以包括任意一个或多个以下特征。所述方法可以包括对于来自血样的多个红细胞重复步骤(a)至(g)来确定所述多个红细胞中每一个的血红蛋白含量值,以及由所述多个红细胞中每一个的血红蛋白含量值确定所述样品的平均细胞血红蛋白值。所述方法可以包括鉴定在所述细胞的每一个图像中鉴定对应于所述细胞的第一组像素。所述方法可以包括在每一个图像中通过从所述第一组像素中去除对应于所述细胞周长区的像素来鉴定对应于所述细胞的第二组像素。所述方法可以包括基于第一组像素确定所述细胞面积。所述方法可以包括基于第一组像素确定所述细胞的周长,以及如果周长的平方对面积的比率超过阈值,那么从所述确定平均细胞血红蛋白值中排除所述细胞。所述方法可以包括确定所述细胞的凸包,确定由该凸包包围的面积,以及如果由该凸包包围的面积对所述细胞面积的比率超过阈值,那么从所述确定平均细胞血红蛋白值中排除所述细胞。所述方法可以包括如果所述细胞面积在选定的面积范围之外,那么从所述确定平均细胞血红蛋白值中排除所述细胞。所述方法可以包括基于对应于每个照射波长的平均光密度对最大光密度的比率确定在所述照射波长上的细胞体积。所述方法可以包括基于在每个照射波长上的平均光密度对最大光密度与校正因子之和的比率确定在所述照射波长上的细胞体积。所述方法可以包括将补偿值添加至所述平均光密度对最大光密度与校正因子之和的比率来确定所述细胞在每个照射波长上的体积。所述方法可以包括由参考组血样确定校正因子的值和补偿值。所述多个照射波长可以包括至少三个照射波长。所述多个照射波长可以包括至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。所述多个照射波长可以包括至少四个波长。所述多个照射波长可以包括至少一个在620nm~750nm之间的波长、至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。评估自动化血液分析装置的操作条件可以包括操作所述装置使得该装置使用本文中披露的方法来确定对照组合物的血红蛋白值,以及比较所述对照组合物的平均细胞血红蛋白的参考值与所述平均细胞血红蛋白的经确定的值来评估所述装置的操作条件。评估所述装置的操作条件可以包括确定所述对照组合物的平均细胞血红蛋白的经确定的值和参考值之间的差值,如果所述差值超过阈值,那么重新校准所述装置。重新校准所述装置可以包括由参考组血样确定多个加权系数,所述加权系数用来基于该细胞对应于照射波长中每一个的体积,该细胞对应于照射波长中每一个的积分光密度,和细胞面积来确定所述细胞的血红蛋白含量值。电子处理器可被配置为对于来自血样的多个红细胞重复步骤(a)至(e)来确定所述多个红细胞中每一个的血红蛋白含量值,并且由所述多个红细胞中的每一个的血红蛋白含量值来确定所述样品的平均细胞血红蛋白值。所述系统可以包括自动化血样制备系统。所述方法可以包括对于来自血样的多个血小板或细胞重复步骤(a)至(g)来确定所述多个血小板或细胞中每一个的体积,并且由所述多个血小板中每一个的体积来确定所述样品的平均血小板体积或平均细胞体积。所述方法可以包括在所述血小板或细胞的每一个图像中鉴定对应于所述血小板或细胞的像素组。鉴定所述像素组可以包括鉴定对应于所述血小板的中心区的第一组像素,鉴定对应于所述血小板非中心区的第二组像素,并且合并所述第一组像素和所述第二组像素以形成对应于所述血小板的像素组。所述方法可以包括基于在对应于不同照射波长的至少两个图像中的像素组每个成员的强度值鉴定所述第二像素组。所述多个照射波长可以包括在电磁谱的蓝色区中的照射波长和在电磁谱的黄色区中的照射波长,以及所述方法可以包括获得所述血小板对应于蓝色区中的照射波长的图像以及所述血小板对应黄色区中的照射波长的图像。所述方法可以包括如果所述血小板在对应于所述黄色区中的照射波长的图像中的积分光密度大于600,那么从所述确定平均血小板体积中排除所述血小板。所述方法可以包括如果所述血小板在对应于所述蓝色区中的照射波长的图像中的积分光密度大于200,那么从所述确定平均血小板体积中排除所述血小板。所述方法可以包括基于像素组确定所述血小板或细胞的面积。所述方法可以包括基于对应于每一个照射波长的平均光密度对最大光密度的比率确定所述血小板或细胞在所述照射波长上的体积。所述方法可以包括基于在每一个照射波长的平均光密度对最大光密度与校正因子之和的比率确定所述血小板或细胞在所述照射波长上的体积。所述方法可以包括将补偿值添加至所述平均光密度对最大光密度与校正因子之和的比率来确定所述血小板或细胞在每个照射波长上的体积。评估自动化血液分析装置的操作条件可以包括操作所述装置使得所述装置使用本文记载的方法来确定对照组合物的平均血小板体积或平均细胞体积,并且比较所述对照组合物的所述平均血小板体积或平均细胞体积的参考值与所述平均血小板体积或平均细胞体积的经确定的值来评估所述装置的操作条件。评估所述装置的操作条件可以包括确定所述对照组合物的所述平均血小板体积或平均细胞体积的经确定的值和参考值之间的差值,并且如果所述差值超过阈值,那么重新校准所述装置。重新校准所述装置可以包括由参考组血样来确定多个加权系数,所述加权系数用来基于所述所述血小板或细胞对应于所述照射波长中每一个的体积,所述血小板或细胞对应于所述照射波长中每一个的积分光密度,和所述血小板或细胞的面积来确定所述血小板的体积或所述细胞的体积。电子处理器可被配置为对于来自血样的多个血小板或细胞重复步骤(a)至(e)来确定所述多个血小板或细胞中每一个的体积,并且由所述多个血小板或细胞中每一个的体积来确定所述样品的平均血小板体积或平均细胞体积。该方法可以包括:对于所述多个细胞或血小板中的每一个,确定对应于所述多个照射波长中每一个的体积;和对于所述多个细胞或血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和体积确定细胞或血小板的体积。该方法可以包括:对于所述多个细胞或血小板中的每一个,确定细胞或血小板的面积;和对于所述多个细胞或血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和细胞或血小板的面积确定该细胞或血小板的体积。该方法可以包括:对于所述多个细胞或血小板中的每一个,确定细胞或血小板的面积;和对于所述多个细胞或血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度,体积,和细胞或血小板的面积确定该细胞或血小板的体积。每个两维图像可以对应于由样品反射或透射的入射光。细胞的周长区可以具有0.5微米或更大的厚度。该方法可以包括:对于所述多个细胞或血小板中的每一个,确定所述细胞或血小板的凸包,确定由该凸包包围的面积,并且如果所述由该凸包包围的面积与细胞或血小板的面积的比率超过阈值,那么从所述确定平均细胞体积或平均血小板体积中排除所述细胞或血小板。该方法可以包括:对于所述多个细胞或血小板中的每一个,如果所述细胞或血小板的面积在选定的面积范围之外,那么从所述确定平均细胞或血小板体积中排除所述细胞或血小板。对于所述多个细胞或血小板中的每一个,对应于所述多个照射波长中每一个确定所述积分光密度可以包括确定细胞或血小板的面积,对于所述多个照射波长中每一个基于所述图像中对应的一个图像确定所述细胞或血小板的平均光密度,并且基于所述细胞或血小板的面积和所述细胞或血小板对应于所述波长的平均光密度确定对应于每一个波长的积分光密度。对于所述多个细胞或血小板中的每一个,对应于所述多个照射波长中每一个确定体积可以包括:对于所述多个照射波长中每一个,确定细胞或血小板的平均光密度和最大光密度;和对于所述多个照射波长中每一个,基于对应于所述波长的平均光密度对最大光密度的比率确定所述细胞或血小板的体积。对于所述多个细胞或血小板中的每一个,确定对应于所述多个照射波长中每一个的体积可以包括:对于所述多个照射波长中每一个,确定细胞或血小板的平均光密度和最大光密度;和对于所述多个照射波长中每一个,基于平均光密度对对应于波长的最大光密度与在该波长上的校正因子之和的比率确定所述细胞或血小板的体积。所述方法可以包括将补偿值添加至所述平均光密度对最大光密度与校正因子之和的比率来确定所述细胞或血小板在每个照射波长上的体积。对于所述多个细胞或血小板中的每一个,所述细胞或血小板的体积可以基于对应于所述多个照射波长中每一个的积分光密度的加权线性组合来确定。对于所述多个细胞或血小板中的每一个,所述细胞或血小板的体积可以基于对应于所述多个照射波长中每一个的积分光密度和体积的加权线性组合来确定。对于所述多个细胞或血小板中的每一个,所述细胞或血小板的体积可以基于对应于所述多个照射波长中每一个的积分光密度和体积和面积的加权线性组合来确定。所述方法可以包括由参考组血样来确定加权线性组合的加权系数。重新校准所述装置可以包括由参考组血样来确定多个加权系数,所述加权系数用来基于对应于所述多个照射波长中每一个的积分光密度来确定所述细胞或血小板的体积。电子处理器可被配置为:对于所述多个细胞或血小板中的每一个,确定对应于所述多个照射波长中每一个的体积;和对于所述多个细胞或血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和体积来确定所述细胞或血小板的体积。所述电子处理器可被配置为:对于所述多个细胞或血小板中的每一个,确定细胞或血小板的面积;和对于所述多个细胞或血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和面积确定所述细胞或血小板的体积。所述电子处理器可被配置为:对于所述多个细胞或血小板中的每一个,确定细胞面积;和对于所述多个细胞或血小板中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和体积和面积确定所述细胞或血小板的体积。适当时,方法、系统和装置的各实施方案还可以包括在本文中披露的其他特征和步骤。尽管描述了各特征和各实施方案的具体组合,但是在本文中披露的任何特征可以与在本文中披露的各方法、各系统和各装置中的其它任何特征进行组合和亚组合,除非明确排除。因此,应当可以理解在本文中披露的各方法、系统和装置的实施方案可以包括与本文中披露的任何实施方案相关而描述的任何特征的组合。此外,本文中披露的各方法、系统和装置的实施方案可以包括本文中披露的特征与在美国临时专利申请61/476,170;61/476,179;61/510,614;61/510,710;和61/589,672中的任何实施方案中的任何特征的组合。除非另行定义,所有在本文中使用的科技术语具有本公开所属领域的普通技术人员通常理解的相同含义。尽管在实践或测试中可以使用与本文中披露的方法或材料类似或等同的方法或材料,但是下文中描述了合适的方法或材料。在本文中提到的所有公开、专利申请或其它文献均通过提述并入本文。若存在矛盾,以本发明(包括定义)为准。此外,所述材料、方法和实施例仅为说明性的,并不旨在限制。一个或多个实施方案的细节在所附附图以及下文的说明中给出。其它特征和优点根据说明书、附图和权利要求书中是显而易见的。附图说明图1a为定位在基底上的红细胞的示意图。图1b为透射光强度作为图1a中细胞位置的函数的示意性曲线。图2为用于测量生物样品中细胞的体积和成份的系统的示意图。图3a为显示用于在生物样品中确定细胞的细胞度量的一系列步骤的示意图。图3b为从生物样品的一个或多个图像选择代表性细胞组的一系列步骤的示意图。图4为显示细胞边界的细胞的示意图。图5为显示对于每个细胞所确定的两个细胞和凸包的示意图。图6为显示在细胞图像中光密度变化的细胞的示意图像。图7为血样的示意图。图8为在将阈值条件应用至图像后图7血样的示意图。图9a和9b为血样的图像。图10为自动化样品处理系统的示意图。图11为用于测量细胞的体积和成份的计算系统的示意图。在各附图中的类似参考符号表示类似要素。具体实施方式人工分析血样–其通常涉及在玻璃片上制备血涂片并且然后在显微镜下评估该涂片–具有大量的缺点,使得此类方法不适合用于高通量环境。人技术人员制备血涂片的易造成非系统性错误,特别是血液在整个涂片上的不均匀分布。经常地,这种涂片的一些区比其它区更厚,造成通过用户进行准确定量分析的困难,除非可以接受显著的妥协(例如,仅检查整个涂片的小区,该区就尺寸和位置而言通常在各涂片之间存在不同)。此外,当将染色剂施用至血样,染色方案在样品之间的差异会由于人的错误而产生。这些差异可以,接着引起取自样品的定量测量的差异,其不必然对应于样品中细胞成份数量中的潜在差异。此外,人技术人员制备单个血涂片是一个耗时过程,并且会导致使用大量的制备性溶液(例如,染色剂,漂洗液,缓冲液,固定剂)。这些溶液的消耗会耗费成本。此外,产生大体积的这些溶液也增加了与处置废溶液体积相关的困难和成本。目前的自动化样品制备系统可以显著降低与人工制备方法相关的非系统性错误。但是差异仍然存在于使用这些系统制备的样品中。例如,对于在载玻片上制备的血样,自动化染色器会对整个样品不均匀地染色;取决于样品厚度、样品干燥时间以及其它与样品制备和染色过程相关的变量,样品可在细胞中显示出不同水平的染色浓度。本文中披露了用于在制备的生物样品的细胞中自动化测量单个细胞的体积和细胞成份的浓度的方法和系统。本方法和系统可以用在经培训的人操作员手工制备的样品上。此外,本方法和系统可以用来分析在自动化系统中制备的样品。以此方式,在本文中披露的方法和系统允许高通量、完全自动化地分析各种从患者提取的生物样品。举例来说,本公开描述了在取自人患者的血样中测量单个红细胞的体积和确定其血红蛋白含量的方法。然而,本公开并不限于这些应用。具体地,本文中披露的方法和系统可以用来以自动化方式测量多种不同类型的细胞包括血小板的体积。此外,其他细胞成份如血红蛋白之外的蛋白质可以使用本文中披露的方法和体系测量。此外,待分析的样品没有必要来自人患者;本文中披露的方法和系统还可以用在来自动物的样品上,或者用在设计用来模拟全血的组合物上以控制、计算和证实得自自动化血液学系统的结果的线性的组合物上。下面将更详细地描述用于测量来自制备的生物样品的细胞体积和细胞成份的自动化系统。一旦样品制备好,就将其输送至自动化测量系统。该测量系统获得样品中的细胞的一张或多张二维图像,并使用这些图像来确定样品中细胞的体积和血红蛋白,以及其他数量。细胞的体积和血红蛋白含量由衍生自细胞图像的信息来确定,该细胞图像通过将入射光导向细胞,然后检测该入射光透射细胞或从细胞反射的部分来获得。每个图像都为二维图像,其中图像内的单个像素的强度值对应于出现自对应于像素的细胞的空间位置的透射光或反射光的量。一般性考虑任何细胞如红细胞或血小板的体积是三维数量。基于衍生自细胞二维图像的信息来确定细胞体积是在本文中要解决的一个挑战。由二维图像获得细胞体积的量度涉及估计细胞在横切图像二维平面(来自衍生自图像的信息)的方向上的形状。如果所有细胞都为相同的形状,确定体积会为相对直接的:任何这种细胞的体积会与细胞横切面面积(其可以由二维图像获得)的3/2次方成比例。然而,细胞的形状不是均匀的,因此上述假设不是在所有情况中都可靠的,或者对于治疗目的不是足够准确的。作为一个实例,红细胞通常显示多种形状:一些为近似球形,而另一些具有接近环形(toroidal)的形状。此外,红细胞具有深度可变的中心凹入。这些细胞的图像描绘了透射光强度相对较弱的边缘区,和称为“中心苍白区”的光透射增加的中心区。图1a为显示定位在基底20上的红细胞10的示意图。细胞10沿着x方向的厚度在差异;厚度在接近细胞边缘处最大,在细胞的中心区15中减少。图1b为透射光强度作为来自细胞10的透射光分布中沿特定横截面位置的x方向的位置的函数的示意性曲线。图1b中显示的强度分布包括在细胞中心苍白区中的局部强度最大值25,和对应于细胞边缘较低光透射的局部强度最小值27和28。甚至未染色的红细胞也会显示出图1b中所示的现象,因为这些细胞含有吸收蓝光的血红蛋白。细胞10通常通过将一种或多种染色剂施用到细胞来制备(作为样品的一部分)以得到图1b所示的强度分布。染色剂结合至细胞的细胞质,并且在细胞图像中用作细胞质的标志物。当以入射光照射细胞时,染色剂吸收一部分入射光;在样品中特定位置的吸收量取决于该位置处存在的染色剂量。如果假定所施用的染色剂以均匀的方式结合至所有细胞质,那么在在给定图像像素处的透射光强度应当与细胞质在该细胞内相应位置处的厚度成比例。因此,与细胞体积成比例的数量可以通过将对在图像内对应于特定细胞的所有像素的透射光强度的贡献进行加和而得到。然而,实际上,所制备的血细胞的样品在所施用的染色剂均匀结合至所有细胞质的程度上显示出差异。然而,透射光在各个像素位置处的量也取决于各种样品成份如红细胞中的血红蛋白在细胞中各处存在的量。而且,染色剂在不同空间位置之间的分布也影响所测量透射光在给定细胞或血液成份的每个像素位置处的量。根据这些考虑,本文中披露的方法和系统适于基于衍生自二维细胞图像的信息确定细胞体积,即从细胞成份(例如,血红蛋白)和各种施用的染色剂的局部差异浓度的吸收效果中去除(decoupling)细胞厚度的估计值。为了实施这种去除,像素强度由每个细胞的最大像素强度进行换算。如下文进一步描述的,细胞体积计算基于用来获取细胞图像的照射的每个颜色的光密度值与细胞面积的加权组合。本文描述的方法可以重复用于为体积测量选用的细胞组的每个成员,以及每个细胞的结果可以用来计算样品的平均细胞体积。细胞成份的浓度,如红细胞的血红蛋白含量,也可以基于用来获取细胞图像的照射的每个颜色的光密度值的计算来确定,如下文将进一步描述的,以下公开也涵盖用于自动化测量来自制备的生物样品的一种或多种成份的方法和系统。举例来说,本公开关注测量取自人患者的血样中的红细胞的血红蛋白。然而,应当理解的是本公开并不局限于这些应用。具体地,本文中披露的方法和系统可以用来以自动化方式测量各种不同类型的细胞中的各种不同成份。此外,细胞样品没有必要取自人患者;本文中披露的方法和系统还可以用在取自动物的样品上,或用来模拟全血而制造的组合物上,其通常用来验证自动化测量系统的性能。常规自动化测量系统,如流式细胞仪,通常通过裂解红细胞和测量溶液中裂解样品吸光度来确定细胞血红蛋白含量,或者通过测量流动流中的单个红细胞的散射光。本文中披露的方法和系统无需裂解血样或流动小室中的任何成份就能实施。相反,细胞成份如血红蛋白可以由沉积在载玻片上的样品的二维图像来测量,其保存细胞的天然形态以供其他测量和分类。用来利用本文描述的自动化方法和系统的样品制备方法通常涉及将多个染色剂施用到样品上。所施用的染色剂差异性地结合至样品内不同化学和/或结构实体,允许选择性分析不同样品特征(例如,一些染色剂择优地结合至血细胞核,而其他结合至细胞膜,并且再其他可以择优地结合至一些细胞质内的成份)。接着,所施用的染色剂使得自动化系统能够在样品上进行多个测量,例如鉴定和计数红细胞、白细胞和血小板,并且进行五部分白细胞区分。然而,由于在样品中存在的多个染色剂,对样品进行的光谱测量可预见地遭受由各种染色剂产生的干扰作用。例如,在给出的测量波长上,多个染色剂可以为入射光的显著的吸收剂。本文中披露的方法和系统导致多个光谱贡献者(例如,吸收性染色剂和/或细胞成份)在样品内的存在,并且基于在多个波长上测量的信息确定在细胞中的一个或多个贡献者的量。血红蛋白在红细胞中的量是受关注的量,因为细胞血红蛋白含量可以用来计算样品的多个与血液相关的量(例如,平均细胞血红蛋白浓度,红细胞压积(hematocrit)),其由医师为了诊断目的而使用。血红蛋白在电磁谱的一些区中比其他区中更强烈地吸收入射光,并且因此具有特征性光谱指纹(signature)。当将一个或多个染色剂施用至样品时,该染色剂也具有特征性光谱指纹,并且在一些波长处比其他处更强烈地吸收入射光。在许多应用中,关注的分析物如血红蛋白和一种或多种施用的染色剂可以在特定波长处具有不可忽略的吸光度。在这样的应用中,入射光在特定波长处透射的量相关于由血红蛋白,由施用至样品的其他染色剂以及由其他样品成份吸收的量。就以下公开和一些实施例的目的而言,设定至少两种染色剂,曙红和天蓝,施用至样品。然而,本文中披露的方法和系统并不限于仅两种染色剂或仅限于曙红和天蓝。相反,本方法和系统能够在施用更少染色剂(例如,一种染色剂或没有染色剂)或更多染色剂(例如,包括曙红的红色染色剂和包括天蓝和亚甲基蓝的蓝色染色剂,三种或更多种染色剂,四种或更多种染色剂,五种或更多种染色剂)的样品上进行测量。自动化测量系统图2显示了用于对来自生物样品细胞体积和细胞成份进行自动化测量的系统100(其可以是更大的样品处理和分析系统的部分)的示意图。系统100包括照射源102、检测器106和电子控制系统108。电子控制系统108可以包括显示器110、人类接口单元112和电子处理器114。电子控制系统108经由控制线120和122分别连接至照射源102和检测器106。设定已经制备了用于分析的样品(如下文会进一步讨论的),所制备的样品104(例如,沉积在载玻片上并接着经固定、染色和漂洗的血样)自动定位在源102附近。源102将入射光116导向样品104。一部分入射光作为透射光118通过样品104,并且由检测器106检测。透射光118在检测器106的活动表面上形成了样品104的图像;检测器捕捉图像,并且然后将图像信息传送至电子控制系统108。一般而言,电子控制系统108引导源102产生入射光116,并且也引导检测器106检测样品104的图像。当检测器106获取来自透射光118的样品104的图像时,控制系统108可以指示源102使用不同的照射波长。如有需要,上文讨论的方法可以在样品104的多个图像上重复。在获取新的图像之前,电子控制系统108可以改变由源102产生的入射光116的波长。因此,样品104的每个图像都对应于不同波长的入射光116,并且因此不同波长的透射光118。重复该方法直到至少已经获得足够的信息来进行样品中细胞的体积或者样品中一种或多种成份的量的准确确定。通常,产生样品中细胞体积或样品中一种或多种成份的量的准确确定的信息的量在校正过程中确定。例如,校正过程可以用来确定(如下文进一步描述的):当所得到的样品图像的数量等于或大于作为样品分析因素的光谱贡献者(例如,吸收剂)的数量时,可以实现对样品中细胞的体积和/或样品中一种或多种成份的量的准确确定。举例而言,对于包含含血红蛋白(作为天然存在的吸收剂)以及曙红和天蓝作为施用的染色剂(总计三个光谱贡献者)的红细胞的经制备的样品,系统100可以继续获取样品图像直到其已经在最少三个不同波长处获得图像。额外的图像–对应于其它不同波长–还可以被获得,并且用于确定样品的细胞体积和细胞成份。照射源102可以包括一个源或多个相同或不同源用于引导入射光至样品。在一些实施方案中,源102可以包括多个发光元件如二极管(leds)、激光二极管、荧光灯、白炽灯和/或闪光灯。例如,源102可以包括四个分别具有在电磁谱的红、黄、绿和蓝色区中的输出波长的led(例如,635、598、525和415nm),或更一般地,约620至750nm(红),约575至600nm(黄),约525至570nm(绿),和约400至475nm(蓝)。在一些实施方案中,源102可以包括一个或多个激光源。代替具有多个发光器,在其他实施方案中,源102可以包括单个宽带发射器,其可被配置为改变其输出波长(例如,在电子控制系统108的控制下)。例如,源102可以包括宽带源(例如,白炽灯)偶联至可配置的滤光系统(例如,多个机械可调节的滤片和/或基于液晶的电可调节的滤片),其在系统108的控制下产生可变的输出光谱。一般而言,源102不在单个波长上输出照射光116,而是在围绕中心波长(例如,带中最大强度的波长)波长带中输出。当本文中的讨论涉及照射光116的波长时,参照为照射带的中心波长。检测器106可以包括多种不同类型的检测器。在一些实施方案中,检测器106包括电荷耦合器件(ccd)。在一些实施方案中,检测器106可以包括光电二极管(例如,二维光电二极管阵列)。在一些实施方案中,检测器106可以包括其它光敏元件如基于cmos的传感器和/或光电倍增管。检测器106还可以包括一个或多个其它滤光元件,如关于源102所描述的。在一些实施方案中,对应于不同波长的样品图像通过使用具有分布相对较宽的波长的照射光116照射样品114,然后对透射光118滤光以选择仅一部分对应于窄带波长的透射光来得到。滤光可以针对激发侧(例如,在源102中)和检测侧(例如,在检测器106中)的任一个或两者进行以确保使用检测器106得到的图像的每一个均对应于具有特定中心波长的光波长的特定分布。一般性方法本文中披露的系统和方法获取样品(例如,血样)中细胞的图像,和基于图像确定数量如细胞体积和细胞成份的量。图3a显示了流程图300,其包括确定这些数量的不同步骤。在第一步骤302中,选择了代表性细胞组。在代表性组中的细胞的图像为用来后续确定样品的细胞数量(cellularquantities)的图像。在后续步骤304中,不同的图像特征基于在代表性组中的细胞的图像所确定。如下文会讨论的,图像特征可以包括由检测器直接测量的强度值,和由图像数据计算的其它值。在步骤306中,细胞度量如细胞体积和细胞成份(例如,血红蛋白)的量基于在步骤304中确定的图像特征来计算。方法终止于步骤308。流程图300中的每个步骤将在下文中更详细的描述。(i)选择代表性细胞组在计算细胞度量之前,本文中披露的系统和方法从制备的生物样品中的多个细胞中鉴定代表性细胞组用于进一步分析。例如和如下文进一步描述的对于血样,这些系统和方法使用从样品图像获得的光密度测量来鉴定适合于体积和成份分析的代表性红细胞组。该过程通常涉及区分和排除其它细胞类型如白细胞和血小板,重叠或畸形的红细胞,和非细胞的矫作物和其它分析的残渣。使用通过检测器106获得的图像,在样品图像中每个像素的强度值可以与在选择代表性细胞组以及后续的细胞体积和成份分析中使用的光密度值相关联。在给定图像像素(x,y)处的透射光强度t(x,y)与吸收系数α和入射光经过样品对应于该像素的样品部分的路径长度ε(x,y)相关:t(x,y)=10-α·ε(x,y)对于图像中的每个像素,像素强度对最大可能像素强度(例如,像素/255,8-位分辨率)的比率代表在该像素的空间位置处透射的光的部分。该部分透射光通过采用方程(1)的对数可以表示为光密度(od)单元:od(x,y)=-log(t)=α·ε(x,y)(2)对于样品图像中的每一个像素,可以重复该过程。以此方式,在每个图像中的每个像素的光密度对应于在对应于该像素的位置处样品中吸收材料的总量(例如,吸收系数与厚度的乘积)。图3b显示了流程图320,其包括用于在制备的血样中选择代表性红细胞组的一系列步骤。在获得该样品的图像后,电子控制系统108以及,特别是电子处理器114,具有图像信息以区分包含在代表性红细胞组中的细胞与样品中存在的其它细胞类型、细胞簇和矫作物。首先,在图3的步骤322中,系统100将红细胞定位于一个或多个样品图像中用于进一步处理工。红细胞由于细胞中存在血红蛋白通常吸收蓝光(例如,415nm)。然而,白细胞不含有血红蛋白,并因此不以相同于红细胞的方式吸收蓝光。在蓝光下获取的样品图像可以用来鉴定红细胞;在这些图像中的白细胞因为这些细胞几乎不吸收蓝光而显得暗淡和歪曲,由此降低了对图像的贡献并通常使它们无法鉴定出。在一些实施方案中,阈值步骤可以用来确保系统100仅鉴定红细胞以供进一步分析。例如,系统100可以仅使用强度(或灰度)在具有160以下强度(或灰度)值的图像像素(对于在8位分辨率捕捉的图像)。范围在100至180的其它强度值阈值可以用来从图像鉴定红细胞,而从进一步分析排除白细胞。接下来,在步骤324中,系统100鉴定在样品图像中的每个红细胞的像素组。多种不同方法可以用来鉴定与这些细胞相关的像素组。例如,在一些实施方案中,系统100使用相关的成份标记步骤进行该鉴定步骤。该过程将来自样品图像的单个像素与图像中的对象相关联。例如,图像中没有被指定为属于背景的像素所分开的任何两个像素被指定为属于相同的细胞。此外,系统100可以从与细胞体积和成份分析相关的一些测量中排除位于边界区的细胞中的像素。具体地,红细胞由于这些细胞折射照射光的方式而常常具有厚而暗的边界,例如如图9所示。这些像素的光密度由于该折射通常是不可靠的。在完成相关成份标记过程后,系统100可以将像素侵蚀掩膜(pixelerosionmask)应用至所鉴定的细胞以去除最外侧n层的像素(例如,对应于折射最大处的边界区的像素)。一般而言,可以选择像素侵蚀掩膜以去除任何数量为n的像素层(例如,一个像素层或更多,两个像素层或更多,三个像素层或更多,四个像素层或更多,五个像素层或更多,六个像素层或更多,八个像素层或更多,十个像素层或更多),这取决于图像的放大倍数。已经通过实验确定了包含红细胞周长最外侧0.5μm的像素侵蚀掩膜一般适于在每个像素对应于细胞的一部分(0.148μmx0.148μm)时显著降低对红细胞的细胞体积和血红蛋白含量测量的错误贡献。使用通过侵蚀掩膜校正的像素组,可以测量多种细胞特征,例如每个细胞的平均和最大光密度,其对细胞体积和成份分析有贡献。在步骤326中,系统100继续从样品图像中鉴定代表性红细胞组的过程,即证实该组仅含有完整的和正常形状及尺寸的红细胞。一般而言,步骤326的功能为从代表性红细胞组的成员(inclusion)中弃去部分细胞、重叠细胞、细胞簇、血小板和非细胞矫作物。例如,被图像框边缘切割或接触图像框边缘的细胞可以从进一步分析中排除掉,由此防止不准确的测量。此外,畸形细胞–其可以在与它们非标准形状相关的经确定的细胞体积中显示出差异–可以从该分析中排除。进一步地,从重叠细胞得到的测量结果(在用于计算细胞体积或成份含量时,其可能为不可靠的)可以从代表性细胞组中排除。出于这些原因,所鉴定的细胞的每一个的形状都在步骤326中检查,且畸形和/或重叠细胞从进一步的分析中排除。多种不同的方法可以用来检查经鉴定的细胞的形状。例如,在一些实施方案中,每个细胞的形状通过比较细胞的周长和面积来检查。图4显示了这种比较的示意图。在图4中,细胞400已经被鉴定为在样品图像中像素组。对应于细胞400的边界的像素在图4中由于展示目的比内部像素阴影略淡–这些并不必然以此方式出现在实际图像中。细胞面积400可以通过对该组中的像素数量进行计数而确定。使用对应细胞400的像素组由边界像素确定细胞周长。这可以通过将经过每个周长像素中心的线连接以形成图像中的多边形并测量该多边形的周长来完成。确定细胞周长值的平方对细胞面积值(即,多边形的面积)的比率来检查细胞的形状。该比率的值对于理想、完美的圆形细胞为4π,。该比率的值随着细胞形状偏离圆形轮廓而增加。使用该标准,周长的平方对面积的比率以阈值或更大的量超过最小值4π的细胞从进一步的分析中排除。通常,阈值的量是最小值4π的百分数(例如,5%或更多,10%或更多,15%或更多,20%或更多,25%或更多)。除了从进一步的分析中排除畸形单个细胞之外,上述讨论的过程还可以排除重叠细胞。在样品图像中,重叠细胞通常呈现为大的、畸形的单个细胞(由于入射光传播经过的材料的厚度增加而带来的透射光强度的差异)。当对该图像应用分析算法时,重叠细胞一般被鉴定为大的单个细胞,具有不规则边界。因此,当对细胞周长和面积进行比较时,比率远超过对于理想值的可允许差异的阈值,而排除重叠细胞。另一种用于检查经鉴定的细胞的形状的方法利用上述的细胞轮廓多边形代表的凸包并将由凸包包围的面积与由图像像素确定的细胞面积。高比率的凸包面积对细胞面积可以用来鉴定不规则形状的细胞,并且从进一步的分析中排除这样的细胞。图5为包括两个细胞500a和500b的示意图。在图5中,细胞500a和500b的周长分别标记为502a和502b。凸包504a围绕细胞500a绘制,凸包504b围绕细胞500b绘制。如图5所示,细胞500a的凸包面积与细胞面积的偏差大于细胞500b。考虑到细胞500a的高度不规则性,细胞500a可以从代表性红细胞组排除。在一些实施方案中,细胞面积测量可以用于步骤326中以从代表性血细胞组中排除矫作物和重叠细胞。例如,仅面积在35平方微米至65平方微米范围的细胞可以考虑用于红细胞细胞体积的测量。面积小于35平方微米的成像对象通常不是红细胞,而是矫作物,例如样品中灰尘的斑点。类似地,面积大于65平方微米的成像对象通常不是红细胞;该对象可能对应于染色剂的团迹或多个重叠细胞。尽管前述实例描述了35~65平方微米的面积范围,但是其它范围也可以用来选择用于供测量的红细胞(例如,20平方微米至80平方微米),并且该范围可以基于样品中的平均细胞尺寸来换算(scale),由此解决了患者之间的差异。已经通过实验确定了:尽管35至65平方微米范围可能排除一些红细胞,但是这样的范围在从样品图像中除去矫作物时比20至80平方微米范围更有效。光密度值可以用来在样品中选择代表性红细胞组。例如,如果在蓝光下成像的对象的平均光密度值过低,那么该对象可能为白细胞核而不是红细胞。平均光密度阈值可以用于(例如,平均光密度小于等于0.33)使用蓝光获取的图像以从样品的代表性红细胞组中排除白细胞(例如,平均光密度小于等于0.33的细胞很有可能为白细胞)。对于在蓝色或黄色照射下获得的图像,超过一定阈值的对象的平均光密度值(例如,平均光密度大于等于0.66)可以用来鉴定堆叠的、重叠的和/或团簇的红细胞,其可以从进一步分析中排除(例如,平均光密度大于等于0.66的红细胞很有可能与另一细胞重叠)。图3b中显示的过程在步骤328中伴随最终确定供进一步分析的代表性细胞组而终止。(ii)确定图像特征本文中披露的系统和方法使用各图像特征的组合来计算细胞体积和成份值。这些组合通常包括(但是不限于)这些图像特征的线性组合,发明人已经发现这些图像特征在广泛种类的样品上产生准确的、可重复的结果。一旦已经如上所述鉴定出代表性细胞组,就基于通过系统100得到的一个或多个细胞图像对于代表性细胞族中的每个细胞计算本文中披露的特征的一些或全部。可以对于每个细胞计算的第一组特征为颜色特异性的积分光密度,iod(c),其可以如下确定:iod(c)=a·odmean(c)(3)其中a为细胞的面积,而odmean(c)为在用颜色c的光照射细胞时细胞中像素的平均光密度。如果在不同照射波长上得到细胞的图像,可以对于在每个照射波长上的细胞计算iod(c)的值。图6显示了通过与流程图320相关而描述的过程鉴定的代表性细胞600的示意图,其使用颜色c的照射光得到。细胞600的图像包括多个像素。细胞600中像素的平均光密度,odmean(c),对应于图6中像素强度的总和除以图像中像素的数量。可以对于代表性组中每个细胞计算的第二组特征为细胞的颜色特异性体积,vol(c)。图6中细胞600的体积通过对应于细胞600的每个像素的光密度值的加和来计算。首先,细胞600在每个像素处的“高度”可以估计为:其中odpixel为与给定像素有关的光密度,odmax为与细胞像素有关的所有光密度中的最大光密度。因此,例如,在细胞600的图像中的像素620的光密度小于与像素610相关的最大光密度。像素620对细胞600的体积的贡献为比率od620/odmax,其中od620为像素620的光密度,odmax为像素610的光密度,然后,细胞体积,v,通过将细胞600中所有像素的像素光密度对最大光密度的比率加和来计算:其中,与细胞600中每个像素相关的光密度的总和在方程(5)被细胞600中的像素数量npixels和细胞600中像素的平均像素光密度,odmean的乘积所代替。通常,接近细胞边缘的像素的光密度对于体积测量而言不是有效的贡献者,因为在细胞边缘折射的光在细胞周围产生了矫作的暗边界。为了避免来自这样的边界像素的作用,所述系统可以如前文所述用在细胞边缘侵蚀掩膜的一个或多个像素,测量细胞被掩蔽区的平均光密度和最大光密度,并且然后,通过乘以全部的、未侵蚀掩模的面积而外推至细胞边缘。此外,当多个对应于不同照射波长的图像用来得到单个细胞的图像时,细胞体积计算确定可以在每个颜色的照射光处完成。相应地,颜色特异性细胞体积可以确定为:其中a为整个细胞(包括细胞边缘)的面积,odmean(c)为在细胞掩模区内的像素的颜色特异性平均光密度,且odmax(c)为细胞的侵蚀性掩膜的颜色特异性最大光密度(例如,图6中的像素610)。计算的颜色特异性细胞体积vol(c)可以进行换算来以合适单位(例如飞升(femtoliters))表达细胞体积。在一些实施方案中,将一种或多种校正因子添加到方程(6)中进行调节是有用的,因为细胞图像的一些深色部分由于细胞的血红蛋白含量而可能不是真实的。此外,可以应用换算因子将体积测量转化成如毫微微升(fl)的测量单位。为了说明这些校正因子和换算因子(scalingfactor),方程(6)可以改写为:其中s对应于换算因子或斜率,c对应于应对最大光密度的确定中的偏移(bias)的校正因子,b对应于总体补偿值所对应的截距值。校正因子、换算因子和截距值可以通过实验使用在例如经校正的流式细胞仪上处理的多个血样的已知体积值的数据组确定。略有不同的校正因子的组,一般而言,会对于每一个不同的样品提供最好的结果,尽管校正因子可以基于跨越整个数据组的结果来确定。例如,对于含有1000个血样的已知体积值的数据组,在整个数据组的平均值上效果最好的校正因子可以通过选择使得整个数据组上的经测量的和期望的体积值之间平方差值的总和最小的校正因子来确定。换算因子可以通过选择这样的换算因子来在整个数据组上确定:所述换算因子最好地将原始体积值转化为合意的测量单位如飞升。可以选择数据组的截距值b以确保当数据呈现在二维曲线上时,方程(7)经过原点。校正因子、换算因子和截距值可以存储在与电子控制系统108相关的存储器单元中,并且当确定如方程(7)所示的颜色特异性体积时从存储器恢复以供分析新样品。使用方程(3)和方程(6)或(7),可以对于每个颜色的照射光确定两个特征(例如,积分光密度iod(c)和体积vol(c))以供获得样品图像。例如,如果使用四种不同颜色的照射光,对于代表性组中的每个细胞可以确定总共八个不同特征。此外,如上文所述,每个单个细胞的面积a可以由细胞图像来确定。然后颜色特异性积分光密度和细胞体积,以及细胞面积,可以用来计算每个细胞的度量。(iii)细胞度量的计算细胞度量如细胞体积和细胞成份量可以基于如上所披露的对于代表性细胞计算的一些或全部特征的加权组合进行计算。一般而言,度量m可以由以下确定:其中n对应于用来获得代表性细胞的图像的照射光的每一个颜色,ωn,i值为对于颜色特异性积分光密度iod(n)中每一个的颜色特异性加权系数,ωn,v值为对于颜色特异性体积vol(n)中每一个的颜色特异性加权系数,ωa为对于细胞面积a的加权系数,k为补偿值。例如,当四种不同的照射波长用来获得细胞图像时(例如,红=r,黄=y,绿=g,蓝=b),则细胞体积v可以确定为:细胞成份的量可以类似方式来确定。例如,细胞中血红蛋白的浓度,h,可以根据以下计算:上述方程(9)和(10)之间的差异在于加权系数和补偿值k的值。使用方程(9)和(10),可以确定样品中多个细胞的细胞体积和成份量(例如,血红蛋白的量)。结果可以平均化,以确定样品的平均细胞体积和成份的平均浓度(例如,平均细胞血红蛋白)。与基于单颜色光密度值和细胞面积的体积和成份测量相比,已经观察到基于颜色特异性图像特征和细胞面积的加权组合确定细胞体积和细胞成份的量显著改善了这种测量的准确性。方程(8)中与颜色特异性特征相关的加权系数可以基于例如,通过确定线性回归系数可得的培训数据来确定,所述线性回归系数将实验上确定的样品特征映射至包含这种样品的已知体积和/或成份浓度值的培训数据。使用线性回归方法来确定颜色特异性加权可以改进样品平均细胞体积和平均成份浓度测量的准确性,即校正影响体积测量的不可控制因子,例如在膜厚度和染色剂吸收中随细胞而不同的差异性。在已经由培训数据确定颜色特异性加权值后,可以存储该加权值并稍后将其从存储单元(例如,电子存储器单元)中恢复,然后分析每个样品。一般而言,广泛种类的不同样品可以用来确定合适的加权系数。为了获得高度可重现的结果,可以有利的是使用跨度在整个范围的经计算数量的值上的培训数据。进一步地,如果待分析的样品包括不常见的形态特征如细胞团块,使用包括这些特征的代表性样品的培训数据可能是有利的。举例而言,在由供确定细胞体积的培训数据组确定加权系数组组之后,方程(9)可以如下重写:v=(-4.04)·iod(r)+8.49·iod(y)+(-3.69)·iod(g)+4.40·iod(b)+4.68·vol(r)+(-8.20)·vol(y)+3.57·vol(g)+0.0159·vol(b)+(-0.125)a+4.84(11)类似地,在由供确定细胞血红蛋白的培训数据组确定合适的加权系数后,方程(10)可以改写为:h=(-1.05)·iod(r)+(-2.44)·iod(y)+1.12·iod(g)+2.15·iod(b)+1.95·vol(r)+(-0.112)·vol(y)+(-1.27)·vol(g)+0.457·vol(b)+(-0.221)·a+-5.73(13)本文中披露的系统和方法可以用来分析全血样(例如,取自患者的样品)和定性对照组合物(qualitycontrolcomposition)。方程(9)-(12)显示的加权系数可以用来分析全血样和定性对照组合物。定性对照组合物通常包括多种类型的保存的哺乳动物血细胞,并设计用来在自动化血液学系统上处理时模拟全血样。可以分析定性对照组合物以评估血液分析装置的操作条件,所述血液分析装置例如实现和执行本文中披露方法的自动化血液学系统。例如,为了进行对装置的评估,该装置可以用来多次分析一种或多种对照组合物。来自重复分析同一对照组合物的分析结果(例如,数量如细胞血红蛋白、细胞体积、平均细胞血红蛋白和平均细胞体积的确定)可以进行比较以评估由装置所产生的结果的线性。在一些实施方案中,装置可以用来分析对照组合物以评估通过装置所产生结果的准确性。例如,通过装置分析对照组合物的结果(例如,数量如细胞血红蛋白、细胞体积、平均细胞血红蛋白和平均细胞体积的确定)可与对照组合物的这些数量的参考值来比较以评估该装置的准确性。如果一个或多个这些数量的经过确定的值和参考值的差值超过阈值,那么可以重新校正装置。重新校正可以包括,例如,由参考血样重新确定方程(9)-(12)中的一些或所有加权系数的值,如本文所述。在方程(9)-(12)中,四种颜色的照射光(红,黄,绿和蓝)用来照射样品,由对应于这些颜色中每一个的图像来计算积分光密度和细胞体积。用来计算颜色特异性积分光密度值和体积的照射波长可以为,例如,635nm,598nm,525nm和415nm,尽管其它在电磁谱的红色、黄色、绿色和蓝色区内的值可以在其它实施方案中使用。更一般而言,可以使用不同数量的照射波长,且可以得到对应于照射波长中每一个的图像并用来计算积分光密度和/或细胞体积的颜色特异性值。例如,在一些实施方案中,三个不同波长的光用来照射样品。在一些实施方案中,可以使用超过四个波长(例如,五个波长,六个波长,七个波长,八个波长,十个波长)的照射光,并且可以在一些或全部照射波长处确定颜色特异性积分光密度、细胞体积和加权系数。一般而言,可以选择照射光波长使得在每个不同波长处的每一个图像都包含关于样品的不同信息。例如,如果样品包含三个光谱贡献者,那么可以选用三个波长的照射光使得三个波长中的每一个被光谱贡献者中不同的一个最强烈地吸收。如上所述,方程(8)中的颜色特异性加权系数可以通过将大量(例如,1,000)个血样的实验确定特征的线性回归系数映射至培训数据组来确定,所述培训数据组包含这些样品的多种细胞成份的浓度和/或细胞体积的已知值,所述值例如从经校正的流式细胞仪系统得到。由于样品制备参数存在差异(例如,对染色剂组合物的修饰影响染色细胞的外观,或影响细胞如何吸收染色剂的其它因素,如样品在固定和染色前干燥的程度),确定方程8的颜色特异性加权和截距值的过程可以重复以确保对于给定的样品制备参数组确定准确体积和细胞成份测量值。然而,一旦样品制备参数已经为了特定的样品制备系统而优化,那么实验衍生的方程(8)中加权系数和其它参数值将会生成准确的和可重复的细胞体积和/或细胞成份量的测量。在方程(8)中,度量m计算为颜色特异性积分光密度、颜色特异性体积和细胞面积的加权线性组合。然而,不是所有这些特征都用来在所有实施方案中确定度量值。例如,在一些实施方案中,度量m可以计算为仅颜色特异性积分光密度或颜色特异性体积的加权组合。在一些实施方案中,度量m可以计算为细胞面积和颜色特异性积分光密度或颜色特异性体积之一的加权组合。在一些实施方案中,度量m可以计算为颜色特异性积分光密度和颜色特异性体积的加权线性组合。一般而言,用来计算特定度量m的特征的合适组合可以使用其度量m值已知的参考样品来确定。当确定样品细胞中特定成份的量时,如果仅单个光谱贡献者存在于样品(例如,吸收性贡献者如血红蛋白)中,那么存在于该特定细胞中的该贡献者的总量可以通过将来自对应于选定的细胞的图像中的每个像素的强度贡献加和而确定。正如强度贡献仅对应于血红蛋白的吸收,将会仅需要一个样品来确定存在于细胞中的血红蛋白的总量。然而,实际上,样品通常用一个或多个染色剂来制备以帮助技术人员或自动化成像系统来鉴定、计数和分类各种细胞类型。由于样品中的多个光谱贡献者,在每个照射波长处的吸收为样品中每一个贡献者的吸收的组合;特定细胞在任何波长上的全部贡献仍然对应于代表细胞的每一个像素在该波长的贡献的总和。因此,由于光谱贡献者血红蛋白(h)、曙红(e)和天蓝(a)存在于样品中,并且设定样品的三个图像对应于具有在电磁谱的黄(y)、绿(g)和蓝(b)区内中心波长的照射光,在特定细胞的这三个波长中每一个的光密度od(或图像中对应于一个或多个细胞的所有像素)可以设定为每个光谱成份在每个波长上的吸收的线性组合:od(y)=h·αy,h+e·αy,e+a·αy,aod(g)=h·αg,h+e·αg,e+a·αg,a(13)od(b)=h·αb,h+e·αb,e+a·αb,a其中αi,j为光谱贡献者j(例如,血红蛋白h,曙红e或天蓝a)在波长i(例如,黄y,绿g,或蓝b)处的吸收系数。每一种光的中心波长都可以通过使已知光谱的光经过样品至检测器并测量样品的吸光度来确定。例如,检测器可以使用分别在黄、绿和蓝区中具有窄照射光谱的照射源来获取样品的三个图像。当每个光谱贡献者具有含有局部最大值的吸收光谱时,可以选择照射源使得发射光谱对应于或最好地近似光谱贡献者局部最大值。例如,蓝色照射可以选择作为对应于样品中血红蛋白的吸收峰的波长(例如,415nm)。黄色照射可以关联于对应于样品中天蓝染色剂的峰值吸光度的波长(例如,598nm)。类似地,绿色照射波长可以选择为对应于样品中曙红染色剂的峰值吸光度的波长(例如,525nm)。其它的照射波长可以选择用来与样品中其它光谱贡献者的峰值吸光度相关联。光密度数量od(y)、od(g)和od(b)可以由图像信息来确定,而吸收系数αi,j可以由文献来源所确定或通过实验确定。因此,方程(13)的系统包括三个未知数–h,e和a–并且可以被解析以产生存在每个特定细胞中的这三个光谱贡献者的量,或者如果选择用来分析的像素总体对应于图像中鉴定出的所有细胞,则为针对样品中所有细胞总体。尽管如此,本文中披露的方法和系统呈现为更简单、更有效的确定细胞成份量的方法。如上所示,方程(8)–具有合适的加权系数–可以用来确定仅那些关注成份的成份量,这增加了完成样品分析的速度。此外,在其中光谱贡献者的数量未知的复杂样品中,难以构建方程例如方程(13)的系统。然而,方程(8)允许具体细胞成份的量的确定,即使在细胞中其它光谱贡献者的存在没有被确立。因此尽管在一些实施方案中,在方程(13)的系统中来自血红蛋白、曙红和天蓝的光谱贡献者可以通过在三个不同照射波长处获得图像来区分,如上所述使用多于三个特征和/或多于三个照射波长来确定细胞量度如细胞血红蛋白、细胞体积、平均细胞血红蛋白和平均细胞体积的值允许在测量血样时校正其它系统性或非系统性来源的错误。除了颜色特异性积分光密度和体积,以及细胞面积之外,还可以使用其它特征来确定细胞体积和/或细胞成份的量。在一些实施方案中,例如,方程(8)可以包括对应于细胞周长和加权系数的乘积的额外项。如上所述,可以由培训数据确定细胞周长项的合适加权因子。更具体地,多个衍生自细胞图像,具有由培训数据确定的合适的加权系数的额外项,可以包含在方程(8)中。这些项可以包括与在超过三或四个照射波长处的积分光密度和体积的颜色特异性测量和/或细胞形态相关的几何图像特征。不欲拘于理论,所述额外项可以允许拟合–其可以对参考样品信息同时进行以确定所有加权因子的值–来校正如成像偏差、其它样品成份的吸收和系统性测量错误的影响,方程(8)的模型没有完全对此进行说明。例如,已经发现对应于红色照射波长的积分光密度和细胞体积的项和对应于细胞面积的项的纳入在许多样品中与不使用在红色照射波长中获得的样品图像或细胞面积测量的测量技术相比,改善了细胞血红蛋白的确定的准确性。一般而言,本文中披露的方法和系统可以用来确定样品中天然存在的成份(例如,在红细胞中的血红蛋白)的量和/或已经添加至样品中的成份的量(例如,已经施用和结合至细胞成份的染色剂)。此外,在一些实施方案中,本文中披露的方法和系统可以用来确定在样品中存在的多于一种成份的量。例如,通过施用合适的染色剂和/或针对样品图像选择合适的中心波长,可以确定两种或更多种成份的量。考虑包括血红蛋白作为天然存在的吸收成份的样品。该样品可以使用两种广谱吸收性染色剂s(1)和s(2)以及具有相对较窄吸收带的第三染色剂s(3)来染色。s(3)选择性结合至在细胞中关注的特定成份,使得测量存在的s(3)的量获得该成份的测量。如果血红蛋白和s(3)的吸收光谱在光谱上可以充分分开,使得血红蛋白在仅波长λ1、λ2和λ3但非λ4具有显著的吸收,那么假设s(1)和s(2)在全部四个波长处具有显著的吸收,细胞血红蛋白的量可以根据本文中披露的用于从对应于照射波长λ1、λ2和λ3的样品的图像来测量细胞成份量的方法来确定,而s(3)的量可以相同的方法从对应于照射波长λ2、λ3和λ4的样品的图像来确定。这些方法可以进一步概括用于更大数量的关注成份,以及更大或更小数量的广谱吸收吸收性光谱贡献者如s(1)和s(2)。结果记录在一些实施方案中,所确定的细胞体积、成份量、平均细胞体积和平均成份浓度可以使用例如显示器110显示给系统操作员。这些结果可以基于每个细胞,或者作为整个样品的平均结果来显示。此外,计算的数值结果(例如,对于单个细胞)可以覆盖在一个或多个细胞图像上。一般而言,系统操作员可以经由使用人类接口单元112(例如,键盘和/或鼠标和/或任何其它输入装置)显示结果的方式来施加控制。系统操作员还可以针对其它与本文中披露的方法相关的参数、条件和选项通过接口单元112和显示器110来施加控制.一个或多个量度也可以由平均细胞体积和/或平均细胞血红蛋白测量来计算,并且显示在步骤210中。在一些实施方案中,例如,可以计算红细胞分布宽度并向人操作员显示。接下来,红细胞分布宽度可以用来计算和显示红血球不均(anisocytosis)和/或贫血的可能性。此外,平均细胞血红蛋白测量可以与样品的红细胞压积值一起使用来计算平均细胞血红蛋白浓度。由此计算的细胞体积和成份浓度测量和/或度量可以与样品图像一起存储在与控制系统108相关的电子存储单元中。例如,该信息可以存储在与样品104所对应的患者相关的电子记录中。或者,或此外,该信息可以传送至一个或多个医师或其他治疗人员。信息可以经由网络(例如,计算机网络)传送至计算装置。此外,信息可以传递至手持装置(handhelddevice)如移动电话,如果量度超出了值的预定范围,所述传送可以包括提示或警告。其他分析物如上文所解释的,出于说明性目的,本公开着眼于在红细胞中的细胞体积和细胞成份量的确定。然而,本文中披露的系统和方法还可以确定其他类型细胞的体积和细胞成份。具体地,方程(8)可以用来确定多种不同类型细胞的细胞度量。举例而言,本文中披露的系统和方法可以使用颜色特异性光密度和体积测量的线性组合–与适当确定的加权系数–来计算在给定血样中的血小板的血小板体积。样品中的血小板体积的测量可以平均化以产生平均血小板体积的测量。与先前描述的在红细胞中计算细胞体积和成份量的实例一样,血样的图像使用多个波长的光来获取。然后样品图像根据流程图300中的步骤来分析来产生血小板体积的测量。在流程图300中的第一步骤为在步骤302中选择代表性血小板组。含有血小板的制备血样的实例示意在图9a和9b中。图9a显示血液标本的图像1100,该血液标本包含大簇或大块的血小板1120。正如血小板可以成块并形成堆积的团簇,可能需要额外的图像处理来鉴定团块或簇内的单个血小板以供可能地纳入代表性血小板组。这种处理的实例在图9b中阐述。对图像中的对象进行分割以鉴定团簇内的单个血小板。如在图9b的分割团簇1220中所示的,单个血小板通过边界来鉴定。分割过程可以分三个阶段进行。在第一阶段,在每个图像中鉴定单个血小板的中心区。血小板中心区在图9b中显示为近似圆形区。血小板中心区作为血小板最深色的区呈现。在第二阶段中,鉴定出图像中可能为血小板一部分的像素。基于对于给定像素的值的一个或多个阈值条件,可以像素确定为血小板的一部分。在一些实施方案中,如果在蓝色照射波长(例如,415nm)处获取的图像中像素的强度值大于120,并且该强度值也比在绿色照射波长(例如,525nm)处获取的图像中的相同像素的强度值至少高出30个水平,那么将该像素鉴定为血小板的一部分。在第三阶段中,在第二阶段中鉴定为血小板一部分的每一个像素指定给对应于与像素最接近的血小板中心的血小板。如果特定像素及其最接近血小板中心之间的距离超过阈值,那么该像素不指定给任何血小板。该阶段导致像素组指定给对应于鉴定出的血小板中每一个。对应于单个血小板的像素组作为不规则地围绕血小板的中心区描绘在图9b中。在一些实施方案中,血小板之间的边界可以经受形态操作例如扩张。可以中止扩张,例如,当血小板边界不重叠时。然而,侵蚀对应于每个血小板的像素掩膜(例如,像素的子组)的进行通常并不如文上所述与红细胞关联。血小板边界通常比红细胞边界更薄且折射性更少。其结果,与红细胞的外观相对,血小板边界在图像中不呈现为深色,并且通常不对应于单个血小板的像素掩膜进行进行侵蚀。由于鉴定出血小板边界和将像素指定给给定的血小板,在代表性组中的每个血小板的面积可以被计算出来。一般而言,多种分割算法可以用来将血小板团簇分割成单个血小板。这种算法的实例记载在美国专利7,689,038和7,881,532中,其均通过全文提述并入本文。如上关于红细胞所述,也可以实施额外的步骤来确定单个血小板是否应当包括在用于后续计算的代表性血小板组中。将接触图像任何边缘的血小板或者在图像中模糊的血小板从代表性血小板组中除去,并且不用于进一步计算。应用积分光密度阈值可以进一步限定代表性血小板组。例如,在使用位于黄色照射波长的光照射时,积分光密度值大于600的血小板可以从代表性血小板组中排出;这种对象通常大于血小板,并且通常为红细胞。此外,在使用位于蓝色照射波长的光照射时,积分光密度值大于200的血小板可以从代表性血小板组中排除;这种对象通常太深而不可能是血小板,并且常常表示的是灰尘或样品中的其他残渣。在一些实施方案中,应用分类器(classifier)如线性判别式分类器(lineardiscriminantclassifier)以鉴定已经沉降样品内红细胞顶部的血小板。分类器使用与血小板候选的形状、纹理和颜色相关的多个血小板候选特征(例如,五或更多个,十或更多个,十五或更多个,等)的组合来从代表性血小板组中鉴定和排除重叠的血小板。接下来,在步骤304中,代表性血小板组的颜色特异性光密度和体积值根据方程(3)和(6)或(7)确定。然后,在步骤306中,血小板度量如血小板体积根据方程(8)使用在步骤304中确定的特征进行计算。如上所述,与这些特征相关的加权可以基于培训数据来确定,例如,通过确定将特征映射到培训数据(包含多个血样的已知血小板体积值)上的线性回归系数(例如,如经校正的流式细胞仪系统所报道的)。举例而言,在由用于确定细胞体积的培训数据组确定加权系数组之后,可以重写方程(9),使得血小板体积(pv)可以如下确定:pv=(-0.047)·iod(y)+0.050·iod(g)+0.082·iod(b)+0.28·vol(y)+(-0.15)·vol(g)+(-0.031)·vol(b)+(-0.058)a+4.0如上所述,本文中披露的系统和方法可以用来分析全血样(例如,取自患者的样品)和定性对照组合物。方程(9)和(14)所示的加权系数可以用来分析全血样和定性对照组合物两者。可以分析定性对照组合物来评估血液分析装置的操作条件,所述血液分析装置例如实现和执行本文中披露方法的自动化血液学系统。例如,为了进行对装置的评估,该装置可以用来多次分析一种或多种对照组合物。来自重复分析同一对照组合物的分析结果(例如,数量如血小板体积和平均血小板体积的确定)可以进行比较以评估由装置所产生的结果的线性和/或准确性,且可以用来确定校准该装置是否得到保障。可以在一组或多组代表性血小板内确定所有血小板的血小板体积以计算样品的平均血小板体积(mpv)值。尽管在电磁谱中的其他照射波长可用来计算血小板体积,但是本发明人已经发现,在方程(8)中纳入使用红色照射波长成像的血小板的颜色-特异性特征并不显著增加计算血小板体积或样品mpv值的准确性。本文中披露的系统和方法还可以用来确定血小板的其他细胞度量。具体地,本系统和方法可以用来使用如上所述的带有由参考样品确定的加权系数的方程(8)来确定血小板中成份的量。自动化样品制备系统本文中披露的系统和方法可以与多种不同的自动化样品制备系统一起使用。图10显示了自动化样品制备系统1000的一个实施方案的示意图。系统1000包括多个子系统,用于存储基底、将样品沉积在基底上、检查在基底上制备的样品并且存储所制备的样品。基底存储子系统1010配置为存储基底,然后在该基底上沉积样品。基底可以包括,例如,载玻片、盖玻片和类似的平面、任选透明的基底。该基地可以由多种不同的无定形或结晶材料形成,所述材料包括多种类型的玻璃。子系统1010可以包括从存储容器中选择单个基底以及将选定的基底转移至样品沉积子系统1020的机械手。样品沉积子系统1020将选定数量的关注样品–如血样–沉积到基底上。子系统1020包括,一般而言,配置以沉积样品的多个流体转移构件(例如,泵、流体管、阀)。流体转移构件还可以配置来使基底暴露于多种类型的溶液,包括洗液、一种或多种结合至样品的染色剂、固定液和缓冲液。子系统1020还可以包括流体除去构件(例如,真空子系统)和干燥装置以确保样品固定至基底。基底机械手可以将支持样品的基底转移到成像子系统1030。检查子系统1030包括多种构件用于得到基底上样品的图像和用于分析图像以确定关于样品的信息。例如,检查子系统1030可以包括一个或多个光源(例如,发光二极管、激光二极管和/或激光)用于将入射光导向样品。成像子系统1030还可以包括光学装置(例如,显微镜物镜)用于捕捉来自样品的透射和/或反射光。偶联至光学装置的检测器(例如,ccd检测器)可被配置来捕捉样品的图像。衍生自对样品图像的分析的信息可以存储在多种光学和/或电子存储媒介上用于以后恢复和/或进一步分析。在检查后,基底机械手可以将基底转移至存储子系统1040。存储子系统1040可以标记单个的基底,例如,使用与施用至基底的样品源相关的信息、分析时间和/或任何分析期间鉴定的不规则性来标记。存储子系统还可以存储在多基底架中处理的基底,其当它们充满基底时可以从系统1000中除去。如图10所示,系统1000的不同子系统中的每一个可以连接至常见的电子处理器1050。处理器1050可被配置为以自动化方式控制系统1000的子系统中每一个的操作,并使用较少的或者不使用来自系统操作员的输入。样品分析的结果可以显示在系统显示器1060上以供监督操作员用。接口1070允许操作员向系统1000发出命令以及人工检查自动化分析结果。自动化样品处理系统的其它方面和特征记载在,例如,美国专利系列号12/943,687(2010年11月10日申请),将其通过全文提述并入本文。硬件和软件的实施本发明所描述的方法步骤或程序可以实施在硬件或软件中,或它们两者的组合中。具体地,电子处理器114可以包括软件和/或硬件指令来进行任何上文讨论的方法。遵循本文中披露的方法步骤或图使用标准编程技术可以在计算机程序中实施本方法。应用程序编码输入数据来进行本文中披露的功能。将输出信息施于一个或多个输出装置如打印机或显示器装置或可访问网站的计算机监视器上的网页,例如,用于远程监控。每一个程序优选以与处理器通信的高级过程或对象定向编程语言(proceduralorobjectorientedprogramminglanguage)来实施。然而,如有需要,该程序可以汇编语言或机器语言来实施。在所有情况中,语言可以为编译或直译语言(compliledorinterpretedlanguage)。每个计算机程序可以存储在可由处理器读取的存储媒介或装置(例如,电子存储器)上用于配置或操作处理器以进行本文所述的过程。图11为计算机系统1300的示意图,该系统1300可以用来控制关于任何本文描述的、根据一个实施方案的计算机实施的方法所描述的操作。系统1300包括处理器1310、存储器1320、存储装置1330和输入/输出装置1340。构件1310、1320、1330和1340中的每一个使用系统总线1350来互相连接。处理器1310能够处理指令以供在系统1300内执行。在一个实施方案中,处理器1310为单线程处理器。在另一实施方案中,处理器1310为多线程处理器。处理器1310能够处理存储在存储器1320内或存储装置1330上的处理指令以在输入/输出装置1340上显示用户接口的图像信息。处理器1310可以与上文参考图10所述的处理器1050实质上类似。在系统1300内,存储器1320存储信息。在一些实施方案中,存储器1320为计算机可读的媒介。存储器1320可以包括易失性存储器和/或非易失性存储器。存储装置1330能够提供用于系统1300的大容量存储。一般而言,存储装置1330可以包括任何非暂时的有形媒介(non-transitorytangiblemedia),其配置为存储计算机可读指令。在一个实施方案中,存储装置1330为计算机可读的媒介。在多个不同的实施方案中,存储装置1330可以为软盘装置、硬盘装置、光盘装置或磁带装置。输入/输出装置1340提供用于系统1300的输入/输出操作。在一些实施方案中,输入/输出装置1340包括键盘和/或点击装置(pointingdevice)。在一些实施方案中,输入/输出装置1340包括用于显示图像用户接口的显示单元。在一些实施方案中,输入/输出装置1340包括一个或多个上文参考图示10所描述的显示器1060和接口1070。所描述的特征可以实施在数字化电路中,或计算机硬件、固件,或在它们的组合中。这些特征可以实施在有形地实现在信息载体如机器可读取存储装置中的计算机程序产品中,用于由可编程的处理器执行;和这些特征可以通过可编程的处理器来执行,该可程控处理器执行指令程序通过操作输入数据和生成输出以进行所描述的实施方案的功能。所描述的特征可以实施在一个或多个计算机程序中,该计算机程序在可编程的系统上是可执行的,该可编程的系统可以包括至少一个可编程的处理器(其偶联以从数据存储系统接收数据和指令,并向数据存储系统传送数据和指令)、至少一个输入装置和至少一个输出装置。计算机程序包括一组可以直接或间接用于计算机中以执行某一活动或带来某一结果的指令。计算机程序可以任何形式的编程语言写入,包括编译或直译语言,并且其可以任何形式配置,包括作为独立程序或作为模块、构件、子例程或其它适合用于计算环境的单元。各种软件体系结构可以用来实施在本申请中描述的方法和系统。例如,发布/订阅通信联系模式(publish/subscribemessagingpattern)可以用来实施本文描述的方法和系统。在发布/订阅通信联系的情况中,系统包括数个仅通过通信联系模块通信的硬件和软件模块。每个模块可被配置为进行具体的功能。例如,该系统可以包括一个或多个硬件模块、照相机模块和聚焦模块。硬件模块可以向实现自动聚焦功能的成像硬件发出命令,该成像模块接着触发照相机以获得图像。在一些实施方案中,硬件模块可以包括上述参考图2所描述的控制系统108。照相机模块可以接收来自照相机的图像并确定照相机参数如快门时间或焦点。图像还可以缓存在计算机存储器中,然后通过照相机模块进行处理。当进行载玻片倾斜的数字化检索(initialsearchforthetiltoftheslide)时,照相机模块还可以在其已经发现足够图像时发出消息中断硬件模块来确定合适的快门时间和焦点。在一些实施方案中,照相机模块包括上述参考图2所描述的检测器106。系统还可以包括聚焦模块,其可以作为软件、硬件或软件和硬件的组合来实现。在一些实施方案中,聚焦模块检查所有叠层中的框架(frame),并估计叠层距理想距离或理想聚焦距离有多远。聚焦模块还可以负责将聚焦分数指派给图像叠层中的每个框架。用于执行指令程序的合适处理器包括,举例来说,通用目的和特殊目的微处理器,以及任何种类计算机的多个处理器中的一个或唯一的处理器。一般而言,处理器会从只读存储器或随机存取存储器或这两者接收指令和数据。计算机包括用于执行指令的处理器和一个或多个用来存储指令和数据的存储器。一般而言,计算机还会包括,或者偶联以通信于一个或多个供存储数据的大容量存储设备;这种设备包括磁盘,如内部硬盘和移动盘;磁光盘;和光盘。适合于有形地实现计算机程序指令和数据的存储装置包括所有形式的非易失性存储器,其包括,例如,半导体存储器装置,如eprom,eeprom和闪速存储器装置;磁盘,如内部硬盘和移动盘;磁光盘;和cd-rom和dvd-rom盘。处理器和存储器可以补充以或组入asics(应用特异性集成电路)。为了提供与用户之间的交互,这些特征可以在计算机上实施,所述计算机具有用于向用户显示信息的显示器装置crt(阴极射线管)或lcd(液晶显示器)监视器,以及键盘和点击装置如鼠标或追踪球,由此用户可以向计算机提供输入。或者,所述计算机可以不具有附接的键盘、鼠标或监视器,并且可以通过另一计算机远程遥控。各特征可以实施在计算机系统中,该计算机系统包括后端构件如数据服务器,或包括中间件构件,如应用服务器或英特网服务器,或包括前端构件,如客户机计算机,其具有图像用户接口或英特网浏览器,或任何它们的组合。该系统的构件可以通过任何形式或媒介的数字化数据通信如通信网络进行连接。通信网络的实例包括,例如,lan、wan,形成英特网的计算机和网络。计算机系统可以包括客户机和服务器。客户机和服务器一般彼此远离,并且通常通过网络(如所描述的)交互作用。客户机和服务器的关系借助在各自计算机上运行的并彼此具有客户机-服务器关系的计算机程序而发生。处理器1310执行与计算机程序相关的指令。处理器1310可以包括硬件,如逻辑门、加法器、乘法器和计数器。处理器1310可以进一步进行实施运算和逻辑操作的单独的运算逻辑单元(alu)。其它实施方案应当理解的是,前述说明意在说明,而非限制本公开的范围,本公开的范围通过所附权利要求的范围所限定。其它方面、优点和改进都在所附权利要求的范围内。例如,尽管前述描述和图2中的示意图讨论了来自样品的透射光的测量,当样品的图像对应于反射自样品的光时,本文中披露的方法和系统也可以使用。一些样品也许天然就是反射性的,或者可以用反射性标志物进行标记,使得反射光提供用于确定细胞成份和/或体积的方便的方法。在一些实施方案中,样品104可以定位在基底如具有反射性涂层的载玻片顶部。反射性涂层可以产生以下作用:将一次透射光引导返回而第二次通过样品,使得所测量的“反射”光实际上对应于两次透射经过样品的入射光。一般而言,本文中披露的方法和系统可以用来确定各种不同样品类型的每细胞体积、成份含量和/或样品平均细胞体积或平均细胞成份含量。例如,可以确定样品的细胞体积和成份含量如血红蛋白或其它蛋白,所述样品包括来自体液和组织的细胞,所述体液和组织包括血液、骨髓、尿、上皮组织、肿瘤、精液、唾液、和其它组合,或循环或非循环生物液。实施例实施例1为了评估本文中披露的用于确定血样的平均细胞体积的系统和方法的有效性,将1μl血样沉积在显微镜载玻片上以在载玻片上形成单层红细胞。使用在共同待决的美国专利申请系列号12/430,885(将其通过全文提述并入本文)中披露的系统沉积血样。然后使用固定剂、红色染色剂(例如,包含曙红y)、蓝色染色剂(例如,包含天蓝b和亚甲基蓝)以及共同待决的美国专利申请系列号61/505,011中记载的漂洗制剂在共同待决的美国专利申请系列号13/293,050(将其通过全文提述并入本文)所记载类型的自动化系统中制备样品。在血样固定、染色、漂洗和干燥后,自动化运输机制将载玻片加载到低倍放大(例如,在10x物镜)成像台处的自动化台阶上。自动化运输机制将样品定位在光源(例如,源106)和检测器(例如,检测器102)之间。所述样品的高倍放大成像在对应于关注物体的位置处获取。检测器配对以50x物镜,并且包括640x480像素的ccd传感器。经由检测器获取的图形的像素尺寸为7.4μm;视场的尺寸为:成像系统使用50x物镜获得数百幅样品的图像。对于样品上的每个位置,在四个颜色的照射光(635,598,525和415nm)处获得图像。每个图像通常包括100或更多个红细胞,并因此图像的高倍放大图像产生60,000或更多个红细胞的图像。图7显示了样品的示意图700,其使用蓝色照射光(例如,在415nm的波长处)获得,尽管更一般而言,其它照射波长(例如,635,598,525nm)或其组合也可以用来获得图像、鉴定红细胞和确定细胞体积和成份含量。图像700包括多个鉴定的对象702a-j。通过向图像700应用阈值条件在图像700内定位红细胞。具体地,仅强度灰度为160或更少的像素(对于8-位分辨率的图像而言)经进一步处理,以从红细胞体积分析中排除白细胞。图8为在阈值条件已经应用至图像后显示在图7中的相同样品的示意图800。对象802a-j存在于图像800中。然后实施相关的成份标记过程以将图像800中的单个像素关联至对象802a-j。在该过程完成后,将像素侵蚀掩膜应用至对应于对象802a-j的像素组的每一个以从每个对象的周长除去代表最外层0.5微米的像素。如上所记载的,像素侵蚀减少了由于细胞边界的光折射导致的图像矫作物;这些矫作物,如果未经补偿的话,会导致细胞体积确定中的错误。测量对象802a-j中每一个的一些特征,并且这些测量总结在表1中。已知的每像素面积(每像素0.022平方微米)用来计算每个对象802a-j的面积。面积计算包括细胞的整个面积,后者包括通过像素侵蚀掩膜除去的面积部分。对象802a-j的圆度通过确定每个对象的横截面性状与完美圆形轮廓的偏差来评估。如上文所披露,周长平方对面积的比率对于完美的圆而言为4π。表1中的圆度栏反映了图像800中每个对象的周长平方对面积的比率除以4π。完美圆形的对象将会具有1的圆度值,并且该圆度值随着对象形状越来越不是非圆形而偏离1。还测量了对象802a-j的光密度值。每个对象中的每个像素的灰度值使用方程(2)换算为光密度值。仅确定在侵蚀掩模中的图像像素的光密度值。接着,这些光密度值用来计算每一个对象的平均光密度和最大光密度值。此外,由细胞面积和平均光密度值计算积分光密度值。图8中的对象802a-j每个都鉴定为可能的红细胞。然而,在计算细胞体积之前,从对象802a-j的组选择红细胞的代表性组。为了选择代表性红细胞,参照它们的几何和光密度性质来评估对象以确保它们具有对应于红细胞的合适形状和特征。在第一步骤中,扫描图像800来确定任一对象是否被图像边缘所切割或模糊化(例如,对象仅部分地包含在该图像中)。对象802h和802j每一个均在图像800的边缘处被切割。因此,从进一步分析中排除对象802h和802j;该过程的结果显示在表1中的“部分细胞”栏中。在鉴定代表性红细胞组中的下一个步骤为确定剩余对象(对象802a-g和802i)是否应当包括在该组中。为了从代表性组中消除矫作物和/或重叠细胞组,从进一步分析中排除具有大于65平方微米的面积或小于35平方微米的面积的对象。在图像800中,对象802a,802b和802i中每一个都具有大于65平方微米的面积(分别为97,76和103平方微米,如表1所示)。因此,这些对象均从代表性红细胞组中消除。图8中对象802a的形状表明该对象对应于高度不规则的单个细胞或多个细胞。对象802b和802i中每一个呈现为对应于多个团簇或重叠的细胞。然后分析剩余对象802c-g的光密度值以确定这些对象是否应当被包括在代表性红细胞组中。具体地,将0.33的平均最小光密度阈值应用至每个对象以排除对应于白细胞的对象。如表1所示,对象800c具有0.29的平均光密度值,这表明对象802c不是红细胞,但也许是白细胞核。比较图800中的对象802c和图像700中的相应的对象702c表明对象802c对应于白细胞核,并且因此合适地通过应用光密度值而从代表性组中排除。相对于图像700而言,像素阈值去除了来自对象702c中明显的细胞质的贡献,仅留下在对象802c中可见的白细胞的核。此外,将0.66的平均最大光密度阈值应用至对象802c-g中每一个以确保该对象不对应于多个重叠细胞,其中重叠程度足够高以至于该对象不能基于形状不规则性被否决。对象802f的光密度值超过阈值,并且对象802f因此从代表性红细胞组排除。图8中的对象802f与图7中的相应对象702f的比较表明对象802f对应于两个重叠细胞,并因此适当地被排除。其结果,代表性红细胞组减少至对象802d,802e和802g。然后将这些代表性红细胞用来计算血样的平均细胞体积。来自表1的这些对象中每一个的面积odmean和odmax值用于方程(5)中以计算每个对象的体积。这些体积计算的结果显示在表1的“体积”栏中。将0.5的校正因子应用至这些体积值将细胞体积表示为飞升,如表1中“体积(fl)”栏所示。这些细胞中每一个的个体体积然后用来计算样品的平均细胞体积,其为11.36fl。前述过程可以对于多个样品上的图像位置进行重复(例如,数百次或更多),基于样品中成百上千个代表性红细胞而得到平均细胞体积计算。此外,可以重复上述过程以由在多个照射波长获得的图像来计算颜色特异性积分光密度,iod(c),和颜色特异性细胞体积,vol(c),值。例如,使用全部四个照射颜色(635,598,525和415nm),则颜色特异性积分光密度和细胞体积值可以用于方程8来计算样品的平均细胞体积。表1对象部分细胞面积odmeaniod圆度odmax体积体积(fl)802a否970.7370.811.311.34n/an/a802b否760.4231.921.050.52n/an/a802c否410.2911.891.010.34n/an/a802d否450.4319.431.010.5323.3111.66802e否510.3919.891.020.5623.1311.56802f否470.5324.911.030.84n/an/a802g否420.4418.481.010.5521.7410.87802h是n/an/an/an/an/an/an/a802i否1030.4142.231.040.51n/an/a实施例2表2显示了实施方程(11)来计算血样的平均细胞血红蛋白值的实施例,所述计算部分地基于这些样品的已知mch值组。六个血样使用已知参考系统来处理,其为一种使用荧光流式细胞仪方法来计算全部血细胞计数的多个参数(包括mch)的校正自动化血液学系统。表2中的“参考mch”报道了使用该参考系统处理的每个样品的平均细胞血红蛋白值,单位皮克。然后以与上述相同的方式,处理和成像该六个样品,包括鉴定每个样品的代表性红细胞组。对于每个样品,该系统计算用来获取样品图像的照射的每个颜色(即,黄–635nm;绿–598nm,和蓝–415nm)上的积分光密度值。每个样品基于使用黄、绿和蓝光得到的图像的积分光密度值报道在表2分别标为iod(y)、iod(g)和iod(b)的栏中。对于每个样品,对应于样品照射颜色的三个光密度值用来计算初步细胞血红蛋白值。将先前由参考样品对每个照射波长确定的加权系数使用在以下型式的方程(8)中:h=-0.16·iod(y)+0.04·iod(g)+2.1·iod(b)每个样品的初步细胞血红蛋白值报道在表2的“h”栏中。然后将每个样品的初步细胞血红蛋白值换算为使用参考系统确定的对应平均细胞血红蛋白值。该换算过程包括进行回归分析以将每个样品的初步细胞血红蛋白值关联至报道的参考平均细胞血红蛋白值。最佳的关联对应于换算黄色加权因子以及将截距值添加到上述用来计算初步细胞血红蛋白测量的方程中,如下所示:h=-0.17·iod(y)+0.04·iod(g)+2.1·iod(b)+0.5使用前述方程,计算每个样品的平均细胞血红蛋白值,报道在表中的“实验mch”栏中。该方程然后可以应用至在该实验系统中处理的新样品中以计算mch值,而无需在参考系统中处理这样的样品。表2iod(y)iod(g)iod(b)参考mchh实验mch血样17.7388217.582513.119727.527.0164627.43907血样27.7805318.284515.360632.231.7437632.16595血样37.224416.950614.836131.130.6779331.10569血样46.8893115.453114.423830.229.8058130.23692血样58.62417.84615.757132.832.4239132.83767血样66.9386215.489313.012827.226.8362727.26689本发明提供以下内容:1.用于确定血样的平均细胞体积的方法,该方法包括:使用在多个照射波长上的入射光照射样品,并且获得该样品在所述多个照射波长中每一个上的二维图像;鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,确定对应于所述多个照射波长中每一个的积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞体积;和由所述多个细胞中每一个的细胞体积确定血样的平均细胞体积。2.项1的方法,进一步包括:对于所述多个细胞中的每一个,确定对应于所述多个照射波长中每一个的体积;和对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和体积确定所述细胞体积。3.项1的方法,进一步包括:对于所述多个细胞中的每一个,确定细胞面积;和对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和细胞面积确定细胞体积。4.项2的方法,进一步包括:对于所述多个细胞中的每一个,确定细胞面积;和对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和体积和细胞面积确定细胞体积。5.项1的方法,其中,所述二维图像对应于由样品反射或透射的入射光。6.项1的方法,其中鉴定所述多个细胞包括,对于所述多个细胞中的每一个,鉴定各图像中对应于细胞的第一组像素。7.项6的方法,其中鉴定所述多个细胞包括,对于所述多个细胞中的每一个,从每个图像的第一组像素中去除对应于细胞周长区的像素。8.项7的方法,其中该细胞的周长区具有0.5μm或更大的厚度。9.项6的方法,进一步包括,对于所述多个细胞中的每一个,基于第一组像素确定细胞面积。10.项9的方法,进一步包括,对于所述多个细胞中的每一个,基于第一组像素确定所述细胞的周长,并且如果周长的平方对面积的比率超过阈值,那么从所述平均细胞体积的确定中排除所述细胞。11.项6的方法,进一步包括,对于所述多个细胞中的每一个,确定所述细胞的凸包,确定由该凸包包围的面积,并且如果由该凸包包围的面积对细胞面积的比率超过阈值那么从所述平均细胞体积的确定中排除所述细胞。12.项9的方法,进一步包括,对于所述多个细胞中的每一个,如果所述细胞面积在选定的面积范围之外,那么从所述平均细胞体积的确定中排除所述细胞。13.项1的方法,其中对于所述多个细胞中的每一个,确定对应于所述多个照射波长中每一个的积分光密度包括:确定细胞面积;对于所述多个照射波长中每一个,基于所述图像中对应的一个图像确定所述细胞的平均光密度;和基于对应于每个波长的平均光密度和细胞面积,确定对应于该波长的积分光密度。14.项2的方法,其中,对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定体积包括:对于所述多个照射波长中每一个,确定细胞的平均光密度和最大光密度;和对于所述多个照射波长中每一个,基于对应于该波长的平均光密度对最大光密度的比率确定该细胞的体积。15.项2的方法,其中,对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定体积包括:对于所述多个照射波长中每一个,确定细胞的平均光密度和最大光密度;和对于所述多个照射波长中每一个,基于对应于该波长的平均光密度对最大光密度与在该波长处的校正因子之和的比率确定该细胞的体积。16.项15的方法,进一步包括将补偿值添加至所述平均光密度对最大光密度与校正因子之和的比率中来确定所述细胞在每个照射波长处的体积。17.项16的方法,进一步包括从参考组血样中确定所述校正因子的值和补偿值。18.项1的方法,其中,对于所述多个细胞中的每一个,所述细胞体积是基于对应于所述多个照射波长中每一个的积分光密度的加权线性组合来确定的。19.项2的方法,其中,对于所述多个细胞中的每一个,所述细胞体积是基于对应于所述多个照射波长中每一个的积分光密度和体积的加权线性组合来确定的。20.项4的方法,其中,对于所述多个细胞中的每一个,所述细胞体积是基于对应于所述多个照射波长中每一个的积分光密度和体积和面积的加权线性组合来确定的。21.项18的方法,进一步包括由参考组血样确定所述加权线性组合的加权系数。22.项19的方法,进一步包括由参考组血样确定所述加权线性组合的加权系数。23.项20的方法,进一步包括由参考组血样确定所述加权线性组合的加权系数。24.项1的方法,其中所述多个照射波长包括至少三个波长。25.项24的方法,其中所述多个照射波长包括至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。26.项1的方法,其中所述多个照射波长包括至少四个波长。27.项26的方法,其中所述多个照射波长包括至少一个在620nm~750nm之间的波长、至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。28.一种评估自动化血液分析装置的操作条件的方法,该方法包括:操作所述装置使得所述装置使用项1的方法来确定对照组合物的平均细胞体积;和比较所述对照组合物的平均细胞体积的参考值与所述平均细胞体积的经确定的值来评估所述装置的操作条件。29.项28的方法,进一步包括:确定所述对照组合物的平均细胞体积的经确定的值和参考值之间的差值;和如果所述差值超过阈值,那么重新校准所述装置。30.项29的方法,其中重新校准所述装置包括由参考组血样确定多个加权系数,所述加权系数用来基于对应于所述多个照射波长中每一个的积分光密度确定所述细胞体积。31.一种用于确定血样平均细胞体积的系统,该系统包括:照射源,其配置为将多个照射波长上的入射光导向该样品;检测器,其配置为在所述多个照射波长中每一个上获得该样品的二维图像;和电子处理器,其配置为:鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞体积;和由所述多个细胞中的每一个的细胞体积确定血样的平均细胞体积。32.项31的系统,其中该系统进一步包括自动化血样制备系统。33.项31的系统,其中所述多个照射波长包括至少一个在620nm~750nm之间的波长、至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。34.项31的系统,其中所述电子处理器进一步配置为:对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定体积;和对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和体积确定细胞体积。35.项31的系统,其中所述电子处理器进一步配置为:对于所述多个细胞中的每一个,确定细胞面积;和对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和面积确定细胞体积。36.项34的系统,其中所述电子处理器进一步配置为:对于所述多个细胞中的每一个,确定细胞面积;和对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度和体积和面积确定细胞体积。37.一种计算机可读的存储装置,具有编码在其上的计算机可读取指令,所述指令当由处理器执行时,造成该处理器:接收多个血样图像,所述多个图像中的每一个对应于入射在样品上的照射光的不同波长;鉴定在每一个图像中出现的多个细胞;对于所述多个细胞中的每一个,对应于所述多个照射波长中每一个确定积分光密度;对于所述多个细胞中的每一个,基于对应于所述多个照射波长中每一个的积分光密度确定细胞体积;和由所述多个细胞中的每一个的细胞体积确定血样的平均细胞体积。38.一种确定红细胞的血红蛋白含量值的方法,所述方法包括:(a)使用在多个照射波长上的入射光照射细胞;(b)对应于每个照射波长获得该细胞的至少一个二维图像;(c)对应于每个照射波长,确定细胞的平均光密度和最大光密度;(d)确定细胞面积;(e)对应于每个照射波长,基于该细胞对应于该照射波长的平均光密度和最大光密度和细胞面积确定该细胞的体积;(f)对应于每个照射波长,基于该细胞对应于该照射波长的平均光密度和细胞面积确定该细胞的积分光密度;和(g)基于该细胞对应于照射波长中每一个的体积,该细胞对应于照射波长中每一个的积分光密度,和细胞面积的加权组合确定该细胞的血红蛋白含量值。39.项38的方法,进一步包括:对于来自血样的多个红细胞重复步骤(a)至(g)来确定所述多个红细胞中每一个的血红蛋白含量值;和由所述多个红细胞中每一个的血红蛋白含量值确定所述样品的平均细胞血红蛋白值。40.项39的方法,进一步包括在所述细胞的每一个图像中鉴定对应于所述细胞的第一组像素。41.项40的方法,进一步包括在每一个图像中通过从第一组像素中去除对应于所述细胞周长区的像素来鉴定对应于细胞的第二组像素。42.项40的方法,进一步包括基于第一组像素确定细胞面积。43.项42的方法,进一步包括基于第一组像素确定所述细胞的周长,并且如果周长的平方对面积的比率超过阈值,那么从平均细胞血红蛋白值的确定中排除所述细胞。44.项42的方法,进一步包括确定所述细胞的凸包,确定由该凸包包围的面积,并且如果该凸包包围的面积对所述细胞面积的比率超过阈值,那么从平均细胞血红蛋白值的确定中排除所述细胞。45.项39的方法,进一步包括如果所述细胞面积在选定的面积范围之外,那么从平均细胞血红蛋白值的确定中排除所述细胞。46.项38的方法,进一步包括基于对应于每个照射波长的平均光密度对最大光密度的比率确定所述细胞在所述照射波长上的体积。47.项38的方法,进一步包括基于在每个照射波长上的平均光密度对最大光密度与校正因子之和的比率确定所述细胞在该照射波长上的体积。48.项47的方法,进一步包括将补偿值添加至所述平均光密度对最大光密度与校正因子之和的比率中来确定所述细胞在每个照射波长上的体积。49.项48的方法,进一步包括由参考组血样确定校正因子的值和补偿值。50.项38的方法,其中所述多个照射波长包括至少三个照射波长。51.项50的方法,其中所述多个照射波长包括至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。52.项38的方法,其中所述多个照射波长包括至少四个照射波长。53.项52的方法,其中所述多个照射波长包括至少一个在620nm~750nm之间的波长、至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。54.一种评估自动化血液分析装置的操作条件的方法,所述方法包括:操作所述装置使得所述装置使用项39的方法来来确定对照组合物的平均细胞血红蛋白值;和比较所述对照组合物的平均细胞血红蛋白的参考值与所述平均细胞血红蛋白的经确定的值来评估所述装置的操作条件。55.项54的方法,进一步包括:确定对照组合物的平均细胞血红蛋白的经确定的值和参考值之间的差值;和如果所述差值超过阈值,那么重新校准所述装置。56.项55的方法,其中重新校准所述装置包括由参考组血样确定多个加权系数,所述加权系数用来基于该细胞对应于照射波长中每一个的体积,该细胞对应于照射波长中每一个的积分光密度,和细胞面积确定所述细胞的血红蛋白含量值。57.一种用于确定红细胞的血红蛋白含量值的系统,所述系统包括:照射源,其配置为使用在多个照射波长上的入射光照射细胞;检测器,其配置为对应于每一个照射波长获得该细胞的至少一个二维图像;和电子处理器,其配置为:(a)确定所述细胞在每个照射波长上的平均光密度和最大光密度;(b)确定所述细胞的面积;(c)对于每个照射波长,基于所述细胞对应于该照射波长的平均光密度和最大光密度和细胞面积确定所述细胞的体积;(d)对于每个照射波长,基于所述细胞对应于该照射波长的平均光密度和细胞面积确定所述细胞的积分光密度;和(e)基于所述细胞对应于照射波长中每一个的体积,所述细胞对应于照射波长中每一个的积分光密度,和细胞面积的加权组合确定所述细胞的血红蛋白含量值。58.项57的系统,其中该电子处理器进一步配置为:对于来自血样的多个红细胞重复步骤(a)至(e)来确定所述多个红细胞中每一个的血红蛋白含量值;和由所述多个红细胞中的每一个的血红蛋白含量值确定所述样品的平均细胞血红蛋白值。59.项57的系统,其中所述多个照射波长包括至少一个在620nm~750nm之间的波长、至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。60.项57的系统,进一步包括自动化血样制备系统。61.一种确定血小板体积的方法,所述方法包括:(a)使用在多个照射波长上的入射光照射血小板;(b)对应于每一个照射波长获得该血小板的至少一个二维图像;(c)对于每个照射波长,确定血小板的平均光密度和最大光密度;(d)确定血小板的面积;(e)对于每个照射波长,基于该血小板对应于所述照射波长的平均光密度和最大光密度和血小板的面积确定血小板的体积;(f)对于每个照射波长,基于该血小板对应于该照射波长的平均光密度和血小板的面积确定该血小板的积分光密度;和(g)基于所述血小板对应于照射波长中每一个的体积,所述血小板对应于照射波长中每一个的积分光密度,和血小板的面积的加权组合确定所述血小板的体积。62.项61的方法,进一步包括:对于来自血样的多个血小板重复步骤(a)至(g)来确定所述多个血小板中每一个的体积;和由所述多个血小板中每一个的体积确定所述样品的平均血小板体积。63.项61的方法,进一步包括在所述血小板的每一个图像中鉴定对应于所述血小板的像素组。64.项63的方法,其中鉴定所述像素组包括:鉴定对应于所述血小板的中心区的第一组像素;鉴定对应于所述血小板的非中心区的第二组像素;和合并所述第一组像素和所述第二组像素以形成对应于所述血小板的像素组。65.项64的方法,进一步包括在对应于不同照射波长的至少两个图像中基于所述像素组的每个成员的强度值鉴定所述第二组像素。66.项62的方法,其中所述多个照射波长包括在电磁谱的蓝色区中的照射波长和在电磁谱的黄色区中的照射波长,以及所述方法包括获得对应于所述蓝色区中照射波长的血小板的图像和对应所述黄色区中照射波长的血小板的图像。67.项66的方法,进一步包括如果所述血小板在对应于所述黄色区中照射波长的图像中的积分光密度大于600,那么从平均血小板体积的确定中排除所述血小板。68.项66的方法,进一步包括如果所述血小板在对应于所述蓝色区中照射波长的图像中的积分光密度大于200,那么从平均血小板体积的确定中排除所述血小板。69.项63的方法,进一步包括基于所述像素组确定所述血小板的面积。70.项61的方法,进一步包括基于对应于每一个照射波长的平均光密度对最大光密度的比率确定所述血小板在该照射波长上的体积。71.项61的方法,进一步包括基于在每个照射波长上的平均光密度对最大光密度与校正因子之和的比率确定所述血小板在该照射波长上的体积。72.项70的方法,进一步包括将补偿值添加至所述平均光密度对最大光密度与校正因子之和的比率中来确定所述血小板在每个照射波长上的体积。73.项72的方法,进一步包括由参考组血样确定校正因子的值和补偿值。74.项61的方法,其中所述多个照射波长包括至少三个照射波长。75.项74的方法,其中所述多个照射波长包括至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。76.项61的方法,其中所述多个照射波长包括至少四个波长.77.项76的方法,其中所述多个照射波长包括至少一个在620nm~750nm之间的波长、至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。78.一种评估自动化血液分析装置的操作条件的方法,所述方法包括:操作所述装置使得所述装置使用项62的方法来确定对照组合物的平均血小板体积;和比较所述对照组合物的平均血小板体积的参考值与所述平均血小板体积的经确定的值来评估所述装置的操作条件。79.项78的方法,进一步包括:确定对照组合物的平均血小板体积的经确定的值和参考值之间的差值;和如果所述差值超过阈值,那么重新校准所述装置。80.项79的方法,其中重新校准所述装置包括由参考组血样确定多个加权系数,所述加权系数用来基于该血小板对应于照射波长中每一个的体积,该血小板对应于照射波长中每一个的积分光密度,和血小板面积来确定所述血小板的体积。81.一种用于确定血小板体积的系统,所述系统包括:照射源,其配置为使用在多个照射波长上的入射光照射血小板;检测器,其配置为对应于每一个照射波长获得所述血小板的至少一个二维图像;和电子处理器,其配置为:(a)在每个照射波长上确定所述血小板的平均光密度和最大光密度;(b)确定所述血小板的面积;(c)对于每个照射波长,基于所述血小板对应于该照射波长的平均光密度和最大光密度和血小板的面积确定所述血小板的体积;(d)对于每个照射波长,基于该血小板对应于该照射波长的平均光密度和血小板的面积确定所述血小板的积分光密度;和(e)基于该血小板对应于照射波长中每一个的体积,该血小板对应于照射波长中每一个的积分光密度,和血小板面积的加权组合确定所述血小板的体积。82.项81的系统,其中所述电子处理器进一步配置为:对于来自血样的多个血小板重复步骤(a)至(e)以确定所述多个血小板中每一个的体积;和由所述多个血小板中每一个的体积确定所述样品的平均血小板体积。83.项81的系统,其中所述多个照射波长包括至少一个在575nm~600nm之间的波长、至少一个在525nm~570nm之间的波长和至少一个在400nm~475nm之间的波长。84.项81的系统,进一步包括自动化血样制备系统。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1