单细胞质谱分析方法与流程
本发明涉及生物领域。具体地,本发明涉及单细胞质谱分析方法。
背景技术:
相同基因型的细胞群体中个体之间会存在较大的差异,即细胞异质性。细胞间在基因转录、蛋白表达、代谢等各个方面均有着显著的差异性。因此,单细胞分析对于研究细胞间异质性研究有着重要意义。多种技术已经被广泛应用于单细胞分析,例如单细胞测序、荧光检测技术、微流控技术、流式细胞仪、质谱仪等。其中,质谱仪因其高灵敏度、准确的结构鉴定、定量分析等特性,广泛应用于单细胞分析中。然而,细胞本身的小尺寸和小体积给单细胞质谱分析带来了巨大的挑战。例如单个细胞的直径为1~30μm,体积为fl~nl级别。对细胞内的代谢物稀释过度,便会导致浓度过低,超出质谱检测范围;如果稀释过少,可供分析的样品量就过少,对样品的操控难度就大大增加。
目前,各种各样的单细胞质谱技术已经被开发出来了,例如活细胞质谱技术、毛细管微采样质谱技术、探针质谱技术等等。这些技术多是依赖于高精度操作平台,利用毛细玻璃管、金属探针等深入到细胞内部,对细胞内代谢物吸取/萃取,从而实现单细胞操控、采样、分析。另一类技术是依托于解吸附技术,例如基质辅助激光解吸附电离、解吸附电喷雾电离、纳米阵列激光解吸附电离等技术。这些技术也需要依赖于高精度操作平台,实现对单个细胞的采样。由此,极大地提高了采样成本,降低了操作的便捷性,不利于推广应用。
因此,目前针对单细胞质谱分析方法仍有待研究。
技术实现要素:
本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。为此,本发明提出了单细胞质谱分析方法,利用该方法无需依赖于高精度操控平台即可有实现对单细胞的采样,尤其适用于具有碳碳双键的脂类化合物,首次实现了单细胞内脂类碳碳双键异构体的鉴定与分析,对生物体内脂类代谢的研究具有重要意义。并且,该方法操作简便,成本低,适于规模化应用。
本发明提出了单细胞质谱分析方法。根据本发明的实施例,所述方法包括:将待测细胞进行细胞固定及稀释处理,以便得到预处理细胞悬浮液;将所述预处理细胞悬浮液由毛细管的尾端注入内腔中,所述内腔中插有电极;向所述电极施加电压,使得细胞迁移至所述毛细管尖端;使所述毛细管内液体蒸发完全;向所述毛细管尖端滴加辅助液体,使所述辅助液体进入所述毛细管中并与所述细胞接触,萃取出目标物,同时,向所述电极施加电压以进行电喷雾,使含有所述目标物的辅助液体被离子化,从所述尖端射出,并进入质谱仪进样口,进行质谱分析。
根据本发明实施例的方法中,将经过细胞固定处理的细胞液稀释一定倍数,使得加入到毛细管中的预处理细胞悬浮液中的细胞数接近单细胞。利用细胞表面带负电的特性,对电极施加负电压,则细胞会迁移至毛细管尖端。因此,由于不利用毛细管、金属探针等深入到细胞内部提取目标物,所以无需依赖于高精度操控平台,方便实施,降低成本。
接着,使毛细管中的液体蒸发,便于后续辅助液体通过毛细作用进入毛细管内腔中。由于毛细管内液体含量很少,所以短时间内即可实现液体完全蒸发。然后,在毛细管尖端滴加辅助液体,辅助液体在毛细作用下进入毛细管内腔中,与细胞接触,从而将细胞内的目标物溶出,达到萃取目的。同时,对电极施加电压以实现电喷雾,被离子化的目标物射出进入质谱仪,即可进行质谱分析。由此,根据本发明实施例的单细胞质谱分析方法操作简便,效率高,成本低,适于规模化应用。
根据本发明的实施例,所述单细胞质谱分析方法还可以具有下列附加技术特征:
根据本发明的实施例,所述目标物为具有碳碳双键的脂类物质,所述方法进一步包括以下步骤,以便于对所述脂类物质中碳碳双键位置进行鉴定:将经过所述细胞固定处理后的细胞悬浮液进行光化学衍生处理,再将所得到的细胞悬液进行所述稀释处理。
根据本发明的实施例,所述光化学衍生处理所采用的衍生试剂选自水溶性羰基化合物,优选2-乙酰吡啶、3-乙酰吡啶或者4-乙酰吡啶。
根据本发明的实施例,所述光化学衍生处理包括:将所述细胞悬液与所述衍生试剂进行混合,并于250~260nm紫外光下照射1~15分钟。
根据本发明的实施例,所述预处理细胞悬浮液中细胞个数为2×103~1×104个/ml,加入所述毛细管中的所述预处理细胞悬浮液的体积为0.3~0.6μl。
根据本发明的实施例,所述细胞固定处理所采用的细胞固定液选自多聚醛基化学物,优选多聚甲醛或戊二醛。
根据本发明的实施例,所述毛细管尖端的外径小于所述预处理细胞悬浮液中的细胞直径。
根据本发明的实施例,所述毛细管尖端的外径为3~10μm。
根据本发明的实施例,所述辅助液体选自甲醇、乙醇、乙腈、丙酮、氯仿、异丙醇和水的至少之一。
根据本发明的实施例,所述目标物选自甘油磷酸胆碱、甘油二酯、甘油三酯、脂肪酸和胆固醇油酸酯的至少之一。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
图1显示了根据本发明一个实施例的单细胞质谱分析方法流程示意图;
图2显示了根据本发明一个实施例的反应装置图;
图3显示了根据本发明一个实施例的毛细玻璃管结构示意图,其中(a)为毛细玻璃管及电极的结构示意图,1为毛细玻璃管,2为电极;(b)为单个mcf7细胞被迁移到拉制的毛细玻璃管尖端的显微镜图;
图4显示了根据本发明一个实施例的单个mcf7细胞的脂类物质质谱图;
图5显示了根据本发明一个实施例的单个光化学衍生后的mcf7细胞的脂类物质质谱图;
图6显示了根据本发明一个实施例的3种乙酰吡啶的转化率比较示意图;
图7显示了根据本发明一个实施例的单个mcf7内,确定甘油磷酸胆碱(pc)的碳碳双键异构体的串级质谱谱图;
图8显示了根据本发明一个实施例的单个mcf7内,确定脂肪酸(fa)、甘油二酯(dag)、甘油三酯(tag)、胆固醇油酸酯(ce)的碳碳双键异构体结构的串级质谱图。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
为了方便理解,下面对单细胞质谱分析方法进行详细描述。
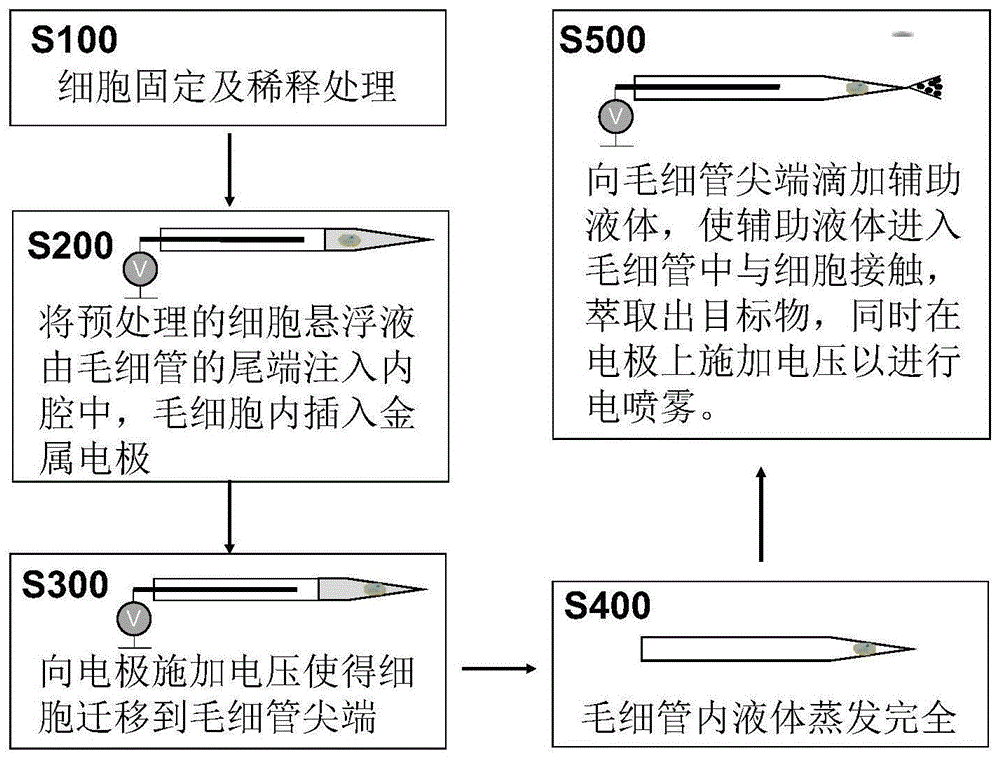
本发明提出了一种单细胞质谱分析方法。根据本发明的实施例,参见图1,该方法包括:
s100细胞固定及稀释处理
在该步骤中,将待测细胞液进行细胞固定及稀释处理,以便得到预处理细胞悬浮液。
通过将细胞固定,使细胞内的蛋白质、抗原、细胞骨架等沉淀或固定,定位在细胞内原有位置,终止或减少外源性和内源性分解酶的反应,防止组织因离体时间延长而发生细胞自溶,减少细胞可溶性蛋白质、脂肪和糖类物质的弥散、破坏与丢失。具体地,可以采用多聚醛基化学物,尤其是多聚甲醛或戊二醛进行细胞固定。
需要说明的是,本发明对于细胞悬液中目标物类型不做严格限定,任何细胞代谢物都可以采用本发明的单细胞质谱分析方法进行分析,尤其是具有碳碳双键的脂类物质,例如甘油磷酸胆碱、甘油二酯、甘油三酯、脂肪酸和胆固醇油酸酯的至少之一。细胞内脂类等物质的同分异构体结构比较复杂。例如,对于甘油磷酸胆碱,其结构信息便包含了脂肪酸链组成、脂肪酸链位置、不饱和双键位置、不饱和双键构型等多种信息。脂类的异构体相对含量变化,对生物的发展有着重要的意义。
根据本发明的实施例,目标物为具有碳碳双键的脂类物质,该方法进一步包括以下步骤,以便于对脂类物质中碳碳双键位置进行鉴定:将经过细胞固定处理后的细胞液进行光化学衍生处理,再将所得到的细胞悬液进行稀释处理。
不饱和脂类物质经过衍生化反应后得到环氧化产物,该环氧化产物较原脂质(即衍生前的脂质分子)的分子量增加特定值。选取待分析物的环氧化产物进行串级质谱分析,选取依据是环氧化产物较衍生前的脂质分子的质量数增加特定值。在cid碎裂模式下,被衍生的脂质分子会生成c=c位置的特异性诊断离子,每对诊断离子会相差该特定值,从而实现对脂质c=c位置的鉴定。
根据本发明的实施例,光化学衍生处理所采用的衍生试剂选自水溶性羰基化合物,优选2-乙酰吡啶、3-乙酰吡啶或者4-乙酰吡啶。发明人发现,针对单细胞的衍生化处理,对所采用的衍生试剂要求较高,某些试剂会导致无法实验单细胞检测,例如丙酮。丙酮为脂溶性有机溶剂,加入到含有众多细胞的细胞悬浮液中容易造成细胞膜溶解,导致众多细胞中的代谢物混为一体,从而无法满足单细胞检测的要求。为此,发明人在众多试剂中发现,水溶性羰基化合物,尤其是2-乙酰吡啶、3-乙酰吡啶或者4-乙酰吡啶的效果较佳,可使得反应在水溶液中进行,不会造成细胞破裂,从而不会造成细胞之间的内部代谢物互通,且能够获得可检测的环氧化物,转化率高,保证质谱检测的准确性。
根据本发明的实施例,光化学衍生处理包括:将细胞悬浮液与衍生试剂进行混合,并于250~260nm紫外光下照射1~15分钟。光衍生反应可在石英反应盒中进行,反应装置参见图2。由此,可以有效地获得环氧化衍生物,从而便于后续质谱检测分析,识别鉴定出c=c位置。
根据本发明的实施例,预处理细胞悬浮液中细胞个数为2×103~1×104个/ml。由此,能够满足后续加入毛细管中的细胞个数为1~5个左右,从而实现单细胞分析。
s200将预处理的细胞悬浮液由毛细管的尾端注入内腔中,毛细胞内插入金属电极
在该步骤中,将预处理的细胞悬浮液由毛细管的尾端注入内腔中,毛细胞内插入金属电极。
根据本发明的实施例,所用的毛细玻璃管可以通过p1000拉针仪拉制,玻璃管尖端直径为3~10μm。可以使用2.5μl标准移液枪,转移0.3~0.6μl预测细胞液(2×103~1×104个/ml)到毛细玻璃管尖端,统计上来看,较大概率会有1~5个细胞被加入到毛细管内。由于细胞数较少,因此可以直接采用含有1~5个细胞的毛细管进行后续实验。若是对于分析要求较高,通过显微镜观察,可以舍弃细胞数过多(例如含有2个、3个、4个或5个细胞)的毛细管,选择仅含有特定细胞数(例如1个、2个)的毛细管进行后续实验。
s300向电极施加电压使细胞迁移到毛细管尖端
在该步骤中,向电极施加电压,使得细胞迁移至毛细管尖端。
目前,大多利用毛细玻璃管、金属探针等深入到细胞内部,对细胞内代谢物提取、萃取,需要依赖于高精度操控平台。本发明通过将0.3~0.6μl具有1~5个细胞的预处理细胞悬浮液由毛细管的尾端加入到毛细管中,利用细胞带负电的特性,施加负电压后,所施加的电压幅值为800~2000v之间。电压可通过不锈钢电极丝施加,施加时间为5~60s。利用显微镜观察,确定细胞被迁移到毛细玻璃管尖端,如图3所示。
根据本发明的实施例,毛细管尖端的外径小于预处理细胞悬液中的细胞直径。毛细管尖端外径小于细胞直径,否则细胞会从尖端流出,无法实现单细胞的隔离以及后续采样分析。根据本发明的具体实施例,毛细管尖端的外径为3~10μm。
s400毛细管内液体蒸发完全
在该步骤中,使毛细管内液体蒸发完全。将毛细管静置一段时间(一般为2~5分钟),使毛细管内液体蒸发完全。毛细管内液体体积较少,短时间内便可蒸发完全。显微镜下观察,尖端无液体,即可视为蒸发完毕。液体蒸发使得毛细管前端开口处可通过毛细作用吸取后续步骤的辅助液体,从而实现细胞内代谢物的萃取与质谱分析。
s500向毛细管尖端滴加辅助液体,使辅助液体进入毛细管中与细胞接触,萃取出目标物,同时在电极上施加电压以进行电喷雾。
在该步骤中,向毛细管尖端滴加辅助液体,使辅助液体进入毛细管中并与细胞接触,萃取出目标物,同时,向电极施加电压以进行电喷雾,使含有目标物的辅助液体被离子化,从尖端射出,并进入质谱仪进样口,进行质谱分析。由此,以实现质谱分析。
需要说明的是,本发明对于辅助液体的类型不做严格限定,可以为本领域所公开的任何萃取试剂,只要能够将细胞内的目标物萃取出来即可,具体可以根据实际情况灵活选择。根据本发明的实施例,辅助液体包括但不限于甲醇、乙醇、乙腈、丙酮、异丙醇、氯仿和水等。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1单个mcf7细胞内的脂类物质分析
细胞的固定:将培养好的mcf7细胞(7~8μm)转移到pbs中,1200rpm离心,将细胞重新悬浮于含有2.5%的戊二醛的磷酸盐缓冲溶液(pbs)中,二十分钟后,离心,收集细胞并重悬于水中,得到细胞悬浮液。
毛细玻璃管制备:使用p1000拉针仪,拉制尖端直径为5μm毛细玻璃管。
质谱分析:
(1)将0.5μl细胞悬浮液由毛细玻璃管尾端加入到毛细玻璃管内,显微镜下选择含有1个细胞的毛细玻璃管,利用-1.2kv电压将单个mcf7细胞迁移到毛细玻璃管前端。
(2)等待毛细玻璃管内液体蒸发完毕。
(3)施加-+1.8kv电压,同时从尖端滴加辅助液滴。滴加的辅助液滴为甲醇:乙腈=1:1(v/v),含有1%的甲酸。
单个细胞被迁移到毛细玻璃管尖端如图3所示,所得到的质谱图如图4所示。检测到的脂类物质主要为甘油磷酸胆碱、甘油三酯等。检测结果表明该方法能够简单高效的实现单细胞内的脂类物质检测分析。
实施例2单个光化学衍生后的mcf7细胞的脂类物质分析
细胞的固定:将培养好的细胞转移到pbs中。利用1200rpm离心,将细胞重新悬浮于含有2.5%的戊二醛的磷酸盐缓冲溶液(pbs)中,二十分钟后,离心,收集细胞并重悬于水中。
细胞的光化学衍生:在细胞悬浮液内,加入终浓度为100mm的2-乙酰吡啶溶液。在石英反应盒(如图2所示)中,进行紫外光化学反应,所用的紫外灯为254nm,反应时间为8分钟。
毛细玻璃管制备:使用p1000拉针仪,拉制尖端直径为5μm毛细玻璃管。
质谱分析:
(1)将0.5μl细胞悬浮液(1~5个细胞)由毛细玻璃管尾端加入到毛细玻璃管内,显微镜下选择含有1个细胞的毛细玻璃管,利用-1.2kv电压将单个衍生后的mcf7细胞迁移到毛细玻璃管前端。
(2)等待毛细玻璃管内液体蒸发完毕。
(3)施加-+1.8kv电压,同时从尖端滴加辅助液滴。滴加的辅助液滴为甲醇:乙腈=1:1(v/v),含有1%的甲酸。
所得到的质谱图如图5所示。检测到的脂类物质主要为甘油磷酸胆碱、脂肪酸、甘油二酯、甘油三酯、胆固醇油酸酯等。检测结果表明该方法能够简单高效的实现衍生后的单细胞内的脂类物质检测分析。
同时,发明人比较了采用2-乙酰吡啶(2ap)、3-乙酰吡啶(3ap)、4-乙酰吡啶(4ap)进行光衍生化反应的效果。结果如图6所示。从反应产率来看,2-乙酰吡啶效果最好。
实施例3单个光化学衍生后的mcf7细胞内甘油磷酸胆碱(pc)的碳碳双键异构体结构鉴定
细胞的固定:将培养好的细胞转移到pbs中。利用1200rpm离心,将细胞重新悬浮于含有2.5%的戊二醛的磷酸盐缓冲溶液(pbs)中,二十分钟后,离心,收集细胞并重悬于水中。
细胞的光化学衍生:在细胞悬浮液内,加入终浓度为100mm的2-乙酰吡啶溶液。在石英反应盒(如图2所示)中,进行紫外光化学反应,所用的紫外灯为254nm,反应时间为8分钟。
毛细玻璃管制备:使用p1000拉针仪,拉制尖端直径为5μm毛细玻璃管。
质谱分析:
(1)将0.5μl细胞悬浮液(1~5个细胞)由毛细玻璃管尾端加入到毛细玻璃管内,显微镜下选择含有1个细胞的毛细玻璃管,利用-1.2kv电压将单个衍生后的mcf7细胞迁移到毛细玻璃管前端。
(2)等待毛细玻璃管内液体蒸发完毕。
(3)施加-+1.8kv电压,同时从尖端滴加辅助液滴。滴加的辅助液滴为甲醇:乙腈=1:1(v/v),含有1%的甲酸。同时采用串级质谱对特定的脂质进行结构分析。
以pc34:1为例,所得到的质谱图如图7。pc34:1的双键异构体有三种:pc16:0_18:1(δ8)、pc16:0_18:1(δ9)和pc16:0_18:1(δ11)。pc16:0_18:1(δ8)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为636和725。pc16:0_18:1(δ9)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为650和739。pc16:0_18:1(δ11)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为678和767。在质谱图中,通过计算这三对诊断离子的强度比值,即可得到细胞内三种异构体的相对含量比值。
实施例4单个光化学衍生后的mcf7细胞内脂肪酸(fa)、甘油二酯(dag)、甘油三酯(tag)、胆固醇油酸酯(ce)的碳碳双键异构体结构鉴定
细胞的固定:将培养好的细胞转移到pbs中。利用1200rpm离心,将细胞重新悬浮于含有2.5%的戊二醛的磷酸盐缓冲溶液(pbs)中,二十分钟后,离心,收集细胞并重悬于水中。
细胞的光化学衍生:在细胞悬浮液内,加入终浓度为100mm的2-乙酰吡啶溶液。在石英反应盒(如图2所示)中,进行紫外光化学反应,所用的紫外灯为254nm,反应时间为8分钟。
毛细玻璃管制备:使用p1000拉针仪,拉制尖端直径为5μm毛细玻璃管。
质谱分析:
(1)将0.5μl细胞悬浮液(1~5个细胞)由毛细玻璃管尾端加入到毛细玻璃管内,显微镜下选择含有1个细胞的毛细玻璃管,利用-1.2kv电压将单个衍生后的mcf7细胞迁移到毛细玻璃管前端。
(2)等待毛细玻璃管内液体蒸发完毕。
(3)施加-+1.8kv电压,同时从尖端滴加辅助液滴。滴加的液滴为甲醇:乙腈:氯仿=45:45:10(v/v),含有1%的甲酸。同时采用串级质谱对特定的脂质进行结构分析。
对于脂肪酸(fa),以fa18:1为例,所得到的质谱图如图8(a)。fa18:1的双键异构体有两种,fa18:1(δ9)和fa18:1(δ11)。fa18:1(δ9)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为232,262。fa18:1(δ11)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为204,290。在质谱图中,通过计算这两对诊断离子的强度比值,即可得到细胞内两种异构体的相对含量比值。
对于甘油二脂(dag),以dag18:1_18:1为例,所得到的质谱图如图8(b)。dag18:1_18:1的双键异构体有两类,含有c18:1(δ9)和c18:1(δ11)。含有c18:1(δ9)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为493,600。含有c18:1(δ11)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为521,628。在质谱图中,通过计算这两对诊断离子的强度比值,即可得到细胞内两种异构体的相对含量比值。
对于胆固醇油酸酯(ce),以ce18:1为例,所得到的质谱图如图8(c)。ce18:1的双键异构体有两种,ce18:1(δ9)和ce18:1(δ11)。ce18:1(δ9)在光化学衍生后,通过串级质谱,可以得到诊断离子,荷质比为630。ce18:1(δ11)在光化学衍生后,通过串级质谱,可以得到诊断离子,荷质比为658。ce特有的胆固醇峰(荷质比369)可以在质谱图中观察到。在质谱图中,通过计算这两个诊断离子的强度比值,即可得到细胞内两种异构体的相对含量比值。
对于甘油三酯(tag),以tag18:1_18:1_18:1为例,所得到的质谱图如图8(d)。tag18:1_18:1_18:1的双键异构体有两种,含有c18:1(δ9)和c18:1(δ11)。含有c18:1(δ9)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为493,864。含有c18:1(δ11)在光化学衍生后,通过串级质谱,可以得到一对诊断离子,荷质比为521,892。在质谱图中,通过计算这两对诊断离子的强度比值,即可得到细胞内两种异构体的相对含量比值。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!