一种循环肿瘤细胞CTCs的检测鉴定方法与流程
本发明属于分子生物学技术领域,具体涉及一种循环肿瘤细胞ctcs的检测鉴定方法。
背景技术:
技术的不断改进和发展,ctcs的研究已成为当前肿瘤学研究的热点:不仅有助于对肿瘤转移机制的了解,而且在临床上有助于发现早期微转移、评估预后、评价治疗效果和实现个体化药物治疗。
ctcs检测首先要把血液中的肿瘤细胞和血细胞分离开来,分离方法有两大类:一类是根据细胞的特异性生物标记来富集,采用这一技术路线的主要有cellsearch系统、免疫磁性细胞分选仪(macs)、adnatest癌细胞检测系统、莱尔系统等。另一类是根据ctcs和血细胞物理特性的不同进行分离富集,包括密度梯度离心法和膜滤过分离肿瘤细胞法(isolationbysizeofepithelialtumorcells,iset)。目前,已有至少53种以上基于上述理论方法的检测技术体系被报道,但没有一种方法能够将ctcs没有遗漏地检测出来。ctcs检测成为制约ctcs临床应用的瓶颈。
目前,山东省第一医科大学、山东省药物研究院联合山东祺欣生物科技有限公司、山东喻晓生物科技有限公司、济南杏恩生物科技有限公司、山东发现生物技术有限公司等单位,对于循环肿瘤细胞检测鉴定关键技术进行产业化推广的研究,本项目为山东省重大科技创新工程项目,本项目将以山东第一医科大学济南校区的山东省药物研究院为核心,落实注册人制度,依托循环肿瘤细胞检测鉴定核心诊断技术,进一步注册鉴定诊断试剂盒,以包括pd1、pd-l1、er、pr、her-2、gpc-3、vegf、p53、vimentin、tki-egfr、ras、ck、alk-d5f3、cd20、alk/eml4、beta-catenin、e-cadherin、ep-cam、hpv、idh-1、psa、psma、vegf、gfap、细胞角蛋白、ae1/ae3、雌激素受体、孕激素受体、bca-225、ca125、cea、ema、ercc1、hpv、ki-67、p53、top2a等作为ctcs表达的示踪剂,注册超灵敏、超快速、高覆盖、低成本、准确特异的鉴定诊断试剂盒,通过与在济南注册的山东祺欣生物科技有限公司、山东喻晓生物科技有限公司、济南杏恩生物科技有限公司、山东发现生物技术有限公司合作进行产业化推广。
技术实现要素:
本发明的目的在于提供一种将多种检测技术手段相结合,科学合理、准确高效的的循环肿瘤细胞ctcs的检测鉴定方法。
本发明是通过以下技术手段来实现的:
一种循环肿瘤细胞ctcs的检测鉴定方法,采用物理方法捕获、形态方法识别、免疫方法验证。
所述的物理方法捕获为:
a.采集癌症患者外周血,盛于血样容器中;
b.血样容器的下方连接一带有过滤膜的过滤器,将外周血经过滤器过滤;所述过滤膜上均匀布满直径为10-25微米的滤孔;
c.过滤完成后,进行瑞氏液染色,pbs缓冲液冲洗干净,取下滤膜,收集过滤膜上的循环肿瘤细胞ctcs。
所述的形态方法识别为:将收集的循环肿瘤细胞ctcs,放置到电子显微镜下,统计循环肿瘤细胞ctcs的数量,测量循环肿瘤细胞ctcs的尺寸,并记录循环肿瘤细胞ctcs的形态,并将其与标准的循环肿瘤细胞ctcs相对比,判断其类别。
所述的免疫方法验证为:将收集的循环肿瘤细胞ctcs加入脱色液中浸泡4-6小时,脱去ctc染色液;室温孵育;滴加100μldab显色液,18~26℃孵育并随时在显微镜下观察显色情况,观察时间为3~10min;弃掉dab显色液,流水冲洗5min,苏木素染色5min;盐酸酒精分化8秒,自来水返蓝5min;返蓝后的ctc采用75%乙醇,95%乙醇,100%乙醇梯度乙醇脱水各10min,然后加入15ml试剂a,振荡均匀后过滤;加入试剂b,脱色30min,干燥,中性树脂封固;光学显微镜下镜检。
上述的检测方法的装置,所述的捕获用的装置有铁架台,铁架台的上方固定有血样容器,血样容器的下方连接有滤器,滤器内固定有滤膜;滤器的下方分别有输液器和废液缸;所述的滤膜均匀布满有向下凹的滤孔,所述的滤孔上孔直径为40-60微米,下孔直径为10-18微米,下凹的深度为10-20微米,上孔与下孔之间呈圆弧状。
本发明的有益效果是,通过物理方法捕获、形态方法识别、免疫方法验证相结合,形成一套科学合理,准确高效的检测鉴定方法,具有简单易行、准确度高的特点。
申请人针对ctcs检测技术体系中关键步骤:富集和鉴定进行攻关,提出了:“物理方法捕获,形态方法识别,免疫方法验证”的解决方案,在截留率、鉴定及假阳性率三个方面取得了核心技术突破性进展,开发了相应的检测设备和配套试剂,开展了临床研究,产生了重要的经济和社会效益。
附图说明:
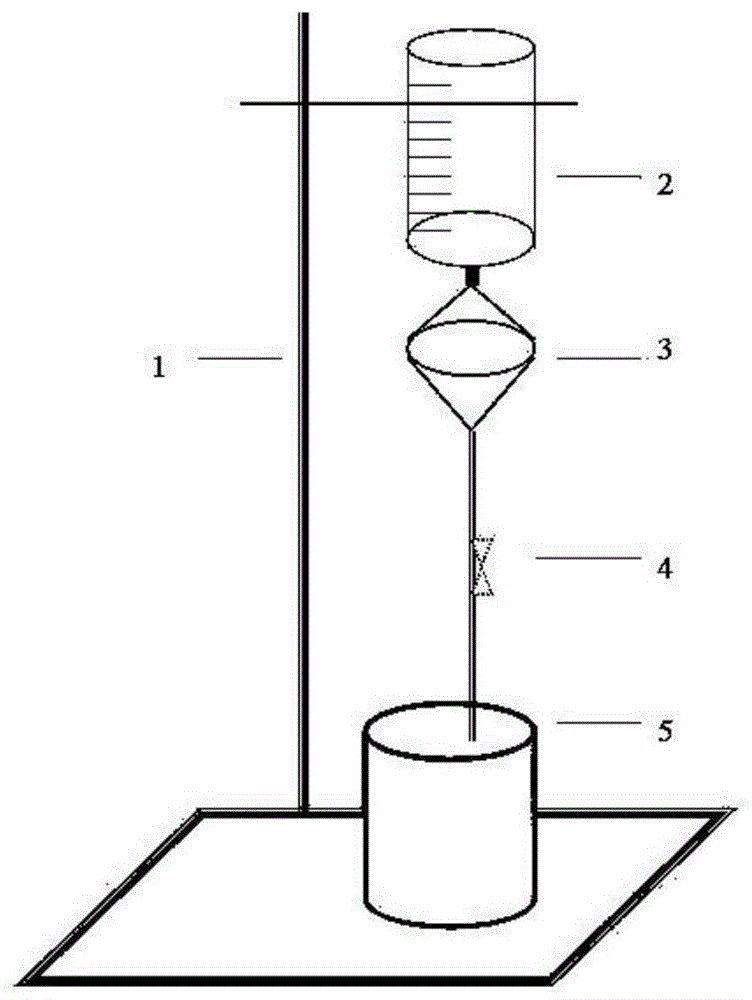
图1是本发明的物理方法捕获的结构示意图。
图2是本发明的过滤膜的俯视图结构示意图。
图3是本发明的过滤膜的剖面图结构示意图。
图4是截留肿瘤细胞示意图。
图5是胰腺癌患者外周血分离获取的循环肿瘤细胞影像图。
图中1.铁架台2.血样容器3.滤器4.输液器5.废液缸。
具体实施方式
实施例1
本发明的过滤装置如图1所示,包括有铁架台1,铁架台1的上方固定有血样容器2,血样容器2的下方连接有滤器3,滤器3内固定有滤膜,滤器3的下方分别有输液器4和废液缸5。
如图2所示,所述的滤膜均匀布满有向下凹的滤孔,所述的滤孔上孔直径为50微米,下孔直径为12微米,下凹的深度为15微米,上孔与下孔之间呈圆弧状。由于本发明将滤膜制成下凹的滤孔,普通细胞可以通过下孔流出,由于循环肿瘤细胞不能通过下孔,因而保留在滤孔内。本发明由于将滤孔制成圆弧状的凹孔,可以最大限度地保留了循环肿瘤细胞原有的形态,避免了循环肿瘤细胞的变形,为下一步的形态识别提供了保障。
以胰腺癌患者外周血循环肿瘤细胞pd-l1为例:
获取循环肿瘤微栓的方法,具体采用以下步骤:分离获取癌症患者外周血5毫升,将外周血经过滤器过滤,过滤完成后,从过滤装置中取下滤器,打开并移走滤器上口,将瑞氏染色液加入到滤器中,a、b染液各染色2min,pbs缓冲液冲洗干净,用眼科镊子取下滤膜,收集过滤膜上的循环肿瘤细胞ctcs。
将收集的循环肿瘤细胞ctcs,放置在载玻片上,直接在显微镜下观察ctm形态特征。统计循环肿瘤细胞ctcs的数量,测量循环肿瘤细胞ctcs的尺寸,并记录循环肿瘤细胞ctcs的形态,并将其与标准的循环肿瘤细胞ctcs相对比,判断其类别。如图4所示,从图中可以看出,分离出长约30微米、宽约18微米的循环肿瘤微栓。
因血样是依靠重力自然滤过,并且采用圆弧形的滤孔,所以分离获得的循环肿瘤微栓形态及免疫特征均不受破坏。
免疫方法验证如下:
将分离的循环肿瘤细胞置于脱色液中浸泡4-6小时,脱去ctc染色液;
滴加100μl0.1%tritonx-100,室温孵育15min,di水洗2min×3次;
滴加100μl0.3%h2o2,室温孵育10min,pbs洗2min×3次;(4)滴加100μl抗人pd-l1一抗,室温孵育2h或4℃过夜,pbs洗2min×3次;
滴加100μl山羊抗人igg/hrp,18~26℃温度下孵育20min,pbs洗2min×3次;
滴加100μldab显色液,18~26℃孵育并随时在显微镜下观察显色情况,观察时间为3~10min;
显色完成后,弃掉dab显色液,流水冲洗5min,苏木素染色5min;
盐酸酒精分化8秒,自来水返蓝5min;
将返蓝后的ctc采用75%乙醇,95%乙醇,100%乙醇梯度乙醇脱水各10min,然后加入15ml试剂a,振荡均匀后过滤;加入试剂b,脱色30min,干燥,中性树脂封固;
光学显微镜下镜检。
- 还没有人留言评论。精彩留言会获得点赞!