一种检测并降解氨苄青霉素的生物传感器及其制备方法与应用与流程
本发明涉及生物传感器技术领域,特别涉及一种检测并降解氨苄青霉素的生物传感器及其制备方法与应用。
背景技术:
氨苄青霉素(ampicillin,amp)又称氨苄西林,是β-内酰胺类抗生素的一种,是在青霉素g侧链羧基α位引入氨基,改变其极性的半合成青霉素。氨苄青霉素耐酸不耐酶,克服了天然青霉素不宜内服的缺点,因此在畜牧养殖过程中常作为消炎抗感染的首选药物,对革兰氏阴性菌和阳性菌均可产生不同程度的抑制作用。
目前,在氨苄青霉素的分析方法中,常用的amp检测方法有高效液相色谱法(hplc)、气相色谱法(gc)、液相-质谱联用法(lc-ms)等,这些方法存在过程繁琐、仪器昂贵和操作复杂等缺点有必要建立更可靠的快速分析方法;免疫分析法(ias)近年来应用日趋广泛,但由于amp是小分子化合物,存在抗体质量不稳定、方法特异性差等问题,限制了ias法的普及;因此,需要探寻一种快速、准确、灵敏、操作简单、且特异性高的检测方法来检测氨苄青霉素。
常用的降解amp的传统方法主要有生物处理法、氯化法、臭氧法、吸附法、薄膜法等,且普遍具有降解率低、降解成本较高,易造成二次污染的现象,因此,tio2光催化为抗生素的降解提供了一种新的方式。
技术实现要素:
为了解决以上现有技术中氨苄青霉素的检测和降解方法中操作繁琐,费时费力,样品的前处理或浓缩过程繁琐,仪器昂贵难以及在环境中难降解的问题,本发明提供了一种特异性强、亲和力高、结合的目标物质种类多、分子量较小以及合成过程简便的基于ag-tio2纳米颗粒的amp超灵敏荧光检测和光催化降解的生物传感器,还涉及其制备方法与应用。
一种检测并降解氨苄青霉素的生物传感器,包括氨苄青霉素适配体aptamer标记的ag-tio2纳米粒子、目标物氨苄青霉素amp、hap1、hap2、限制性核酸内切酶iv、10×的缓冲液buffer及灭菌水;
所用的碱基序列为:
aptamer碱基序列如seqno.1所示;具体为:5’-sh-tttttttgcgggcggttgtatagcggtgcttatacaacc-3’;
hap1碱基序列如seqno.2所示;具体为:5’-ggtgcttatacaaaaxgttgtataagcaccgc-3’;
hap2碱基序列如seqno.3所示;具体为:5’-ggtgcttatacaacct(dabcyl)txt(fam)gtataagcacc-3’;
所述的hap1的5’端第十五个碱基后连接有四氢呋喃位点x;
所述的aptamer的5’端连接有-sh;
所述的hap2的5’端第十六个碱基上连接有猝灭基团dabcyl,5’端第十八个碱基后四氢呋喃位点x,5’端第十九个碱基上连接有荧光基团fam。
上述生物传感器的制备方法,包括以下步骤:
(1)制备ag-tio2纳米颗粒溶液;
(2)aptamer标记ag-tio2纳米粒子;
(3)将标记的纳米dna-ag-tio2溶液与目标物氨苄青霉素、hap1、hap2、限制性核酸内切酶iv、10×的缓冲液buffer及灭菌水混合;
(4)催化发夹自组装反应、荧光检测,amp浓度检测;
(5)继续放置,amp降解。
所述步骤(1)的ag-tio2纳米颗粒溶液的制备步骤如下:
a1.将柠檬酸钠与agno3,80℃水浴下搅拌,待溶液从无色逐渐深至黑褐色时,将逐滴加入hno3使ag+的还原反应终止,随后逐滴加入钛酸异丙酯,搅拌;
a2.将a1的溶液置于高压反应釜,,130℃,反应,即得到ag-tio2溶胶;烘箱烘干,研磨即可得到ag掺杂的tio2粉末;
a3.a2的粉末,融入超纯水中,搅拌均匀,即可得到纳米颗粒溶液。
所述步骤(2)的aptamer标记ag-tio2纳米粒子,操作步骤如下:
b1.取(1)的纳米颗粒溶液,离心,sds溶液分散;
b2.加入aptamer溶液,超声;
b3.90℃孵育;向混合溶液中加入一定量na2so4,超声,再次孵育;该步骤重复三次,停止孵育,冷却至室温,纳米粒子的dna修饰完成。
所述步骤(3)中加入顺序为:灭菌水与标记好纳米ag-tio2粒子混合,其次将目标物、hap1、hap2、与缓冲液加入,最后加入核酸内切酶vi。
所述的步骤(4)催化发夹自组装反应温度为37℃,时间是2h。
上述生物传感器在氨苄青霉素的检测上的应用。
上述生物传感器在氨苄青霉素的降解上的应用。
上述降解上的应用,过程为:氨苄青霉素被ag-tio2光催化降解。
此外,氨苄青霉素与适配体结合后,被固定到dna-ag-tio2纳米粒子表面,在42wled灯照射下,ag-tio2表面生成空穴h+和电子e-,空穴h+使h2o氧化,电子e-使o2还原,生成·oh基团,·oh将抗生素氧化成co2,氨苄青霉素被ag-tio2光催化降解。
该发明的检测方式是荧光法检测,利用荧光仪。在检测之前,先通过ag-s键将aptamer修饰到ag-tio2纳米粒子表面,将均相反应溶液与标记好纳米ag-tio2粒子混合,其次将目标物、hap1、hap2、与缓冲液加入到均相溶液,最后加入核酸内切酶vi,在37℃孵育2h,完成催化发夹自组装反应放大过程。然后用荧光仪设置激发波长为486nm,检测518nm处荧光强度。
本发明一共用到3条dna链,其碱基序列为:
aptamer:5’-sh-tttttttgcgggcggttgtatagcggtgcttatacaacc-3’
hap1:5’-ggtgcttatacaaaaxgttgtataagcaccgc-3’
hap2:5’-ggtgcttatacaacct(dabcyl)txt(fam)gtataagcacc-3’
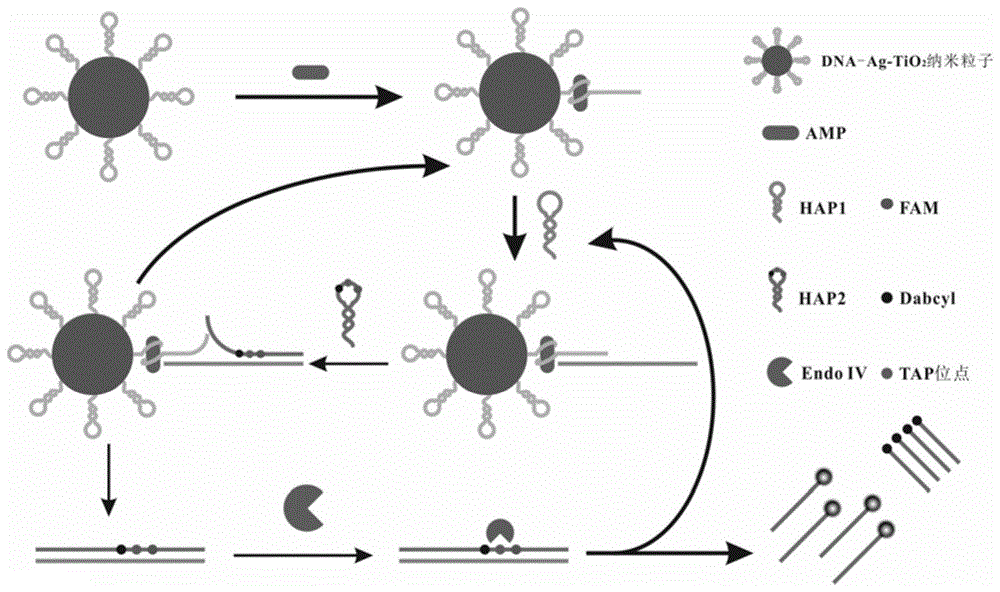
其中,aptamer下划线部分与hap1下划线部分是互补序列,hap1与hap2完全互补杂交。aptamer5’段修饰有-sh,通过ag-s共价键将aptamer修饰到纳米粒子表面。hap1与hap2上的x是四氢呋喃位点(tap位点),可以被内切酶iv切割,fam是荧光基团,dabcyl是猝灭基团。
本发明中氨苄青霉素的检测是在均相中进行的,通过催化发夹自组装的方式来实现信号的放大,从而实现氨苄青霉素的高灵敏检测,并获得较低的检测下限。
均相中发生的反应主要有:
当有目标物存在的时候,目标物打开修饰在dna-ag-tio2纳米粒子上的aptamer发夹,并与其中的适配体部分特异性结合,从而使aptamer的3’段暴露出来,aptamer3’段暴露出来的序列与发夹hap1的部分序列互补,因而打开打开hap1,并进行碱基互补配对形成双链结构,打开的发夹hap1可以打开发夹hap2杂交形成双链结构,进而将aptamer3’段序列挤掉,完成催化发夹字组装反应,释放下来的aptamer序列又可以与hap1杂交进行下一个循环。发夹hap2上,修饰了一个四氢呋喃碱基位点(tap位点),一个fam荧光基团、一个dabcyl猝灭基团,核酸内切酶iv可以对tap位点进行切割。hap2上的tap位点在核酸内切酶iv的作用下被切割,双链结构被破坏,且荧光基团和猝灭基团被远离,进而产生荧光信号,同时,发夹hap2从发夹hap1上掉落下来,hap1可以循环加入到新一轮催化发夹自组装反应中。
此外,氨苄青霉素与适配体结合后,被固定到dna-ag-tio2纳米粒子表面,在42wled灯照射下,ag-tio2表面生成空穴h+和电子e-,空穴h+使h2o氧化,电子e-使o2还原,生成·oh基团,·oh将抗生素氧化成co2,氨苄青霉素被ag-tio2光催化降解。
本发明基于核酸适配体与目标物的特异性识别,aptamerr在纳米ag-tio2表面的杂交反应,核酸内切酶vi的配合的催化发夹自组装反应放大作用以及荧光共振能量转移将猝灭的荧光信号恢复构建了适体生物传感器。该传感器具有检测速度快,检测限低,特异性高等优点,可以弥补氨苄青霉素现有检测方法的缺陷与不足,实现对其快速,准确的定量检测,以及对氨苄青霉素的光催化降解。
本发明的有益效果:
1、高特异性、超灵敏性检测
利用了核酸适配体的特异型识别,利用适配体与氨苄青霉素的结合实现了对目标物的高特异性检测;利用了核酸内切酶vi的切割位点,实现定位切割;利用催化发夹自组装反应,放大了荧光信号,提高了检测的灵敏度,实现对目标物氨苄青霉素的超灵敏性检测;该方法的检测下限为5pm。
2、操作简单,检测时间短
该传感器的反应条件温和,反应速度快;由于使用荧光法,其检测方法操作简便、检测周期短;检测原理的主要过程均是在均相中实现的,提高了反应速度,降低了操作的复杂程度,实现了目标物的快速,简单,灵敏的检测。
3、性能稳定,适合工业化生产
制备方法简单,性能稳定,荧光检测的重复性好,适用于食品安全及水体中氨苄青霉素的检测和生物传感器产业化的实际应用;制作该生物传感器的工艺成本低,适用于产业化中价廉的要求。
4、降解效率高,无污染
该传感器对抗生素的降解效率在2h达到80%左右,速度快,效率高,且降解产物对环境无毒副作用。
附图说明
图1为该实验的原理图;
图2为实施例1检测结果图;
图3为实施例2检测结果图;
图4为实施例3检测结果图;
图5为实施例4传感器检测氨苄青霉素的标准曲线;
图6为该实验tio2光催化降解氨苄青霉素结果图。
具体实施方式
下面结合具体实施例对本发明进行进一步说明。
实施例1
所述的生物传感器的制备方法,包括以下步骤:
(1)制备ag-tio2纳米颗粒溶液;
(2)aptamer标记ag-tio2纳米粒子;
(3)将标记的纳米dna-ag-tio2溶液与目标物氨苄青霉素、hap1、hap2、限制性核酸内切酶iv、10×的缓冲液buffer及灭菌水混合;
(4)催化发夹自组装反应、荧光检测、amp浓度检测;
(5)继续放置2h,amp降解。
所述步骤(1)的ag-tio2纳米颗粒溶液的制备步骤如下:
a1.采用溶胶-凝胶法制备ag-tio2。将500ml的柠檬酸钠(4.0mmol/l)与agno3(32mmol)放置于顶空瓶中,在80℃水浴下持续搅拌,待溶液从无色逐渐深至黑褐色时,将0.15mol的hno3逐滴加入溶液中使ag+的还原反应终止,随后将1mol钛酸异丙酯逐滴加入溶液中,50℃持续搅拌24h。
a2.将所得的溶液置于高压反应釜中,在130℃的烘箱中反应5h,即得到ag-tio2溶胶。将该反应釜中的溶胶取出放在80℃烘箱中烘干后研磨即可得到ag掺杂的tio2粉末。
a3.称取0.1878g上述粉末,融入250ml超纯水中,搅拌均匀,即可得到1mm的ag-tio2纳米颗粒溶液。
所述步骤(2)的amp适配体标记ag-tio2纳米粒子,操作步骤如下:
b1.取500μl的纳米粒子溶液于ep管中,10000rpm/min离心,用500μl(5mmcitrate,0.01%)sds溶液分散。
b2.加入4μl(100μm)apt溶液,超声20s。
b3.将混合溶液放入恒温混匀仪中,90℃孵育20min;向混合溶液中加入一定量na2so4(加入量根据dna序列号的长短而定),使其钠离子的浓度上升,超声20s,再次孵育20min;该步骤重复三次,停止孵育,冷却至室温,ag-tio2纳米粒子的dna修饰完成。步骤(3)的主要步骤如下:
c1、将灭菌水(2μl)、目标物(2μl,10nm)、dna-ag-tio2溶液(2ml,10nm)、hap1(2μl,1μm,)、hap2(4μl,5μm)、、10×的缓冲液(bμffer)(2μl,1x)、限制性核酸内切酶iv(1μl,浓度分别为20u/ml,40u/ml,60u/ml,80u/ml,100u/ml,120u/ml),加入到预先准备好的灭菌的ep管中。震荡30s,放入37℃的恒温箱中孵育2h;
c2、取a步反应后的溶液(10μl)稀释至100μl,用荧光仪在488nm处检测荧光。
荧光仪激发波长设置为485nm,发射波长为518nm,检测范围450nm-650nm,读取荧光信号变化,检测目标物。
经检测方向,该传感器对amp的降解效率在2h达到80%左右。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(bμffer)是随聚合酶一起买来的,可直接使用。
结果见图2,从图中可以看出,随着限制性核酸内切酶iv量的增加,实验得到的荧光强度不断增强,在酶量达到100μml之后,荧光强度基本不变。说明酶修复循环所需限制性核酸内切酶iv量为2μl(100u/ml)。
实施例2
所述的生物传感器的制备方法,包括以下步骤:
(1)制备ag-tio2纳米颗粒溶液;
(2)aptamer标记ag-tio2纳米粒子;
(3)将标记的纳米dna-ag-tio2溶液与目标物氨苄青霉素、hap1、hap2、限制性核酸内切酶iv、10×的缓冲液buffer及灭菌水混合;
(4)催化发夹自组装反应、荧光检测、amp浓度检测;
(5)继续放置2h,amp降解。
(1)-(2)同实施例1。
步骤(3)反应过程的主要步骤如下:
c1、将灭菌水(2μl)、目标物(2μl,10nm)、dna-ag-tio2溶液(2ml,10nm)、hap1(2μl,浓度分别为0.2μm,0.4μm,0.6μm,0.8μm,1μm,1.2μm)、hap2(4μl,5μm)、、10×的缓冲液(bμffer)(2μl,1x)、限制性核酸内切酶iv(1μl,5u/ml),加入到预先准备好的灭菌的ep管中。震荡30s,放入37℃的恒温箱中孵育2h;
c2、取a步反应后的溶液(10μl)稀释至100μl,用荧光仪在488nm处检测荧光。
荧光仪激发波长设置为485nm,发射波长为518nm,检测范围450nm-650nm,读取荧光信号变化,检测目标物。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(bμffer)是随聚合酶一起买来的,可直接使用。
结果见图3,从图中可以看出,随着hap1量的增加,实验得到的荧光强度先增强,后维持不变,在hap1量达到1μm之后,荧光强度基本不变。说明催化发夹自组装反应所需hap1量为2μl(1μm)。
实施例3
所述的生物传感器的制备方法,包括以下步骤:
(1)制备ag-tio2纳米颗粒溶液;
(2)aptamer标记ag-tio2纳米粒子;
(3)将标记的纳米dna-ag-tio2溶液与目标物氨苄青霉素、hap1、hap2、限制性核酸内切酶iv、10×的缓冲液buffer及灭菌水混合;
(4)催化发夹自组装反应、荧光检测、amp浓度检测;
(5)继续放置2h,amp降解。
所述的制备方法,ag-tio2纳米粒子的制备操作步骤如下:
(1)-(2)同实施例1。
步骤(3)反应过程的主要步骤如下:
a、将灭菌水(2μl)、目标物(2μl,10nm)、dna-ag-tio2溶液(2ml,10nm)、hap1(2μl,1μm)、hap2(4μl,浓度分别为1μm,2μm,3μm,4μm,5μm,6μm)、10×的缓冲液(bμffer)(2μl,1x)、限制性核酸内切酶iv(1μl,5u/ml),加入到预先准备好的灭菌的ep管中。震荡30s,放入37℃的恒温箱中孵育2h;
b、取a步反应后的溶液(10μl)稀释至100μl,用荧光仪在488nm处检测荧光。
荧光仪激发波长设置为485nm,发射波长为518nm,检测范围450nm-650nm,读取荧光信号变化,检测目标物。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(bμffer)是随聚合酶一起买来的,可直接使用。
结果见图4,从图中可以看出,随着hap2的增加,实验得到的荧光强度先增强,后维持不变,在hap2达到5μm之后,荧光强度基本不变。说明催化发夹自组装反应所需hap2量为4μl(5μm)。
实施例4
所述的生物传感器的制备方法,包括以下步骤:
(1)制备ag-tio2纳米颗粒溶液;
(2)aptamer标记ag-tio2纳米粒子;
(3)将标记的纳米dna-ag-tio2溶液与目标物氨苄青霉素、hap1、hap2、限制性核酸内切酶iv、10×的缓冲液buffer及灭菌水混合;
(4)催化发夹自组装反应、荧光检测、amp浓度检测;
(5)继续放置2h,amp降解。
(1)-(2)同实施例1。
步骤(3)反应过程的主要步骤如下:
a、将灭菌水(2μl)、目标物(2μl,终浓度分别为0,5pm,10pm,50pm,100pm,500pm,1nm,5nm,10nm)、dna-ag-tio2溶液(2ml,10nm)、hap1(2μl,1μm)、hap2(4μl,浓度分别为1μm,2μm,3μm,4μm,5μm,6μm)、10×的缓冲液(bμffer)(2μl,1x)、限制性核酸内切酶iv(1μl,5u/ml),加入到预先准备好的灭菌的ep管中。震荡30s,放入37℃的恒温箱中孵育2h;
b、取a步反应后的溶液(10μl)稀释至100μl,用荧光仪在488nm处检测荧光。
荧光仪激发波长设置为485nm,发射波长为518nm,检测范围450nm-650nm,读取荧光信号变化,检测目标物。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(bμffer)是随聚合酶一起买来的,可直接使用。
检测结果如图5所示,图中我们可以看到,当氨苄青霉素浓度在5pm到10000pm时荧光值不断增加,反应稳定进行。在氨苄青霉素的浓度在5pm到10000pm时,氨苄青霉素浓度的对数与荧光强度值的大小成正比关系,拟合曲线:a=159.7*logc+215.9(a是荧光强度值,c是氨苄青霉素的浓度),同时,我们在5pm的浓度基础上继续向更低的浓度检测,经检测当浓度低于5pm时,荧光强度与浓度的关系恰好不再符合拟合曲线规律,即图中的吸收峰值的最高点因此可得到该方法的检测下限为5pm。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
序列表
<110>济南大学
<120>一种检测并降解氨苄青霉素的生物传感器及其制备方法与应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>39
<212>dna
<213>人工序列(artiartificialsequence)
<400>1
tttttttgcgggcggttgtatagcggtgcttatacaacc39
<210>2
<211>31
<212>dna
<213>人工序列(artiartificialsequence)
<400>2
ggtgcttatacaaaagttgtataagcaccgc31
<210>3
<211>29
<212>dna
<213>人工序列(artiartificialsequence)
<400>3
ggtgcttatacaacctttgtataagcacc29
- 还没有人留言评论。精彩留言会获得点赞!