化学发光增强剂及其制备方法和在检测亚硝酸盐中的用途与流程
本说明书实施例涉及亚硝酸盐检测技术领域,尤其涉及一种化学发光增强剂及其制备方法和在检测亚硝酸盐中的用途。
背景技术:
亚硝酸盐广泛分布在蔬菜、饮用水、食品甚至生理系统中,在特定条件下可以形成亚硝胺,对人体有一定危害作用。亚硝酸盐的化学性质很不稳定,因此,对亚硝酸盐的快速检测很重要。
最常见的检测方法有色谱法、分光光度法、电化学方法以及化学发光法等。传统的检测误差较大且程序比较复杂。电化学方法虽然响应快、操作简单,但是检测所需仪器较为昂贵,因而限制了其广泛应用。
化学发光作为一种强有力的分析技术,具有线性范围宽、背景信号低、仪器设备简单等优点。因此,基于化学发光的亚硝酸盐的检测技术是值得研究的方向。
技术实现要素:
鉴于上述问题,本说明书实施例提供了一种化学发光增强剂,化学发光增强试剂及其制备方法和用途、试剂盒,可以通过增强亚硝酸盐检测过程中的化学发光强度,从而提高利用化学发光法检测亚硝酸盐的检测效果。
第一方面,本说明书实施例提供了一种化学发光增强剂,所述化学发光增强剂包括纳米粒度的稀土氟化物,所述稀土氟化物掺杂有铈元素,所述铈元素的价态为正三价;其中,所述铈元素和所述稀土氟化物中的稀土元素为不同元素,所述铈元素和所述稀土氟化物中的稀土元素的摩尔比为(1:10)-(3:10)。
在一些实施例中,所述铈元素和所述稀土氟化物中的稀土元素的摩尔比为1:10,所述稀土氟化物为氟化镧;所述化学发光增强剂用于线性增强过氧化氢-亚硝酸盐体系的化学发光强度。
第二方面,本说明书实施例提供了一种用于检测亚硝酸盐的化学发光增强试剂,由第一方面所述的化学发光增强剂和水制备而成。
在一些实施例中,每4ml的所述化学发光增强试剂中含有5×10-5-1.5×10-4mol的铈离子;所述化学发光增强试剂用于线性增强过氧化氢-亚硝酸盐体系的化学发光强度。
第三方面,本说明书实施例提供了一种如第二方面所述的化学发光增强试剂的制备方法,其特征在于,包括如下步骤:
步骤(1)配制反应溶液,在所述反应溶液中,第一稀土元素的正三价态离子和铈元素的正三价态离子的摩尔比为(1:10)-(3:10),所述反应溶液中氟离子的摩尔数至少是第一稀土元素的正三价态离子的三倍,所述第一稀土元素和铈元素为不同元素;
步骤(2)将所述反应溶液、无水乙醇、油酸混合,得到混合液;
步骤(3)将所述混合液转移至反应釜中,在150-250℃下,反应6-10小时;反应结束后,去除反应釜中的上清液,将余下的悬浊液进行第一次离心;第一次离心结束后,去除上清液,并向剩余沉淀中加入盐酸,超声分散后,加入无水乙醇,进行第二次离心;第二次离心结束后,去除上清液后,向剩余的沉淀加入水,得到所述化学发光增强试剂。
在一种可能的实现方式中,在所述步骤(1)中,分别配制0.2mol·l-1lacl3水溶液、0.05mol·l-1cecl3水溶液、1.0mol·l-1naf水溶液;取2.25mllacl3水溶液、1.00mlcecl3水溶液、2mlnaf水溶液,得到所述反应溶液;
在所述步骤(2)中,向所述反应溶液20ml无水乙醇和10ml油酸在反应釜中混合,搅拌30min;
在所述步骤(3)中,在200℃加热8h;反应结束后,吸出反应釜中的上清液,剩余悬浊液以6000rpm离心5min,去除上清液,向剩余沉淀加入4-5ml的2mol·l-1盐酸,超声分散;然后,加入无水乙醇,以6000rpm离心5min,去除上清液,向剩余沉淀中加4ml水,混匀后,得到所述化学发光增强试剂。
第四方面,本说明书实施例提供了第二方面所述的化学发光增强试剂在检测亚硝酸盐中的用途。
在一些实施例中,所述用途为所述化学发光增强试剂联合过氧化氢在检测亚硝酸盐中的用途;所述化学发光增强试剂用于线性增强过氧化氢-亚硝酸盐体系的化学发光强度。
第五方面,本说明书实施例提供了一种亚硝酸盐检测方法,所述方法检测亚硝酸根离子的检出限等于或小于1.0×10-6mol·l-1;
所述方法包括如下步骤:
(1)配制待检溶液;
(2)向待检溶液中,加入权利要求3或4所述的化学发光增强试剂;
(3)向步骤(2)得到的第二混合液中,加入h2o2的h2so4溶液,使得的第二混合液中的h2o2终浓度为3mol·l-1,h2so4终浓度为0.04mol·l-1,且每550μl的第二混合液中含有50μl所述化学发光增强试剂;
(4)检测所述第二混合液的发光强度;
(5)根据发光强度,依据标准曲线确定待检溶液中的硝酸根离子浓度。
第六方面,本说明书实施例提供了一种亚硝酸盐检测试剂盒,所述试剂盒检测亚硝酸根离子的检出限等于或小于1.0×10-6mol·l-1;
所述试剂盒包括:
第一方面所述的化学发光增强剂;
或者,
第二方面所述的化学发光增强试剂。
申请提供的化学发光增强剂可以线性增强亚硝酸根-过氧化氢体系的化学发光强度。对亚硝酸根的检测灵敏度可以达到1×10-6mol·l-1。因此,本说明书实施例提供的化学发光增强剂、检测方法及试剂盒可以用于通过化学发光法来检测亚硝酸根离子,并具有较佳的检测效果。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
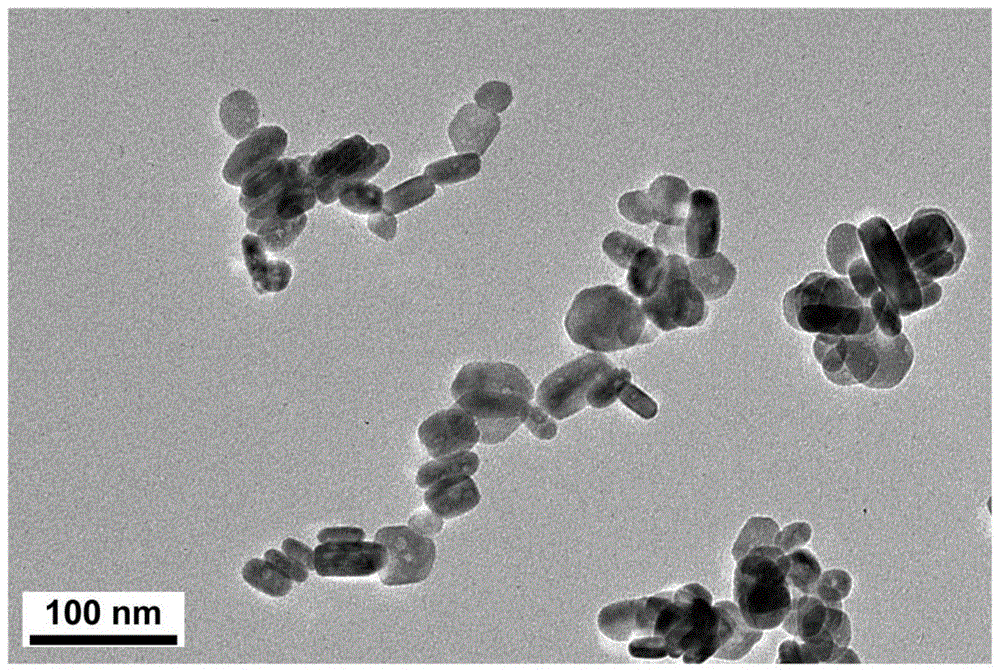
图1示出了本说明书实施例提供的纳米材料的透射电镜(tem)照片;
图2示出了本说明书实施例提供的纳米材料的荧光发射光谱(λex=365nm);
图3示出了本说明书实施例提供的纳米材料的吸收光谱;
图4示出了本说明书实施例提供的纳米材料的红外光谱;
图5示出了对比在nano2-h2o2体系中是否加入本说明书实施例提供的纳米材料的化学发光强度;
图6示出了本说明书实施例提供的纳米材料加入nano2-h2o2体系后的化学发光光谱;
图7示出了不同加样顺序对cenps-nano2-h2o2体系化学发光强度的影响(1:将cenps加入到nano2和h2o2的混合液,2:将nano2加入到h2o2和cenps的混合液,3:将h2o2加入到cenps和nano2混合液);
图8示出了nano2-h2o2体系和cenps-h2o2体系的化学发光强度;
图9示出了cenps-nano2-h2o2体系中h2so4浓度的优化(实验重复3次);
图10示出了cenps-nano2-h2o2体系中h2o2浓度的优化(实验重复3次);
图11示出了cenps-nano2-h2o2体系中cenps加入量的优化(实验重复3次);
图12示出了为利用本说明书实施例所构建的化学发光体系检测不同浓度的nano2溶液所得的标准曲线;
图13示出了本说明书实施例提供的纳米材料增强nano2-h2o2体系的化学发光的原理。
具体实施方式
应理解,本申请的保护范围不局限于下述特定的具体实施方案;还应当理解,本申请实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本申请的保护范围;在本申请说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本申请另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本申请中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本申请的记载,还可以使用与本申请实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本申请。
本申请制备得到一种纳米材料,可以在亚硝酸盐检测中用作化学发光增强剂,该纳米材料制备简单、成本较低,有利于工业化生产。该纳米材料可以增强亚硝酸盐检测过程中的化学发光,从而提高利用化学发光法检测亚硝酸盐的检测效果,因此,在亚硝酸检测领域具有很好的应用价值。
接下来,结合不同实施例,对本申请提供的方案进行具体说明。
实施例1
本申请的发明人经过大量实验发现,稀土元素掺杂的氟化物纳米颗粒易产生活性氧物质,该物质可增强nano2-h2o2体系的化学发光且增强程度与no2-浓度线性相关。并且,本申请的发明人经过大量实验发现还发现掺杂稀土元素的氟化物具有很好的热稳定性、高离子性、低折射率、宽带隙和低声子能量,因此,掺杂稀土元素的氟化物适合用作化学发光的材料并可用于no2-检测。
基于上述的发现,本申请实施例提供了一种纳米材料,该纳米材料包括氟化物和掺杂的稀土元素,所述的氟化物可选用稀土氟化物,所述的稀土元素可选用铈元素。
本实施例提供的纳米材料,可明显增强nano2-h2o2体系的化学发光,且增强后的化学发光强度与nano2浓度线性相关,可用于no2-浓度检测。因此,可以将实施例提供的纳米材料称为化学发光增强剂。
实施例2
本申请实施例提供了实施例1中的纳米材料的制备方法,具体为用水热法制备稀土元素掺杂的氟化物纳米颗粒。具体包括如下步骤。
2.1,分别配制稀土盐水溶液和naf水溶液。
2.2,取稀土盐水溶液、naf水溶液、无水乙醇和油酸在反应釜中混合,搅拌30min,在200℃加热8h。
2.3,反应结束后,吸出反应釜中的上清液,剩余悬浊液以6000rpm离心5min,去除上清液,剩余固体加盐酸,超声分散。
2.4,加入无水乙醇,再以6000rpm离心5min,去除上清液,剩余固体加水溶解备用。
接下来,以具体实施例示例说明本申请提供的纳米材料的制备过程、纳米材料的特征表征,及纳米材料在化学发光中的应用。
实施例3
在本实施例中,将正三价态的ce(iii)掺杂到laf3纳米颗粒,合成化学发光增强剂(cenps)。具体如下。
分别配制0.2mol·l-1lacl3水溶液、0.05mol·l-1cecl3水溶液、1.0mol·l-1naf水溶液。取2.25mllacl3水溶液、1.00mlcecl3水溶液、2mlnaf水溶液、20ml乙醇和10ml油酸在反应釜中混合,搅拌30min,在200℃加热8h。反应结束后,静止,待温度降到室温,吸出反应釜中的上清液,剩余悬浊液以6000rpm离心5min,去除上清液,剩余沉淀物加4-5ml的2mol·l-1盐酸,超声分散(例如,超声的功率为300w,超声时间为30分钟)。然后,加入4-5ml的无水乙醇,再以6000rpm离心5min,去除上清液,剩余沉淀物加4ml水溶解,得到cenps母液。cenps母液用作后续实施例中的实验。
本实施例得到cenps母液也可以称为化学发光增强试剂。
实施例4,cenps的tem表征。
cenps的形貌表征使用透射电子显微镜(tem)进行观测,其结果如图1所示。可以看出,cenps为纳米粒度的材料,即cenps为纳米材料;并且,cenps呈六方晶型。除此之外,由于ce的掺入,致使其晶格和电性并不完全规整而难以分散,进而产生了纳米晶在小规模范围内的团聚。
实施例5,cenps的光谱表征
作为稀土掺杂元素,ce3+的外层存在大量的空4f轨道和1个单电子,致使cenps具有优秀的荧光性质,其不同波长激发光的荧光光谱如图2所示。可以看出,由于f-f能级的跃迁禁阻,cenps的激发光和发射光波长接近,其stokes位移较小,光学性质稳定。并且随着入射光波长的移动至270nm,发射光的最大发射波长也移动至330nm附近并稳定,这也是由于4f轨道的能量分布紧密而导致的。
并且,如图3所示,整个cenps-nano2-h2o2体系的紫外-可见光吸收光谱显示:cenps本身拥有较弱的全光谱吸收,nano2在354nm处有一个强吸收峰,在加入h2o2后,该吸收峰消失,在301nm处出现新的吸收峰,吸收峰强度急剧下降。图4所示的红外光谱则显示在cenps表面存在-oh基团。
实施例6,cenps-nano2-h2o2化学发光体系的构建
分别在是否加入cenps的情况下,检测nano2-h2o2体系和cenps-nano2-h2o2体系的化学发光强度,以考察cenps对nano2-h2o2体系的化学发光是否有增强作用。
实验条件为:将3mol·l-1h2o2配制于含有0.04mol·l-1h2so4中并与1.0×10-5mol·l-1nano2、cenps溶液混合,得到cenps-nano2-h2o2体系。即在配制得到的cenps-nano2-h2o2体系中,h2so4浓度为0.04mol·l-1,nano2浓度为1.0×10-5mol·l-1,h2o2浓度为3mol·l-1。其中,每550μl的cenps-nano2-h2o2体系含有50μlcenps母液的比例,加入cenps母液。
用滤光片每隔25nm测cenps-nano2-h2o2体系的化学发光强度,以确定其化学发光光谱。如图5所示,在nano2-h2o2体系中加入cenps后发现该体系的化学发光强度明显增强。如图6所示,其发光光谱峰位置约在450nm。
实施例7,cenps-nano2-h2o2化学发光动力学研究
在静态条件下,对cenps-nano2-h2o2体系的化学发光动力学进行研究,采取如下三种不同的加样顺序:
(1)将h2o2加入到cenps和nano2的混合溶液中,得到cenps-nano2-h2o2体系;
(2)将nano2加入cenps和h2o2的混合溶液中,得到cenps-nano2-h2o2体系;
(3)将cenps加入h2o2和nano2的混合溶液中,得到cenps-nano2-h2o2体系。
上述三种加样顺序均按照配制得到的cenps-nano2-h2o2体系中的h2so4浓度为0.04mol·l-1,nano2浓度为1.0×10-5mol·l-1,h2o2浓度为3mol·l-1进行配制;其中,在加入cenps母液时,按照每550μl的cenps-nano2-h2o2体系含有50μlcenps母液的比例,加入cenps母液。
在本实施例中,考察三种不同的加样顺序得到的cenps-nano2-h2o2体系的化学发光强度,从而确定最优的加样顺序。发现试剂的加入顺序会影响cenps-nano2-h2o2体系的化学发光强度。如图7所示,将h2o2加入cenps和nano2混合液中所得的化学发光强度最强。无论是将cenps加入h2o2和nano2混合液中,还是将nano2加入cenps和nano2混合液中都得不到最强的化学发光。过氧亚硝酸(onooh)经hoono*转变为硝酸被认为是产生化学发光的一步反应。而过氧亚硝酸则是酸化的h2o2与nano2反应的产物。如果将h2o2加入cenps和nano2混合液中,产生的过氧亚硝酸能立即与cenps反应产生增强的化学发光。
在本实施例中,还考察了h2o2和nano2的混合溶液及cenps和h2o2的混合溶液的发光强度。如图8所示,在无cenps的条件下将h2o2与nano2混合可以观察到微弱并且持续时间较长的化学发光,而将cenps与h2o2混合则能产生信号快速并且微弱的化学发光。
实施例8,cenps-nano2-h2o2化学发光体系的实验条件优化
在上述确定的最优加样顺序下,体系的化学发光强度与nano2浓度表现出一定的相关性,为获得最佳的线性关系,实验中分别考察了h2so4浓度、h2o2浓度和cenps加入量对化学发光强度的影响。
固定0.1mol·l-1h2o2、1.0×10-5mol·l-1nano2和cenps母液的加入量为50μl,h2so4浓度的考察范围为0-0.06mol·l-1。需要说明的是,前述各成分的浓度为在配制的cenps-nano2-h2o2体系中的终浓度。cenps母液的加入量为50μl指0.55ml的cenps-nano2-h2o2体系中含有50μl的cenps母液。
固定0.04mol·l-1h2so4、1.0×10-5mol·l-1nano2和cenps母液的加入量为50μl,h2o2浓度的考察范围为0-5mol·l-1。需要说明的是,前述各成分的浓度为在配制的cenps-nano2-h2o2体系中的终浓度。cenps母液的加入量为50μl指0.55ml的cenps-nano2-h2o2体系中含有50μl的cenps母液。
固定3mol·l-1h2o2配制于0.04mol·l-1h2so4中和1.0×10-5mol·l-1nano2,cenps加入量的考察范围为每0.5ml的终体积,cenps母液的加入量为0-0.07ml。需要说明的是,前述各成分的浓度为在配制的cenps-nano2-h2o2体系中的终浓度。
考察不同条件下的化学发光强度,由此确定最优的实验条件。h2o2与nano2反应只有在酸性条件下才能产生过氧亚硝酸,因此,酸化是该体系产生化学发光的必要条件。本实施例中以h2so4作为酸化h2o2的试剂,因此,首先对h2so4浓度进行优化。
如图9所示,在没有h2so4时几乎观察不到化学发光信号,这也说明了酸化在本体系中的必要性。在h2so4浓度为0.04mol·l-1时所得的化学发光信号最强。
如图10所示,其他条件固定不变时,在h2o2浓度为3.00mol·l-1时所得的化学发光信号最强。h2o2浓度过大会淬灭发光,过小则发光信号较弱。
如图11所示,cenps母液的加入量为50μl时所得发光信号最强。
因此,本实验的最佳条件是:3mol·l-1h2o2配制于0.04mol·l-1h2so4中、cenps母液加入量为50μl。即配制的550μl的用于检测亚硝酸盐的体系含有50μlcenps母液,且h2o2浓度为3mol·l-1、h2so4浓度为0.04mol·l-1。
实施例9,检测no2-的标准曲线的制定
在最优的实验条件下,化学发光强度与nano2浓度呈现线性相关关系。在实验条件为:3mol·l-1h2o2配制于0.04mol·l-1h2so4中和加入50μlcenps时,在nano2浓度为0以及1×10-6mol·l-1-0.5mol·l-1范围内制定标准曲线,并进行线性拟合。
如图12所示,随着nano2浓度的增大,化学发光信号逐渐增强并表现出很好的线性(其中,在nano2浓度为1×10-6mol·l-1-5×10-6mol·l-1范围时,y=267.8x+2.73,r2=0.9914;在nano2浓度为0mol·l-1-1×10-5mol·l-1范围时,y=255.4x+48.05,r2=0.9978)。
表明本申请提供的化学发光增强剂可以线性增强nano2-h2o2体系的化学发光强度。对亚硝酸根的检测灵敏度可以达到1×10-6mol·l-1。因此,本实施例所建立的cenps-nano2-h2o2体系可以用于基于化学发光法来检测no2-离子。
上述实施例仅例示性说明本申请的原理及其功效,而非用于限制本申请。任何熟悉此技术的人士皆可在不违背本申请的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本申请所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本申请的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!