基于荧光MOF-植物杂交体的水体污染物的检测方法与流程
本发明属于污染物检测技术领域,具体涉及一种基于荧光mof-植物杂交体的水体污染物的检测方法。
背景技术:
随着工业、农业、军事和人类社会活动的迅速发展,大量有毒金属离子和有机污染物释放到环境水体中,对环境和人类健康造成了严重的不利影响。超过人体允许水平的各种有毒金属离子和有机污染物的摄入会带来各种疾病的风险。例如,铁离子(fe3+)、铜离子(cu2+)、银离子(ag+)、镉离子(cd2+)和苯胺的摄入可能会导致如帕金森氏症、胰腺疾病、肝脏疾病、心脏疾病、阿尔茨海默氏病、器官衰竭和某些癌症。考虑到与人体健康相关的风险不断升高,快速准确的定量检测环境水体中的有毒金属离子和有机污染物至关重要。
目前,各种各样的分析方法,如固相萃取、原子吸收光谱法、化学发光技术、电泳法、电感耦合等离子体质谱法、光纤化学传感法、伏安法、高效液相色谱技术和气相色谱等技术已用于检测水体中的金属离子和有机污染物。然而,这些技术通常需要复杂的样品预处理过程、仪器复杂且成本高。因此,迫切需要开发一种简单的分析方法,用于现场、快速、选择性和高灵敏的检测污染物。近年来,荧光传感器具有简单、精确、选择性高、灵敏度高和低成本等优点,被认为是检测有毒金属离子和有机污染物的有效方法之一,其中,发光的镧系金属有机框架(ln-mof)由于其奇特的光学特性(例如高色纯度、较大的斯托克斯位移和相对较长的发光寿命)受到了广泛关注,这些特性是由于分子间“天线效应”引起的f-f跃迁而引起的,其发光强度根据不同的污染物显示“增强”或“减弱”的荧光响应。在过去十年中,发光ln-mofs用于检测有毒金属离子或有机分子的研究已有相关报道。
但对于现场检测而言,mof纳米颗粒很难在水环境中收集以及其对生态系统具有潜在的长期毒性,因此,非常有必要寻找合适的mof固定基质。由于植物具有维管网络和其主要使用主动力来传输流体或流体中的分子或纳米粒子,是固定mof的最佳选择之一。目前已有各种材料被嵌入到植物中,形成了材料-生物杂交体,如导电聚合物聚、单壁碳纳米管、碳点等,使活的杂交植物具有电子功能、增强的光合作用和抗病能力。此外,现场传感技术也得到了发展,以补充基于智能纳米生物技术的植物传感器,包括温度、水位、气孔导度、蒸腾效率、叶绿素含量和荧光等的检测。
目前,亟需提供一种灵敏度高、成本低的水体污染物的检测方法。
技术实现要素:
本发明的目的是提供一种基于荧光mof-植物杂交体的水体污染物的检测方法,灵敏度高,成本低,可以对水体环境进行现场原位检测。
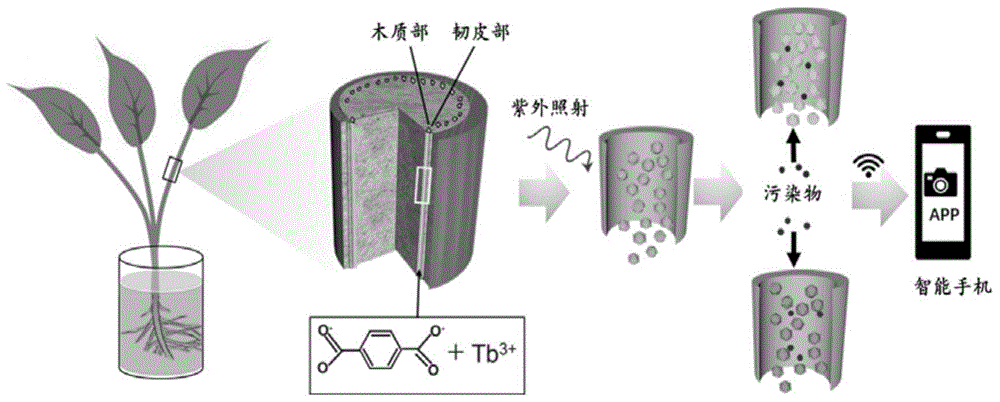
本发明所述的基于荧光mof-植物杂交体的水体污染物的检测方法是将荧光mof嵌入植物体内制备得到荧光mof-植物杂交体,采用荧光mof-植物杂交体定量检测水体污染物的含量。
本发明所述的基于荧光mof-植物杂交体的水体污染物的检测方法,包括如下步骤:
(1)荧光mof-植物杂交体的制备
先将植物在对苯二甲酸二钠水溶液中培养,然后清洗,切除部分根部,再将植物在六水合氯化铽水溶液中培养,然后清洗,切除部分根部,制得荧光mof-植物杂交体;
(2)采用荧光mof-植物杂交体检测水体污染物
在紫外线照射下对荧光mof-植物杂交体进行拍照得到培养前荧光图像,再将荧光mof-植物杂交体在待测水样品中培养,培养结束后,取出荧光mof-植物杂交体在紫外线照射下进行拍照得到培养后荧光图像,通过分析培养前荧光图像和培养后荧光图像得到荧光mof-植物杂交体的荧光强度,通过荧光mof-植物杂交体的荧光强度计算得到水体污染物的含量。
步骤(1)中所述的植物为合果芋。
步骤(1)中所述的对苯二甲酸二钠水溶液的浓度为5-50mm。
步骤(1)中所述的在对苯二甲酸二钠水溶液中培养时间为2-24h。
步骤(1)中所述的六水合氯化铽水溶液的浓度为5-50mm。
步骤(1)中所述的在六水合氯化铽水溶液中培养时间为2-24h。
步骤(1)中所述的切除部分根部是切除2-3mm的根部。
步骤(2)中所述的培养时间为1-12h。
步骤(2)中所述的紫外线的波长为254nm。
步骤(2)中所述的通过分析培养前荧光图像和培养后荧光图像是通过imagej或智能手机app分析培养前荧光图像和培养后荧光图像。
所述的通过imagej分析培养前荧光图像和培养后荧光图像是使用绘图或选择工具选择荧光mof-植物杂交体的荧光区域,然后在设置测量值下选择区域、积分密度和平均灰度值进行分析,然后,使用分析菜单中的测量,选择没有荧光的荧光mof-植物杂交体区域作为背景,按以下公式计算荧光mof-植物杂交体的荧光强度:
荧光mof-植物杂交体的荧光强度=积分密度-(选定区域的面积×背景读数的平均荧光强度)
δ荧光强度(fi)=fi样品-fi空白
相对荧光强度变化比=(fi样品-fi空白)/fi空白
其中,fi空白和fi样品是荧光mof-植物杂交体在培养前后通过imagej分析荧光图像的荧光强度。
所述的通过智能手机app分析培养前荧光图像和培养后荧光图像包括如下步骤:
(1)使用智能手机摄像头采集荧光mof-植物杂交体的培养前荧光图像和培养后荧光图像,然后裁剪出荧光区域图像,智能手机相册中裁剪出的荧光区域图像直接加载到app中,通过处理荧光区域图像得到δ强度,通过original9.1计算得出δ强度和浓度的线性拟合方程,然后校准,得到线性校准曲线,将线性校准曲线导入到app中;
δ强度计算公式如下:
δ强度=(s样品-s空白)×100%
其中,s空白是用待测水样品培养前的荧光mof-植物杂交体的平均色相饱和度值,s样品是用待测水样品培养后的荧光mof-植物杂交体的平均色相饱和度值;
(2)之后,再使用智能手机摄像头采集荧光mof-植物杂交体的培养前荧光图像和培养后荧光图像后,app直接输出污染物浓度。
本发明所述的基于荧光mof-植物杂交体的水体污染物的检测方法,包括如下具体步骤:
(1)荧光mof-植物杂交体的制备
首先将植物的根部浸入装有20ml浓度为20mmna2(bdc)水溶液的玻璃烧杯中培养12h,然后用自来水清洗植物根部,切割根部2-3mm后,再将植物浸入20ml浓度为20mmtbcl3·6h2o水溶液中培养12小时,最后用自来水洗涤植物根部,将根部切除2-3mm,制得荧光mof-植物杂交体;
(2)采用荧光mof-植物杂交体检测水体污染物
在紫外线照射下对荧光mof-植物杂交体进行拍照得到培养前荧光图像,再将荧光mof-植物杂交体在待测水样品中培养,培养结束后,取出荧光mof-植物杂交体在紫外线照射下进行拍照得到培养后荧光图像,通过分析培养前荧光图像和培养后荧光图像得到荧光mof-植物杂交体的荧光强度,通过荧光mof-植物杂交体的荧光强度计算得到水体污染物的含量。
当通过imagej分析培养前荧光图像和培养后荧光图像时,包括如下步骤:
拍摄照片时,应尽可能每次以相同的角度和方向放置荧光mof-植物杂交体。在紫外灯254nm波长下拍照得到图片,通过imagej分析图片,方法是使用任何绘图/选择工具(如矩形、圆形、多边形或自由形式)选择植物的荧光区域,然后在“设置测量值”下进行分析,其中选择“区域”、“积分密度”和“平均灰度值”。随后,使用分析菜单中的“测量”功能,选择了没有荧光的植物区域作为背景,计算荧光mof-植物杂交体的荧光强度。
当通过智能手机app分析培养前荧光图像和培养后荧光图像时,包括如下步骤:
智能手机app优选安卓手机app,该应用程序是使用java编程语言通过使用适用于google的android操作系统androidstudio(版本3.5.2)的官方集成开发环境(ide)开发的。该应用程序的操作流程见图2。需要两个主要输入的图像,即在254nm波长的紫外线激发下,荧光mof-植物杂交体在污染物培养前和培养4h后的荧光图像。使用智能手机摄像头采集荧光mof-植物杂交体的图像,然后裁剪出荧光区域,从智能手机相册中裁剪的图像可以直接加载到应用程序中,平均色相饱和度值(hsv)是通过矩阵转换算法从裁剪后的图像中转换每个像素的红绿蓝(rgb)值而获得的。进一步建立图像的hsv和污染物浓度间的模型,通过点击应用程序中的“generateδintensityandconcentration”按钮获得δ强度(荧光mof-植物杂交体在培养前后色相饱和度值的差值),通过original9.1计算得出不同分析物的线性拟合方程,然后通过“校准”按钮将这些线性校准曲线导入到app中。输入荧光图片后,该应用程序可以直接输出污染物浓度。
为了分析荧光信号与环境污染物浓度之间的相关性,在显着性水平上为0.05使用pearson相关系数,并使用线性回归分析它们之间的关系。回归分析的显着性水平(r)说明了污染物引起的荧光信号的程度。original9.1的统计数据包用于进行此分析。
本发明所述的基于荧光mof-植物杂交体的水体污染物的检测方法用于低浓度的水体污染物的检测,低浓度是50nm-2μm,水体污染物是有毒金属离子和/或有机污染物,水体污染物优选是fe3+、cu2+、ag+、cd2+或苯胺中的一种或几种。
本发明中将荧光mof嵌入植物体内,使荧光mof-植物可高灵敏度的检测环境水中的有毒金属离子和有机污染物。完整的植物首先在有机配体溶液中培养,洗涤后镧系金属离子溶液中培养,mof可在植物内部形成。合成的荧光mof-植物杂交体可通过荧光mof的增强/减弱响应选择性检测水体中低浓度的有毒金属离子和有机污染物的含量。评估荧光mof-植物杂交体的敏感性、选择性和耐久性。此外,还开发了一个android应用程序,用于使用智能手机对环境污染物进行现场分析。这种由荧光mof-植物杂交体实现的智能传感功能显示了在安全和可控条件下经济高效的现场监测环境污染物的巨大潜力,并且还通过用先进的纳米材料赋予活体植物新的功能。
鉴于ln-mof对无机和有机污染物选择性以及植物通过其粘附力和内聚力主动传输流体,本发明中ln-mof-植物生物杂交体可以主动浓缩水体中低浓度的毒害性有机污染物,并且将荧光mof-植物杂交体的荧光信号转化为数字信息,实现低浓度污染物的现场原位检测分析。
本发明中在植物内部的荧光mof将活的植物转变为用于环境污染物检测的传感器,借助照明源(例如紫外灯)和电子设备(例如计算机或智能手机),荧光-mof植物的生物混合传感器可用于监测水中的污染物。
本发明的有益效果如下:
本发明将荧光mof嵌入植物体内赋予了植物新的功能,可以固定mof,减少mof对水体环境的污染,对环境污染物的检测限足够低,检测灵敏,采用智能手机app辅助分析,可以用于水体污染物的现场原位检测。
本发明通过在植物体内原位生长光致发光的tb2(bdc)3mof,开发出了一种具有生物活性的纳米生物杂交植物,这些纳米生物杂交植物证明了其作为经济高效、高度灵敏的现场传感器检测环境水污染物的潜力,对不同的污染物具有“增强”或“减弱”的荧光信号。荧光mof-植物杂交体的检出限比纯tb2(bdc)3mof更低(更敏感),这是由于该植物能够通过其粘附力和内聚力主动传输流体来浓缩污染物。此外,还开发了智能手机app,赋予了荧光mof-植物杂交体的快速分析能力,此外,荧光mof对植物毒性极低,证实了荧光mof-植物杂交体用于现场检测环境污染物的可行性。因此,具有新型传感功能的荧光mof-植物杂交体的开发可为水体污染物的检测提供一种高效、灵敏且经济的检测方法。
附图说明
图1是本发明的水体污染物的检测示意图。
图2是智能手机app分析荧光mof-植物杂交体检测水体污染物的流程图。
图3是植物合果芋的图片。
图4是实施例1中荧光mof-植物杂交体的图像及saxs/waxs图;其中,a是荧光mof-植物杂交体的纵截面sem图,b和c是荧光mof-植物杂交体的eds图像,d是荧光mof-植物杂交体在室内灯光照射下的照片,e是荧光mof-植物杂交体在254nm紫外灯照射下的照片,f是荧光mof-植物杂交体的茎纵截面的sem图像,对其上假色以突出植物(黄色)和荧光mof(绿色),g是植物、纯tb2(bdc)3mof(纯mof)和荧光mof-植物杂交体的saxs/waxs图。
图5是在自来水中生长的植物的纵截面eds图像。
图6是植物在mof前体物和自来水中生长的纵截面的sem图,其中,a和b是植物在mof前体物中生长的纵截面的sem图,c和d是植物在自来水中生长的纵截面的sem图。
图7是纯tb2(bdc)3mof的sem图像和xrd图,其中,a是纯tb2(bdc)3mof的sem图像,b是纯tb2(bdc)3mof的xrd图。
图8是荧光mof-植物杂交体的荧光照片和线性关系图;其中,a是荧光mof-植物杂交体在不同浓度fe3+下的荧光照片(254nm激发波长),b是通过imagej分析得出荧光-mof植物杂交体和fe3+浓度的线性关系图;c是androidapp分析了荧光mof-植物杂交体中的fe3+浓度的界面;d是不同浓度的fe3+的条件下,荧光mof-植物杂交体的荧光区域裁剪图像;e是app得到的荧光-mof植物杂交体和fe3+浓度的线性关系图。
图9是在紫外灯254nm激发波长下,拍摄到的荧光mof-植物杂交体在不同浓度cu2+水溶液中培养前后的照片及其线性关系图。
图10是在紫外灯254nm激发波长下,拍摄到的荧光mof-植物杂交体在不同浓度ag+水溶液中培养前后的照片及其线性关系图。
图11是在紫外灯254nm激发波长下,拍摄到的荧光mof-植物杂交体在不同浓度cd2+水溶液中培养前后的照片及其线性关系图。
图12是在紫外灯254nm激发波长下,拍摄到的荧光mof-植物杂交体在不同浓度苯胺水溶液中培养前后的照片及其线性关系图。
图13是智能手机app每个分析阶段的界面;其中,①打开应用程序;②裁剪的图像直接从智能手机相册加载到应用程序中;③可得到不同浓度污染物的mof-植物杂交体荧光区域图像的δ强度,并在original9.1中进行线性拟合方程;④通过“calibration”按钮将这些线性校准曲线导入到app中;⑤可以校准不同分析物的线性拟合方程;⑥此后,输入荧光mof-植物杂交体在不同浓度污染物水溶液中培养前后的图像,即可输出污染物的浓度。
图14是通过app计算不同污染物的标准曲线;其中,a是cu2+浓度与平均色相饱和度值的线性关系图,b是ag+浓度与平均色相饱和度值的线性关系图,c是cd2+浓度与平均色相饱和度值的线性关系图,d是苯胺浓度与平均色相饱和度值的线性关系图。
图15是在纯tb2(bdc)3mof悬浮液中加入不同污染物(250μm)的荧光强度变化比图。
图16是纯tb2(bdc)3mof的激发和发射光谱图及与不同污染物的响应趋势及其线性关系图,其中,a是纯tb2(bdc)3mof的激发和发射光谱图,插图是紫外灯在320±20nm激发波长下拍摄的图片;b是在545nm发射波长下纯tb2(bdc)3mof对水溶液中fe3+浓度的响应趋势(ex:320±20nm)及其线性关系图,c是在545nm发射波长下纯tb2(bdc)3mof对水溶液中cu2+浓度的响应趋势(ex:320±20nm)及其线性关系图,d是在545nm发射波长下纯tb2(bdc)3mof对水溶液中ag+浓度的响应趋势(ex:320±20nm)及其线性关系图,e是在545nm发射波长下纯tb2(bdc)3mof对水溶液中cd2+浓度的响应趋势(ex:320±20nm)及其线性关系图,f是在545nm发射波长下纯tb2(bdc)3mof对水溶液中苯胺浓度的响应趋势(ex:320±20nm)及其线性关系图。
图17是有荧光mof和无荧光mof的植物的外观随时间的变化图,其中,a是没有荧光mof的植物的外观随时间的变化图,b是有荧光mof的植物的外观随时间的变化图。
具体实施方式
以下结合实施例对本发明做进一步描述。
实施例1
(1)材料准备:植物合果芋购自flowerpowergardencenterglenhaven(澳大利亚新南威尔士州),见图3。完整的植物合果芋用于原位生长荧光mof,合果芋可在水中生长,是水溶液培养形成荧光mof-植物杂交体的理想选择。将新鲜植物在自来水中培养(每两天更换一次水,始终保持培养水中含有足够的氧气),并在实验前用自来水清洗根部。六水合氯化铽(tbcl3﹒6h2o)购自sigmaaldrich(澳大利亚)。对苯二甲酸二钠(na2bdc)购买于自tci(美国)。所有其他试剂均购自sigmaaldrich(澳大利亚),无需进一步纯化即可使用。
(2)纯tb2(bdc)3mof的形成:在去离子水中分别制备tbcl3·6h2o(20mm,1ml)和na2(bdc)(20mm,1ml)溶液。将这两种溶液混合30s,将形成的荧光mof用去离子水中洗涤3次,样品冷藏于4℃直到用于分析和表征。
(3)荧光mof-植物体杂交体的形成:首先将植物的根部浸入装有20ml浓度为20mmna2(bdc)水溶液的玻璃烧杯中培养12h,然后用自来水清洗植物根部,切割根部2-3mm后,再将植物浸入20ml浓度为20mmtbcl3·6h2o水溶液中培养12小时,最后用自来水洗涤植物根部,将根部切除2-3mm,制得荧光mof-植物杂交体。
(4)表征:荧光mof-植物杂交体在澳大利亚同步辐射中心的同步小角度和广角x射线散射仪器上收集saxs/waxs数据,使用pilatus1m检测器从样品中收集衍射图,光子能量=16kev,光学照片采用华为荣耀10智能手机拍摄获得的。在zeissmerlinsem上以5.0kv的加速电压收集扫描电子显微镜(sem)图像和元素图。通过用便携式紫外灯在254nm激发波长下来获取荧光mof-植物杂交体的图像。
mof前体物金属离子和有机配体通过植物体内的粘附力和内聚力被植物吸收,并在植物体内的生物分子(例如纤维素和木质素)中积聚,使moftb2(bdc)3在植物体内形成。利用能量色散x射线光谱法(eds)采集的元素图谱分析tb元素的存在,如图4a-c和图5所示,在自来水培养植物中不存在tb元素,而tb元素在mof前体物培养的植物体内分布均匀。在紫外灯254nm照射下可观察到植物的茎部有大部分荧光,叶片中较少出现(图4d、e)。茎的纵向截面的扫描电子显微镜(sem)分析发现植物茎内有纳米级的颗粒(图4f,图6a、b),而在自来水中培养的植物茎中未观察到荧光颗粒。植物体内的tb2(bdc)3mof(图6c、d)与体外合成的纯tb2(bdc)3mof具有相同的形态(图7a)。进一步的xrd(图7b)和同步辐射的小/广角x射线散射(saxs/waxs)证实了植物内部的tb2(bdc)3mof与纯tb2(bdc)3mof的晶体结构相同(图4g)。
(5)荧光mof-植物杂交体检测环境污染物:在紫外灯254nm波长照射下对荧光mof-植物杂交体拍照得到培养前荧光图像,再将荧光mof-植物杂交体在待测污染物水样中培养4h后,取出荧光mof-植物杂交体在紫外灯254nm波长照射下拍照得到培养后荧光图像,通过分析培养前荧光图像和培养后荧光图像得到荧光mof-植物杂交体的荧光变化强度,通过荧光mof-植物杂交体的荧光变化强度计算得到水体污染物的浓度。
拍摄照片时,应尽可能每次以相同的角度和方向放置荧光mof-植物杂交体。在紫外灯254nm波长下拍照得到图片,通过imagej分析图片,使用任何绘图/选择工具(如矩形、圆形、多边形或自由形式)选择植物的荧光区域,然后在“设置测量值”下进行分析。其中选择“区域”,“积分密度”和“平均灰度值”。随后,使用分析菜单中的“测量”功能,选择了没有荧光的植物区域作为背景。
将荧光mof-植物杂交体分别在含有fe3+、cu2+、ag+、cd2+和苯胺的一系列水样品中培养4h。含fe3+的水溶液与不含fe3+的溶液相比,在植物体内富集fe3+后,荧光mof-植物杂交体的荧光信号会发生强烈的淬灭(图8a)。fe3+测量范围为0-2μm时,荧光mof-植物杂交体的荧光强度与fe3+浓度呈负线性相关(r=-0.990)(图8b),检测浓度远低于纯tb2(bdc)3mof。此外,cu2+、ag+、cd2+和苯胺的趋势也与纯tb2(bdc)3mof一致(图9-12),但与纯tb2(bdc)3mof相比,具有更低的检测限(50nm),这是因为荧光mof-植物杂交体通过使用植物的粘附力和内聚力主动传输流体对低浓度污染物具有浓缩富集作用。其检出限几乎达到了美国环境保护署(epa)设定的饮用水标准的最大允许水平(即,ag+为50μg/l(0.46μm),cd2+为5μg/l(0.044μm)和cu2+为1.3mg/l(20.4μm)),表明这种新型的荧光mof-植物杂交体对水体中低浓度的污染物检测足够灵敏,可以在安全和可控的条件下监测环境水体中的低浓度污染物。
上面的结果是通过一个简单的便携式紫外灯获得的,这显示了其具有方便操作、低成本的优点。
实施例2
步骤(1)-(4)同实施例1。
(5)荧光mof-植物杂交体检测环境污染物:在智能手机app中输入紫外灯在254nm波长的激发下,荧光mof-植物杂交体在污染物培养前和培养4h后的荧光图像。使用智能手机摄像头采集mof-植物杂交体的图像,然后裁剪出荧光区域。从智能手机相册中裁剪的图像可以直接加载到应用程序中。平均色相饱和度值(hsv)是通过矩阵转换算法从裁剪后的图像中转换每个像素的红绿蓝(rgb)值而获得的。进一步建立图像的hsv和污染物浓度间的模型,通过点击应用程序中的“generateδintensityandconcentration”按钮获得δ强度,通过original9.1计算得出不同分析物的线性拟合方程,然后通过“calibration”按钮将这些线性校准曲线导入到app中。输入荧光图片后,该应用程序可以直接输出污染物浓度。
开发的android应用程序可将荧光mof-植物杂交体发光信号转换为智能手机上的数字信息,以便现场监测环境污染物。智能手机上的高分辨率摄像头用于识别mof-植物杂交体的荧光信号,并通过已建立的hsv-app处理图像(图13)。androidapp的界面如图8c所示。输入与fe3+培养前后的荧光mof-植物杂交体的裁剪图像,从app获得的平均色相饱和度值与fe3+浓度在50nm至2μm之间具有极好的负线性相关关系,可描述为δ强度=0.497x-1.117(r=-0.992)(图8d、e)。此外,cu2+、ag+、cd2+和苯胺也显示出极好的正或负线性相关关系(图14)。而且污染物(fe3+、cu2+、ag+、cd2+和苯胺)的最低可检测浓度为50nm,优于其他荧光mof材料,结果见表1。此外,在污染物加标培养液中,环境污染物的加标回收率极高,在81.92%至150.27%之间,这表明荧光mof-植物杂交体用于环境污染物检测结果的准确性,见表2。
表1荧光mof-植物杂交体与其他荧光法的检测限比较结果
*n.d:未检出
表2荧光mof-植物杂交体对不同污染物的加标回收率
对比例1
纯tb2(bdc)3mof检测环境污染物:通过将2.4mgfe(no3)3溶解在去离子水中,并在微量离心管中将体积调节至1ml储备溶液,再逐步稀释至10-250μm制备一系列不同浓度的fe3+标准溶液。其他金属离子也一样制备标准溶液。将500μltb2(bdc)3mof(40μg/ml)与500μl不同浓度的污染物溶液(agno3、cu(no3)2、fe(no3)3、cdcl2和苯胺)简单混合后,超声处理10分钟,然后将200μl的混合物转移到96孔板读板计上(himadzurf-5301pc)进行发光测量。所有稳态发光测量值均在室温下450-650nm范围内,固定激发波长为320±20nm。
纯tb2(bdc)3mof的室温固态发光响应光谱见图15。激发波长为320±20nm时,tb2(bdc)3在491、545、586和622nm处出现四个发射峰,对应于5d4→7fj(j=6、5、4、3)跃迁,其中545nm处的发射峰强度最高,是最佳发射波长。水中的tb2(bdc)3对有毒金属离子溶液(fe3+、cu2+、ag+、cd2+)和有机物苯胺的发光响应光谱见图16a。在fe3+和cu2+溶液中,观察到tb2(bdc)3光谱中的荧光强度显著降低,而在ag+、cd2+和苯胺溶液中观察到tb2(bdc)3的荧光信号增加(图15)。为了更好地了解tb2(bdc)3对fe3+的荧光响应,进行了不同浓度的荧光响应分析。将tb2(bdc)3固体样品浸入含有各种浓度的fe3+的水溶液中,超声处理10分钟后,进行荧光测量。如图16b所示,tb2(bdc)3悬浮液的荧光响应随着fe3+浓度从0到250μm的增加而降低。也就是说,在fe3+的0-250μm范围内测量时,tb2(bdc)3和fe3+的发射强度间存在负线性相关关系(图16b)。tb2(bdc)3悬浮液在cu2+溶液中的发射强度显示出相同的趋势(图16c)。通常,由“天线效应”引起的tb-mof的荧光包括三个步骤:首先,紫外线被tb3+周围的有机配体吸收,然后能量从有机配体转移到tb3+,最后tb3+产生荧光。因此,阻断配体到镧系金属离子的电荷转移会导致mof淬灭。对于fe3+和cu2+,金属离子在结合过程会影响配体的光物理性质,并进一步影响其向tb3+的能量转移效率,从而影响荧光mof的发光强度。另一方面,fe3+/cu2+(客体)-mof(主体)间的强相互作用也被认为是荧光淬灭的原因。但如果能更有效地激发tb3+,则会使荧光增强。事实证明,添加某些金属离子能更有效地进行能量转移。在本项研究中,观察到随着ag+和cd2+浓度的增加,tb-mof的荧光强度增强(图16d、e),这归因于体系间交叉能量转移(s1→t1)及tb3+和配体之间能量匹配度的增强,从而导致能量更有效地从配体转移到tb3+。对于有机化合物苯胺的荧光增强机理是基于有机化合物的富电子/吸电子基团与mof的有机配体分子或富电子的开放金属位点间的相互作用。如客体硝基芳族化合物的吸电子能力可诱导从mof的光激发电子转移到分析物,从而导致mof的荧光淬灭。苯胺含有富电子基团-nh2,可提高配体的光激发电子转移到mof,从而提高tb-mof的荧光强度(图16f)。但是,高浓度下的苯胺(500μm-10mm)会阻断光激发电子从配体转移到镧系金属离子,从而导致mof荧光淬灭。随着mof荧光信号的增强/减弱变化,mof对金属离子和苯胺的检测限可低至10μm(图16b-f)。
评估荧光mof-植物杂交体的毒性:
荧光mof-植物杂交体形成后,继续培养了14天,植物的外观没有显著差异(图17),这表明mof对植物没有显著的毒性。但流体运输通道(即木质部)中存在的mof颗粒可能会阻碍水和营养的输送。16天后,荧光mof-植物杂交体的叶子开始逐渐呈现黄色,在未来研究中可通过调节mof的前体物浓度,在不降低mof-植物杂交体灵敏度的情况下,减少内部mof对植物的长期影响。
- 还没有人留言评论。精彩留言会获得点赞!