一种等离激元增强荧光免疫检测芯片及其应用的制作方法
本发明属于免疫检测领域,具体涉及一种等离激元增强荧光免疫检测芯片及其应用。
背景技术:
免疫检测作为蛋白的检测手段,是生化检测不可或缺的手段。现阶段的免疫检测技术大多基于酶联免疫吸附检测(elisa),或者是elisa的衍生技术,其特点是利用了生物酶来标记蛋白抗体进行信号放大。生物酶标记技术的免疫检测由于检测信号的均相性,即信号放大和检测需要在液相中进行,使得其在检测通量方面有着瓶颈,并且检测需要的样本量随着检测指标的增多而增多。蛋白生物芯片利用表面荧光信号对蛋白分子进行检测,由于是异相性检测,即发出信号的荧光分子吸附于表面,其检测样本的多指标情况可以通过空间位置来进行分辨,但是由于蛋白芯片异相检测缺少信号放大手段,灵敏度方面明显不足。市场上生物芯片的主要应用还是在拥有pcr(聚合酶链式反应)放大技术的核酸检测领域。为了提高蛋白检测的通量,同时提检测灵敏度能够满足大多数检测需求,一种基于异相检测的荧光增强手段与蛋白芯片相结合是解决通量和灵敏度问题的关键。
技术实现要素:
基于上述现有技术,本发明提供了一种等离激元增强荧光免疫检测芯片及其应用,该芯片可用于免疫检测,如可检测核酸、蛋白和多肽等生物分子,可显著提高免疫检测的通量和灵敏度。
实现本发明上述目的所采用的技术方案为:
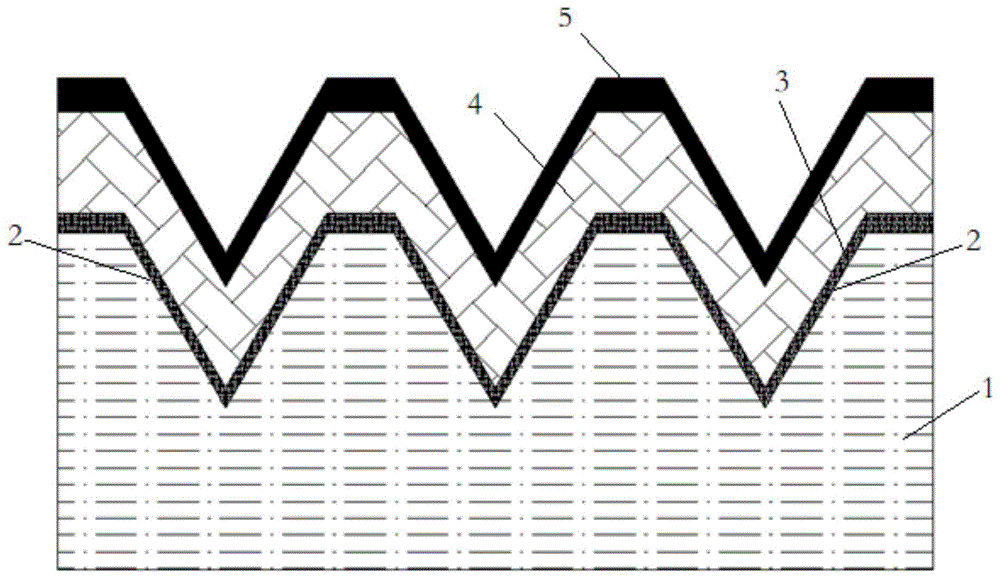
一种等离激元增强荧光免疫检测芯片,包括衬底,衬底上制备有周期性纳米坑结构,周期性纳米坑结构中的纳米坑呈矩阵分布,纳米坑呈倒金字塔状,在周期性纳米坑结构上沉积有金属粘附层,在金属粘附层上沉积有金属增强层,在金属增强层上修饰有高分子层。
所述的纳米坑的顶面呈正方形,侧面呈等腰三角形,纳米坑顶面边长为300-1400nm,纳米坑顶面边长与纳米坑深度的比例为1:1.3-1.5,纳米坑结构的周期为500-2000nm。
所述的金属粘附层所选用的金属为铬或钛,其厚度为5-30nm。
所述的金属增强层所选用的金属为金或银,其厚度为200-300nm。
所述的高分子层的厚度为10-100nm,高分子层中所选用的高分子的结构单元是:
所述的衬底的材质为硅。
当所述的衬底的材质为硅时,所述的等离激元增强荧光免疫检测芯片的制备方法如下:
1、取一个带有氧化硅层的衬底a,在氧化硅层上涂覆电子束光刻胶层,利用电子束曝光的方法在电子束光刻胶层上加工出由圆柱形凹槽周期性排列而成的矩阵,圆柱形凹槽矩阵的周期为500-2000nm,圆柱形凹槽的直径为300-1400nm,圆柱形凹槽的深度为200nm,再通过显影使各圆柱形凹槽底部的氧化硅层暴露;
2、将经过步骤1处理的衬底a放入反应离子刻蚀设备,向反应离子刻蚀设备中通入三氟甲烷气体,对经过步骤1处理的衬底a进行刻蚀,接着更换三氟甲烷为氧气,向反应反应离子刻蚀设备中通入氧气再次刻蚀,刻蚀完毕后,将经刻蚀处理的衬底a取出,在器皿中滴加三甲基氯硅烷,将经刻蚀处理的衬底a放在器皿中并且不与三甲基氯硅烷接触,密封器皿并静置,将经过静置处理的衬底a取出并清洗吹干,得到纳米压印模板;
3、用聚苯乙烯薄膜对纳米印压模板进行纳米印压,将周期性圆柱形凹槽矩阵转印至聚苯乙烯薄上,在聚苯乙烯薄膜上得到周期性圆柱形凸起矩阵;
4、取一个带有氧化硅层的衬底b,在氧化硅层上涂覆紫外纳米压印胶层,将聚苯乙烯薄膜印压有周期性圆柱形凸起矩阵的一面贴合在紫外纳米压印胶层上,再次进行纳米印压,将周期性圆柱形凸起矩阵转印至紫外纳米压印胶层,在紫外纳米压印胶层得到周期性圆柱形凹槽矩阵;
5、将经过步骤4处理的衬底b放入反应离子刻蚀设备,向反应离子刻蚀设备中通入氧气,刻蚀掉各圆柱形凹槽底部残留的紫外纳米压印胶,使各圆柱形凹槽底部的氧化硅层暴露,接着更换氧气为三氟甲烷,向反应反应离子刻蚀设备中通入三氟甲烷再次刻蚀,使各圆柱形凹槽底部暴露的氧化硅层完全刻蚀,使各圆柱形凹槽底部的衬底b暴露,再接着更换三氟甲烷为氧气,向反应反应离子刻蚀设备中通入氧气,刻蚀掉残余的紫外纳米压印胶,得到待处理基底;
6、将待处理基底用氢氧化钾溶液进行腐蚀,在衬底b上制备周期性纳米坑结构,得到周期性纳米坑结构,接着利用氢氟酸去除衬底b上残余的氧化硅层,得到周期性纳米坑结构基底;
7、采用物理气相沉积的方法在周期性纳米坑结构基底上先沉积5-30nm厚度的金属粘附层,再在金属粘附层上沉积厚度为200-300nm的金属增强层,得到周期性金属纳米坑结构基底;
8、在周期性金属纳米坑结构基底上偶联修饰厚度为10-100nm的高分子层。
一种等离激元增强荧光免疫检测芯片在免疫检测中的应用。
与现有技术相比,本发明的有益效果和优点在于:
1、本发明的芯片上制备有特殊的周期性纳米坑结构,即纳米坑呈倒金字塔状,而且纳米坑呈该特殊的周期性纳米坑结构与其上的金属层可以利用等离激元共振增强荧光信号,相比较其他普通形状的纳米坑,如圆柱形,其荧光信号强度增强了35倍左右,可见,采用这种特殊的周期性纳米坑结构,可大幅度提高免疫检测的灵敏度。
2、利用该芯片对emmprin蛋白(细胞外基质金属蛋白酶诱导因子)进行检测,相对于elisa技术,其检测灵敏度提高了26倍。
3、该芯片的制备方法简单,采用电子束光刻、反应离子刻蚀、纳米印压和物理气相沉积等技术进行制作,制作工艺简单易操作,制备成本低。
附图说明
图1为等离激元增强荧光免疫检测芯片的结构示意图。
图2为实施例2制备周期性纳米坑结构基底的工艺流程示意图。
图3为实施例2制备的等离激元增强荧光免疫检测芯片的sem图。
图4为实施例2制备的等离激元增强荧光免疫检测芯片检测goatantimouseigg的荧光信号对比图。
图5为实施例2制备的等离激元增强荧光免疫检测芯片检测山羊抗人emmprin抗体时所得的点线图。
图6为商业化试剂盒检测山羊抗人emmprin抗体时所得的点线图。
图7为对比例2制备的等离激元增强荧光免疫检测芯片的结构示意图。
图8为对比例2制备周期性纳米坑结构基底的工艺流程示意图。
图9为对比例2制备的等离激元增强荧光免疫检测芯片的sem图。
图10为实施例2和对比例2制备的等离激元增强荧光免疫检测芯片检测检测goatantimouseigg的荧光信号对比图。
其中,1-衬底、2-纳米坑、3-金属粘附层、4-金属增强层、5-高分子层。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例1
本实施例提供的等离激元增强荧光免疫检测芯片的结构示意图如图1所示,包括衬底,本实施例中,衬底采用硅基片。
如图1所示,衬底1上制备有周期性纳米坑结构,周期性纳米坑结构中的纳米坑呈矩阵分布,纳米坑结构的周期为2000nm,纳米坑2呈倒金字塔状,纳米坑2的顶面呈正方形,侧面呈等腰三角形,纳米坑2顶面边长为1400nm,纳米坑2的深度为1900nm。
在周期性纳米坑结构上沉积有厚度为30nm的金属粘附层3,金属粘附层3所选用的金属为铬。
在金属粘附层3上沉积有厚度为300nm的金属增强层4,金属增强层4所选用的金属为金。
在金属增强层4上修饰有厚度为10nm的高分子层5,高分子层5中所用的高分子的结构单元为:
实施例2
1、取带有300nm厚度的氧化硅层的硅衬底a(商业购买),在氧化硅层上旋涂厚度为200nm的电子束光刻胶层(采用pmma光刻胶),利用电子束曝光的方法在电子束光刻胶层上加工出由圆柱形凹槽周期性排列而成的矩阵,周期性圆柱形凹槽矩阵的周期为2000nm,圆柱形凹槽的直径为1400nm,圆柱形凹槽的深度为200nm,再通过显影使各圆柱形凹槽底部的氧化硅层暴露;
2、将经过步骤1处理的硅衬底a放入反应离子刻蚀设备,向反应离子刻蚀设备中通入三氟甲烷气体,对经过步骤1处理的衬底a进行刻蚀,刻蚀条件:三氟甲烷气流量300sccm、气压1.6pa、射频功率150w,刻蚀时间250s;接着更换三氟甲烷为氧气,向反应反应离子刻蚀设备中通入氧气再次刻蚀,刻蚀条件:氧气流量100sccm,气压1pa,射频功率100w,刻蚀时间60s;刻蚀完毕后,将经刻蚀处理的衬底a取出,在器皿中滴加0.5ml三甲基氯硅烷,将经刻蚀处理的衬底a放在器皿中并且不与三甲基氯硅烷接触,密封器皿并静置30min,将经过静置处理的衬底a取出,用乙醇清洗后吹干,得到纳米压印模板,如图2(a)所示;
3、用聚苯乙烯薄膜对纳米印压模板进行纳米印压,纳米印压的压力为40bar,温度为150℃,如图2(b)所示,将周期性圆柱形凹槽矩阵转印至聚苯乙烯薄上,在聚苯乙烯薄膜上得到周期性圆柱形凸起矩阵,如图2(c)所示;
4、取带有100nm厚度的氧化硅层的硅衬底b,在氧化硅层上旋涂厚度为200nm的紫外纳米压印胶层,如图2(d)所示,将聚苯乙烯薄膜印压有周期性圆柱形凸起矩阵的一面贴合在紫外纳米压印胶层上,再次进行纳米印压,纳米印压的压力为30bar,温度为65℃,如图2(e)所示,将周期性圆柱形凸起矩阵转印至紫外纳米压印胶层,在紫外纳米压印胶层得到周期性圆柱形凹槽矩阵,如图2(f)所示;
5、将经过步骤4处理的衬底b放入反应离子刻蚀设备,向反应离子刻蚀设备中通入氧气,刻蚀掉各圆柱形凹槽底部残留的紫外纳米压印胶,使各圆柱形凹槽底部的氧化硅层暴露,刻蚀条件为:氧气流量100sccm,气压1pa,射频功率50w,刻蚀时间30s;接着更换氧气为三氟甲烷,向反应反应离子刻蚀设备中通入三氟甲烷再次刻蚀,使各圆柱形凹槽底部暴露的氧化硅层完全刻蚀,使各圆柱形凹槽底部的硅暴露,如图2(g)所示,刻蚀条件为:三氟甲烷气流量300sccm、气压1.6pa、射频功率150w,刻蚀时间250s;最后更换三氯甲烷为氧气,向反应反应离子刻蚀设备中通入氧气,刻蚀掉残余的紫外纳米压印胶,得到待处理基底,如图2(h)所示,刻蚀条件为:氧气流量100sccm,气压1pa,射频功率100w,刻蚀时间60s;
6、将待处理基底用质量百分浓度为28.6%的氢氧化钾溶液进行腐蚀15min,可通过控制腐蚀时间来控制倒金字塔状的纳米坑的尺寸,在衬底b上制备周期性纳米坑结构,如图2(i)所示,接着利用氢氟酸去除残余的氧化硅,得到周期性纳米坑结构基底,如图2(j)所示;
7、采用物理气相沉积的方法在周期性纳米坑结构基底上先沉积30nm厚度的金属粘附层(选用的金属为铬),再在金属粘附层上沉积厚度为300nm的金属增强层(选用的金属为金),得到周期性金属纳米坑结构基底;
8、在周期性金属纳米坑结构基底上偶联修饰高分子层:
8.1、按乙醇与水的体积比为4:1将乙醇与水混合均匀,得到混合溶剂,向混合溶剂中加入巯基十一醇,配制成含10mmol/l的巯基十一醇的混合溶液,将周期性金属纳米坑结构基底浸泡入混合溶液中,浸泡12小时,使得金属增强层上偶联羟基层;
8.2、将环氧氯丙烷加入到0.2mol/l氢氧化钠溶液中,配制成含0.2mol/l的氧氯丙烷碱性溶液,将经8.1处理的周期性金属纳米坑结构基底浸泡入氧氯丙烷碱性溶液4小时,将羟基层活化成环氧基团层,再将含有环氧基团层的周期性金属纳米坑结构基底浸泡入0.3g/ml的葡聚糖溶液或者壳聚糖溶液20小时,得到带有厚度为10nm的葡聚糖层或者壳聚糖层的周期性金属纳米坑结构基底;
8.3、将溴乙酸加入到2mol/l的naoh溶液中,配制0.1mol/l溴乙酸碱性溶液,将经8.3处理的周期性金属纳米坑结构基底浸泡入溴乙酸碱性溶液中,浸泡12小时,将葡聚糖层或者壳聚糖层改性为羧基化葡聚糖层;
8.4、将经过步骤8.3处理的周期性金属纳米坑结构基底泡入含0.1mol/l的n-羟基琥珀酰亚胺和含0.1mol/l(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)的水溶液中,浸泡1小时,得到实施例1所述的等离激元增强荧光免疫检测芯片,记为免疫检测芯片-s。
将本实施例制备的等离激元增强荧光免疫检测芯片用扫描电子显微镜进行扫描,所得的sem图如图3所示,从图3中可以看出,本实施例制备的等离激元增强荧光免疫检测芯片上的纳米坑呈倒金字塔状,且纳米坑呈矩阵分布。
试验一、本发明的等离激元增强荧光免疫检测芯片检测goatantimouseigg抗体试验试验方法:
1、配制浓度为1mg/ml的山羊抗小鼠抗体磷酸缓冲液,将实施例2制备的等离激元增强荧光免疫检测芯片浸没入浓度为山羊抗小鼠抗体磷酸缓冲液60分钟,取出后用磷酸缓冲液浸泡清洗清洗三次,每次5分钟;
2、配制浓度为1mg/ml的小鼠抗体磷酸缓冲液,将经过步骤1处理的等离激元增强荧光免疫检测芯片浸泡入小鼠抗体磷酸缓冲液中30分钟,取出后用磷酸缓冲液浸泡清洗三次,每次5分钟;
3、配制荧光alexa647标记的1ug/ml山羊抗小鼠抗体磷酸缓冲液,将经步骤2处理的等离激元增强荧光免疫检测芯片浸泡入荧光alexa647标记的山羊抗小鼠抗体磷酸缓冲液中15分钟,取出后用磷酸缓冲液浸泡清洗三次,每次5分钟,再用去离子水冲洗,并用氮气吹干;
4、利用荧光扫描仪(激发波长632nm)检测经步骤3处理的等离激元增强荧光免疫检测芯片上设有周期性金属纳米坑结构区域和没有周期性金属纳米坑结构区域(即平面区域)的荧光信号;
试验结果:
将实施例2制备的等离激元增强荧光免疫检测芯片修饰goatantimouseigg抗体后,其荧光检测结果如图4所示,由图4可知,其荧光在设有周期性金属纳米坑结构区域上,相对于没有周期性金属纳米坑结构区域,其荧光信号强度约增强了120倍,荧光信号强度增强越多,其检测的灵敏度就越高。
试验二、本发明的等离激元增强荧光免疫检测芯片的检测限试验
本试验将实施例2制备的等离激元增强荧光免疫检测芯片与商业化试剂盒(r&d公司humanemmprinduoset试剂盒)两者对emmprin抗体的检测限进行对比,具体的试验方法如下:
1、利用实施例2制备的等离激元增强荧光免疫检测芯片检测方法如下:
1.1、配制5份浓度为250ug/ml的山羊抗人emmprin抗体磷酸缓冲液,将5片按照实施例2的方法制备的等离激元增强荧光免疫检测芯片分别浸泡入5份山羊抗人emmprin抗体磷酸缓冲液中,浸泡时间为60min,将5片等离激元增强荧光免疫检测芯片取出后用分别磷酸缓冲液浸泡清洗三次,每次5分钟;
1.2、配制浓度分别为150pg/ml、15pg/ml、1.5pg/ml、0.15pg/ml和0pg/ml的emmprin磷酸缓冲液,将经步骤1处理的5片等离激元增强荧光免疫检测芯片分别浸泡入浓度为150pg/ml、15pg/ml、1.5pg/ml、0.15pg/ml和0pg/ml的emmprin磷酸缓冲液中,浸泡时间为120min,将5片等离激元增强荧光免疫检测芯片取出后分别用磷酸缓冲液浸泡清洗三次,每次5分钟;
1.3、配制5份荧光alexa647标记的小鼠抗人emmprin抗体磷酸缓冲液,将经步骤2处理的5片等离激元增强荧光免疫检测芯片分别浸泡入5份荧光alexa647标记的小鼠抗人emmprin抗体磷酸缓冲液中,浸泡时间为30分钟,将5片等离激元增强荧光免疫检测芯片取出后用分别磷酸缓冲液浸泡清洗三次,每次5分钟,再用去离子水冲洗,并用氮气吹干;
1.4、利用荧光扫描仪(激发波长632nm、发射波长677nm)检测经步骤3处理的5片等离激元增强荧光免疫检测芯片的荧光信号;
试验结果:
1、以荧光信号强度为纵坐标,以emmprin磷酸缓冲液的浓度为横坐标,根据5片等离激元增强荧光免疫检测芯片检测到的数据进行作图,所得的点线图如图5所示,拟合后得到标准曲线,根据标准曲线得到实施例2制备的等离激元增强荧光免疫检测芯片的检测限为1.5pg/ml;
2、以荧光信号强度为纵坐标,以emmprin磷酸缓冲液的浓度为横坐标,商业化试剂盒检测到数据进行作图,所得的点线图如图6所示,拟合后得到标准曲线,根据标准曲线得到商业化试剂盒的39pg/ml;可见,相对于采用elisa技术的试剂盒,本发明的等离激元增强荧光免疫检测芯片的检测限大幅度降低,检测灵敏度提高了26倍,检测的灵敏度大幅度提高。
对比例1
本对比例制备的等离激元增强荧光免疫检测芯片的结构如图7所示,包括衬底,本实施例中,衬底采用氧化硅基片。
如图7所示,衬底7上制备有周期性纳米坑结构,周期性纳米坑结构中的纳米坑呈蜂窝状分布,纳米坑结构的周期为500nm,纳米坑2呈圆柱状,纳米坑2的直径为400nm,纳米坑2的深度为300nm。
在周期性纳米坑结构上沉积有厚度为10nm的金属粘附层3,金属粘附层3所选用的金属为铬。
在金属粘附层3上沉积有厚度为100nm的金属增强层4,金属增强层4所选用的金属为金。
在金属增强层4上修饰有厚度为10nm的高分子层5,高分子层5中所用的高分子的结构单元为:
对比例2
1、取带有300nm厚度的氧化硅层的硅衬底a,在氧化硅层上旋涂厚度为200nm的电子束光刻胶层(采用pmma光刻胶),利用电子束曝光的方法在电子束光刻胶层上加工出由圆柱形凹槽周期性排列而成的蜂窝状阵列,周期性圆柱形凹槽蜂窝状阵列的周期为500nm,圆柱形凹槽的直径为400nm,圆柱形凹槽的深度为200nm,再通过显影使各圆柱形凹槽底部的氧化硅层暴露;
2、将经过步骤1处理的硅衬底a放入反应离子刻蚀设备,向反应离子刻蚀设备中通入三氟甲烷气体,对经过步骤1处理的衬底a进行刻蚀,刻蚀条件:三氟甲烷气流量300sccm、气压1.6pa、射频功率150w,刻蚀时间250s;接着更换三氟甲烷为氧气,向反应反应离子刻蚀设备中通入氧气再次刻蚀,刻蚀条件:氧气流量100sccm,气压1pa,射频功率100w,刻蚀时间60s;刻蚀完毕后,将经刻蚀处理的衬底a取出,在器皿中滴加0.5ml三甲基氯硅烷,将经刻蚀处理的衬底a放在器皿中并且不与三甲基氯硅烷接触,密封器皿并静置30min,将经过静置处理的衬底a取出,用乙醇清洗后吹干,得到纳米压印模板,如图8(a)所示;
3、用聚苯乙烯薄膜对纳米印压模板进行纳米印压,纳米印压的压力为40.5bar,温度为150℃,如图8(b)所示,将周期性圆柱形凹槽矩阵转印至聚苯乙烯薄上,在聚苯乙烯薄膜上得到周期性圆柱形凸起矩阵,如图8(c)所示;
4、取带有100nm厚度的氧化硅层的硅衬底b,在氧化硅层上旋涂厚度为200nm的紫外纳米压印胶层,如图8(d)所示,将聚苯乙烯薄膜印压有周期性圆柱形凸起矩阵的一面贴合在紫外纳米压印胶层上,再次进行纳米印压,纳米印压的压力为30bar,温度为65℃,如图8(e)所示,将周期性圆柱形凸起矩阵转印至紫外纳米压印胶层,在紫外纳米压印胶层得到周期性圆柱形凹槽矩阵,如图8(f)所示;
5、将经过步骤4处理的衬底b放入反应离子刻蚀设备,向反应离子刻蚀设备中通入氧气,刻蚀掉各圆柱形凹槽底部残留的紫外纳米压印胶,使各圆柱形凹槽底部的氧化硅层暴露,刻蚀条件为:氧气流量100sccm,气压1pa,射频功率50w,刻蚀时间30s;接着更换氧气为三氟甲烷,向反应反应离子刻蚀设备中通入三氟甲烷再次刻蚀,使各圆柱形凹槽底部暴露的氧化硅层完全刻蚀,使各圆柱形凹槽底部的硅暴露,如图8(g)所示,刻蚀条件为:三氟甲烷气流量300sccm、气压1.6pa、射频功率150w,刻蚀时间250s;最后更换三氯甲烷为氧气,向反应反应离子刻蚀设备中通入氧气,刻蚀掉残余的紫外纳米压印胶,得到待处理基底,如图8(h)所示,刻蚀条件为:氧气流量100sccm,气压1pa,射频功率100w,刻蚀时间60s;
7、采用物理气相沉积的方法在周期性纳米坑结构基底上先沉积10nm厚度的金属粘附层(选用的金属为铬),再在金属粘附层上沉积厚度为100nm的金属增强层(选用的金属为金),得到周期性金属纳米坑结构基底;
8、在周期性金属纳米坑结构基底上偶联修饰高分子层:
8.1、按乙醇与水的体积比为4:1将乙醇与水混合均匀,得到混合溶剂,向混合溶剂中加入巯基十一醇,配制成含10mmol/l的巯基十一醇的混合溶液,将周期性金属纳米坑结构基底浸泡入混合溶液中,浸泡12小时,使得金属增强层上偶联羟基层;
8.2、将环氧氯丙烷加入到0.2mol/l氢氧化钠溶液中,配制成含0.2mol/l的氧氯丙烷碱性溶液,将经8.1处理的周期性金属纳米坑结构基底浸泡入氧氯丙烷碱性溶液4小时,将羟基层活化成环氧基团层,再将含有环氧基团层的周期性金属纳米坑结构基底浸泡入0.3g/ml的葡聚糖溶液或者壳聚糖溶液20小时,得到带有厚度为10nm的葡聚糖层或者壳聚糖层的周期性金属纳米坑结构基底;
8.3、将溴乙酸加入到2mol/l的naoh溶液中,配制0.1mol/l溴乙酸碱性溶液,将经8.3处理的周期性金属纳米坑结构基底浸泡入溴乙酸碱性溶液中,浸泡12小时,将葡聚糖层或者壳聚糖层改性为羧基化葡聚糖层;
8.4、将经过步骤8.3处理的周期性金属纳米坑结构基底泡入含0.1mol/l的n-羟基琥珀酰亚胺和含0.1mol/l(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)的水溶液中,浸泡1小时,得到实施例1所述的等离激元增强荧光免疫检测芯片,记为免疫检测芯片-d。
将本对比例制备的等离激元增强荧光免疫检测芯片用扫描电子显微镜进行扫描,所得的sem图如图9所示,从图9中可以看出,本对比例制备的等离激元增强荧光免疫检测芯片上的纳米坑呈圆柱状,且纳米坑呈蜂窝状分布。
试验三、不同等离激元增强荧光免疫检测芯片免疫检测的效果试验
试验方法:
1、配制两份浓度为1mg/ml的山羊抗小鼠抗体磷酸缓冲液,将实施例2制备的的免疫检测芯片-s和对比例2制备的免疫检测芯片-d分别浸没入两份山羊抗小鼠抗体磷酸缓冲液中,浸泡60分钟,取出两免疫芯片后分别磷酸缓冲液浸泡清洗三次,每次5分钟;
2、配制两份浓度为1ug/ml的小鼠抗体磷酸缓冲液,将经步骤1处理的免疫检测芯片-s和免疫检测芯片-d分别浸泡入两份小鼠抗体磷酸缓冲液中,浸泡30分钟,取出两免疫芯片后分别磷酸缓冲液浸泡清洗三次,每次5分钟;
3、配制两份荧光alexa647标记的1ug/ml山羊抗小鼠抗体磷酸缓冲液,将经步骤2处理的免疫检测芯片-s和免疫检测芯片-d分别浸泡入两份alexa647标记的山羊抗小鼠抗体磷酸缓冲液中,浸泡15分钟,取出两免疫芯片后分别磷酸缓冲液浸泡清洗三次,每次5分钟,再用去离子水冲洗,并用氮气吹干;
4、利用荧光扫描仪(激发波长632nm、发射波长677nm)检测经步骤3处理的免疫检测芯片-s和免疫检测芯片-d的荧光信号;
试验结果:
将实施例2和对比例2制备的等离激元增强荧光免疫检测芯片修饰goatantimouseigg抗体后,其荧光检测结果如图9所示,由图9可知,实施例2制备的的免疫检测芯片-s,相对于对比例2制备的免疫检测芯片-d,其荧光信号增强了30倍,荧光信号越强,其检测的灵敏度越高。
- 还没有人留言评论。精彩留言会获得点赞!