一种检测羊的配种时机的方法与流程
本发明涉及一种检测方法,尤其是一种检测羊的配种时机的方法,属于动物检测方法技术领域。
背景技术:
目前,在羊的繁殖过程中,羊的配种时机通常选择在母羊自然发情期1-2天内,通过羊的自然交配或者人工授精完成配种。由于母羊的自然发情期会受自身雌激素及外界影响,致使发情症状开始到排卵这一期间的时段较长,且受个体差异影响,通常为9—37小时,因此难于精准预测排卵时间,过早完成自然或人工配种,会导致输入的公羊精子老化、数量减少、活力降低,过晚会导致母羊卵细胞老化,从而降低配种成功率。因此,有必要对现有技术加以改进。
技术实现要素:
由于卵细胞的成熟、卵泡的破裂,均会受促黄体生成素lh高峰的影响,通常山羊、绵羊会于促黄体生成素lh高峰后的14-14.5小时排卵,波尔羊会于促黄体生成素lh高峰后8小时排卵,越靠近排卵时间完成配种或输精,配种的成功率就越高,为此,本发明基于这一自然规律,提供一种羊配种时机的检测方法,为羊的准确配种提供可靠的技术支撑。
本发明通过下列技术方案完成:一种检测羊的配种时机的方法,其特征在于包括下列步骤:
1)将1--10ml母羊血于阴凉处静置1-2小时,分离出血清;或者收集母羊在上次小便后1-2小时再小便的尿液1-10ml;
2)将羊的促黄体生成素lh检测试纸插入步骤1)的血清或者尿液中5--10秒,取出,于15-18分钟后,观察该检测试纸中的质控线c与检测线t是否显色:
3)显色结果如下:
试纸质控线c未显色、检测线t显色,表明检测结果无效,需要重复检测;
试纸质控线c显色,检测线t未显色,表明母羊的促黄体生成素lh水平低下,需要隔日再检测;
试纸质控线c及检测线t都显色,用该显色与lh比色卡进行下列对比;
31)当促黄体生成素lh≦10miu/ml,表明母羊的促黄体生成素lh处于基础水平,卵细胞尚未成熟,不能配种;
32)当促黄体生成素lh在10—20miu/ml时,表明母羊开始进入排卵期;
33)每隔4小时重复步骤1)-3)进行一次检测,每天检测三次,直至母羊的促黄体生成素lh达到40---100miu/m时,表明母羊的促黄体生成素lh高峰到来,距离排卵时间8---15小时;
4)根据步骤3)的检测结果,进行自然或人工配种。
所述步骤4)的自然或人工配种时,公羊的精子进入到母羊体内的存活时间是:24-36小时。
所述步骤2)羊的促黄体生成素lh检测试纸经过下列方法制备:
21)按下列制备各组分:
金溶液:将质量浓度为1%的氯金酸溶液2ml、质量浓度为1%的柠檬酸钠2ml,加入纯化水至100ml,加热至溶液呈现紫红色后,冷却至室温,得金溶液;
封闭液:将0.005g牛血清白蛋白溶解在300ul纯化水中,加入30ul碳酸钾溶液,混合均匀,得330ul封闭液;
样本垫处理液:将0.605g三羧甲氨基甲烷、1.5g氯化钠完全溶解在100ml纯化水中,得样本垫处理液;
胶体金结合物稀释液:将0.605g三羧甲氨基甲烷,0.2g聚乙烯吡咯烷酮,5g蔗糖,0.9g氯化钠,0.5g牛血清白蛋白,3ml羊血清,0.15ml吐温20,与100ml纯化水混合均匀,得胶体金结合物稀释液;
lh包被液:将100-200mg羊的促绒毛膜性腺激素单克隆α亚级抗体hcgmabcoating、质量浓度为1%的海藻糖溶液1ml溶解在0.01mpbs缓冲液100ml中,混合均匀,得lh包被液;
igg包被液:将羊抗鼠igg抗体100mg、质量浓度为1%的海藻糖溶液1ml溶解在0.01mpbs缓冲液100ml中,混合均匀,得igg包被液;
22)在底板上划膜
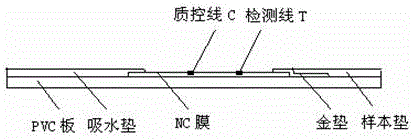
22a)将nc膜贴在pvc板上表面的中部,得底板;
22b)按0.8μl/cm的量,以500mm/s的速度,将步骤21)的igg包被液均匀地划在步骤22a)底板上的nc膜的上端作为质控线c,将lh包被液均匀地划在nc膜的下端作为检测线t,质控线c与检测线t相距6mm±1mm,质控线c距离nc膜上端8mm±1mm,检测线t距离nc膜下端7mm±1mm,然后放入干燥箱内,于温度为25℃±2℃、湿度≤30%下干燥18h±2h,得划膜板;
23)金垫制备
23a)在100ml步骤21)的金溶液中加入1.2ml碳酸钾溶液、1.5-2mglhmb2,搅拌40min,滴加330ul封闭液,搅拌10min,于4℃、12000r/min的条件下离心40min,直至上清液变为水,弃上清液,取余液5.3ml,加入40ml胶体金结合物稀释液混匀;
23b)将40ml胶体金结合物稀释液均匀铺在1080cm2玻璃纤维素膜上,然后放入干燥箱内,于温度为25℃±2℃、湿度≤30%下干燥18h±2h,得金垫;
24)样本垫制备
24a)按30ml/张的量,将步骤21)的样本垫处理液均匀铺在玻璃纤维素膜上,然后放入干燥箱内,于温度为25℃±2℃、湿度≤30%下干燥18h±2h,得样本垫;
25)贴板
25a)将步骤23)的金垫贴于步骤22b)划膜板的nc膜下端,并使1-2mm的金垫后端搭在nc膜上;
25b)将步骤24)的样本垫贴于步骤25a)的金垫前端上面,并使样本垫后端完全搭在金垫上,样本垫前端贴于pvc板前端;
25c)将吸水垫贴于25b)的pvc板后端,并使1-2mm的吸水垫前端搭在nc膜后端;
26)将步骤25c)贴板切割成3.0±0.5mm的试纸条,得羊促黄体生成素lh检测试纸。
本发明具有下列优点和效果:采用上述方案,可方便地在母羊发情期,提取其血清或尿液,用本发明提供的促黄体生成素lh检测试纸进行促黄体生成素lh的检测,通过检测母羊的促黄体生成素lh水平,与比色卡进行下列对比,可以将母羊的排卵时间准确预测在8—15小时内,而公羊的精子进入到母羊体内的存活时间是24-36小时,因此,可大大提高羊的配种成功率,且通过一次自然交配或人工输精,即可配种成功。从根本上解决了现有技术只能通过目测母羊是否发情,而进行自然交配或人工输精导致需通过多次配种或输精才能成功的弊端,节约了大量的人力、物力、财力、时间,提高羊的繁殖率。
附图说明
图1为lh检测试纸条的结构示意图;
图2为lh比色卡图。
具体实施方式
下面通过实施例对本发明做进一步说明。
实施例1
羊的促黄体生成素lh检测试纸经过下列方法制备:
1)按下列制备各组分:
11)金溶液:将质量浓度为1%的氯金酸溶液2ml、质量浓度为1%的柠檬酸钠2ml,加入纯化水至100ml,加热至溶液呈现紫红色后,冷却至室温,得金溶液;
12)封闭液:将0.005g牛血清白蛋白溶解在300ul纯化水中,加入30ul碳酸钾溶液,混合均匀,得330ul封闭液;
13)样本垫处理液:将0.605g三羧甲氨基甲烷、1.5g氯化钠完全溶解在100ml纯化水中,得样本垫处理液;
14)胶体金结合物稀释液:将0.605g三羧甲氨基甲烷,0.2g聚乙烯吡咯烷酮,5g蔗糖,0.9g氯化钠,0.5g牛血清白蛋白,3ml羊血清,0.15ml吐温20,与100ml纯化水混合均匀,得胶体金结合物稀释液;
15)lh包被液:将100-200mg羊的促绒毛膜性腺激素单克隆α亚级抗体hcgmabcoating、质量浓度为1%的海藻糖溶液1ml溶解在0.01mpbs缓冲液100ml中,混合均匀,得lh包被液;
16)igg包被液:将羊抗鼠igg抗体100mg、质量浓度为1%的海藻糖溶液1ml溶解在0.01mpbs缓冲液100ml中,混合均匀,得igg包被液;
上述各组分的量是用于5块6cm×30cm的pvc板,每块pvc板切为100条3mm×6cm的试纸条;
2)在底板上划膜
2a)将nc膜分别贴在5块pvc板上表面的中部,得底板;
2b)用xyz3010喷金划膜仪,并按0.8μl/cm的量,以500mm/s的速度,将步骤16)的igg包被液均匀地划在5块步骤2a)底板上的nc膜的上端作为质控线c、将步骤15)的lh包被液均匀地划在5块步骤2a)底板上的nc膜的下端作为检测线t,质控线c与检测线t相距6mm±1mm,质控线c距离nc膜上端8mm±1mm,检测线t距离nc膜下端7mm±1mm,然后放入干燥箱内,于温度为25℃±2℃、湿度≤30%下干燥18h±2h,得划膜板;
3)金垫制备
3a)在100ml步骤11)的金溶液中加入1.2ml碳酸钾溶液、1.5-2mglhmb2,搅拌40min,滴加330ul步骤12)的封闭液,搅拌10min,于4℃、12000r/min的条件下离心40min,直至上清液变为水,弃上清液,取余液5.3ml,加入40ml步骤14)的胶体金结合物稀释液混匀,得45.3ml胶体金结合物稀释液的混合液;
3b)将步骤3a)的45.3ml胶体金结合物稀释液的混合液均匀铺在5块玻璃纤维素膜rb65上,每块玻璃纤维素膜rb65尺寸为6mm×30cm,然后放入干燥箱内,于温度为25℃±2℃、湿度≤30%下干燥18h±2h,得金垫;
4)样本垫制备
4a)按30ml/张的量,将步骤13)的样本垫处理液均匀铺在5块玻璃纤维素膜sb06上,每块玻璃纤维素膜rb65尺寸为20mm×30cm,然后放入干燥箱内,于温度为25℃±2℃、湿度≤30%下干燥18h±2h,得样本垫;
5)每一块贴板的制备
5a)将步骤3)的金垫贴于步骤2b)划膜板的nc膜下端,并使1-2mm的金垫后端搭在nc膜上;
5b)将步骤4)的样本垫贴于步骤5a)的金垫前端上面,并使样本垫后端完全搭在金垫上,样本垫前端贴于pvc板前端;
5c)将吸水垫贴于5b)的pvc板后端,并使1-2mm的吸水垫前端搭在nc膜后端;
6)将步骤5c)的每一块贴板切割成100条6cm×3mm的试纸条,装盒,得500条促黄体生成素lh检测试纸,每一条促黄体生成素lh检测试纸的结构如图1。
实施例2
检测羊的配种时机的方法,包括下列步骤:
1)取样,利用采血针与抗凝血管从山羊母羊颈脖静脉处抽取5毫升羊血,于阴凉处静置1小时,分离出血清;
2)检测,将一条实施例1的促黄体生成素lh检测试纸插入步骤1)的血清中,10秒,取出,于15分钟后观察该试纸中的质控线c与检测线t是否显色:
3)检测结果如下:
试纸质控线c未显色、检测线t显色,表明本次检测结果无效;
4)当即再重复步骤1)、2),得到下列检测结果:
试纸质控线c和检测线t都显色,用该试纸上的显色与lh比色卡(如图2)进行下列对比;
41)促黄体生成素lh≦10miu/ml,表明该山羊母羊的促黄体生成素lh处于基础水平,卵细胞尚未成熟,不能配种。
实施例3
检测羊的配种时机的方法,包括下列步骤:
1)取样,利用采血针与抗凝血管从山羊母羊颈脖静脉处抽取6毫升羊血,于阴凉处静置2小时,分离出血清;
2)检测,将一条实施例1的促黄体生成素lh检测试纸插入步骤1)的血清中,5秒,取出,于18分钟后观察该试纸中的质控线c与检测线t是否显色:
3)检测结果如下:
试纸质控线c显色,检测线t未显色,表明母羊的促黄体生成素lh水平低下,二天后重复步骤1)、2)进行检测,结果如下:
试纸质控线c和检测线t都显色,用该试纸上的显色与lh比色卡(如图2)进行下列对比;
促黄体生成素lh为20miu/ml,表明该山羊母羊开始进入排卵期,之后每隔4小时重复步骤1)、2)进行一次检测,每天检测三次,第二天该山羊母羊的促黄体生成素lh达到80miu/m,表明该山羊母羊的促黄体生成素lh高峰出现,距离排卵时间如下:14---14.5小时;
4)根据步骤3)的检测结果,进行自然配种,且没有再发情,该山羊母羊受孕,半年后产小羊。
实施例4
检测羊的配种时机的方法,包括下列步骤:
1)取样,利用采血针与抗凝血管从山羊母羊颈脖静脉处抽取2毫升羊血,于阴凉处静置1.5小时,分离出血清;
2)检测,将一条实施例1的促黄体生成素lh检测试纸插入步骤1)的血清中,8秒,取出,于16分钟后观察该试纸中的质控线c与检测线t是否显色:
3)检测结果如下:
试纸质控线c和检测线t都显色,用该试纸上的显色与lh比色卡(如图2)进行下列对比;
促黄体生成素lh为10miu/ml,表明该山羊母羊开始进入排卵期,之后每隔4小时重复步骤1)、2)进行一次检测,每天检测三次,第二天该山羊母羊的促黄体生成素lh达到40miu/m,表明该山羊母羊的促黄体生成素lh高峰出现,距离排卵时间如下:14---14.5小时;
4)根据步骤3)的检测结果,进行自然配种,且没有再发情,该山羊母羊受孕,半年后产小羊。
实施例5
检测羊的配种时机的方法,包括下列步骤:
1)取样,收集波尔羊母羊在上次小便后1小时再小便的尿液10ml;
2)检测,将一条实施例1的促黄体生成素lh检测试纸插入步骤1)的尿液中,7秒,取出,于16分钟后观察该试纸中的质控线c与检测线t是否显色:
3)检测结果如下:
试纸质控线c和检测线t都显色,用该试纸上的显色与lh比色卡(如图2)进行下列对比;
促黄体生成素lh为20miu/ml,表明该波尔羊母羊开始进入排卵期,之后每隔4小时重复步骤1)、2)进行一次检测,每天检测三次,第二天该波尔羊母羊的促黄体生成素lh达到60miu/m,表明该波尔羊母羊的促黄体生成素lh高峰出现,距离排卵时间如下:8小时;
4)根据步骤3)的检测结果,按常规进行人工授精,之后该波尔羊母羊没有再发情,表明已受孕,半年后产小羊。
实施例6
检测羊的配种时机的方法,包括下列步骤:
1)取样,收集绵羊母羊在上次小便后2小时再小便的尿液8ml;
2)检测,将一条实施例1的促黄体生成素lh检测试纸插入步骤1)的尿液中,7秒,取出,于17分钟后观察该试纸中的质控线c与检测线t是否显色:
3)检测结果如下:
试纸质控线c和检测线t都显色,用该试纸上的显色与lh比色卡(如图2)进行下列对比;
促黄体生成素lh为20miu/ml,表明该绵羊母羊开始进入排卵期,之后每隔4小时重复步骤1)、2)进行一次检测,每天检测三次,第二天该绵羊母羊的促黄体生成素lh达到100miu/m,表明该绵羊母羊的促黄体生成素lh高峰出现,距离排卵时间如下:8小时;
4)根据步骤3)的检测结果,按常规进行人工授精,之后该绵羊母羊没有再发情,表明已受孕,半年后产小羊。
上述lh比色卡均为常规产品。
下面通过对比实验证明本发明的效果:
采用实施例3-6的方法,分别对120只母羊进行检测,其中:
山羊的母羊30只作为第一组,采用与实施例3相同的方法进行检测、配种;
绵羊的母羊30只作为第二组,采用与实施例4相同的方法进行检测、配种;
波尔羊的母羊30只作为第三组,采用与实施例5相同的方法进行检测、配种;
混合羊30只作为第四组,山羊、绵羊、波尔羊各10只,采用与实施例6相同的方法进行检测、配种;
检测结果如下:
第一组有26只受孕,4只返情;
第二组有28只受孕,2只返情;
第三组有25只受孕,5只返情;
第四组有27只受孕,3只返情,山羊、绵羊、波尔羊各1只;
配种成功率为88%以上。
对比例1
取30只山羊的母羊,按常规进行自然配种,其中14只受孕,其余16只返情,配种成功率为46%。
对比例2
取30绵羊的母羊,按常规进行人工受精,其中15只受孕,其余15只返情,配种成功率为50%。
对比例3
取30波尔羊的母羊,按常规进行人工受精,其中15只受孕,其余15只返情,配种成功率为50%。
- 还没有人留言评论。精彩留言会获得点赞!