一种检测NDM-1耐药蛋白双抗夹心ELISA试剂盒及检测方法与流程
本发明涉及一种用于检测细菌中ndm-1耐药蛋白的双抗夹心elisa检测试剂盒及其检测方法,属于免疫学分析技术领域。
背景技术:
近年来,由于抗生素在临床大量使用甚至不当使用,在抗生素的选择压力下,临床疾病相关细菌的耐药菌株不断出现,而且出现多重耐药株,由于耐药菌可进行多途径高速率传播,尤其是人畜的交叉感染,严重威胁了人类的生命安全,同时大大增加了临床抗感染的难度。
ndm-1又名“新德里金属-β-内酰胺酶1”,简称为ndm-1。新德里金属β内酰胺酶-1(ndm-1)属于b1亚类金属β内酰胺酶,能水解除氨曲南外的绝大多数β内酰胺类抗菌药物,其基因大多定位在质粒上,易引起水平传播。2010年kumarasamy等报道了产ndm-1肠杆菌在印度、巴基斯坦以及英国等国家的流行,引起国际性的关注。随后,美国、德国、日本、中国香港等地不断检出携带ndm-1的菌株,多为大肠埃希菌、肺炎克雷伯菌和鲍曼不动杆菌等临床常见的致病菌。据报道,这种病可以通过饮水等途径传染,表现症状为肠道感染,这种新型细菌对几乎所有抗生素都具有抗药性,死亡率很高,不仅在医院中存在,在自然界中也同样存在。
目前现有检测ndm-1的方法主要有纸片扩散法、etest检测法、微量稀释法、pcr等。其中,纸片扩散法缺乏特异性,仅适合初筛试验,etest检测法、微量稀释法灵敏度低,而pcr可通过特异性引物对ndm-1阳性细菌进行确证,但对仪器设备的要求较高,且操作复杂,不易在临床应用,而elisa作为常用的检测微生物的方法,具有快速、灵敏、高通量、特异性好等特点,因此建立一种用于检测ndm-1耐药蛋白的双抗夹心elisa试剂盒及方法具有重要的应用价值。
技术实现要素:
本发明的目的是提供一种灵敏度高、特异性强、操作简便、检测快速的检测细菌中ndm-1耐药蛋白的双抗夹心酶联免疫试剂盒及检测方法。
为了实现上述目的,本发明采用的技术方案是:
一种用于检测细菌中ndm-1耐药蛋白的双抗夹心elisa检测试剂盒,包括:包被有单克隆抗体8e3的酶标板、检测抗体4g7-hrp、ndm-1蛋白。
在一个实施方案中,所述检测ndm-1耐药蛋白的双抗夹心elisa检测试剂盒,包括:
1)重组ndm-1(36-270)蛋白为通过截断ndm-1序列,n端添加his标签,克隆至表达载体pet-28a,并转化入大肠杆菌bl21(de3)宿主菌株中,经iptg诱导表达,使用ni-nta镍柱纯化得到的;
上述重组ndm-1(36-270)蛋白氨基酸序列为序列1;
在一个实施方案中,所述ndm-1单克隆抗体8e3,4g7为采用重组ndm-1(36-270)蛋白免疫小鼠,经融合、克隆、筛选,得到的;
所述单克隆抗体8e3的重链可变区的氨基酸序列为序列2;
所述单克隆抗体8e3的轻链可变区的氨基酸序列为序列3;
所述单克隆抗体4g7的重链可变区的氨基酸序列为序列4;
所述单克隆抗体4g7的轻链可变区的氨基酸序列为序列5。
在一个实施方案中,所述检测抗体4g7-hrp的制备方法包括如下步骤:
(1)称取5mghrp溶于1ml三蒸水中,逐滴缓慢加入0.20ml新配的0.1mnaio4溶液,4℃避光搅拌25min,活化hrp,颜色由棕色变为绿色;上述溶液装入透析袋中,用1m,ph4.4的醋酸钠缓冲液中4℃过夜透析,然后10000r/min,4℃,离心10min,去除沉淀,得到透析后的hrp;
(2)将单克隆抗体4g7用0.2m,ph为9.5的碳酸缓冲液4℃透析过夜,得到透析后的抗体;
(3)将透析后的hrp加入0.16m乙二醇(每mg酶加0.1ml),4℃避光搅拌1h,然后加入透析后的抗体;两者混匀后用0.05m,ph为9.5的碳酸缓冲液4℃透析过夜,得到hrp-抗体混合液;
(4)对0.15mph7.4pbs透析过夜;搅拌下逐滴加入等体积饱和硫酸氨,4℃避光搅拌3h;4℃,10000rpm离心15min,弃上清;pbs溶解沉淀,得到经辣根过氧化物酶标记的检测抗体hrp-4g7。
在一个实施方案中,所述检测细菌中ndm-1耐药蛋白的双抗夹心elisa检测试剂盒,还包括如下步骤:
1)包被有单克隆抗体8e3的酶标板的制备:将单克隆抗体8e3用0.05m碳酸盐缓冲液(ph9.6)稀释成浓度为5μg/ml,每孔100μl,4℃包被过夜后洗板;然后每孔加入100μl2%bsa(含0.3%nan3),37℃,湿度30-40%封闭2h,然后37℃,湿度30-40%恒温干燥2h;
2)检测抗体稀释液:0.01mph7.4的pbst溶液;
3)检测抗体工作液的制备:检测抗体4g7-hrp按照1:30000比例稀释后备用;
4)样品稀释液的制备:0.01mph7.4的pbs溶液;
5)底物a液的制备:含0.08%过氧化脲、0.025%peg-2000、3.58%十二水合磷酸氢二钠、0.96%一水合柠檬酸钠水溶液,调ph值至7.4;
6)底物b液的制备:含1.03%一水合柠檬酸钠、0.04%tmb、0.0008%硫代硫酸钠、0.1%光稳定剂292、3%dmf水溶液,调ph值至5.0。
本发明的第二个目的在于提供一种ndm-1蛋白双抗夹心elisa检测方法,该方法操作简便,检测快速,特异性强,灵敏度高。
具体的说,一种细菌中ndm-1蛋白双抗夹心elisa检测法,采用以下步骤:(1)以ph9.6的0.05m碳酸盐缓冲溶液包被捕获抗体8e3(5μg/ml),酶标板中每孔加入100μl,4℃过夜,使其与酶标板紧密结合;(2)次日,弃去孔内溶液,用洗涤液(pbst)洗板3次,每次3min;每孔加入100μl2%bsa(含0.3%nan3)进行封闭,37℃温育2h;封闭结束后向酶标板孔内加入细菌裂解液,并同时设置阴性对照孔(0.01mpb,ph7.4)和阳性对照孔(ndm-1蛋白,2ng/ml),100μl/孔,37℃孵育1h;(3)弃去孔内溶液,洗板3次后,加入检测抗体4g7-hrp,100μl/孔,37℃孵育1h;(4)弃去孔内溶液,洗板3次,最后加入的显色剂tmb溶液(现用现配),每孔100μl,37℃孵育10min。在hrp作用下,显色剂发生颜色变化,加入终止液(2mh2so4)50μl/孔;(5)测定:用酶标仪检测od450nm。
在一个实施方案中,所述试剂盒中还包括终止液、封闭液和洗涤液;
具体的所述终止液为2mol/l硫酸;
所述封闭液为2%bsa(含0.3%nan3);
所述洗涤液为含0.1%tween-20的0.01mph7.4pbst溶液。
所述ndm-1蛋白阳性对照为ndm-1(36-270),浓度为2ng/ml。
本发明的有益效果是:本发明制备了ndm-1单克隆抗体,并建立了细菌中ndm-1蛋白的双抗夹心elisa方法,该方法检测ndm-1(36-270)蛋白lod为0.5ng/ml,与大肠杆菌、不动杆菌、肺炎克雷伯菌、铜绿假单胞菌无交叉,说明具有良好的特异性。
附图说明
图1ndm-1蛋白检测结果
图2双抗夹心elisa法的标准曲线
图3ndm-1与其他菌属的交叉反应。
具体实施方案
为了使本发明的目的和技术方案更加清楚,下面对本发明的优选实施案例进行详细描述。
1.ndm-1耐药蛋白的双抗夹心elisa检测试剂盒的组成
本发明的双抗夹心elisa试剂盒包括包被有单克隆抗体8e3的酶标板、检测抗体4g7-hrp、ndm-1蛋白标准品、包被缓冲液、检测抗体稀释液、检测抗体工作液、样本稀释液、底物a液、底物b液、显色液、终止液、封闭液、洗涤液。
2.ndm-1耐药蛋白的双抗夹心elisa检测试剂盒的制备
1)制备ndm-1蛋白
a、ndm-1基因的合成
从genebank中获取ndm-1基因的氨基酸序列(accession:afi72857.1),依据大肠杆菌的密码子偏好性进行ndm-1基因的碱基序列的密码子优化,并委托南京金斯瑞生物科技有限公司合成了密码子优化后的基因序列。
b、载体的构建
通过截断目的片段(29-270),用gst标签表达,克隆至表达载体pgs-21a,gst-tag+tevcleavagesite+ndm-1(29-270);
c、ndm-1重组蛋白的表达与纯化
构建完成的重组质粒转入感受态细胞转化入大肠杆菌bl21(de3)宿主菌株中,挑取单菌落接种至含有50μg/ml卡那霉素的lb培养基中,37℃,200rpm培养至od600达到0.6~0.8时,加入终浓度为0.5mm的iptg,25℃条件下进行诱导表达。
4℃条件下,3200g离心15min收集菌体;然后使用20mmtris-hcl(含150mmnacl)重悬菌体,3000w,10s/10s,15min超声裂解菌体。采用ni-nta镍柱纯化系统纯化表达的ndm-1重组蛋白,得到ndm-1(36-270)蛋白,用作免疫原制备鼠单克隆抗体。
2)ndm-1单克隆抗体的制备
a、免疫实验动物
取步骤2制备的免疫原溶液,将免疫原用无菌生理盐水稀释至1mg/ml,首次免疫加入等量的弗氏完全佐剂,完全乳化后,采用颈背部皮下、多点注射的方式免疫8只小鼠,免疫剂量为100μg/只。共免疫6次,每次免疫间隔时间均为2周,具体免疫程序见表1。
表1.单克隆抗体(小鼠)的免疫程序
b、抗血清的筛选
四免一周后,对小鼠眼眶采血,室温放置2h,4000rpm离心10min后取血清检测;抗血清筛选先采用间接elisa方阵滴定法确定包被原、抗体的最佳工作浓度,再采用间接竞争elisa方法检测抗体的特异性和灵敏度。
c、杂交瘤细胞株的融合与筛选
按照常规方法进行,取免疫小鼠的脾细胞与处于对数生长期的小鼠骨髓瘤细胞(sp2/0)混合,然后用50%peg进行免疫融合,用hat培养基悬浮均匀,再加入适量的饲养细胞,培养于96孔培养板,于37℃,5%co2培养箱中培养,5天后用hat培养基半换液,9天时候进行全换液。
细胞融合后,待细胞长到培养孔面积的1/4时,吸出杂交瘤细胞上清液,并采用ndm-1(36-270)蛋白包被酶标板及间接elisa方法筛选阳性、效价高的培养孔,得到的阳性孔用中国农业大学提供的ndm-1阳性大肠杆菌、不动杆菌、肺炎克雷伯菌、铜绿假单胞菌裂解液包被的酶标板检测细胞的交叉反应,挑选所有ndm-1阳性菌株均有反应的强阳性孔进行性亚克隆。其中ndm-1阳性菌的鉴定方法参照:nordmann,patriceetal.howtodetectndm-1producers.jclinmicrobiol.2011,49(2):718-21.
将数次亚克隆后的杂交瘤细胞扩大培养,收集上清液用间接elisa测定效价,冻存;并取8-10周龄balb/c小鼠腹腔注射0.3ml/只含1.3x106个细胞的细胞悬液。6天后观察小鼠,当小鼠腹部膨大时,抽取腹水,每隔2天观察小鼠,及时抽取腹水;将抽取的腹水10000r/min离心5min,收集上清,分装保存于-20℃冰箱。
d、腹水中抗体的纯化
将5ml腹水在10000r/min、4℃条件下离心5min,收集上清液,然后加入20ml倍体的0.06mm醋酸钠缓冲液(ph4.0)进行稀释,再使用0.2mnaoh调节ph至4.5左右;加入1000μl正辛酸缓慢加入正辛酸并搅拌30min,4℃静置1h;将上述液体在6000r/min、4℃条件下离心30min,收集上清并过滤;加入2.6ml的pbs缓冲液进行稀释(加入的量应为上述滤液的10%);加入等体积的饱和硫酸铵,并搅拌30min,4℃静置1h;弃上清,加入适量pbs缓冲液重悬后装入透析袋,置于0.02mmpbs缓冲液中与4℃透析24-48h并适时换液,收集透析袋内液体,-20℃保存,得到单克隆抗体。
测序结果,单克隆抗体8e3的重链可变区的氨基酸序列为序列2;单克隆抗体8e3的轻链可变区的氨基酸序列为序列3;单克隆抗体4g7的重链可变区的氨基酸序列为序列4;单克隆抗体4g7的轻链可变区的氨基酸序列为序列5。
e、经辣根过氧化物酶标记的ndm-1检测抗体的制备方法:
(1)称取5mghrp(辣根过氧化物酶,购自sigma)溶于1ml三蒸水中,逐滴缓慢加入0.20ml新配的0.1mnaio4溶液,4℃避光搅拌25min,活化hrp,颜色由棕色变为绿色。上述溶液装入透析袋中,用1m,ph为4.4的醋酸钠缓冲液透析,4℃过夜。10000r/min,4℃,10min,离心去除沉淀。得到透析后的hrp。
(2)将4g7检测抗体用0.2m,ph为9.5的碳酸缓冲液4℃透析过夜。观察是否有沉淀,并分析沉淀性状,10000r/min,4℃,10min,离心去除沉淀,得到透析后的抗体。
(3)将透析后的hrp加入0.16m乙二醇(每mg酶加0.1ml),4℃避光搅拌1h,然后加入透析后的抗体;两者混匀后用0.05m,ph为9.5的碳酸缓冲液4℃透析过夜,得到hrp-抗体混合液;
(4)将上述溶液装入透析袋中,对0.15mph7.4pbs透析过夜。搅拌下逐滴加入等体积饱和硫酸氨,4℃避光搅拌3h。4℃,10000rpm离心15min,弃上清。pbs溶解沉淀,得到经辣根过氧化物酶标记的4g7-hrp检测抗体。
f、包被有8e3单克隆抗体的酶标板的制备
将8e3单克隆抗体用碳酸盐缓冲液稀释成浓度为5μg/ml的抗体包被液,每孔100μl,4℃包被过夜后洗板;然后每孔加入100μl封闭液,37℃、湿度30-40%封闭2h,37℃、湿度30-40%恒温干燥2h。
3.ndm-1双抗夹心elisa检测方法建立
a、双抗体夹心elisa检测法测定步骤
(1)用0.05m,ph9.5碳酸盐缓冲液包被捕获抗体8e3(2ng/ml),在96孔酶标板中每孔加入100μl,4℃包被过夜,使其与酶标板紧密结合;
(2)次日,弃去孔内溶液,洗板3次,每次3min;每孔再加100μl封闭液,37℃温育2h;封闭结束后,弃去孔内溶液,洗板3次,在酶标板孔内加入待测蛋白提取物溶液(以待测样品与pbs缓冲液的体积比为稀释倍数)和ndm-1蛋白(每孔4ng/ml),100μl/孔,37℃孵育1h;
(3)接着加入检测抗体4g7-hrp,100μl/孔,37℃孵育1h;
(4)最后在形成的复合物中加入临时配制的显色剂tmb溶液,每孔100μl,37℃孵育10~30min。在hrp作用下,显色剂发生颜色变化,加入终止液50μl/孔;
(5)测定:用酶标仪检测od450nm。
b、方法的建立
(1)ndm-1蛋白的线性范围
将ndm-1蛋白标准品作系列稀释至0.5~16ng/ml,用上述建立的双抗体夹心elisa方法进行检测,进行3次重复,以ndm-1蛋白标准品质量浓度(ng/ml)为横坐标,a450nm值为纵坐标,用origin8.0(originlabcorp,northampton,ma,usa)软件中的四参数拟合标准曲线,确定线性范围与检测限lod(lod是空白的平均吸收值加3倍的空白吸收值的标准偏差对应的抗原浓度)。
(2)特异性验证
以最佳配对的抗体以及最佳浓度来进行双抗体夹心elisa检测特异性,分别用ndm-1阳性的大肠杆菌,不动杆菌,肺炎克雷伯氏菌,铜绿假单胞菌,以及大肠杆菌atcc25922,大肠杆菌atcc35150,鲍曼不动杆菌atcc19606,肺炎克雷伯氏菌atcc10031,铜绿假单胞菌atcc9027进行特异性检测。
4.结果
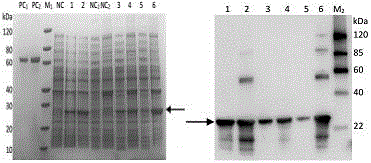
1)重组蛋白诱导表达鉴定
ndm-1蛋白分子表达量为27.1kda,与预期融合蛋白分子量大小一致,可以满足免疫动物和抗体筛选与鉴定的要求,见图1。
2)elisa检测方法建立
(1)标准曲线:通过测试数据拟合曲线表明(图2),本方法对ndm-1,检出限为0.5ng/ml,r2=0.9963,方程为y=2.387+(0.222-2.387)/(1+(x/1.096)^1.723)。
(2)特异性的检测
以最佳配对的抗体以及最佳浓度来进行双抗体夹心elisa检测特异性.其分别与带有ndm-1的大肠杆菌,不动杆菌,肺炎克雷伯菌,铜绿假单胞菌进行特异性检测(图3)。结果表明,与ndm-1阳性的的大肠杆菌,不动杆菌,肺炎克雷伯菌,铜绿假单胞菌进行特异性检测均有交叉反应,与标准菌株大肠杆菌atcc25922,大肠杆菌atcc35150,鲍曼不动杆菌atcc19606,肺炎克雷伯氏菌atcc10031,铜绿假单胞菌atcc9027无交叉反应,说明特异性良好。
序列表
<110>北京明日达科技发展有限责任公司
<120>一种检测ndm-1耐药蛋白双抗夹心elisa试剂盒及检测方法
<141>2020-06-15
<150>202010180297x
<151>2020-03-16
<160>5
<170>siposequencelisting1.0
<210>1
<211>705
<212>dna
<213>人工序列(artificialsequence)
<400>1
ggtcaacagatggaaaccggcgatcaacgctttggcgacctggtcttccgtcaactggct60
ccgaacgtctggcagcatacctcatatctggatatgccgggctttggtgcagtggcttcg120
aacggcctgatcgttcgtgatggcggtcgtgtcctggtggttgacaccgcctggacggat180
gaccagaccgcccaaattctgaactggatcaaacaggaaattaatctgccggtggccctg240
gcggttgtgacccatgcacaccaagataaaatgggcggtatggatgcactgcatgccgca300
ggcattgctacgtatgcaaacgctctgagcaatcagctggccccgcaagaaggtatggtt360
gcagctcagcactctctgacctttgccgcaaatggttgggtggaaccggccaccgccccg420
aattttggtccgctgaaagttttctacccgggcccgggtcacaccagcgataacatcacg480
gtcggcattgatggtaccgacatcgcgttcggcggttgcctgattaaagatagcaaagcg540
aaatctctgggcaatctgggtgatgccgacacggaacattacgcagctagcgcacgtgct600
tttggtgcggccttcccgaaagcgagtatgatcgttatgtcccactctgccccggactct660
cgtgccgctatcacccacaccgctcgtatggctgacaaactgcgt705
<210>2
<211>114
<212>prt
<213>人工序列(artificialsequence)
<400>2
glyalathralaglyvaltrpglyleuthrglylysthrtrpglyphe
151015
sergluvalvalleuglnglyphetrpleuhisleutyrhisleuala
202530
valleuvalglylysthrglualatrpthrglyserglyvalasptrp
354045
glyhisleusertrplystrpargphehisvalargserlysvalgln
505560
argileglyhisileaspglncyscysargvalglnhisserhismet
65707580
serthrglnglnpheglyileleuglyleucysglyleuleuleucys
859095
asntrpaspglyvaltyrleuleuglyhisargaspproglyhisarg
100105110
leuleu
<210>3
<211>114
<212>prt
<213>人工序列(artificialsequence)
<400>3
aspilevalalaglyvaltrpglylysthrglylysthrtrpglyphe
151015
sergluvalvalleuglnglyphetrpleuhisleutyrlysleuleu
202530
valalavalglylysthrglualatrpthrglyserglyvalasptrp
354045
glyhisvalsertrplysvalmetphehisvalargserlysvalgln
505560
glyglncyshisileaspcysargileilevalglnhisserhismet
65707580
serthrglnglnpheglyilemetglyleucysglyleuleuleutyr
859095
asntrpaspglyvaltyrleuleuglyproarghisasphisglyarg
100105110
leuleu
<210>4
<211>115
<212>prt
<213>人工序列(artificialsequence)
<400>4
valilevalalaglytrpglythrthrglylysthrtrpglypheser
151015
gluvalvalleuglnglyphetrpleuleulyshisleulysleuval
202530
alavalglylysthrglualatrpthrglyglyhisvalaspglyser
354045
trpleusertrplysvalglyphehisvalargserlysvalglncys
505560
glnglyhisileaspcysargserilevalglnhisserhismetgln
65707580
glnpheserthrglyleuglyileaspcysglyleutrpleuasnleu
859095
tyraspglyvaltyrleuleuglyproargasphisglyhisargleu
100105110
leuleucys
115
<210>5
<211>112
<212>prt
<213>人工序列(artificialsequence)
<400>5
aspilevalalaglyvaltrpglyglythrglylysthrtrpglyphe
151015
sergluvalvalleuglnglyphetrpleuglyleuhistyrglyleu
202530
valalavalglylysthrglualatrpthrglyvalhisproserasp
354045
trpglyglysertrplystrpcysphelysvalargserlysvalgln
505560
cysglnglyhisileaspcysargglnilevalglnhisserhismet
65707580
glnglnpheglyserthrileglyglyleucysglyleutrpleugly
859095
leutyraspglyvaltyrleuleuglyproargasphishisargleu
100105110
- 还没有人留言评论。精彩留言会获得点赞!