血红素加氧酶-1在诊断和治疗放射性肺损伤的应用的制作方法
本发明属于放射性肺损伤的分子生物学诊断和治疗领域,具体涉及血红素加氧酶-1在诊断和治疗放射性肺损伤的应用。
背景技术:
放射性肺损伤(radiation-inducedlunginjury,rili)是胸部恶性肿瘤放射治疗后非常常见的并发症,是一种以间质性肺炎和肺纤维化为主要特征的致命性疾病。rili临床表现主要有咳嗽、气短、发热、呼吸功能不全、重者发展为呼吸衰竭。目前只能采用激素联合抗生素及维生素、抗氧化剂等药物治疗,虽然能取得了一定的疗效,但其引发的不良反应较多(参见文献:kalmanns,zhaoss,anscherms,urdanetaai.currentstatusoftargetedradioprotectionandradiationinjurymitigationandtreatmentagents:acriticalreviewoftheliterature.intjradiatoncolbiolphys2017;98:662-682)。目前rili的发生机制尚不清楚,且缺乏有效的预测指标和治疗措施,不仅限制了肿瘤的放疗剂量,而且严重影响患者的后续治疗及生活质量,成为提高胸部肿瘤放疗疗效的瓶颈,甚至危及患者生命安全。由于rili发病率高(15.5-36%),且缺乏特效的治疗手段,给社会及家庭带来了沉重的负担。因此,探索早期rili的分子病理机制,发现和鉴定有效药物靶点,对于预防和治疗rili具有重大意义。
最新研究发现:巨噬细胞过度活化、产生和释放大量炎症因子损伤肺组织是rili的关键机制。促进巨噬细胞m1向m2表型转换能够改善rili的发生,而m1型巨噬细胞则促进rili病理进程(参考文献:liy,luh,lvx,tangq,liw,zhuh,etal.blockadeofaquaporin4inhibitsirradiation-inducedpulmonaryinflammationandmodulatesmacrophagepolarizationinmice.inflammation2018;41:2196-20)。因此,寻找抑制巨噬细胞在大剂量射线照射时过度激活是防治rili的新方法。
血红素加氧酶1(hemeoxygenase-1,ho-1)是主要存在于巨噬细胞中,是血红素代谢的限速酶。作为一种应激蛋白,ho-1具有显著的抗炎、抗氧化应激、抗气道平滑肌细胞增殖等重要功能,ho-1不仅在高表达后具有抗炎抗氧化作用,而且其催化产物如胆绿素、胆红素、二价铁和一氧化碳很强的抗炎、抗氧化作用。目前已经发现ho-1对脓血症急性肺损伤、博来霉素诱导的肺纤维化和慢性阻塞性疾病等肺脏多种疾病表现出保护作用,但是ho-1在大剂量x射线诱导的rili中的作用及其机制目前尚未有任何相关的研究和报道。
技术实现要素:
针对目前缺乏准确预测和有效治疗rili的方法,本发明提供一种血红素加氧酶1的应用。巨噬细胞特异性ho-1敲除小鼠rili各种炎症因子表达明显增加,肺组织明显加重。
为了解决上述技术问题,本发明提供了血红素加氧酶-1在诊断和治疗rili药物中的应用依据。
血红素加氧酶-1在制备诊断rili试剂盒中的应用。
血红素加氧酶-1在制备治疗rili药物中的应用。
首先明确ho-1在rili发生过程中的作用。建立rili小鼠模型,提取rili小鼠肺组织中的总蛋白通过免疫印迹检测ho-1的表达水平,实验结果表明x-ray可以显著诱导肺组织中ho-1的表达;此外,通过分离rili小鼠肺巨噬细胞,并检测其ho-1的表达,结果显示,x-ray可以诱导肺巨噬细胞内ho-1表达升高。这些研究结果表明大剂量x射线可以促使巨噬细胞中ho-1大量表达。
利用ho-1特异性抑制剂znpp(10μm)预处理小鼠骨髓来源的巨噬细胞(bmdms)细胞30分钟,然后用x-ray照射,6小时后trizol裂解细胞,荧光定量pcr检测tnf-α、il-1β和il-6的表达情况,结果发现znpp可以显著增加tnf-α、il-1β和il-6的mrna水平。提示ho-1功能抑制将导致巨噬细胞产生大量的促炎因子,使肺组织发生严重的炎症反应。特异性抑制剂znpp促进辐照诱导的巨噬细胞活化。
为了准确的阐明血红素加氧酶-1在诊断和治疗rili的作用,本发明进一步建立了巨噬细胞特异性ho-1敲除(ho-1lyz2-ko)小鼠rili模型。结果显示:巨噬细胞特异性ho-1基因敲除小鼠肺组织中炎性细胞数量明显增多,肺组织明显损伤。同时,在细胞水平层面,我们分离ho-1lyz2-wt和ho-1lyz2-ko小鼠bmdm,经x射线照射,6小时后trizol裂解细胞,荧光定量pcr检测tnf-α、il-1β和il-6的表达情况,结果发现ho-1缺失的巨噬细胞,经辐照后,tnf-α、il-1β和il-6等促炎因子的mrna水平显著增加,提示ho-1功能缺失会使x射线诱导的巨噬细胞释放大量炎症因子。利用巨噬细胞特异性ho-1敲除的小鼠和bmdm,证实了ho-1含量降低必然会促使rili的发生。
进一步说明血红素加氧酶-1在诊断和治疗rili的应用,本发明考察血红素加氧酶-1对炎症因子生成起关键作用的mk2和foxo3a的作用。结果显示:ho-1lyz2-ko小鼠的巨噬细胞foxo3a磷酸化水平明显增高;ho-1特异性抑制剂znpp也可以显著上调x-ray照射小鼠骨髓来源巨噬细胞中mk2的磷酸化;而ho-1诱导剂hemin则能够抑制x-ray诱导的mk2磷酸化。
本发明的有益效果:
本发明发现ho-1的含量不足将导致严重的rili,故大剂量x射线放射治疗患者,如果血液中ho-1降低将出现rili,因此外周血ho-1含量的测定可以作为诊断rili的新生物标志物。同时,鉴于ho-1含量降低或者功能受限将导致严重的放射性肺组织损伤,增强ho-1的表达和功能的药物如ho-1诱导剂hemin可以作为rili治疗的新方法。
附图说明
图1小鼠rili模型的建立图。
图2小鼠经x射线(13.5gy)胸部照射,7天后取材,肺组织及肺巨噬细胞中ho-1表达情况图。
图3x射线(6gy,剂量率为600cgy/min)照射后不同时间(0,1,3,6,12,24h)后bmdm中检测ho-1表达情况图。
图4巨噬细胞特异性ho-1敲除小鼠构建示意图及鉴定图。
图5巨噬细胞特异性ho-1敲除小鼠的rili肺组织病理切片图。
图6巨噬细胞特异性ho-1敲除和未敲除的bmdm在6gy射线照射后炎症因子的表达变化情况图。
图7ho-1特异性抑制剂10μmznpp预处理对x射线刺激的bmdm炎症因子的表达变化情况图。
图8x射线刺激的ho-1lyz2-wt和ho-1lyz2-ko小鼠bmdmfoxo3a活化水平图。
图9ho-1特异性抑制剂znpp对x射线刺激的bmdm中mk2磷酸化的影响图。
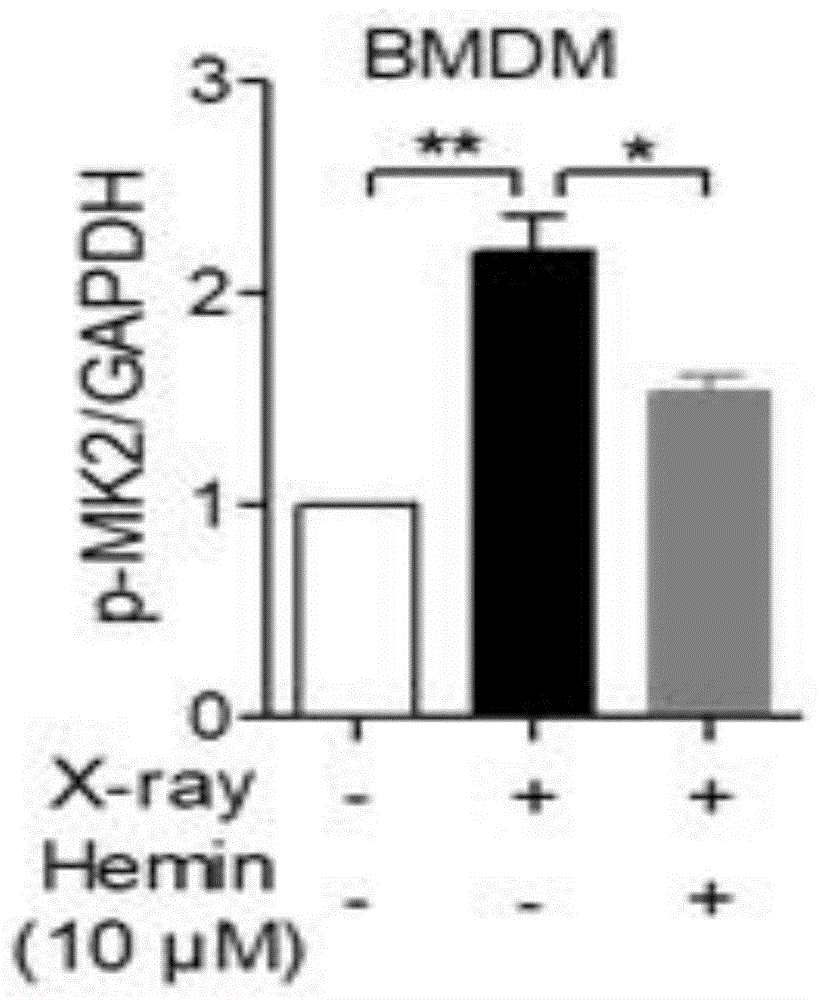
图10ho-1诱导剂hemin对x射线刺激的bmdm中mk2磷酸化的影响图。
具体实施方式
下面的实施例可使本专业技术人员可全面地理解本发明,但不以任何方式限制本发明。
实施例1:小鼠rili模型的建立
为了尽可能与临床胸部肿瘤放疗继发引起的rili相吻合,我们选择对小鼠进行肺部局部照射:小鼠麻醉后,用生物胶带将其固定于x-radsmart小动物放射治疗模拟定位仪内,使其保持俯卧位,双上肢向前,双下肢向后,四肢平衡伸直,在ct定位(图1a)指导下勾画出肺部照射范围,尽量避开心脏和脊柱(图1b)。定位小鼠肺部后,采用x-ray单次照射13.5gy,剂量率为3gy/min,照射结束后,取下小鼠,并将其放回饲养笼中正常饲养,7天后取材,分析小鼠肺损伤情况。
实验结果:
通过对小鼠肺组织切片病理h&e染色分析,我们发现x-ray照射后,小鼠肺组织中肺泡结构破坏、红细胞增多、炎性细胞浸润增加(图1c),表明本研究成功建立了小鼠rili模型。
实施例2:rili小鼠肺组织及肺巨噬细胞中ho-1表达情况测定
为考察ho-1是否参与调控rili,提取将rili小鼠肺组织中的总蛋白,并通过免疫印迹检测ho-1的表达水平。
实验结果:x-ray可以显著诱导肺组织中ho-1的表达(图2a和2c),提示ho-1参与x-ray诱导的rili。此外,本研究通过分离rili小鼠肺巨噬细胞,并检测其ho-1的表达,结果显示,x-ray可以诱导肺巨噬细胞内ho-1表达升高(图2b和2d),说明ho-1可能通过调控巨噬细胞功能参与rili。
实施例3大剂量(6gy,剂量率为600cgy/min)照射诱导的肺巨噬细胞中ho-1不同时间表达情况测定
分离小鼠骨髓来源巨噬细胞(bmdms),并经x-ray辐照不同时间(0,1,3,6,12,24h)后收集细胞,并通过免疫印迹检测ho-1的表达水平。
实验结果:免疫印迹发现x-ray辐照的巨噬细胞中ho-1能够被诱导表达,且在6小时达到表达高峰(图3)
实施例4巨噬细胞ho-1特异性敲除小鼠的构建及鉴定
巨噬细胞ho-1特异性敲除(ho-1lyz2-ko)小鼠通过cre-loxp技术杂交,得到的f1代小鼠出生2周后,剪鼠尾,提取基因组dna进行pcr检测小鼠基因型。肺泡巨噬细胞(ams)的分离和培养:取8-10周龄野生型(ho-1lyz2-wt)和巨噬细胞特异性ho-1敲除(ho-1lyz2-ko)小鼠,经气管向肺注入dpbs冲洗肺泡,收集肺泡灌洗液,裂解红细胞后,培养箱孵育2小时,随后弃去上清,贴壁细胞即为肺泡巨噬细胞。免疫印迹方法检测ho-1在巨噬细胞中的含量。
实验结果:
1f1代小鼠pcr鉴定结果如图2a,上方为ho-1loxp的鉴定,pcr产物大小:野生型为254bp,ki为288bp。下方为cre鉴定,pcr产物大小为272bp。从鉴定结果可以看出,在得到的10只f1代小鼠中,有5只为杂合小鼠(图3a中编号为3、6、7、9、10的小鼠),其中
免疫印迹法检测敲除小鼠ho-1表达也证实ho-1lyz2-ko来源巨噬细胞不表达ho-1(图3d),而肺组织中的ho-1表达无明显变化(图3e),表明我们成功建立巨噬细胞特异性ho-1敲除小鼠。
实施例5ho-1在小鼠rili的作用
采用ho-1lyz2-wt小鼠和ho-1lyz2-ko小鼠,构建rili模型,7天后,肺组织切片病理h&e染色分析小鼠肺损伤情况。
实验结果:
肺组织切片病理h&e染色显示ho-1lyz2-ko小鼠炎性细胞浸润明显增多,肺损伤加剧(图5),表明ho-1可通过调控巨噬细胞介导rili。
实施例6ho-1在x射线诱导的巨噬细胞促炎因子分泌中的作用
分离小鼠骨髓分化巨噬细胞(bmdms)和ho-1lyz2-ko小鼠巨噬细胞。在野生型骨髓分化巨噬细胞模型上,选用ho-1特异性抑制剂znpp(10μm)预处理bmdm细胞30分钟,然后用6gyx-ray照射,6小时后trizol裂解细胞,荧光定量pcr检测ho-1特异性抑制剂znpp和巨噬细胞特异性敲除ho-1对tnf-α、il-1β和il-6mrna变化情况。
实验结果:
荧光定量pcr发现x射线照射后6h巨噬细胞中tnf-α、il-1β和il-6的mrna水平升高,说明辐照能够诱导巨噬细胞活化(图6)。同时相较于ho-1lyz2-wt小鼠巨噬细胞,ho-1lyz2-ko小鼠巨噬细胞经x射线照射后,tnf-α、il-1β和il-6的表达显著增加(图7),说明ho-1功能被抑制或者基因缺失可引起辐照诱导的巨噬细胞活化,释放大量炎症因子。
实施例7ho-1抑制巨噬细胞foxo3a活化水平
巨噬细胞炎症介质的释放是rili发生的重要环节,抑制放射线诱导的tnf-α和il-6等m1型细胞因子的产生,能够缓解早期rili。foxo3a主要表达于巨噬细胞等髓系细胞中,主要受磷酸化等翻译后调控。foxo3a在胞浆中可以与nf-κb结合,当其被磷酸化后则促进nf-κb向细胞核转运,从而增强nf-κb的转录活性,增加tnf-α和il-6等促炎因子的表达。本研究分离ho-1lyz2-wt和ho-1lyz2-ko小鼠bmdm,并经x射线(6gy)辐照,6小时后用含有蛋白酶抑制剂的ripa裂解液裂解细胞,免疫印迹检测foxo3a和nf-κb磷酸化水平。
实验结果:
x射线能够诱导foxo3a磷酸化,且ho-1lyz2-ko小鼠巨噬细胞foxo3a磷酸化水平明显增高(图8),这一结果提示foxo3a参与x射线诱导的巨噬细胞活化,且ho-1是调控foxo3a磷酸化的重要信号分子。
实施例8ho-1调控巨噬细胞mapk活化的蛋白激酶2(mk2)活化水平
mk2能够调控巨噬细胞内tnf-α和il-6等炎症介质的释放。因此,mk2rili的病理过程发挥重要作用。我们分别选用ho-1特异性抑制剂znpp(10μm)和ho-1诱导剂heme(10μm)预处理bmdm细胞30分钟,然后用x-ray照射,6小时后用含有蛋白酶抑制剂的ripa裂解液裂解细胞,免疫印迹检测mk2t334位点的磷酸化水平。
实验结果:
x-ray能够诱导mk2磷酸化,提示mk2参与x-ray诱导的巨噬细胞活化。此外,我们发现ho-1特异性抑制剂znpp可以显著上调mk2的磷酸化(图9),而ho-1诱导剂hemin则能够抑制x-ray诱导的mk2磷酸化(图10),该结果提示mk2参与x-ray诱导的巨噬细胞活化,且ho-1是调控mk2磷酸化的重要信号分子。
以上的实验结果充分证明,ho-1功能被抑制或者表达不足将导致严重的rili,故对于临床上大剂量x射线放射治疗患者,检测血液中ho-1含量可以预测rili。同时,寻找能够有效增加ho-1的表达和功能的药物可以用于rili的治疗。因此,我们认为ho-1可以作为临床上诊断和治疗rili的一个新的重要靶标,在rili的防治中具有重大的临床应用价值。
上述实例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人是能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!