一种检测血清中核苷类抗病毒药物的试剂盒及其应用的制作方法
本发明属于药物分析
技术领域:
,具体涉及一种检测血清中核苷类抗病毒药物的试剂盒及其应用。
背景技术:
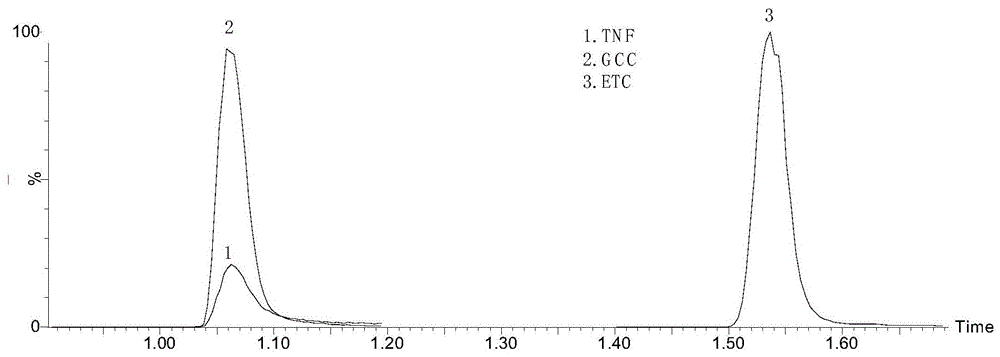
:核苷酸类抗病毒药物,是临床上用于治疗艾滋病、肝炎等病毒性疾病的首选药物,其作用靶点为抑制dna病毒的dna聚合酶或者rna病毒的逆转录酶的作用。替诺福韦(tenofovir,tnf)是一种新型核苷类逆转录酶抑制剂,是治疗hiv和乙肝病毒感染的一线抗病毒药物,其在安全性、有效性、耐受性方面具有很大的优势,但是其生物利用度很差,需要对其浓度进行实时的监测。更昔洛韦(ganciclovir,gcc)也是一种核苷酸类似物,口服更昔洛韦可用于治疗肝炎病毒、人巨细胞病毒(cmv),单纯疱疹病毒(hsv)等感染。恩替卡韦(entecavir,etc)是高效的核苷类似物,具有较低的耐药突变率和副作用,由于其对病毒复制具有强大的抑制作用和对耐药性的巨大遗传障碍,恩替卡韦现已成为慢性乙型肝炎(chb)患者治疗指南中的第一线选择,并已成为不可或缺的一部分。但是由于抗病毒治疗效果与药物剂型、吸收、年龄、性别、体重指数、血脂水平等有关,导致治疗的复杂化。因此对其浓度进行监测的研究对优化治疗具有重要的临床价值。随着抗病毒药物引起的耐药和毒副作用等药物性疾病的不断增加,在使用药物时需要对病人的需要浓度进行监测,从而保证疗效、降低毒副作用、实现个性化给药和治疗。目前针对抗病毒药物体内浓度检测的方法主要有高效液相色谱法、超高效液相-串联质谱法,如专利cn109900819a公开了一种uplc/ms-ms联用检测人血清中替诺福韦的方法、专利cn109239215a公开了同位素稀释超高效液相色谱质谱联用测定血清或血浆中恩替卡韦的方法,但这些方法样本量需要大,只针对一种药物进行检测,存在单个样品分析时间长、线性范围不适宜等不足。技术实现要素:针对上述现有技术的不足,本发明提供了一种检测血清中核苷类抗病毒药物的试剂盒,通过采用lc-ms/ms法,可以一次性对3种常用的抗病毒药物进行检测,灵敏度高、准确性好,可很好应用于临床,可为抗病毒药联合用药研究提供可靠依据。为了实现上述发明目的,本发明采用以下技术方案:一种检测血清中核苷类抗病毒药物的试剂盒,所述核苷类抗病毒药物包括更昔洛韦、替诺福韦和恩替卡韦;所述试剂盒包括:脱液、校准品溶液、混合内标溶液、蛋白质沉淀剂和质控品;所述洗脱液包括洗脱液a和洗脱液b;洗脱液a为0.01%-0.2%甲酸水溶液,洗脱液b为0.01%-0.2%甲酸甲醇溶液;所述校准品溶液包括系列浓度已知的由空白血清配制的更昔洛韦、替诺福韦和恩替卡韦的混合溶液;所述混合内标溶液为浓度已知的由甲醇水溶液配制的更昔洛韦-d5、替诺福韦-d6和恩替卡韦-d3的混合溶液;所述质控品包括浓度已知的由空白血清配制的更昔洛韦、替诺福韦和恩替卡韦的混合溶液;所述蛋白质沉淀剂为甲醇和乙腈的混合液。进一步地,所述洗脱液a为0.1%甲酸水溶液,洗脱液b为0.1%甲酸甲醇溶液。进一步地,所述校准品溶液包括七种系列浓度的混合溶液。进一步地,所述混合内标溶液中更昔洛韦-d5、替诺福韦-d6和恩替卡韦-d3的浓度分别为更昔洛韦-d55000ng/ml、替诺福韦-d610000ng/ml和恩替卡韦-d350ng/ml。进一步地,所述蛋白质沉淀剂中甲醇与乙腈的体积比1~5:1。进一步地,所述蛋白质沉淀剂中甲醇与乙腈的体积比2:1。进一步地,所述质控品包括三种浓度的混合溶液。上述试剂盒在利用超高效液相色谱串联质谱技术检测血清中核苷类抗病毒药物中的应用。有益效果:采用本发明的试剂盒检测血清中核苷类抗病毒药物时,前处理过程简单,成本低,且灵敏度高、特异性强,3.5min之内完成核苷类抗病毒药物的分离和检测,准确度与精密度基本满足要求,可用于临床上核苷类抗病毒药物的定量分析,为临床上核苷类抗病毒药物的治疗浓度监测提供一种可靠的检测方法。附图说明图1为实施例1核苷类抗病毒药物标准品的提取离子流谱图。图2为实施例1血清中核苷类抗病毒药物的提取离子流谱图。具体实施方式本发明提供了一种利用超高效液相色谱串联质谱技术检测血清中核苷类抗病毒药物的试剂盒,所述核苷类抗病毒药物分别为:更昔洛韦(ganciclovir,gcc)、替诺福韦(tenofovir,tnf)、恩替卡韦(entecavir,etc)。上述核苷类抗病毒药物对应的同位素内标物分别为:更昔洛韦-d5(gcc-d5)、替诺福韦-d6(tnf-d6)、恩替卡韦-d3(etc-d3)。在采用内标法时,内标物的选择是一项十分重要的工作。理想的内标物应当能以准确、已知的量加到样品中去,和被分析的样品有基本相同或尽可能一致的物理化学性质、色谱行为和响应特征;在色谱分析条件下,内标物必须能与样品中各组分充分分离。本发明分别采用更昔洛韦-d5(gcc-d5)、替诺福韦-d6(tnf-d6)、恩替卡韦-d3(etc-d3)作为内标,氘代内标和待测物具有相同的保留时间、化学性质和基质效应,测定血清中核苷类抗病毒药物时的重现性、准确度均较好。所述的试剂盒包含如下试剂:(1)洗脱液:洗脱液a:0.01%-0.2%甲酸水溶液;洗脱液b:0.01%-0.2%甲酸甲醇溶液;(2)校准品溶液:分别将核苷类抗病毒药物母液,浓度分别为gcc20mg/ml、tnf10mg/ml和etc0.1mg/ml,配制成含gcc200000ng/ml、tnf40000ng/ml和etc200ng/ml混合标准品溶液;将上述混合标准品溶液以空白血清基质溶液配制成七个不同浓度点的校准品溶液,所述校准品溶液的七个浓度点为:gcc:50ng/ml、100ng/ml、250ng/ml、500ng/ml、2500ng/ml、5000ng/ml、10000ng/ml,tnf:10ng/ml、20ng/ml、50ng/ml、100ng/ml、500ng/ml、1000ng/ml、2000ng/ml,etc:0.05ng/ml、0.1ng/ml、0.25ng/ml、0.5ng/ml、2.5ng/ml、5ng/ml、10ng/ml;(3)混合内标溶液:包含有gcc-d55000ng/ml、tnf-d610000ng/ml和etc-d350ng/ml的甲醇水溶液;(4)蛋白质沉淀剂:甲醇与乙腈混合溶液;(5)质控品:含有核苷类抗病毒药物的无干扰血清基质溶液,分为低、中、高三个浓度,分别为qc(l)、qc(m)、qc(h),其中,qc(l)为qc(m)用无干扰血清基质溶液稀释至10倍,qc(m)为上述混合标准溶液用无干扰血清基质溶液稀释至200倍,qc(h)为上述混合标准溶液用无干扰血清基质溶液稀释至50倍。在一种优选方案中,上述洗脱液a为0.1%甲酸水溶液;洗脱液b为0.1%甲酸甲醇溶液。在一种方案中,蛋白质沉淀剂中甲醇与乙腈的体积比1~5:1;优选地,蛋白质沉淀剂中甲醇与乙腈的体积比2:1。本发明提及的混合标准品溶液按照如下方法制备:分别将核苷类抗病毒药物母液gcc20mg/ml、tnf10mg/ml和etc0.1mg/ml,用甲醇水溶液配制成含gcc200000ng/ml、tnf40000ng/ml和etc200ng/ml混合标准品溶液。本发明提及的混合内标溶液按照如下方法制备:将gcc-d51mg/ml、tnf-d60.5mg/ml和etc-d30.05mg/ml母液用甲醇水溶液配制成包含gcc-d55000ng/ml、tnf-d610000ng/ml和etc-d350ng/ml的混合内标溶液。在制备混合标准品溶液和混合内标溶液时,采用的甲醇水溶液为50%~95%甲醇水溶液;优选为70%~90%甲醇水溶液;更优选为80%甲醇水溶液。在制备校准品溶液和质控品时,无干扰血清基质为无核苷类抗病毒药物的空白血清。本发明提及的甲醇水溶液浓度一般指体积浓度。本发明提及的血清为人或动物的血清。在一种优选方案中,超高效液相色谱串联质谱技术检测血清中核苷类抗病毒药物的试剂盒包含如下试剂:(1)洗脱液:洗脱液a:0.01%~0.2%甲酸水溶液;洗脱液b:0.01%~0.2%甲酸甲醇溶液;(2)校准品溶液:分别将核苷类抗病毒药物母液,浓度分别为gcc20mg/ml、tnf10mg/ml和etc0.1mg/ml,配制成含gcc200000ng/ml、tnf40000ng/ml和etc200ng/ml混合标准品溶液,将所述混合标准品溶液以无核苷类抗病毒药物的空白血清配制成七个不同浓度点的校准品溶液;(3)混合内标溶液:将gcc-d51mg/ml、tnf-d60.5mg/ml和etc-d30.05mg/ml母液用甲醇水溶液配制成包含gcc-d55000ng/ml、tnf-d610000ng/ml、etc-d350ng/ml的混合内标溶液;(4)蛋白质沉淀剂:甲醇与乙腈的体积比1~5:1(5)质控品:取上述混合标准品溶液以无核苷类抗病毒药物的空白血清配制成三个不同浓度qc(l)、qc(m)、qc(h)。在一种更优选方案中,超高效液相色谱串联质谱技术检测血清中核苷类抗病毒药物的试剂盒包含如下试剂:(1)洗脱液:洗脱液a:0.1%甲酸水溶液;洗脱液b:0.1%甲酸甲醇溶液;(2)校准品溶液:分别将核苷类抗病毒药物母液,浓度分别为gcc20mg/ml、tnf10mg/ml和etc0.1mg/ml,用80%甲醇水溶液配制成含gcc200000ng/ml、tnf40000ng/ml和etc200ng/ml混合标准品溶液,将所述混合标准品溶液以无核苷类抗病毒药物的空白血清配制成七个不同浓度点的校准品溶液;(3)混合内标溶液:将gcc-d51mg/ml、tnf-d60.5mg/ml和etc-d30.05mg/ml母液用80%甲醇水溶液配制成包含gcc-d55000ng/ml、tnf-d610000ng/ml和etc-d350ng/ml的混合内标溶液;(4)蛋白质沉淀剂:甲醇与乙腈的体积比2:1;(5)质控品:取上述混合标准品溶液以无核苷类抗病毒药物的空白血清配制成三个不同浓度qc(l)、qc(m)、qc(h),其中,qc(l),qc(m),qc(h)中核苷类抗病毒药物质控品对应浓度见表1。表1核苷类抗病毒药物质控品对应浓度(单位:ng/ml)编号组分qc(l)qc(m)qc(h)1gcc100100040002tnf202008003etc0.114qc(l)中包含:gcc100ng/ml、tnf20ng/ml、etc0.1ng/ml;qc(m)中包含:gcc1000ng/ml、tnf200ng/ml、etc1ng/ml;qc(h)中包含:gcc4000ng/ml、tnf800ng/ml、etc4ng/ml。在一种更优选方案中,混合内标溶液按照如下方法制备:分别准确移取一定体积的核苷类抗病毒药物同位素内标母液,加入80%甲醇水溶液959μl,混匀得到1ml混合内标溶液,浓度见表2。表2混合内标溶液配制在一种更优选方案中,校准品溶液按照如下方法制备:分别准确移取一定体积的核苷类抗病毒药物标准母液,加入80%甲醇水溶液984μl,充分混匀得到1ml混合标准溶液,浓度见表3。表3混合标准溶液编号组分母液浓度(μg/ml)移取体积(μl)总体积(μl)混合标准溶液浓度(ng/ml)1gcc201010002000002tnf1041000400003etc0.121000200采用梯度稀释法进行标曲配制,从-20℃冰箱取出标准溶液后,涡旋10s,2min内使用标准溶液配制标曲最高浓度点,配制好后-80℃保存。具体过程如表4(单位:ng/ml):表4标曲配制标曲移取溶液(μl)空白血清(μl)gcc(ng/ml)tnf(ng/ml)etc(ng/ml)s7标准溶液1019010000200010s6s75050500010005s5s74012025005002.5s4s6201805001000.5s3s520180250500.25s2s450200100200.1s1s35020050100.05上述试剂盒在利用超高效液相色谱串联质谱技术检测血清中核苷类抗病毒药物的应用也在本发明的保护范围之内。具体检测方法如下:采用超高效液相色谱串联质谱技术检测经过预处理的血清中的上述核苷类抗病毒药物,先利用超高效液相色谱将目标待测物与血清基质中的干扰组分进行分离,再利用质谱同位素内标定量法,以标准品与内标物的浓度比为x轴,标准品与内标物的峰面积比为y轴,建立校准曲线,计算血清中核苷类抗病毒药物的含量。所述核苷类抗病毒药物分别为:更昔洛韦(ganciclovir,gcc)、替诺福韦(tenofovir,tnf)、恩替卡韦(entecavir,etc);上述核苷类抗病毒药物对应的同位素内标物分别为:更昔洛韦-d5(gcc-d5)、替诺福韦-d6(tnf-d6)、恩替卡韦-d3(etc-d3)。具体色谱条件为:(1)超高效液相色谱条件:流动相a:0.01%~0.2%甲酸水溶液;流动相b:0.01%~0.2%甲酸甲醇溶液;色谱柱型号:acquityuplcbehc18(2.1×50mm,1.7μm);采用流动相a和流动相b为混合流动相进行梯度洗脱的方式,流动相a和流动相b的初始比例为95:5,在0-1.0分钟内,流动相a和流动相b的体积比由95:5匀速渐变至70:30;在1.0-2.1分钟内,流动相a和流动相b的体积比由70:30匀速渐变至10:90;在2.1-3.5分钟内,流动相a和流动相b的体积比由10:90变至95:5,流速为0.1~0.4ml/min,每个样品采集时间为3.5min,柱温为35~50℃,进样体积为1~5μl;(2)质谱条件:在电喷雾电离(esi)模式下,采用多反应监测(mrm)进行正离子扫描;喷雾电压为3.0kv(esi+);去溶剂温度为120℃;雾化气温度为400℃,雾化气流速为800l/h,锥孔气流速为150l/h;同时监测了各目标物及其对应同位素内标。为了改善色谱分离选择性,可以考虑调节流动相的极性。本发明在流动相a中添加了甲酸,可有效提高某些目标化合物的离子化效率,在其他条件的配合下,较现有技术中采用lc-ms/ms方法检测血清中核苷类抗病毒药物的灵敏度更高,前处理过程简单,成本低,且灵敏度高、特异性强,5min之内完成核苷类抗病毒药物的分离和检测。在不影响本发明效果的情况下,在一种优选方案中,流动相a为0.01%~0.2%甲酸水溶液,流动相b为0.01%~0.2%甲酸甲醇水溶液。在一种更优选方案中,流动相a为0.1%甲酸水溶液,流动相b为0.1%甲酸甲醇溶液。在色谱法中,色谱柱的选择十分重要,对色谱柱的要求:柱效高、选择性好,分析速度快等。本发明采用0.01%~0.2%甲酸水溶液和乙腈作为流动相,色谱柱型号:acquityuplcbehc18(2.1×50mm,1.7μm),在其他条件的配合下,内源性物质不干扰样品的测定,灵敏度高、特异性强、成本低且前处理过程简单,3.5min之内可完成分离和检测,精密度及准确度均满足要求。在一种方案中,流速为0.1~0.4ml/min,优选为0.3ml/min。进一步地,柱温为35~50℃,优选为45℃。更进一步地,进样体积为1~5μl,优选为1μl。在一种优选方案中,采用超高效液相色谱串联质谱技术检测血清中核苷类抗病毒药物时,具体色谱条件为:(1)高效液相色谱条件:流动相a:0.1%甲酸-水溶液;流动相b:0.1%甲酸-甲醇溶液;色谱柱型号:acquityuplcbehc18(2.1×50mm,1.7μm);采用梯度洗脱的方式,见表5;流速为0.3ml/min,柱温为45℃,进样体积为1μl;表5流动相梯度洗脱参数时间流速(ml/min)%a%bcurve00.3955-10.3703062.10.3109063.50.39551(2)质谱条件:在电喷雾电离(esi)模式下,采用多反应监测(mrm)进行正离子模式扫描;喷雾电压为3.0kv(esi+);去溶剂温度为120℃;雾化气温度为400℃,雾化气流速为800l/h,锥孔气流速为150l/h;同时监测了核苷类抗病毒药物及其对应同位素内标,各目标待测物的质谱采集参数见表6。表6核苷类抗病毒药物质谱参数化合物母离子子离子去簇电压(v)碰撞电压(v)gcc256.21522210gcc-d5261.1152.1612tnf288.11764018tnf-d6294.2182.14024etc278.1151.92616etc-d3281.1155.12815本发明提及的血清为人或动物血清。在一种方案中,经过预处理的血清按照如下方法制备:向血清中加入含内标的蛋白沉淀剂,再涡旋离心后取上清液;其中,含内标的蛋白沉淀剂是由混合内标溶液与蛋白沉淀剂混合配制而成,蛋白质沉淀剂为甲醇与乙腈混合溶液。优选地,蛋白质沉淀剂中甲醇与乙腈的体积比1~5:1,在不影响本发明效果的情况下,例如,蛋白质沉淀剂中甲醇与乙腈的体积比2:1。在一种优选方案中,经过预处理的血清按照如下方法制备:取50μl血清于1.5ml离心管中,向其中加入200μl含内标的蛋白沉淀剂(甲醇与乙腈的体积比1~5:1),在12000~15000r/min,1~5℃离心4~10min后,取60μl上清液。其中含内标的蛋白沉淀剂是由混合内标溶液与蛋白沉淀剂混合配制而成,混合内标溶液与蛋白沉淀剂比例为0.1~0.3:19.7~19.9。在一种更优选方案中,经过预处理的血清按照如下方法制备:取50μl血清于1.5ml离心管中,向其中加入200μl含内标的蛋白沉淀剂(甲醇与乙腈的体积比2:1),高速振荡(最大振速)5min;在14000r/min,4℃离心5min;转移ep管中的上清液60μl至塑料内衬管中,进样量1μl。其中含内标的蛋白沉淀剂是由混合内标溶液与蛋白沉淀剂混合配制而成,混合内标溶液与蛋白沉淀剂比例为0.2:19.8,下同。在一种方案中,混合内标溶液按照如下方法制备:将gcc-d51mg/ml、tnf-d60.5mg/ml和etc-d30.05mg/ml母液用80%甲醇水溶液配制成包含gcc-d55000ng/ml、tnf-d610000ng/ml和etc-d350ng/ml的混合内标溶液。在一种方案中,标准品溶液按照如下方法制备:分别将核苷类抗病毒药物母液,浓度分别为:gcc20mg/ml、tnf10mg/ml和etc0.1mg/ml,用80%甲醇水溶液配制成含gcc200000ng/ml、tnf40000ng/ml和etc200ng/ml混合标准品溶液。将上述混合标准品溶液以空白血清基质溶液配制成七个不同浓度点的校准品溶液,所述校准品溶液的七个浓度点为:gcc:50ng/ml、100ng/ml、250ng/ml、500ng/ml、2500ng/ml、5000ng/ml、10000ng/ml;tnf:10ng/ml、20ng/ml、50ng/ml、100ng/ml、500ng/ml、1000ng/ml、2000ng/ml;etc:0.05ng/ml、0.1ng/ml、0.25ng/ml、0.5ng/ml、2.5ng/ml、5ng/ml、10ng/ml。每个浓度点样品取50μl于1.5ml离心管中,向其中加入200μl含内标的蛋白沉淀剂(甲醇与乙腈的体积比2:1),高速振荡(最大振速)5min;在14000r/min,4℃离心5min;转移ep管中的上清液60μl至塑料内衬管中,进样量1μl。在一种方案中,质控品按照如下方法制备:取上述混合标准溶液以无核苷类抗病毒药物的空白血清配制成三个不同浓度qc(l)、qc(m)、qc(h):qc(l)中包含:gcc100ng/ml、tnf20ng/ml、etc0.1ng/ml;qc(m)中包含:gcc1000ng/ml、tnf200ng/ml、etc1ng/ml;qc(h)中包含:gcc4000ng/ml、tnf800ng/ml、etc4ng/ml。根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。实施例1一、实验材料与仪器试剂盒研究实验的样本来自于南京鼓楼医院2019年8月份门诊收集的血清样本。1.仪器:xevotq-s三重四级杆质谱仪(waterscorporation);uplci-class超高效液相色谱系统(配自动进样器,waterscorporation);scilogexd2012高速台式离心机(美国);超纯水仪(elgalabwater,英国);多管涡旋混合仪(vortexgenie2,美国);可调移液器(eppendorf0.5~10μl,10~100μl,100~1000μl);玻璃仪器、量筒等。2.试剂耗材:ms级甲醇(fisher,美国);ms级乙腈(fisher,美国);hplc级乙腈(honeywell,美国);ms级甲酸(fisher,美国);hplc级甲醇(honeywell,美国);色谱柱acquityuplcbehc18(2.1×50mm,1.7μm)。3.标准品:标准品及其对应的内标物,见下表7。表7标准品和内标序号中文名称厂家1替诺福韦trc2替诺福韦-d6trc3更昔洛韦trc4更昔洛韦-d5trc5恩替卡韦trc6恩替卡韦-d3trc4.质控品:含有核苷类抗病毒药物的无干扰血清基质溶液,分为低、中、高三个浓度,分别为qc(l)、qc(m)、qc(h),如表1所示。试剂盒上下四周加膜,防震保温,左上方放置流动相a和b,左下方分别放置11个安瓿瓶,分别为标准液、质控品和混合内标溶液和质控品;右边放置25ml蛋白沉淀剂。二、液质条件1.色谱条件:流动相a:0.1%甲酸-水溶液;流动相b:0.1%甲酸-甲醇溶液。色谱柱型号:acquityuplcbehc18(2.1×50mm,1.7μm),采用梯度洗脱的方式,详见表5。流速为0.3ml/min,柱温为45℃,进样体积为1μl。2.质谱条件:在电喷雾电离检测模式下,采用多反应监测的质谱扫描模式;喷雾电压为3.0kv(esi+);去溶剂温度为120℃;雾化气温度为400℃,雾化气流速为800l/h,锥孔气流速为150l/h;同时监测各目标物以及同位素内标。各目标待测物的质谱采集参数见表6。三、实验过程1.标准品配制:分别将核苷类抗病毒药物母液,浓度分别为:gcc20mg/ml、tnf10mg/ml和etc0.1mg/ml,用80%甲醇水溶液配制成含gcc200000ng/ml、tnf40000ng/ml和etc200ng/ml混合标准溶液(详见表3)。将上述混合标准溶液以空白血清基质溶液配制成七个不同浓度点的校准品溶液,各标曲点的浓度如表4中所列,所述校准品溶液的七个浓度点为:gcc:50ng/ml、100ng/ml、250ng/ml、500ng/ml、2500ng/ml、5000ng/ml、10000ng/mltnf:10ng/ml、20ng/ml、50ng/ml、100ng/ml、500ng/ml、1000ng/ml、2000ng/mletc:0.05ng/ml、0.1ng/ml、0.25ng/ml、0.5ng/ml、2.5ng/ml、5ng/ml、10ng/ml2.混合内标溶液配制将gcc-d51mg/ml、tnf-d60.5mg/ml和etc-d30.05mg/ml母液用80%甲醇水溶液配制成包含gcc-d55000ng/ml、tnf-d610000ng/ml和etc-d350ng/ml的混合内标溶液,(详见表2)。3.质控品配制:取上述混合标准溶液以无核苷类抗病毒药物的空白血清配制成三个不同浓度qc(l)、qc(m)、qc(h),详见表1。qc(l)中包含:gcc100ng/ml、tnf20ng/ml、etc0.1ng/mlqc(m)中包含:gcc1000ng/ml、tnf200ng/ml、etc1ng/mlqc(h)中包含:gcc4000ng/ml、tnf800ng/ml、etc4ng/ml4.样品处理(1)标准品前处理:每个浓度点样品取50μl于1.5ml离心管中,向其中加入200μl含内标的蛋白沉淀剂(甲醇与乙腈的体积比2:1),高速振荡(最大振速)5min;在14000r/min,4℃离心5min;转移ep管中的上清液60μl至塑料内衬管中,进样量1μl。(2)血清样品前处理:取50μl血清于1.5ml离心管中,向其中加入200μl含内标的蛋白沉淀剂(甲醇与乙腈的体积比2:1),高速振荡(最大振速)5min;在14000r/min,4℃离心5min;转移ep管中的上清液60μl至塑料内衬管中,进样量1μl。(3)质控品前处理:分别取质控品溶液qc(l)、qc(m)、qc(h)各50μl于1.5ml离心管中,然后与血清样品前处理一致,此处不再赘述。分析试剂盒中各组分见表8。表8核苷类抗病毒药物分析试剂盒组分的制备(100人份)备注:所述含内标的蛋白沉淀剂按照如下方法制备,取200μl上述混合内标溶液加入至19.8ml蛋白沉淀剂中,即得含内标的蛋白沉淀剂。四、方法验证1.提取离子流色谱图:核苷类抗病毒药物的标准品和血清样品的峰形比较对称,且没有杂峰干扰,说明在此条件下能够得到良好的检测,图1为核苷类抗病毒药物标准品的提取离子流谱图;图2为血清样本中核苷类抗病毒药物的提取离子流色谱图。2.校准曲线:采用同位素内标定量法,利用targetlynx软件以标准物与内标物的浓度比为x轴,标准物与内标物峰面积比为y轴,建立校准曲线,并计算出血清中待测物的浓度。核苷类抗病毒药物在各自浓度范围内的线性拟合方程,线性良好,相关系数在0.99以上,满足定量要求,见表9。表9核苷类抗病毒药物线性回归方程及线性相关系数序号化合物保留时间(min)线性范围(ng/ml)线性方程相关系数(r)1gcc1.0850-10000y=0.00247089*x-0.01290570.99812tnf1.0710-2000y=0.000936988*x+0.00150830.99933etc1.560.05-10y=0.522084*x+0.008816420.99763.准确度考察:采用加标回收率试验评估方法的准确性。准备一混合空白血清样品,分别加入低、中、高3个浓度的标准品,以相同步骤重复处理并测定5次,结果显示,核苷类抗病毒药物的加标回收率在88.45%-107.1%之间,5次重复试验的rsd在2.07%-8.88%范围,统计结果见表10。表10核苷类抗病毒药物加标回收率结果(单位:ng/ml)4.精密度试验:取无干扰空白血清样本,加入不同浓度核苷类抗病毒药物标准品,得到低、中、高三个浓度血清样本,一天内重复处理6批,连续处理三天,以同位素内标法定量测定核苷类抗病毒药物的浓度,批内精密度为1.47~11.02%,三日内分3批处理,计算批间精密度为2.96~9.24%,结果见表11。表11批内批间精密度测试结果(单位:ng/ml)采用本发明的试剂盒检测人体血清中核苷类抗病毒药物,血清用量少(仅需50μl)且前处理简单,且一针分析多种物质只需3.5min,简单快速。采用同位素内标法定量不仅可以极大消除基质干扰,而且结果不受前处理过程、仪器响应波动等条件的影响,能够达到准确定量。以加标回收率试验评估方法的准确性,结果显示,核苷类抗病毒药物的加标回收率为88.45%-107.1%之间,5次重复试验的rsd为2.07%-8.88%,准确度良好。方法的重现性结果表明,核苷类抗病毒药物批内精密度为1.47~11.02%,批间精密度为2.96~9.24%,方法的重现性良好。总之,本发明的试剂盒灵敏度高、特异性强、准确且前处理过程简单,3.5min之内完成化合物的分离和检测,准确度及精密度满足要求,可用于临床上血清核苷类抗病毒药物的定量分析,为相关的药物浓度监测提供一种可靠的检测方法。以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可能对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1