一种末梢微量血维生素D质谱检测方法与流程
本发明涉及末梢微量血维生素d检测技术领域,特别是涉及一种末梢微量血维生素d质谱检测方法。
背景技术:
维生素d是一种脂溶性维生素,具有类固醇激素的功能。维生素d(vitd)缺乏是儿童健康面临的重大公共卫生问题。
研究表明:6-12月龄婴儿vitd缺乏不足率高达35%-40%。维生素d缺乏诊断标准是依据血清中的25-羟基维生素d浓度。目前国际公认液相色谱-串联质谱法是检测25-羟基维生素d最可靠的方法,具有很高的灵敏度、特异性和准确性,并且可同时测定血清25-羟基维生素d2和25-羟基维生素d3浓度。
临床上测定血清vitd通常需采集静脉血(常量血),由于低龄儿童尤其是新生儿及婴幼儿的血管比较细,常规采取静脉血的过程中会哭闹等,依从性差,且家长顾虑孩子年龄小,不愿意一次抽取2ml的静脉血,常规采集静脉血比较困难。因此,采取微量血进行检测,可以缓解儿童采血过程的痛苦,提高患者和家长的依从性。
但由于微量血采集受采血部位深浅、组织液干扰等因素影响,与常量血检测结果有差异,目前尚无法用微量血方法来检测25-羟基维生素d。
前面的叙述在于提供一般的背景信息,并不一定构成现有技术。
技术实现要素:
本发明的目的在于提供一种末梢微量血维生素d质谱检测方法,该方法在传统用hplc-ms/ms测定静脉常量血清中25-羟基维生素d的基础上,建立了hplc-ms/ms法测定手指微量血中25-羟基维生素d的新方法;简便、快速、灵敏度高、干扰少、准确度和重现性好;为临床上用微量血取代常量血进行vitd检测提供可靠依据。
本发明提供一种末梢微量血维生素d质谱检测方法,所述末梢微量血维生素d质谱检测方法包括以下步骤:
(1)血清标本收集:
静脉血样本通过静脉穿刺进入含有凝血激活剂的试管;取指尖血放入ep试管中,再向ep试管中加入抗凝剂乙二胺四乙酸(edta),血清分离,在-20℃避光中保存;
(2)准备检测材料和化学制品:
25-羟基维生素d2(100μg/ml,purity98%)、25-羟基维生素d3(100μg/ml,purity98%)、25-羟基维生素d2-d3(25-羟基维生素d2的内标,100μg/ml,purity98%)、25-羟基维生素d3-d6(25-羟基维生素d3的内标,0.5mg,purity95%)、甲酸、标准物质(srm2972、srm972a)、有机溶剂正己烷和甲醇(高效液相色谱级)、硫酸锌(znso4);
(3)校准标准品:
在甲醇浓度为6.25/6.25、12.5/12.5、25/25、50/50、125/125、250/250和500/500nmol/l(25-羟基维生素d2/25-羟基维生素d3)时制备混合校准标准品,每批校准品均作为样品处理;
(4)静脉血清、微量血清25-羟基维生素d检测方法:
采用高效液相色谱串联质谱法定量测定血清25-羟基维生素d浓度,检测仪器为高效液相色谱串联质谱仪;
(5)数据分析:
采用hplc-ms/ms方法对静脉血、微量血的血清标本进行25-羟基维生素d检测;统计分析两种方法的均值偏差;评估25-羟基维生素d状态之间的一致性;
(6)hplc-ms/ms方法的分析性能评价:
通过静脉血清样本、末梢微量血样本的hplc-ms/ms色谱图,采用hplc-ms/ms技术,对维生素d代谢产物和内标进行了充分分离;
(7)静脉和微量血hplc-ms/ms分析方法的结果验证;
(8)静脉和微量血中25-羟基维生素d水平:
比较三组静脉血和微量血中25-羟基维生素d浓度的变化,25-羟基维生素d的量等于25-羟基维生素d3和25-羟基维生素d2的量之和。
(9)静脉和微量血标本中25-羟基维生素d浓度结果比较:
进一步采用bland-altman方法对两种标本结果的一致性进行检验,统计得出两种标本的转换模型:log(校正后微量25-羟基维生素d)=0.01049+1.06692*log(微量25-羟基维生素d),log(校正后微量25-羟基维生素d3)=0.02864+1.05947*log(微量25-羟基维生素d3);根据公式对微量血25(oh)d和25(oh)d3结果进行转换;
(10)校正后25-羟基维生素d和25-羟基维生素d3结果比较分析:
三组中静脉血25-羟基维生素d与校正微量血25-羟基维生素d均值相比组间没有差异,予以三组数据进行合并。
进一步地,所述步骤(4)中静脉血清检测仪器为高效液相色谱串联质谱仪,型号为shimadzu8040;质谱仪设置条件:雾化器温度350℃,雾化气气流6l/min,雾化气压35psi,dl管温度150℃。
进一步地,所述步骤(4)中微量血清检测仪器为高效液相色谱串联质谱仪,型号为absciex4500md;质谱仪设置条件:离子源温度400℃,喷雾气压力70psi,气帘气压力20psi,离子化电压4500v
本发明的末梢微量血维生素d质谱检测方法,通过同时采集同一对象的微量血和常量血,用高效液相色谱-串联质谱法同时检测常量血和微量血25-羟基维生素d水平,采用直线回归分析法分析两者25-羟基维生素d的相关性及转换系数,从而得出log(校正后微量25-羟基维生素d)=0.01049+1.06692*log(微量25-羟基维生素d),log(校正后微量25-羟基维生素d3)=0.02864+1.05947*log(微量25-羟基维生素d3)公式;从而可以通过公式将常量血和微量血25-羟基维生素d浓度相互转换;为临床上用微量血取代常量血进行vitd检测提供可靠依据。
附图说明
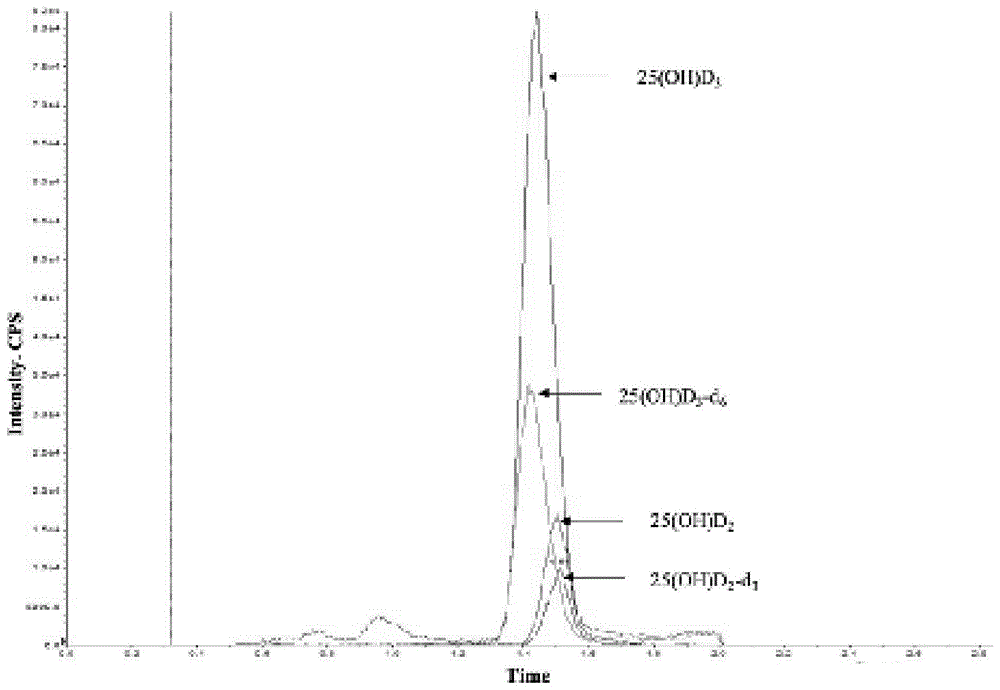
图1为本发明实施例的静脉血清样本hplc-ms/ms色谱图。
图2为本发明实施例的末梢微量血样本hplc-ms/ms色谱图。
图3为本发明实施例的两种标本25-羟基维生素d和25-羟基维生素d3结果的bland-altman一致性检验散点图。
图4为本发明实施例的静脉25-羟基维生素d/25-羟基维生素d3与校正微量血25-羟基维生素d/25-羟基维生素d3的相关性分析图。
图5为本发明实施例的静脉25-羟基维生素d/25-羟基维生素d3浓度与校正微量血25-羟基维生素d/25-羟基维生素d3的roc曲线分析图。
具体实施方式
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
本发明的说明书和权利要求书中的术语“第一”、“第二”、“第三”、“第四”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。
本发明的目的在于提供一种末梢微量血维生素d质谱检测方法,该方法在传统用hplc-ms/ms测定静脉常量血清中25(oh)d的基础上,建立了hplc-ms/ms法测定手指微量血中25(oh)d的新方法;简便、快速、灵敏度高、干扰少、准确度和重现性好;为临床上用微量血取代常量血进行vitd检测提供可靠依据。
血清标本收集:
静脉血样本通过静脉穿刺进入含有凝血激活剂的试管;从手指采集的微量血被挤入含有抗凝剂乙二胺四乙酸(edta)的ep管中;分离血清,在-20℃避光中保存。
检测材料和化学制品:
25(oh)d2(100μg/ml,purity98%)、25(oh)d3(100μg/ml,purity98%)、25(oh)d2-d3(25(oh)d2的内标,100μg/ml,purity98%)、25(oh)d3-d6(25(oh)d3的内标,0.5mg,purity95%)和甲酸。标准物质srm2972和srm972a;有机溶剂正己烷、甲醇(高效液相色谱级)和硫酸锌(znso4)。
校准标准品:
在甲醇浓度为6.25/6.25、12.5/12.5、25/25、50/50、125/125、250/250和500/500nmol/l(25(oh)d2/25(oh)d3)时制备混合校准标准品;每批校准品均作为样品处理。
静脉血清25-(oh)d检测方法:
采用高效液相色谱串联质谱法定量测定血清25-(oh)d浓度,检测仪器为高效液相色谱串联质谱仪(型号:shimadzu8040)。采集静脉血清,取样本100ul经过蛋白质去除、提取、纯化等预处理后,提取有效成分。质谱仪配备esi源采用正离子扫描模式,采用质谱mrm离子监测方法选择前体离子(m/z401.3for25ohd3,m/z413.3for25ohd2,andm/z407.3for25(oh)d3-d6,m/z416.3for25(oh)d2-d3),进一步生成特定的产物离子用于数据分析。如下表(基于hplc-ms/ms方法静脉血反应监测采集设置参数表)所示:
质谱仪设置条件:雾化器温度350℃,雾化气气流6l/min,雾化气压35psi,dl管温度150℃。
根据仪器检测标准物质数据制作标准曲线方程,相对标准偏差<15%。根据标准曲线方程计算质控样本和待测样本25-(oh)d3和25-(oh)d2含量,质控范围
微量血25-(oh)d检测方法:
采用高效液相色谱串联质谱法定量测定微量血25-(oh)d浓度,检测仪器为高效液相色谱串联质谱仪(型号:absciex4500md)。采集微量指血,取样本20ul经过除蛋白与杂质处理后,提取有效成分。质谱仪配备esi源采用正离子扫描模式,采用质谱mrm离子监测方法选择前体离子(m/z401.3for25ohd3,m/z413.3for25ohd2,andm/z407.3for25(oh)d3-d6,m/z416.3for25(oh)d2-d3),进一步生成特定的产物离子用于数据分析。如下表(基于hplc-ms/ms方法微量血反应监测采集设置参数表)所示:
质谱仪设置条件:离子源温度400℃,喷雾气压力70psi,气帘气压力20psi,离子化电压4500v。
根据仪器检测标准物质数据制作标准曲线方程,相对标准偏差<15%。根据标准曲线方程计算质控样本和待测样本25-(oh)d3和25-(oh)d2含量,质控范围
数据分析:
采用hplc-ms/ms两种方法对血清标本进行25(oh)d检测。用bland-altman统计分析两种方法的均值偏差。使用cohen'skappa评估25(oh)d状态之间的一致性(一致性:<0.4,差;0.4-0.75,适中到好;大于0.75,好)。p<0.05具有统计学意义。所有数据分析应用empower(r)和graphpad统计软件。
hplc-ms/ms方法的分析性能评价:
图1所示为静脉血清样本的hplc-ms/ms色谱图,采用hplc-ms/ms技术,对维生素d代谢产物和内标进行了充分分离,25(oh)d3在1.50min,其内标在1.45min洗脱;而25(oh)d2在1.60min,其内标在1.61min洗脱。潜在干扰3-epi-25(oh)d在1.00-1.25min或2.00min洗脱,25(oh)d2和25(oh)d3检测不产生干扰。
图2所示为末梢微量血样本的hplc-ms/ms色谱图,采用hplc-ms/ms技术,对维生素d代谢产物和内标进行了充分分离,25(oh)d3在1.40min,其内标也在1.40min洗脱;而25(oh)d2在1.50min,其内标也在1.50min洗脱。潜在干扰3-epi-25(oh)d在1.00-1.25min或2.00min洗脱,25(oh)d2和25(oh)d3检测不产生干扰。
静脉和微量血hplc-ms/ms分析方法的结果验证:
对静脉血清标本,25(oh)d3的检测限(limitofdetection,lod)均为0.01ng/ml,25(oh)d2的检出限为0.05ng/ml;25(oh)d3的定量限(limitofquantification,loq)为1.5ng/ml,25(oh)d2的loq为1.5ng/ml,当25(oh)d2在0.8ng/ml~50.0ng/ml范围内时,线性良好,相关系数r2>0.99。当25(oh)d3在2.5ng/ml~160.0ng/ml范围内时,线性良好,相关系数r2>0.99。在测定25(oh)d3时,三种浓度10ng/ml、40ng/ml和160ng/ml被设置为质量控制。在测定25(oh)d2时,三种浓度5、10和40ng/ml用于质量控制。两种化合物的准确度回收率(%)在85%~115%合理范围内,准确率分别为3.87%和4.91%。如下表(静脉血清标本hplc-ms/ms检测方法的验证结果表)所示:
对微量血标本,25(oh)d3的lod为0.01ng/ml,25(oh)d2的检出限为0.05ng/ml;25(oh)d3的loq为5ng/ml,25(oh)d2的定量限为0.8ng/ml,当25(oh)d2在0.10ng/ml~12.50ng/ml范围内时,线性良好,相关系数r2>0.99。当25(oh)d3在0.31ng/ml~40.0ng/ml范围内时,线性良好,相关系数r2>0.99。在测定25(oh)d3时,三种浓度1.25ng/ml、5.00ng/ml和20.00ng/ml被设置为质量控制。在测定25(oh)d2时,三种浓度0.39、1.56和6.25ng/ml用于质量控制。两种化合物的准确度回收率(%)在85%~115%合理范围内,准确率分别为1.65%和45.32%。如下表(微量血清标本hplc-ms/ms检测方法的验证结果表)所示:
静脉和微量血中25(oh)d水平:
比较三组静脉血和微量血中25(oh)d浓度的变化。25(oh)d的量等于25(oh)d3和25(oh)d2的量之和。静脉血和毛细血管血中25(oh)d和25(oh)d3的平均值在三组之间存在差异。如下表(静脉和微量血25(oh)d/25(oh)d3结果及精密度比较表)所示:
因为92%的样品含有小于0.1ng/ml的25(oh)d2,我们在随后的统计分析中没有包括该分析物。
静脉和微量血标本中25(oh)d浓度结果比较:
进一步采用bland-altman方法对两种标本结果的一致性进行检验(见图3),两种标本25(oh)d浓度结果95%一致性界限为(-4.36,12.75),结果的偏倚为4.196,偏倚sd为4.365,表示两种标本结果有较好一致性。同样地,其中25(oh)d3浓度95%的一致性界限为(-4.01,12.40)。进一步统计得出两种标本的转换模型:log(校正后微量25(oh)d)=0.01049+1.06692*log(微量25(oh)d),log(校正后微量25(oh)d3)=0.02864+1.05947*log(微量25(oh)d3)。根据公式对微量血25(oh)d和25(oh)d3结果进行转换。
校正后25(oh)d和25(oh)d3结果比较分析:
三组中静脉血25(oh)d与校正微量血25(oh)d均值相比组间没有差异,如下表(静脉血25(oh)d/25(oh)d3与校正毛细血管血25(oh)d/25(oh)d3结果比较表)所示:
予以三组数据进行合并。进一步分别分析静脉25(oh)d和25(oh)d3与校正微量血中25(oh)d和25(oh)d3的相关性为0.7941和0.8103(见图4),roc曲线统计分析两种25(oh)d和25(oh)d3的auc分别为0.9367和0.9565(见图5)。以上结果分析证明hplc-ms/ms检测微量血25(oh)d具有良好的准确性和灵敏度。
基于上文的描述可知,本发明优点在于:
1、通过同时采集同一对象的微量血和常量血,用高效液相色谱-串联质谱法同时检测常量血和微量血25(oh)d水平,采用直线回归分析法分析两者25(oh)d的相关性及转换系数,从而得出log(校正后微量25(oh)d)=0.01049+1.06692*log(微量25(oh)d),log(校正后微量25(oh)d3)=0.02864+1.05947*log(微量25(oh)d3)公式;从而可以通过公式将常量血和微量血25(oh)d浓度相互转换;为临床上用微量血取代常量血进行vitd检测提供可靠依据。
2、本方法在传统用hplc-ms/ms测定静脉常量血清中25(oh)d的基础上,建立了hplc-ms/ms法测定手指微量血中25(oh)d的新方法,该方法简便、快速、灵敏度高、干扰少,准确度和重现性好。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!