一种污染物对绿藻细胞内活性氧含量影响的测定方法与流程
本发明属于环境毒理学领域,特别涉及一种污染物对绿藻细胞内活性氧含量影响的测定方法。该方法利用流式细胞仪检测农药污染物唑类杀菌剂(克霉唑)对蛋白核小球藻(chlorellapyrenoidosa)细胞内活性氧含量的影响。
背景技术:
绿藻是水生生态系统的初级生产者,对水体的平衡和稳定起着极其重要的作用,是反映水体环境质量的重要指标。活性氧(ros)对生物体十分重要,但过量会对生物体产生氧化损伤导致细胞死亡。由于ros寿命短、反应活性高,且大部分都存在于体内很难被捕获,因此活体中ros的直接检测对于解释生命机体的各种生理反应有着重要的意义。
dcfh-da是迄今最常用、最灵敏的细胞内ros检测探针,进入细胞后被酯酶水解为dcfh,在ros存在时dcfh被氧化为不能透过细胞膜的强绿色荧光物质dcf。流式细胞术采用细胞作为实验对象,悬液中的单细胞或其他生物粒子通过检测标记的dcf荧光信号,实现高速、逐一的细胞定量分析和分选。传统的方法是将细胞进行孵育后,使用酶标仪、色谱分析等技术记录细胞所发射的荧光强弱确定细胞内ros的含量,常常会忽略细胞数量变化所导致的荧光强度的改变。由于污染物的影响可能会导致处理组和对照组之间活细胞数目的差异,因此有必要对活细胞数量进行定量以补偿细胞数量不同所造成的荧光强度的差异。
技术实现要素:
本发明的目的在于提供一种污染物对绿藻细胞内活性氧含量影响的测定方法。使之可以更直观、全面地评价污染物对绿藻细胞内活性氧含量的的影响。
具体步骤为:
(1)试验液配置:称取目标污染物原药,溶于bg-ii培养液中配置母液,并将母液稀释至所需浓度,配制成梯度浓度的试验液。
(2)绿藻培养:选择纯培养条件下处于对数生长期的蛋白核小球藻,并用血球计数法计算藻细胞浓度,用bg-ii培养液稀释至所需的初始藻细胞浓度,获得处于对数生长期的蛋白核小球藻均匀藻液。
(3)毒性暴露及藻细胞收集:采用摇瓶法,在无菌条件下,将步骤(2)获得的处于对数生长期的蛋白核小球藻均匀藻液,分装于250ml的锥形瓶中,每个锥形瓶20ml藻液;再次向各锥形瓶中依次添加步骤(1)配制的梯度浓度的试验液至总体积为100ml,并将bg-ii培养液作为空白对照,使各个浓度组的每个目标污染物的浓度分别为0、0.008、0.08、0.8和8mg/l;加入目标污染物后,将蛋白核小球藻置于原培养条件下暴露处理,每天定时摇动3~4次,连续培养至96h后,取5ml均匀藻液,冷冻离心后收集藻细胞,用pbs洗涤1~2次离心收集细胞沉淀物。
(4)装载荧光探针dcfh-da及荧光检测:将dcfh-da溶于培养基中混合均匀制得浓度为10μm的混合液,然后取1ml混合液加入到步骤(3)收集的细胞沉淀物中,37℃避光孵育细胞45min,将孵育后的藻细胞用培养基清洗2~3次,用pbs重悬,过滤后,采用流式细胞仪检测,通过dcf的荧光强度,反映不同浓度污染物暴露下对绿藻细胞内活性氧含量的影响,从而实现污染物对绿藻细胞内活性氧含量影响的测定。
所述步骤(1)中的目标污染物是克霉唑。
所述步骤(2)中的初始藻细胞浓度为4×105个cell/ml。
所述步骤(3)中的原培养条件为:温度22℃,光照度2500~3000lux,光暗周期12h:12h。
所述步骤(3)中冷冻离心的条件为:温度4℃,转速1500g,时间5min。
所述步骤(4)中过滤采用的是70μmd的细胞滤网。
所属步骤(4)中流式细胞仪的型号为cytoflex流式细胞分析仪。
与现有技术相比,本发明的优点在于:
(1)本发明提供了一种操作简单、测试简便快速、实用性强的污染物对绿藻细胞内活性氧含量影响的测定方法;该方法定量的分析细胞发射的荧光强度,从而准确的判断细胞内活性氧的含量。
(2)本发明提供了一种污染物对绿藻细胞内活性氧含量影响的测定方法,评价终点更加直观易判断,具有简单、易操作的优势。
附图说明
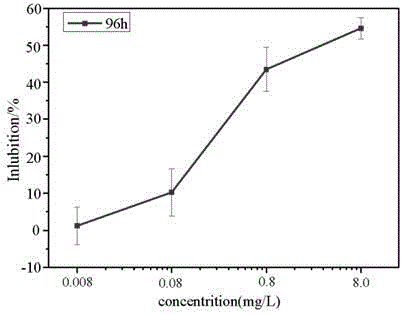
图1为本发明实施例中绿藻在不同浓度污染物暴露96h后的生长抑制率曲线图。
图2为本发明实施例中空白对照(零污染物)暴露下绿藻细胞内dcf荧光信号值变化直方图。
图3为本发明实施例中污染物暴露下绿藻细胞内dcf荧光信号值变化直方图,污染物的浓度为0.008mg/l。
图4为本发明实施例中污染物暴露下绿藻细胞内dcf荧光信号值变化直方图,污染物的浓度为0.08mg/l。
图5为本发明实施例中污染物暴露下绿藻细胞内dcf荧光信号值变化直方图,污染物的浓度为0.8mg/l。
图6为本发明实施例中污染物暴露下绿藻细胞内dcf荧光信号值变化直方图,污染物的浓度为8mg/l。
具体实施方式
以下结合具体实施例对上述方案做进一步说明。应理解,这些实施例是用于说明本发明而不限于限制本发明的范围。实施例中采用的实施条件可以根据具体厂家的条件做进一步调整,未注明的实施条件通常为常规实验中的条件。
以下将以举例形式进行说明,如有未详尽之处,可以参见常用的实验手册,以及所用试剂和仪器的厂商说明书。其中,所有化学试剂均采用分析级,实验用水为超纯水,各试剂均和材料可以商用渠道获得,具体而言:实验中所用到的农药唑类杀菌剂克霉唑,购自catoresearchchemicalsinc.。
实施例:
1.1相关药品的配制
1.1.1配制bg-ii培养基:绿藻的培养基采用bg-ii培养基,其配方见表1。按照表1的配方配制bg-ii培养基配方,其制备方法为:将表1中的成分配制成相应母液浓度,并按照标明顺序依次将相应母液用量转移至1000ml容量瓶中,密封并贴好标签,并用蒸馏水定容至1000ml,在121℃、101kpa下灭菌20min,灭完菌冷却后,置于4℃冰箱保存,有效期2个月。
表1bg-ii培养基配方
注:使用1mnaoh或hcl将ph调至7.1。
1.1.2检测物质农药唑类杀菌剂母液的配置:称取一定量的污染物原药,放入小烧杯中加bg-ii培养基溶解定容。
1.1.3毒性实验相关浓度的配制:用bg-ii培养基将母液稀释并配制成梯度浓度的试验液。
1.2确定初始接种藻细胞浓度:用血球计数法,将处于对数生长期的蛋白核小球藻在显微镜下进行藻细胞计数,计数三次,取平均值,并用bg-ii培养基将藻液稀释到藻细胞浓度为4×105个cell/ml。
1.3毒性暴露实验步骤
1)开机预热紫外分光光度计15min,备用。
2)摇瓶法具体步骤:在无菌条件下,将处于对数生长期、初始密度约为4×105cell/ml的蛋白核小球藻均匀藻液,分装于250ml的锥形瓶中,每瓶20ml藻液。在预实验的基础上将目标污染物设置4个实验组和1个对照组,每组设置3个平行。再次向各锥形瓶中依次添加对应剂量的唑类杀菌剂至总体积为100ml,使各个浓度组的目标污染物的浓度分别为0、0.008、0.08、0.8和8mg/l。加入目标污染物后,将蛋白核小球藻置于原培养条件下暴露处理,每天定时摇动3~4次,连续培养至96h。最后每24h在od681下用紫外可见分光光度计测定其藻液吸光度。并计算不同浓度暴露后的生长抑制率,抑制率公式如下:
e=1-(odi/od0)
1.4藻细胞的收集
1.4.1在无菌条件下,取5ml不同浓度唑类杀菌剂暴露处理96h的均匀藻液于10ml离心管中,作为处理组;分别取5ml未进行污染物刺激的藻液于两个不同的10ml离心管,作为阴性对照和阳性对照。
1.4.2将准备好的藻液在4℃、1500g的条件下,离心5min,弃去上清液。加入1mlph=7.4的pbs,轻轻吹打后转移至1.5ml离心管。同上条件进行冷冻离心后,弃去上清液,收集细胞沉淀物。
1.5装载dcfh-da荧光探针
将dcfh-da溶于bg-ii培养基中,混合均匀后取1ml加入到处理好的细胞沉淀物中,37℃避光孵育细胞45min。期间每间隔5min颠倒摇晃一次,使细胞染色充分。将孵育后的藻细胞用bg-ii培养基清洗2~3次,用pbs重悬。然后取2μl活性氧供体加入到阳性对照管,室温下孵育20~30min。通过70μm细胞滤网过滤后用于荧光检测。
1.6荧光检测
1.6.1上样前打开流式细胞仪及其软件,进行开机流程和质控流程,以保证仪器状态正常。
1.6.2新建试验后,选择fitc通道,设置细胞采集流速为低速,细胞个数为10000个。首先测定阴性对照管,进行增益调节;然后测定阳性对照管,设置门控;最后依次测定处理组。
图2~6中,m1为阴性细胞群,m2为阳性细胞群。如图所示,随着污染物浓度的升高,绿藻细胞生长受到抑制的程度越大,阳性细胞群所占的比例越大,说明在不同浓度污染物的暴露下,绿藻细胞内活性氧的含量表现出显著性的差异,而且污染物浓度越高,细胞内产生的活性氧含量越高,呈现出明显的剂量-效应关系。
以上所述,仅是本发明的较佳实施例而已,只为说明本发明的技术构思及特点,并非对本发明做任何形式上的限制。虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明。其目的在于让任何熟悉本领域的技术人员,在不脱离本发明的精神实质和技术方案的情况下,都可利用上述揭示的方法和技术内容对本发明技术方案做出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同替换、等效变化及修饰,均仍属于本发明技术方案保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!