中药配方颗粒和标准汤剂的质量一致性评价方法与流程
本发明属于医药技术领域,具体涉及一种中药配方颗粒和标准汤剂的质量一致性评价方法。
背景技术:
中药配方颗粒是中药饮片水煎液经浓缩、干燥、制粒而得,以供临床配方用的颗粒。它无需煎煮,直接冲服,体积小,方便携带,有统一的剂量和规格,便于随证加减,受到许多医生和患者的喜爱,使用越来越普遍,越来越全球化。中药配方颗粒是一种新型饮片,如何评价和控制其与传统饮片间的质量一致性是亟需解决的关键问题。国家药品监督管理局于2019年11月颁布了《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》,指出将标准汤剂作为评价配方颗粒质量一致性的基准物质。一项对临床试验的系统回顾和荟萃分析显示,目前仍没有足够的数据证明配方颗粒与传统汤剂在临床治疗上的可替代性。欧洲草药质量专论进展报告中也指出,商品中药颗粒与其相应的水提取物即汤剂之间的等同性存在质疑。由于没有规定具体的一致性评价方法和标准,配方颗粒与传统汤剂的质量一致性仍然没有得到更加科学的分析和证实。由此可以看出,为了确保配方颗粒的质量,有必要建立更加全面具体、科学严谨、普适性强的质量一致性评价方法。
黄连(coptidisrhizoma)是一种常用的中药,具有清热燥湿、泻火解毒的功效。现代药理学研究表明,黄连具有抗菌、抗病毒、解热、降血糖、降血脂、抗溃疡等药理作用,临床上常用来治疗细菌性痢疾、伤寒、肺结核、糖尿病等疾病。在国家药品监督管理局于2019年11月颁布的《关于中药配方颗粒品种试点统一标准的公示》中,规定了黄连标准汤剂出膏率范围以及黄连配方颗粒中四种生物碱含量范围,然而没有涉及二者之间的质量一致性评价。
技术实现要素:
本发明的目的是提供一种中药配方颗粒和标准汤剂的质量一致性评价方法。
为了实现上述发明目的,本发明采用以下技术方案:
黄连配方颗粒和标准汤剂的质量一致性评价方法,包括化学一致性评价和生物活性等效性评价,具体步骤如下:
步骤1,化学一致性评价:取黄连配方颗粒,采用高效液相色谱测定配方颗粒中六种生物碱的成分含量,得到高效液相色谱图,以黄连标准汤剂的高效液相色谱图生成的指纹图谱作为对照,将步骤1得到的黄连配方颗粒高效液相色谱图与其进行比较,以评价配方颗粒与标准汤剂间化学成分种类和比例的相似性,同时以六种生物碱的含量进行化学一致性评价;
步骤2,体外生物活性等效性评价:采用黄连标准汤剂为对照,检测黄连配方颗粒的抑菌活性和降糖活性,以评价配方颗粒的体外生物活性,同时进行等效性评价。
进一步地,步骤1中高效液相色谱的条件为:
色谱柱:agilentsb-c18250×4.6mm、5μm;
流动相:体积比为36:64的乙腈和0.05mol/l磷酸二氢钾溶液,每1l磷酸二氢钾溶液中加庚烷磺酸钠25.24g、再以磷酸调节ph值至4.0;
洗脱方式:等度洗脱;检测波长:345nm;流速:0.5ml/min;柱温:25℃;进样体积:10μl。
进一步地,步骤1中所述六种生物碱为非洲防己碱、药根碱、表小檗碱、黄连碱、巴马汀和小檗碱。
进一步地,步骤1中将容许区间“mean±3sd”作为化学一致性评价标准,
进一步地,步骤2中抑菌活性为对金黄色葡萄球菌的抑制作用,降糖活性为对α-葡萄糖苷酶的抑制作用。
进一步地,步骤2中采用双单侧检验和(1-2α)%置信区间进行等效性评价。
本发明以黄连配方颗粒为例,综合其化学成分信息和生物活性特征,使用指纹图谱、化学计量学、统计学方法,尝试建立以标准汤剂作为标准参照的、具有普适性的一致性评价标准,对黄连配方颗粒与标准汤剂之间的质量一致性进行评价,为配方颗粒质量标准的制定提供参考,为临床用药提供指导意见。
附图说明
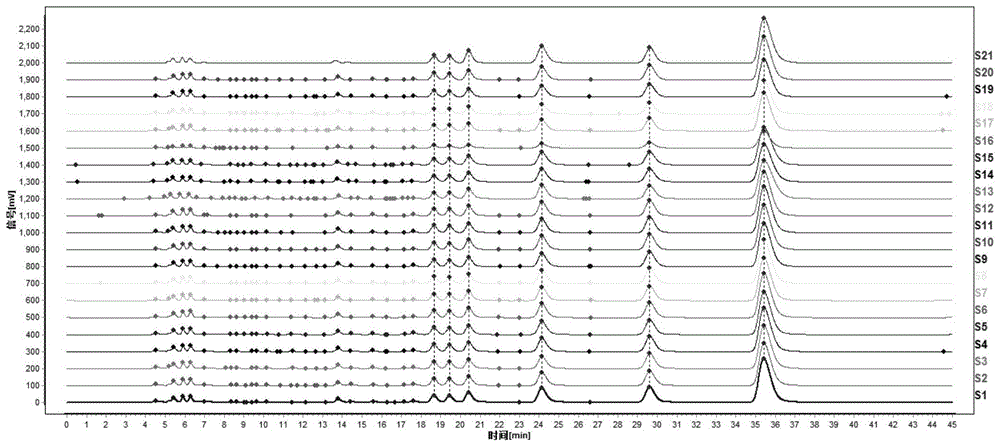
图1为实施例1中以黄连标准汤剂对照指纹图谱为对照得到的黄连配方颗粒指纹图谱。
图2为实施例1中黄连标准汤剂和配方颗粒的抑菌(a)及降糖(b)活性结果。
图3为实施例1中以“80.00%~125.00%”为等效区间20批黄连配方颗粒的抑菌(a)及降糖(b)的分析结果。
图4为实施例1中以“80.00%~125.00%”为等效区间8批黄连配方颗粒的抑菌(a)及降糖(b)的分析结果。
图5为实施例1中以“-1.5σr~1.5σr”为等效区间20批黄连配方颗粒的抑菌(a)及降糖(b)的分析结果。
图6为实施例1中以“-1.5σr~1.5σr”为等效区间8批黄连配方颗粒的抑菌(a)及降糖(b)的分析结果。
具体实施方式
下面结合具体实施例,进一步阐述本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到,未详细描述的技术均按照本领域人员熟知的标准方法进行。本申请中提及的相关试剂等均有商品供应或以别的途径能为公众所得,它们仅作为举例,对本发明不是唯一的。可分别用其它适合的工具或生物材料来替代。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
本发明以黄连配方颗粒为例,综合其化学成分信息和生物活性特征,使用指纹图谱、化学计量学、统计学方法,尝试建立以标准汤剂作为标准参照的、具有普适性的一致性评价标准,对黄连配方颗粒与标准汤剂之间的质量一致性进行评价,为配方颗粒质量标准的制定提供参考,为临床用药提供指导意见。
本发明中共收集了15批黄连标准汤剂,来自一个不同的厂家,具体样品信息如表1所示;共收集20批黄连配方颗粒,来自四个不同的生产厂家。具体样品信息如表2所示。
表1黄连标准汤剂样品
表2黄连配方颗粒样品
实施例1
一、黄连配方颗粒与标准汤剂化学一致性评价
(一)黄连配方颗粒质控成分定量分析
1.样品溶液制备
对照品溶液的制备:取盐酸黄连碱、盐酸小檗碱对照品适量,精密称定,加甲醇制得每1ml含盐酸黄连碱0.1mg、盐酸小檗碱0.3mg的溶液,即得。
配方颗粒溶液的制备:将黄连配方颗粒于研钵中研磨成粉末,取0.1g,加甲醇-盐酸(100:1,v/v)125ml于具塞锥形瓶中,超声处理30min,放冷,补足失重,滤过,取续滤液,即得。
2.高效液相色谱条件
色谱柱:agilentsb-c18(250×4.6mm,5μm);流动相:乙腈-0.05mol/l磷酸二氢钾溶液(36:64)(每1l中加庚烷磺酸钠25.24g,再以磷酸调节ph值至4.0);洗脱方式:等度洗脱;检测波长:345nm;流速:0.5ml/min;柱温:25℃;进样体积:10μl。
3.测定方法
本品以小檗碱对照品为参照,计算非洲防己碱、药根碱、巴马汀、小檗碱的含量;以黄连碱对照品为参照,计算表小檗碱和黄连碱的含量。
20批黄连配方颗粒中六种生物碱成分含量如表3所示。
表3黄连配方颗粒中六种生物碱含量
由上表可知,20批黄连配方颗粒中非洲防己碱、药根碱、表小檗碱、黄连碱、巴马汀、小檗碱的含量范围依次是0.61%~1.89%、0.83%~2.61%、0.91%~3.03%、1.51%~5.24%、1.76%~5.35%、7.34%~22.53%。
(二)化学一致性评价
1.将15批黄连标准汤剂及20批配方颗粒高效液相色谱图导入“中药色谱指纹图谱相似度评价系统”(2012版),分析指纹图谱相似度。以黄连标准汤剂为参照,将其色谱图导入软件中,生成对照指纹图谱。将黄连配方颗粒高效液相色谱图与标准汤剂对照指纹图谱进行比较,评价配方颗粒与标准汤剂间化学成分种类和比例的相似性。
指纹图谱相似度结果如图1和表4所示。
表4黄连配方颗粒相似度值(以黄连标准汤剂对照指纹图谱为对照)
由图1和表4可知,黄连配方颗粒指纹图谱与标准汤剂对照图谱间相似度大于0.99,说明黄连配方颗粒与标准汤剂间化学成分种类及比例相似。
2.一致性区间的确定
容许区间“mean±3sd”是判断离群值的一种方法,区间包含了绝大多数(99.7%)个体观察值可能出现的范围。国家药典委员会将区间“mean±3sd”作为规范中药标准汤剂质量的范围,用来控制出膏率和成分转移率在允许的波动范围内。美国生物药第二层级相似性评价,同样使用质量范围均值加减标准差“μ±xσ”作为相似性区间]。中药配方颗粒是由标准汤剂加入适量辅料制得,其质量优劣与中间体标准汤剂息息相关。
本实施例尝试将容许区间“mean±3sd”作为评价配方颗粒与标准汤剂间化学一致性的标准。首先将测得的黄连标准汤剂和配方颗粒中六种生物碱的百分含量,换算为相当于同等量(100g)原饮片的绝对的量,以便于开展质量一致性评价。将15批黄连标准汤剂中6种生物碱含量的均值和标准差代入公式,得到化学一致区间。若配方颗粒样品中的生物碱含量在此区间内,则认为其与标准汤剂质量一致。
通过高效液相色谱法定量了20批黄连配方颗粒和15批黄连标准汤剂中的非洲防己碱、药根碱、表小檗碱、黄连碱、巴马汀、小檗碱的含量,为了平行比较,根据标准汤剂出膏率和配方颗粒说明书,将其中的生物碱成分含量换算为相当于100g黄连饮片制得样品中绝对的量。结果如表5所示。
表5黄连标准汤剂及配方颗粒中生物碱含量
注:标粗为化学不一致。
由上表可知,15批黄连标准汤剂非洲防己碱、药根碱、表小檗碱、黄连碱、巴马汀、小檗碱含量均值依次为0.35g、0.47g、0.63g、1.06g、0.98g、3.99g,标准差分别为0.03、0.04、0.07、0.12、0.07、0.26,化学一致性范围“mean±3sd”分别为0.26g~0.44g、0.36g~0.58g、0.43g~0.82g、0.70g~1.42g、0.77g~1.20g、3.23g~4.76g。全部黄连标准汤剂样品均落在此范围内,而配方颗粒样品中只有8批样品(g18、g20、g22、g25、g26、g33、g34、g35)的六种生物碱含量符合一致性标准,与标准汤剂化学一致。
二、黄连配方颗粒与标准汤剂生物活性等效性评价
(一)黄连配方颗粒与标准汤剂体外生物活性测定
1.抑菌活性测定
(1)样品溶液的制备
分别称取与0.5g黄连饮片相当的黄连标准汤剂和配方颗粒,加纯净水5ml,超声10min,即得。
(2)菌悬液的制备
取金黄色葡萄球菌菌株,加入复溶液并反复吹打使其完全溶解。将菌液均匀涂布于平板培养基上,于37℃下培养48h后得到单个菌落。将菌落接种于斜面培养基,于37℃下培养24h。取金黄色葡萄球菌接种于20ml营养肉汤液体培养基中,于37℃下培养24h得到菌悬液。
(3)培养基的制备
取适量营养肉汤培养基和琼脂,按照每1l水加入18g培养基、15g琼脂的比例配制后,置于高压蒸汽灭菌器中,于115℃灭菌30min后使用。
(4)抑菌活性的测定
采用平板法测定黄连样品对金黄色葡萄球菌的抑菌圈直经。取1ml菌悬液,加入220ml灭菌后的培养基中(50℃),摇匀,倒入定制的玻璃平板中;待琼脂凝固后,打孔若干个,直径6mm;每孔加入样品溶液25μl,平行3份,于37℃下培养24h后,使用游标卡尺测量抑菌圈直径。
2.降糖活性测定
(1)溶液的配制
磷酸盐缓冲液(pbs)的配制:称取磷酸氢二钾71.6g和磷酸二氢钾31.2g,分别溶于1000ml水中;取49ml磷酸氢二钾溶液和51ml磷酸二氢钾溶液,混合后定容至1000ml,得到0.01mmol/l的pbs溶液(ph=6.8)。
α-葡萄糖苷酶溶液的配制:精密称取α-葡萄糖苷酶适量,溶于0.01mmol/l的磷酸盐缓冲液中,得到0.5u/ml的α-葡萄糖苷酶溶液。
底物pnpg溶液的配制:精密称取pnpg适量,溶于0.01mmol/l的磷酸盐缓冲液中,得到0.5mmol/l的pnpg溶液。
碳酸钠溶液(na2co3)的配制:称取na2co3适量,加水溶解,得到0.1mol/l的na2co3溶液。
样品溶液的配制:称取黄连样品0.15g,加pbs溶液适量,超声10min,定容至10ml,稀释得到一系列浓度(15、13、11、9、7、5、3mg/ml)的样品溶液。
(2)降糖活性的测定
降糖活性的测定参考文献中的方法(tangy,lisl,lisn,etal.medicinalchemistryresearch,2017,26:3384-3394.geah,baiy,lij,etal.journalofpharmaceuticalandbiomedicalanalysis,2014,100:79-87.),作适当改进,在96孔板上进行。按照表6操作,在405nm波长下测定光密度值(od);按照公式(1),计算不同浓度样品对α-葡萄糖苷酶的抑制率;根据样品浓度和相应的抑制率,作非线性回归分析,计算得到黄连样品对α-葡萄糖苷酶的半数抑制浓度(ic50)。
表6降糖活性测定
抑制率(%)=[(odc-odcb)-(ods-odsb)]/(odc-odcb)×100(1)
odc为空白组光密度值;odcb为空白对照组光密度值;ods为样品组光密度值;odsb为样品对照组光密度值。
通过对20批黄连配方颗粒和15批标准汤剂的抑菌活性和对α-葡萄糖苷酶的抑制作用进行了测定,旨在评价二者之间的质量一致性。结果如表7所示。
表7黄连标准汤剂和配方颗粒的抑菌及降糖活性
由上表可知,黄连标准汤剂对金黄色葡萄球菌的抑菌圈直径在14.09mm~19.83mm范围内,配方颗粒样品抑菌圈直径为9.76mm~19.32mm,直观分析二者抑菌活性相差不大;黄连标准汤剂样品的对α-葡萄糖苷酶半数抑制浓度为26.99mg/ml~49.75mg/ml,而配方颗粒的ic50值变化范围为40.29mg/ml至120.70mg/ml,从测量数据来看,二者降糖活性有一定差异。将测量数据输入graphpadprism5.0中生成柱形图,从图2中可以看出,第32批样品(配方颗粒g32)的抑菌与降糖活性明显弱于其他样品。
(二)体外生物活性等效性评价
本实施例借鉴等效性检验的统计分析方法即双单侧检验和(1-2α)%置信区间,对黄连配方颗粒和标准汤剂间生物活性等效性开展评价。具体方法是将抑菌圈直径及降糖ic50值作对数转换,进行两次单侧t检验并计算90%ci范围,判断两组数据总体均值的差值是否在设定的标准范围内。
1.实验方法
(1)统计分析方法
1)生物等效性的统计分析方法
生物等效性评价是对两种药物在人体内吸收程度和速度的一致性评价,其评价方法是通过测定药物的药动学参数auc和cmax,采用双单侧t检验及(1-2α)%置信区间法检验总体均值的差异是否在可接受的范围内。公式如下:
2)生物药分析相似性的统计分析方法
美国fda规定了生物药分析相似性的评价方法,于2017年发布了《用于评估分析相似性的统计方法》,文件中从三个层级对相似性进行评价。其中第一层级是对与临床相关性强的质量属性如效价和生物活性的相似性评价,采用了与生物等效性评价方法类似的等效性检验,评估样本均值的差异大小。公式如下:
h01和h02为原假设,h11和h12为备择假设;μg和μd分别是黄连配方颗粒和标准汤剂活性参数的总体均值;
2.评价标准
(1)生物等效性及生物药相似性评价标准
对于化学仿制药生物等效性评价标准,cfda在2015年颁布了《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,规定auc和cmax的90%ci的判定标准为“80.00%~125.00%”。fda、欧盟药品审评局、日本厚生省和世界卫生组织也都以“80.00%~125.00%”作为一般药物的生物等效性评价范围。对于高变异药物,即药动学参数的个体内差异(cvintra)在30%以上的药物,fda推荐使用比例标化均值法评价生物等效性,根据参比制剂个体内变异程度,适当放宽生物等效性评价标准。上限/下限=exp[±ln(1.25)·(sωr/sω0)],sωr为个体内变异,sω0=0.25。在此标准下,当cvintra=35%,生物等效范围可以扩大到“73.17%~136.67%”,当cvintra=40%时,该范围可扩大至69.98%~142.90%,当cvintra=50%,可以扩大至“64.00%~156.25%”。欧盟药品审评局仅接受扩大cmax的等效性判定标准的范围,规定了上限为“69.84%~143.19%”(cvintra≥50)。其等效性界限计算公式为上限/下限=exp(±k·sωr),其中k=0.760。在此标准下,对于cvintra为35%的药物,90%ci可以扩大到“77.23%~129.48%”,当cvintra=40%,90%ci可扩大至74.62%~134.02%,当cvintra≥50%,则可以扩大至“69.84%~143.19%”。
对于生物类似药相似性评价,美国fda于2017年发布的《生物类似药分析相似性评价的统计方法指导原则》中规定,生物类似药的第一层级质量属性的等效范围是“-δ~δ”,等效界值δ=f·σr,其中σr是参照药的总体标准差,由样本标准差估计得到。fda根据标化均值生物等效性法和经验判断,推荐f取值为1.5,即等效范围为“-1.5σr~1.5σr”。
(2)黄连配方颗粒生物活性等效性评价标准
中药的化学成分复杂多样并且含量存在波动,生物活性效应也因此不尽相同。一般常见的活性一致性评价方法是检验总体均值是否相同,属于点估计。本实施例采用区间估计的方法,允许均值存在不同,分别参照仿制药生物等效性、生物类似药分析相似性第一层级评价标准,计算黄连样品生物活性测定值的变异程度,设置一致性评价界限值。
仿制药生物等效性界值是根据药物个体内变异程度来确定的,类似地,本实施例计算了不同批次样品的抑菌圈直径和ic50值的变异系数,以此代替个体内变异。如表7所示,黄连标准汤剂的抑菌圈直径的变异系数(cv)为10.52%,ic50值的变异程度为9.25%,均小于30%。因此,设置80.00%~125.00%为黄连配方颗粒生物活性等效性判定标准,即l=ln0.80,u=ln1.25。当tl≥t1-α(λ)、-tu≥t1-α(λ)、90%ci在“80.00%~125.00%”范围内时,认为黄连配方颗粒与标准汤剂生物活性等效。
生物类似药相似性评价的前提是质量参数服从正态分布或近似正态分布,并且相似性界值与质量参数标准差成倍数关系为±1.5σr。本实施例将抑菌圈直径和ic50值进行对数转换改善其正态性,计算得到转换后的标准差。如表7所示,抑菌圈直径标准差为0.10,ic50值标准差为0.09。因此,得到相应的抑菌活性等效性范围为“-0.150~0.150”,降糖活性一致性范围为“-0.135~0.135”。当t1≥t1-α(λ)、-t2≥t1-α(λ)、抑菌及降糖活性的90%ci均在各自的等效性范围内时,认为黄连配方颗粒与标准汤剂生物活性等效。
3.结果
1.以“80.00%~125.00%”为等效区间的分析结果
首先对15批标准汤剂和20批配方颗粒的抑菌和降糖活性进行统计分析。将样品抑菌圈直径和ic50值经对数转换后,计算样本均值和标准差,代入公式。结果如表8和图3所示。抑菌活性评价中,tl>t1-α(33),-tu>t1-α(33),拒绝零假设hl0和hu0,90%ci为“88.73%~104.04%”,表明黄连配方颗粒与标准汤剂抑菌活性一致。降糖活性分析中,tl>t1-α(33),-tu<t1-α(33),拒绝零假设hl0,接受零假设hu0,90%ci为“104.46%~129.23%”,表明黄连配方颗粒与标准汤剂降糖活性不等效。
对15批标准汤剂和8批被证明化学一致的配方颗粒的抑菌和降糖活性进行统计分析。结果如表8和图4所示。抑菌活性评价中,tl>t1-α(21),-tu>t1-α(21),拒绝零假设hl0和hu0,90%ci为“95.57%~111.11%”,表明黄连配方颗粒与标准汤剂抑菌活性一致。降糖活性分析中,tl>t1-α(21),-tu>t1-α(21),拒绝零假设hl0和hu0,90%ci为“94.55%~110.08%”,表明黄连配方颗粒与标准汤剂降糖活性一致。综上,在以“80.00%~125.00%”为等效区间评价生物活性时,有8批黄连配方颗粒样品与标准汤剂体外生物活性等效。
表4-2体外生物活性等效性评价(以“80.00%~125.00%”为标准)
2.以“-1.5σr~1.5σr”为等效区间的分析结果
首先对15批标准汤剂和20批配方颗粒的抑菌和降糖活性进行统计分析。将样品抑菌圈直径和ic50值经对数转换后,计算样本均值和标准差,代入公式。结果如表9和图5所示。抑菌活性评价中,t1>t1-α(33),-t2>t1-α(33),拒绝零假设h01和h02,90%ci为“-0.120~0.040”,在等效区间“-0.150~0.150”内,表明黄连配方颗粒与标准汤剂抑菌活性一致。降糖活性分析中,t1>t1-α(33),-t2<t1-α(33),拒绝零假设h01,接受h02,90%ci为“0.044~0.256”,没有完全落在等效区间“-0.135~0.135”内,表明黄连配方颗粒与标准汤剂降糖活性不一致。综上,受试的20批黄连配方颗粒与标准汤剂生物活性不一致。
对15批标准汤剂和8批被证明化学一致的配方颗粒的抑菌和降糖活性进行统计分析。结果如表9和图6所示。抑菌活性评价中,t1>t1-α(21),-t2>t1-α(21),拒绝零假设h01和h02,90%ci为“-0.045~0.105”,在等效区间“-0.150~0.150”内,表明黄连配方颗粒与标准汤剂抑菌活性一致。降糖活性分析中,t1>t1-α(21),-t2>t1-α(21),拒绝零假设h01和h02,90%ci为“-0.056~0.096”,在等效区间“-0.135~0.135”内,表明黄连配方颗粒与标准汤剂降糖活性一致。综上,满足化学一致的8批黄连配方颗粒与标准汤剂体外生物活性一致。
表9体外生物活性等效性评价(以“-1.5σr,1.5σr”为标准)
在两种不同的等效标准下,配方颗粒与标准汤剂质量一致性评价结果相同。将“80.00%~125.00%”反对数转换,其对应的等效区间为“-0.223~0.223”。与“-1.5σr~1.5σr”(抑菌:“-0.150~0.150”;降糖:“-0.135~0.135”)相比,化药生物等效范围“80.00%~125.00%”更宽。化药生物等效标准的设定依据是,当药物的吸收程度和速度的个体内变异小于30%,药物在人体循环系统的暴露差别在20%以内时不会对临床治疗效果产生显著影响,从而规定“80.00%~125.00%”为等效区间。然而,中药不同批次的生物活性变异远小于药物的个体内变异程度,“80.00%~125.00%”的评价标准会将原本生物活性不等效的样品判定为等效。因此,根据活性参数变异程度设定的等效范围即“-1.5σr~1.5σr”,更加适用于中药体外生物活性等效性评价。
本实施例测定了黄连标准汤剂和配方颗粒对金黄色葡萄球菌的抑菌圈直径和对α-葡萄糖苷酶的半数抑制浓度,采用双单侧t检验和90%ci方法,在“80.00%~125.00%”和“-1.5σr~1.5σr”两种评价标准下,评价二者之间抑菌及降糖活性的等效性,两种评价标准下得到的结论相同:当全部配方颗粒(20批)作为整体与标准汤剂(15批)进行比较时,二者之间抑菌活性等效,降糖活性不等效;当与标准汤剂化学一致的8批配方颗粒作为整体,与标准汤剂(15批)进行比较时,抑菌和降糖活性均等效。结果表明,这8批配方颗粒同时满足化学一致性和生物活性等效性,与黄连标准汤剂质量一致。
- 还没有人留言评论。精彩留言会获得点赞!