高灵敏度化学发光免疫诊断试剂及消除两步法免疫试剂HOOK效应的方法与流程
本发明涉及生物化学技术领域,特别涉及免疫诊断技术领域,具体是指一种高灵敏度化学发光免疫诊断试剂及消除两步法免疫试剂hook效应的方法。
背景技术:
免疫分析技术经历了酶免分析技术(eia)、放射免疫分析技术(ria)、荧光免疫分析技术(fia)、时间分辨荧光免疫分析技术(trfia)和化学发光免疫分析技术(clia)几个阶段。其中,clia作为最先进的免疫分析技术,不仅自动化程度高、检测速度快,而且还具有较高的灵敏度和分析特异性,在临床检测中发挥着越来越重要的作用。
临床上对免疫试剂灵敏度要求越来越高,尤其是传染病检测试剂,灵敏度越高,就越能更早检测出感染状况,所以提高试剂的灵敏度一直是体外诊断试剂厂商所追求的一大目标。
众所周知,(链霉)亲和素-生物素是免疫检测中常用的信号放大系统。亲和素是蛋清中常见的糖蛋白,由四个相同亚基组成,每一个亚基都包含一个生物素结合位点,因此理论上一个亲和素能结合四个生物素。亲和素与生物素之间具有强烈的亲和力,其解离常数约1.3*1015mol/l,是自然界中最强的非共价相互作用之一,远高于抗原-抗体之间的亲和力(5*105-11mol/l)。而且,亲和素稳定性很好,即使在浓度高达8m的尿素溶液中,也能保持结构的完整性和对生物素的亲和力。另外,亲和素-生物素系统结合具有高度特异性,能够在复杂溶液环境中互相结合。因此,亲和素-生物素系统广泛应用在免疫检测中,其中应用最为广泛的就是将链霉亲和素包被在磁珠表面,生物素标记抗原/抗体,链霉亲和素和生物素结合,作为固相使用,这样的固相系统由于固相空间上延伸出一个亲和素-生物素系统,故而更接近液相中的均相反应,因而试剂精密性更高;另外包被工艺本身比生物素标记工艺复杂,所以链霉亲和素的通用固相能简化工艺。罗氏elecys电化学发光绝大部分免疫试剂,西门子centaur系统一部分免疫试剂,以及贝克曼access/dxi系统一部分免疫试剂,均采用链霉亲和素-生物素系统做固相系统;国内体外诊断试剂中苏州长光华医、迪瑞生物等多家企业均采用链霉亲和素-生物素磁珠系统,可见这一系统在免疫诊断试剂中应用相当成熟。
然而发明人发现,可能是由于固相空间位阻的缘故,链霉亲和素-生物素磁珠免疫诊断试剂并没有呈现理论上的指数级信号放大效果;但是应用于免疫试剂后端时,通常会出现指数级的信号放大效果,因而可以应用于提高标记免疫分析试剂的灵敏度上,尤其是可以应用于一些对灵敏度要求高的标记免疫试剂,如人类免疫缺陷病毒抗体检测试剂(anti-hiv)、人类丙型肝炎病毒抗体检测试剂(anti-hcv)等。但是,由于一些人群体内会产生极高浓度的抗体,比如一些hiv阳性孕妇的抗体浓度极高,而双抗原夹心法测抗体如果搭配后端链霉亲和素-生物素放大体系,客户端要求快速出结果,这就需要两端抗原和样本中的抗体在第一步反应,链霉亲和素标记物放在第二步反应,抗体浓度太高,会导致强阳样本可能由于hook效应检测成阴性,因此,有必要改善链霉亲和素-生物素后端放大体系在两步法操作中由于hook效应带来的漏检风险。
因此,希望提供一种高灵敏度化学发光免疫诊断试剂,其能够大幅度提高免疫诊断试剂灵敏度,提高检测准确性,还希望提供一种消除两步法免疫试剂hook效应的方法,其可以确保强阳样本不漏检,提高检测准确性。
技术实现要素:
为了克服上述现有技术中的缺点,本发明的一个目的在于提供一种高灵敏度化学发光免疫诊断试剂,其能够大幅度提高免疫诊断试剂灵敏度,提高检测准确性,适于大规模推广应用。
本发明的另一目的在于提供一种高灵敏度化学发光免疫诊断试剂,其设计巧妙,配制简便,成本低廉,适于大规模推广应用。
本发明的另一目的在于提供一种消除两步法免疫试剂hook效应的方法,其可以确保强阳样本不漏检,提高检测准确性,适于大规模推广应用。
本发明的另一目的在于提供一种消除两步法免疫试剂hook效应的方法,其设计巧妙,操作简便,适于大规模推广应用。
为达到以上目的,在本发明的第一方面,提供一种高灵敏度化学发光免疫诊断试剂,其特点是,包括:包被有第一抗原/第一抗体的磁珠、生物素标记的第二抗原/第二抗体、以及链霉亲和素标记的化学发光试剂,所述第一抗原和所述第二抗原用于特异性结合待检测样本中的待检测抗体,所述第一抗体和所述第二抗体用于特异性结合待检测样本中的待检测抗原。
较佳地,所述第一抗体和所述第二抗体均为hivanti-protein24或抗-hbsag抗体。
较佳地,所述第一抗原和所述第二抗原均为hiv-i型融合抗原和hiv-ii型抗原、或者hcv融合抗原。
较佳地,所述化学发光试剂是吖啶酯或吖啶磺酰胺。
在本发明的第二方面,提供了一种消除两步法免疫试剂hook效应的方法,其特点是,采用上述的高灵敏度化学发光免疫诊断试剂,所述的消除两步法免疫试剂hook效应的方法包括以下步骤:
(1)将所述的包被有第一抗原/第一抗体的磁珠与待检测样本进行第一步反应;
(2)洗涤后加入所述的链霉亲和素标记的化学发光试剂进行第二步反应,所述的链霉亲和素标记的化学发光试剂预先添加所述的生物素标记的第二抗原/第二抗体。
较佳地,所述的生物素标记的第二抗原/第二抗体的浓度稀释20倍~80倍。
较佳地,所述的链霉亲和素标记的化学发光试剂是链霉亲和素-吖啶酯试剂,所述链霉亲和素-吖啶酯试剂的浓度为0.45/4000mg/ml,所述的生物素标记的第二抗原/第二抗体是hiv-i抗原生物素和hiv-ii抗原生物素,所述hiv-i抗原生物素的浓度为0.5/2500mg/ml,所述hiv-ii抗原生物素的浓度为0.38/5000mg/ml。
较佳地,所述的链霉亲和素标记的化学发光试剂是链霉亲和素-吖啶酯试剂,所述链霉亲和素-吖啶酯试剂的浓度为0.45/4000mg/ml,所述的生物素标记的第二抗原/第二抗体是hcv抗原生物素,所述hcv抗原生物素的浓度为0.8/2000mg/ml。
较佳地,所述的链霉亲和素标记的化学发光试剂是链霉亲和素-吖啶酯试剂,所述链霉亲和素-吖啶酯试剂的浓度为0.45/4000mg/ml,所述的生物素标记的第二抗原/第二抗体是hbsag多抗生物素,所述hbsag多抗生物素的浓度为0.78/2000mg/ml。
本发明的有益效果主要在于:
1、本发明的高灵敏度化学发光免疫诊断试剂包括:包被有第一抗原/第一抗体的磁珠、生物素标记的第二抗原/第二抗体、以及链霉亲和素标记的化学发光试剂,第一抗原和第二抗原用于特异性结合待检测样本中的待检测抗体,第一抗体和第二抗体用于特异性结合待检测样本中的待检测抗原,即采用后端链霉亲和素-生物素放大体系,因此,其能够大幅度提高免疫诊断试剂灵敏度,提高检测准确性,适于大规模推广应用。
2、本发明的高灵敏度化学发光免疫诊断试剂包括:包被有第一抗原/第一抗体的磁珠、生物素标记的第二抗原/第二抗体、以及链霉亲和素标记的化学发光试剂,第一抗原和第二抗原用于特异性结合待检测样本中的待检测抗体,第一抗体和第二抗体用于特异性结合待检测样本中的待检测抗原,即采用后端链霉亲和素-生物素放大体系,因此,其设计巧妙,配制简便,成本低廉,适于大规模推广应用。
3、本发明的消除两步法免疫试剂hook效应的方法,采用上述的高灵敏度化学发光免疫诊断试剂,包括以下步骤:将包被有第一抗原/第一抗体的磁珠与待检测样本进行第一步反应;洗涤后加入链霉亲和素标记的化学发光试剂进行第二步反应,链霉亲和素标记的化学发光试剂预先添加生物素标记的第二抗原/第二抗体,因此,其可以确保强阳样本不漏检,提高检测准确性,适于大规模推广应用。
4、本发明的消除两步法免疫试剂hook效应的方法,采用上述的高灵敏度化学发光免疫诊断试剂,包括以下步骤:将包被有第一抗原/第一抗体的磁珠与待检测样本进行第一步反应;洗涤后加入链霉亲和素标记的化学发光试剂进行第二步反应,链霉亲和素标记的化学发光试剂预先添加生物素标记的第二抗原/第二抗体,因此,其设计巧妙,操作简便,适于大规模推广应用。
本发明的这些和其它目的、特点和优势,通过下述的详细说明,附图和权利要求得以充分体现,并可通过所附权利要求中特地指出的手段、装置和它们的组合得以实现。
附图说明
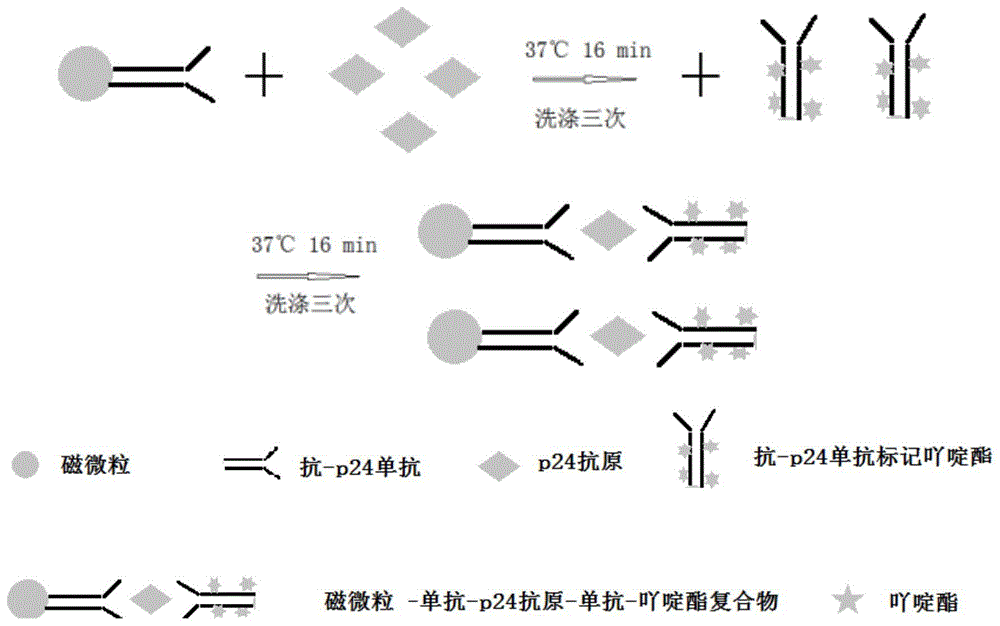
图1是双抗体夹心法测p24抗原的直接包被直接标记模式的反应示意图。
图2是双抗体夹心法测p24抗原的直接包被间接标记模式的反应示意图。
图3是双抗体夹心法测p24抗原的间接包被直接标记模式的反应示意图。
图4是双抗原夹心法测抗体的直接包被间接标记模式的漏检反应示意图。
图5是双抗原夹心法测抗体的直接包被间接标记模式的确保强阳样本不漏检的测试方法的示意图。
具体实施方式
为了大幅度提高免疫诊断试剂灵敏度,提高检测的准确性,本发明提供了一种高灵敏度化学发光免疫诊断试剂,包括:包被有第一抗原/第一抗体的磁珠、生物素标记的第二抗原/第二抗体、以及链霉亲和素标记的化学发光试剂,所述第一抗原和所述第二抗原用于特异性结合待检测样本中的待检测抗体,所述第一抗体和所述第二抗体用于特异性结合待检测样本中的待检测抗原。
所述第一抗体和所述第二抗体可以是任何合适的抗体,只要特异性结合相同抗原即可,较佳地,所述第一抗体和所述第二抗体均为hivanti-protein24或抗-hbsag抗体。
所述第一抗原和所述第二抗原可以是任何合适的抗原,只要特异性结合相同抗体即可,较佳地,所述第一抗原和所述第二抗原均为hiv-i型融合抗原和hiv-ii型抗原、或者hcv融合抗原。
所述化学发光试剂可以是任何合适的化学发光试剂,较佳地,所述化学发光试剂是吖啶酯或吖啶磺酰胺。
但是采用上述高灵敏度化学发光免疫诊断试剂,需要两端抗原/抗体和样本中的抗体/抗原在第一步反应,链霉亲和素标记物放在第二步反应,抗体/抗原浓度太高,会导致强阳样本可能由于hook效应检测成阴性,为了消除两步法免疫试剂hook效应,本发明还提供了一种消除两步法免疫试剂hook效应的方法,采用上述的高灵敏度化学发光免疫诊断试剂,所述的消除两步法免疫试剂hook效应的方法包括以下步骤:
(1)将所述的包被有第一抗原/第一抗体的磁珠与待检测样本进行第一步反应;
(2)洗涤后加入所述的链霉亲和素标记的化学发光试剂进行第二步反应,所述的链霉亲和素标记的化学发光试剂预先添加所述的生物素标记的第二抗原/第二抗体。
所述的生物素标记的第二抗原/第二抗体添加至所述的链霉亲和素标记的化学发光试剂中的比例需要控制,较佳地,所述的生物素标记的第二抗原/第二抗体的浓度稀释20倍~80倍。
所述的链霉亲和素标记的化学发光试剂,所述的生物素标记的第二抗原/第二抗体,可以是任何合适的试剂,较佳地,所述的链霉亲和素标记的化学发光试剂是链霉亲和素-吖啶酯试剂,所述链霉亲和素-吖啶酯试剂的浓度为0.45/4000mg/ml,所述的生物素标记的第二抗原/第二抗体是hiv-i抗原生物素和hiv-ii抗原生物素,所述hiv-i抗原生物素的浓度为0.5/2500mg/ml,所述hiv-ii抗原生物素的浓度为0.38/5000mg/ml。
所述的链霉亲和素标记的化学发光试剂,所述的生物素标记的第二抗原/第二抗体,可以是任何合适的试剂,较佳地,所述的链霉亲和素标记的化学发光试剂是链霉亲和素-吖啶酯试剂,所述链霉亲和素-吖啶酯试剂的浓度为0.45/4000mg/ml,所述的生物素标记的第二抗原/第二抗体是hcv抗原生物素,所述hcv抗原生物素的浓度为0.8/2000mg/ml。
所述的链霉亲和素标记的化学发光试剂,所述的生物素标记的第二抗原/第二抗体,可以是任何合适的试剂,较佳地,所述的链霉亲和素标记的化学发光试剂是链霉亲和素-吖啶酯试剂,所述链霉亲和素-吖啶酯试剂的浓度为0.45/4000mg/ml,所述的生物素标记的第二抗原/第二抗体是hbsag多抗生物素,所述hbsag多抗生物素的浓度为0.78/2000mg/ml。
为了能够更清楚地理解本发明的技术内容,特举以下实施例详细说明。其中所用到的所有生物活性原料、化学药品均为市售;阳性样本、阴性样本为从医院通过正常渠道获取的;参考品、标准品为市售或者通过阳性样本配制而成。
实施例1双抗体夹心法测p24抗原
一、直接包被直接标记模式
1、将hivanti-protein24通过共价结合偶联羧基磁微粒,按100ug抗体/mg磁珠的浓度进行偶联,然后进行封闭,并用20mmpb(ph6.5)+0.5%nacl+1%bsa+5%小牛血清+0.02%nan3稀释到0.1mg磁珠/ml的浓度,作为固相磁颗粒试剂。
2、将另一株hivanti-protein24抗体标记吖啶磺酰胺,抗体浓度用0.1m硼酸(ph8.5)+0.02%tw20缓冲液调整至1mg/ml;用dmso配制1mg/ml的吖啶磺酰胺;然后在抗体中加入抗体体积1/100的吖啶磺酰胺,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集抗体-吖啶磺酰胺结合物,紫外分光光度计检测抗体-吖啶磺酰胺结合物浓度为0.75mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液,将抗体-吖啶酯结合物稀释5000倍,作为发光免疫试剂的结合物试剂。
3、用hiv病毒纯化出的p24抗原配制标准品和阳性质控,小牛血清为阴性质控;另外购买的一支hiv早期感染p24阳性血清样本经雅培试剂测p24以及血清稀释,同时用p24国家标准品标化后作为抗原灵敏度样本稀释系列,浓度分别为1.25iu/ml、2.5iu/ml、5iu/ml、10iu/ml、20iu/ml。准备500例体检样本作为阴性样本用于计算试剂cutoff值。
4、将上述试剂在全自动化学发光分析仪上检测hivp24校准品和阴阳性质控及新鲜血样500例,反应模式(示意图请参见图1所示)为100ul样本+50ul磁颗粒试剂在37摄氏度下反应16分钟,然后用pbs-t洗涤3次,之后加入100ul结合物试剂,反应16分钟,再次洗涤3次,之后分别加入预激发液(0.1mhno3)及激发液(0.25mnaoh)各100ul;记录信号值。
二、直接包被间接标记模式
1、将hivanti-protein24通过共价结合偶联羧基磁微粒,按100ug抗体/mg磁珠的浓度进行偶联,然后进行封闭,并用20mmpb(ph6.5)+0.5%nacl+1%bsa+5%小牛血清+0.02%nan3稀释到0.1mg磁珠/ml的浓度,作为固相磁颗粒试剂;
2、将另一株hivanti-p24抗体标记生物素,抗体浓度用0.1m硼酸(ph8.5)+0.02%tw20缓冲液调整至1mg/ml;用dmso配制1mg/ml的生物素;然后在抗体中加入抗体体积1/100的生物素,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集抗体-生物素结合物,紫外分光光度计检测抗体-生物素结合物浓度为0.78mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液,将抗体-生物素结合物稀释5000倍,作为发光免疫试剂的生物素试剂。
3、将链霉亲和素标记吖啶酯:sa浓度用0.1m硼酸(ph8.5)+0.02%tw20缓冲液调整至1mg/ml,用dmso配制1mg/ml的吖啶酯;然后在sa中加入sa体积1/100的吖啶酯,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集sa-吖啶酯结合物,紫外分光光度计检测sa-吖啶酯结合物浓度为0.45mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液,将sa-吖啶酯结合物稀释4000倍,作为发光免疫试剂的吖啶酯试剂。
样本配制跟直接包被直接标记模式相同;
将上述试剂在全自动化学发光分析仪上检测hivp24校准品和阴阳性质控及新鲜血样500例,反应模式(示意图请参见图2所示)为100ul样本+50ul磁颗粒试剂+50ul生物素试剂,在37摄氏度下反应16分钟,然后用pbs-t洗涤3次,之后加入100ul吖啶酯试剂,反应6分钟,再次洗涤3次,之后分别加入预激发液(0.1mhno3)及激发液(0.25mnaoh)各100ul;记录信号值。
三、间接包被直接标记模式
1、将商品化的sa磁珠用20mmpb(ph6.5)+0.5%nacl+1%bsa+5%小牛血清+0.02%nan3稀释到0.2mg磁珠/ml的浓度,作为固相磁颗粒试剂;
2、将hivanti-p24标记生物素,抗体浓度用0.1m硼酸(ph8.5)+0.02%tw20缓冲液调整至1mg/ml;用dmso配制1mg/ml的生物素;然后在抗体中加入抗体体积1/100的生物素,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集抗体-生物素结合物,紫外分光光度计检测抗体-生物素结合物浓度为0.78mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液,将抗体-生物素结合物稀释2500倍,作为发光免疫试剂的生物素试剂。
3、将另一株hivanti-p24抗体标记吖啶磺酰胺,抗体浓度用0.1m硼酸(ph8.5)+0.02%tw20缓冲液调整至1mg/ml;用dmso配制1mg/ml的吖啶磺酰胺;然后在抗体中加入抗体体积1/100的吖啶磺酰胺,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集抗体-吖啶磺酰胺结合物,紫外分光光度计检测抗体-吖啶磺酰胺结合物浓度为0.75mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液,将抗体-吖啶酯结合物稀释5000倍,作为发光免疫试剂的结合物试剂。
样本准备同前;
将上述试剂在全自动化学发光分析仪上检测hivp24校准品和阴阳性质控及新鲜血样500例,反应模式(示意图请参见图3所示)为50ul链霉亲和素磁颗粒试剂+50ul生物素标记抗体+100ul样本,在37摄氏度下反应16分钟,然后用pbs-t洗涤3次,之后加入100ul吖啶酯标记抗体,反应16分钟,再次洗涤3次,之后分别加入预激发液(0.1mhno3)及激发液(0.25mnaoh)各100ul;记录信号值。
四、cutoff值的计算:统计各种模式下500例阴性血样样本的发光值,使用正态分布的u检验,根据单侧99.5%的可信限,得到cut-off的决定值。
表1双抗体夹心法测p24抗原三种模式比较
结论:直接包被间接标记系统测p24抗体的灵敏度最好,比直接包被直接标记高至少3个稀释梯度,比间接包被直接标记高2个稀释梯度,可以轻松达到国家要求的测出2.5iu/ml的标准。
实施例2双抗原夹心法测anti-hiv
一、直接包被直接标记模式
1、将hiv-i型融合抗原和hiv-ii型抗原通过共价结合偶联羧基磁微粒,按100ug/mg磁珠的浓度进行偶联,然后进行封闭,并用20mmpb(ph6.5)+0.5%nacl+1%bsa+5%小牛血清+0.02%nan3稀释到0.1mg磁珠/ml的浓度,作为固相磁颗粒试剂。
2、将hiv-i型融合抗原和hiv-ii型抗原分别标记吖啶磺酰胺,抗原浓度用0.1mes(ph5.0)调整至1mg/ml;用dmso配制1mg/ml的吖啶磺酰胺;然后在抗原中加入抗原体积1/100的吖啶磺酰胺,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集抗原-吖啶磺酰胺结合物,紫外分光光度计检测抗原-吖啶磺酰胺结合物浓度,hiv-i抗原结合物为0.5mg/ml,而hiv-ii抗原结合物浓度为0.38mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液将hiv-i型抗原结合物和hiv-ii型抗原结合物分别按2.5k和5k倍稀释,作为发光免疫试剂的结合物试剂。
3、样本准备:用hiv阳性样本稀释配制校准品和阳性质控,小牛血清为阴性样本,500例阴性体检血清样本做cutoff值检测用;另准备4例阳性样本,用小牛血清按5000、10000、20000、40000、80000倍稀释,作为抗体灵敏度系列稀释样本;另外拿一份高浓度阳性样本用小牛血清稀释2、4、8倍,作为hook效应的系列样本。
4、将上述试剂在全自动化学发光分析仪上分别检测上述样本,反应模式为100ul样本+50ul磁颗粒试剂在37摄氏度下反应16分钟,然后用pbs-t洗涤3次,之后加入100ul结合物试剂,反应16分钟,再次洗涤3次,之后分别加入预激发液(0.1mhno3)及激发液(0.25mnaoh)各100ul;记录信号值并比较结果。
二、直接包被间接标记模式
1、抗原包被:跟上述模式一共用试剂。
2、将hiv-i型融合抗原和hiv-ii型抗原分别标记生物素,抗原浓度用0.1mes(ph5.0)调整至1mg/ml;用dmso配制1mg/ml的生物素;然后在抗原中加入抗原体积1/100的生物素,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集抗原-生物素结合物,紫外分光光度计检测结合物浓度,hiv-i抗原结合物为0.5mg/ml,而hiv-ii抗原结合物浓度为0.38mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液将hiv-i型抗原和hiv-ii型抗原结合物分别按2.5k和5k倍稀释,作为发光免疫试剂的生物素试剂。
4、链霉亲和素标记吖啶酯:跟实施例1中的直接包被间接标记模式的链霉亲和素-吖啶酯试剂一样。
5、将上述试剂在全自动化学发光分析仪上分别检测上述样本,反应模式为100ul样本+50ul磁颗粒试剂+50ul生物素标记抗原试剂在37℃下反应16分钟,然后用pbs-t洗涤3次,之后加入100ul结合物试剂,反应6分钟,再次洗涤3次,之后分别加入预激发液(0.1mhno3)及激发液(0.25mnaoh)各100ul;记录信号值并比较结果。
表2两种试剂模式的灵敏度和hook效应比较
结论:直接包被间接标记二步法模式,可以将抗体检测灵敏度提高3-4个稀释梯度;但是由于样本中可能存在高浓度抗体,此模式会出现hook模式(高浓度抗体随着稀释倍数增加,检测数值反而增加),而直接包被直接标记不会出现hook模式。
实施例3hiv项目双抗原夹心法测抗体的直接包被间接标记模式下消除hook效应带来的漏检风险
正常反应模式下强阳样本的漏检风险如图4所示。
通过图4可以看出,强阳样本由于抗体浓度含量极高,分别跟磁珠包被的抗原和生物素标记抗原结合(还有一部分游离抗体)而不形成夹心,生物素抗原结合的抗体而后被洗去;再加入链霉亲和素标记吖啶酯时,无法结合到磁珠-抗体上而没有信号值,导致强阳样本漏检。
为防止强阳样本漏检,根据理论,可以在链霉亲和素-吖啶酯试剂中补充少量生物素标记的抗原。
试剂制备和检测跟实施例2中的直接包被间接标记模式类似,只是在配制sa-吖啶酯试剂时,补充一定比例的hiv-i-生物素和hiv-ii-生物素,比例为生物素试剂中抗原生物素的浓度比,生物素试剂中hiv-1抗原生物素浓度为0.5/2500mg/ml;hiv-ii抗原生物素浓度为0.38/5000mg/ml,那么生物素试剂的5%比例,即在sa-吖啶酯试剂中加入按0.05*0.5/2500mg/ml的hiv-i-生物素和0.05*0.38/5000mg/ml的hiv-ii-生物素;50%比例即在sa-吖啶酯试剂中加入0.5*0.5/2500mg/ml的hiv-i-生物素和0.5*0.38/5000mg/ml的hiv-ii-生物素。其余同实施例2。
反应模式:100ul样本+50ul磁珠+100ul生物素抗原-----反应16分钟,洗涤3次-----100ulsa-ae(添加各种比例生物素抗原),反应6分钟后洗涤---添加激发液和预激发液各100ul,读信号值,结果见表3。
表3在链霉亲和素-吖啶酯中加入不同比例生物素抗原的检测结果
结论:当向链霉亲和素-吖啶酯试剂中补充一定比例的生物素抗原时,过少(0.5%)则不能解决hook问题,过多(10%、20%、50%)则又会带来生物素跟链霉亲和素形成网络反应而沉淀,导致反应信号低甚至低浓度样本根本无信号的情况;而补充1.25%-5%的生物素抗原比例,既能消除hook效应,又因为生物素抗原和链霉亲和素-吖啶酯比例相差太大,不至于形成网格沉淀,对灵敏度提高和hook效应消除都有利。
实施例4确保强阳样本不漏检的测试方法
因为研发收集的hiv抗体阳性样本可能无法涵盖上市后可能面临的超高浓度阳性样本,为确保这种在sa-ae中添加少量生物素标记物的方法不会导致超高浓度阳性样本漏检,本发明提供了一种检测方法,有效地验证了此体系不会出现强阳样本漏检风险。此检测方法即在正常反应模式基础上去掉第一步中的生物素试剂,只将强阳样本与磁珠试剂反应,此模拟强阳样本在正常反应模式时由于各自与磁珠抗原和生物素抗原结合,不形成夹心,生物素抗原-抗体随后被洗掉,只剩磁珠抗原-抗体复合物;第二步反应加入链霉亲和素-吖啶酯试剂(含少量生物素抗原),此生物素抗原与链霉亲和素吖啶酯提前形成了复合物,再与磁珠抗原-抗体结合,形成磁珠抗原-抗体-生物素抗原-链霉亲和素吖啶酯复合物,在预激发液和激发液的作用下产生光信号,系统中强阳样本是否漏检的测试方法示意图见图5所示。
正常反应模式:100ul样本+50ul磁珠+100ul生物素抗原-----反应16分钟,洗涤3次-----100ulsa-ae(添加2.5%生物素抗原),反应6分钟后洗涤---添加激发液和预激发液各100ul,读信号值。
检测强阳样本是否漏检模式:100ul样本+50ul磁珠-----反应16分钟,洗涤3次-----100ulsa-ae(添加2.5%生物素抗原),反应6分钟后洗涤---添加激发液和预激发液各100ul,读信号值。
上述反应试剂均采用实施例3的试剂。
表4两种模式下测阳性样本
结论:从检测强阳样本是否漏检模式看,样本中的抗体与磁珠上包被的抗原结合,但由于没有单独的生物素试剂,而只是在sa-ae试剂中少量添加抗原生物素,校准品由于浓度较普通的阳性样本低,所以跟磁珠抗原和吖啶试剂中少量的抗原生物素形成夹心的信号值也很低;但正常阳性样本由于抗体浓度很高,所以即使不加生物素试剂组分,也可以跟磁珠抗原及sa-吖啶酯-抗原生物素形成夹心而进一步结合而产生较高的信号值。28例hiv抗体阳性血样正常模式下均为阳性,在此不添加生物素试剂组分的模式下,也全都检测为阳性,说明此模式可以确保阳性样本不会因为hook效应而造成漏检风险;由于产品上市后可能会面临一些抗体浓度超高的阳性样本,而正常的反应模式可能由于阳性样本浓度不那么高,达不到hook成阴性的上限,而无法得知该系统是否可能会漏检,该检测强阳样本是否漏检模式可以模拟超高浓度阳性样本在此系统下不会因hook而漏检。
实施例5双抗原夹心法测anti-hcv
1、将hcv融合抗原通过共价结合偶联羧基磁微粒,按100ug/mg磁珠的浓度进行偶联,然后进行封闭,并用20mmpb(ph6.5)+0.5%nacl+1%bsa+5%小牛血清+0.02%nan3稀释到0.1mg磁珠/ml的浓度,作为固相磁颗粒试剂。
2、将另一hcv融合抗原标记生物素,抗原浓度用0.1mes(ph5.0)调整至1mg/ml;用dmso配制1mg/ml的生物素;然后在抗原中加入抗原体积1/100的生物素,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集抗原-生物素结合物,紫外分光光度计检测hcv抗原结合物浓度,hcv抗原结合物为0.8mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液将此标记物按1:2k稀释,作为发光免疫试剂的生物素试剂。
3、将链霉亲和素标记吖啶酯:sa浓度用0.1m硼酸(ph8.5)+0.02%tw20缓冲液调整至1mg/ml,用dmso配制1mg/ml的吖啶酯;然后在抗原中加入抗原体积1/100的生物素,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集链霉亲和素-吖啶酯结合物,紫外分光光度计检测链霉亲和素-吖啶酯结合物浓度为0.45mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液,将sa-吖啶酯结合物稀释4000倍即sa-ae终浓度为0.45/4000mg/ml,将生物素标记的hcv抗原稀释成0.05*0.8/2000mg/ml的终浓度,即5%比例的上述步骤2的生物素试剂,作为发光免疫试剂的吖啶酯试剂。
两种检测模式同实施例4的两种检测模式,结果见下表5。
表5两种模式下测阳性样本
从实验结果可以看出,在链霉亲和素标记吖啶酯试剂中添加少量的生物素标记hcv抗原,可以确保强阳样本不漏检。
实施例6双抗体夹心法测乙型肝炎表面抗原(hbsag)
乙型肝炎病毒(hbv)感染人体后,乙型肝炎表面抗原(hbsag)是首个出现的感染标志物,其检测灵敏度是一个重要指标。随着市场对操作时间和灵敏度的要求,两步法间接标记提高灵敏度模式是一种很好的解决方案。但hbsag在一些感染人群中可以达到极高的浓度。据报道,献血员中所发现的hbsag携带者最低含量为0.2ng/ml,最高含量可达2000ug/ml,再加上有些突变株的产生,对突变株的灵敏度检测要求更高,需要达到0.02ng/ml才可能检出突变株。应用本发明的试剂和方法来检测hbsag,可以达到很好的效果。
1、将一株野生型抗-hbsag抗体和一株针对g145r突变株的抗-hbsag抗体通过共价结合偶联羧基磁微粒,按200ug/mg磁珠的浓度进行偶联,然后进行封闭,并用20mmpb(ph6.5)+0.5%nacl+1%bsa+5%小牛血清+0.02%nan3稀释到0.1mg磁珠/ml的浓度,作为固相磁颗粒试剂。
2、将另一株抗-hbsag多抗标记生物素,浓度用0.1mes(ph5.0)调整至1mg/ml;用dmso配制1mg/ml的生物素;然后在抗体中加入抗体体积1/100的生物素,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集抗体-生物素结合物,紫外分光光度计检测抗体-生物素结合物浓度,结合物为0.78mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液将此标记物按1:2k稀释,作为发光免疫试剂的生物素试剂。
3、将链霉亲和素标记吖啶酯:sa浓度用0.1m硼酸(ph8.5)+0.02%tw20缓冲液调整至1mg/ml,用dmso配制1mg/ml的吖啶酯;然后在链霉亲和素中加入链霉亲和素体积1/100的吖啶酯,混匀,避光反应半小时;之后装重力柱,并用0.01m硼酸(ph8.5)洗脱纯化,收集链霉亲和素-吖啶酯结合物,紫外分光光度计检测链霉亲和素-吖啶酯结合物浓度为0.45mg/ml;之后50mmmes(ph6.5)+1%nacl+1%bsa+0.5%casin+10%小牛血清+0.1%tw20+0.1%阻断剂(小鼠血清)+0.02%nan3作为稀释液,将sa-ae稀释4千倍即sa-ae终浓度为0.45/4000mg/ml,将hbsag多克隆抗体-生物素结合物稀释4万倍即hbsag-多抗-生物素终浓度为0.05*0.78/2000mg/ml,即5%比例的上述步骤2的生物素试剂,作为发光免疫试剂的吖啶酯试剂。
4、反应过程:用全自动化学发光仪上操作,100ul样本加入50ul固相磁颗粒试剂和50ul生物素试剂(测试强阳样本是否漏检模式下不加生物素试剂),反应16分钟后,洗涤三次,再加上100ul吖啶酯试剂,反应6分钟,洗涤三次后,加入100ul预激发液和100ul激发液,读取光信号值,hbsag两种模式下检测结果如表6所示。
表6两种模式下测阳性样本
如上表所示,采用正常模式检测,hbsag国家标准品和g145r突变株的灵敏度系列参考品均可达到国际先进的0.05ng/ml甚至更可达到更优的0.05ng/ml,50例阳性样本均测为阳性;采用不加生物素试剂组分的强阳样本是否漏检模式检测,50例阳性样本均可检测为阳性,说明调试的检测系统可以确保强阳样本不会因为hook效应而漏检。
因此,本发明提供了一种大幅度提高免疫诊断试剂灵敏度的化学发光试剂及试剂制备过程。该试剂包含抗原/抗体包被的磁珠试剂、抗原/抗体标记生物素试剂、链霉亲和素标记的吖啶酯试剂三种组分,反应步骤跟传统的免疫分析试剂一致,也为两步法,第一步磁珠试剂与样本及生物素试剂反应,常规洗涤三遍后加入链霉亲和素-吖啶酯试剂短时间反应即可达到最大反应信号;本发明的试剂盒灵敏度远高于磁珠直接包被、抗原抗体直接标记的同类试剂;本发明的试剂盒灵敏度也高于链霉亲和素磁珠-生物素抗原/抗体、抗原/抗体直接标记的试剂;一些项目中,样本中抗原抗体浓度含量极高,如anti-hiv抗体在样本中含量极高,双抗原夹心法测anti-hiv时,样本直接与磁珠试剂和生物素标记的抗原反应,可能会出现hook效应带来强阳样本的漏检风险,本发明通过在链霉亲和素-吖啶酯试剂中少量补充生物素标记的抗原,来防止强阳样本由于第一步反应中分别与磁微粒和亲和素试剂结合,形不成夹心而导致的漏检风险;但由于生物素标记抗原/抗体跟链霉亲和素标记的吖啶酯放在同一个试剂组分容易形成网格沉淀而不能再与之前的夹心物反应,所以sa-ae中补充的生物素抗原/抗体需要控制好比例,浓度较低,不会在同一个试剂组分中形成网格沉淀。由于研发过程中收集的强阳样本可能不能涵盖产品上市后可能遇到的强阳样本,本发明研发了一种可以确保强阳样本不漏检的测试方法,即将磁珠包被的抗原与阳性样本在第一步反应,不添加生物素标记抗原,反应洗涤后再加链霉亲和素-吖啶酯试剂(补充了少量生物素标记抗原)再次反应,测信号值。如果强阳样本测值呈阳性,说明强阳样本可以跟磁珠抗原和链霉亲和素中添加的生物素抗原及链霉亲和素-吖啶酯形成夹心,模拟了强阳样本在第一步反应中分别跟磁珠抗原和生物素抗原反应而没有形成夹心,洗涤后生物素抗原--抗体被洗涤了,剩下磁珠抗原--抗体,如果链霉亲和素-吖啶酯试剂中没有少量添加生物素抗原,则磁珠抗原--抗体无法跟链霉亲和素-吖啶酯反应从而漏检。
综上,本发明的高灵敏度化学发光免疫诊断试剂能够大幅度提高免疫诊断试剂灵敏度,提高检测准确性,设计巧妙,配制简便,成本低廉,适于大规模推广应用。
由此可见,本发明的目的已经完整并有效的予以实现。本发明的功能及结构原理已在实施例中予以展示和说明,在不背离所述原理下,实施方式可作任意修改。所以,本发明包括了基于权利要求精神及权利要求范围的所有变形实施方式。
- 还没有人留言评论。精彩留言会获得点赞!