一种缓解森林N2O排放的方法与流程
一种缓解森林n2o排放的方法
技术领域
[0001]
本发明涉及环境保护领域,特别是涉及一种缓解森林n2o排放的方法。
背景技术:
[0002]
氧化亚氮(n2o)是主要的温室气体之一,在100年的尺度上其全球变暖潜势持续通量比二氧化碳(co2)大270倍,并且n2o也是主要的臭氧层消耗物质之一。因此缓解n2o排放对缓解温室效应、保护全球环境具有重要意义。1992年至2015年,森林生态系统向大气排放的n2o速率为3.62
±
0.16t g n yr-1
。据估计,热带森林土壤净n2o排放到大气中的速率为4.76
±
0.81kg n2o ha-1
y-1
。
[0003]
森林土壤被认为是森林生态系统中n2o的主要来源。到目前为止,森林与大气之间的n2o排放仅基于计算土壤与大气之间的n2o交换量确定,然而植物本身已经被证明与土壤-植物系统的n2o排放有关(chen等,1999;m
ü
ller,2003)。植物能够将土壤产生的n2o输送到茎和叶,并将其排放到大气中,甚至能够在n同化过程中产生n2o。然而,树木作为n2o排放源的作用并没有引起足够的重视,有些研究者甚至认为其在森林生态系统n2o交换中发挥的作用可以忽略不计(lenhart等,2019)。因此,森林生态系统中树木n2o的排放应当引起重视。
[0004]
在林业生产过程中,过多的氮肥的施用导致土壤中活性氮的含量过剩,使得n2o和no的排放量增加,从而引发全球变暖和空气污染。一项原位研究证实了n的添加增加了樟树人工林土壤的n2o排放量(zheng等,2020)。目前多数国家已经制定了减少土壤n2o排放的战略。
[0005]
目前生物炭的主要原料是农林废弃物,关于动物产生生物炭对植物n2o排放的影响尚不清楚。香樟是一种具有重要经济价值的常绿阔叶树种,其叶片可用于提取香料和精油。密集的氮投入和采叶活动可能使樟树人工林土壤成为排放n2o的重点,但香樟植株的n2o排放尚未有相关研究。
技术实现要素:
[0006]
本发明的目的是提供一种缓解森林n2o排放的方法,以解决上述现有技术存在的问题,确定死猪源生物炭对香樟林植物n2o排放的影响及其微生物机制,提供其在缓解香樟林土壤和植株氧化亚氮排放中的应用。
[0007]
为实现上述目的,本发明提供了如下方案:
[0008]
本发明提供一种缓解森林n2o排放的方法,通过在土壤中添加动物源生物炭来缓解森林n2o排放。
[0009]
优选的,所述的森林为香樟林。
[0010]
优选的,所述的动物源生物炭为病死猪加工生物炭。
[0011]
优选的,所述动物源生物炭能够缓解森林n2o排放包括森林土壤n2o排放和植株n2o排放。
[0012]
优选的,所述生物炭能够降低土壤温度从而缓解土壤n2o排放。
[0013]
优选的,所述生物炭能够过影响土壤微生物功能基因表达量来缓解土壤n2o排放。
[0014]
优选的,所述的生物炭能够增加所述土壤微生物功能基因的表达量。
[0015]
优选的,所述的土壤微生物功能基因为nosz基因。
[0016]
本发明公开了以下技术效果:
[0017]
猪源生物炭通过增加nosz基因的丰度,降低了香樟的土壤n2o排放。通过方差分析,发现生物炭的添加能够显著降低低氮条件下香樟植株n2o的排放量,证明了以病死猪为原料制备的生物炭可被用于缓解森林生态系统中的氧化亚氮排放。为病死猪资源化、无害化利用以及氧化亚氮减排提供了新的思路。
附图说明
[0018]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0019]
图1为土壤aob(a)、nirs(b)、nosz(c)、aoa(d)和nirk(e)(均值+se)丰度对氮或生物炭添加处理的关系图,相同字母的平均值在α=0.05的事后多重比较中差异无显著性;d和e面板显示双因素方差分析结果;ns为无意义;**,p<0.01;***,p<0.001;****,p<0.0001;
[0020]
图2为土壤nh
4+-n(a)、no
3--
n(b)、ph(c)和微生物生物量碳(mbc)(d)(均值+se)对氮或生物炭添加处理的关系图,双因素方差分析结果显示在a中;相同字母的平均值在事后多重比较中无显著差异,且值为0.05;
[0021]
图3为氮素生物炭添加对土壤n2o排放速率的影响;
[0022]
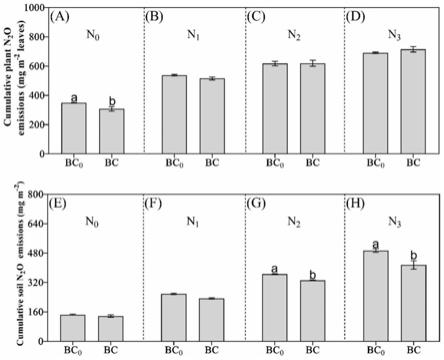
图4为不同氮水平下生物质炭添加对植株和土壤n2o累积排放量的影响,图中a、b、c、d为不同氮水平下生物质炭添加对植株n2o累积排放量的影响;e、f、g、h为不同氮水平下生物质炭添加对土壤n2o累积排放量的影响;
[0023]
图5为土壤温度动态图;
[0024]
图6为土壤湿度动态图。
具体实施方式
[0025]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
[0026]
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0027]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的
文献冲突时,以本说明书的内容为准。
[0028]
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本申请说明书和实施例仅是示例性的。
[0029]
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
[0030]
实施例1
[0031]
一、材料与方法
[0032]
1.1、盆栽实验设计
[0033]
本研究于2017年11月(采集种子)至2018年11月(收获幼苗)在中国江西江西农业大学(28
°
46
′
05”n,115
°
50
′
22”e)进行。2018年1月,香樟种子被播种。4月初种子发芽后,选择相同大小的香樟幼苗,将其移植到塑料花盆中,花盆中填入2公斤过2毫米筛的土。
[0034]
采用全因子随机设计,设计四种n处理水平(n0,1kg干土中施加0gn;n1,1kg干土中施加0.1gn;n2,1kg干土中施加0.2gn;n3,1kg干土中施加0.3gn)和两种猪生物炭水平(bc0,对照;bc,1%猪生物炭)。于2018年8月2日和9月1日分别喷施尿素(co(nh2)2)溶液以添加氮。所使用的生物炭来源于病死猪(中国浙江湖州工业和医疗废物处理中心),施用前过2毫米筛,与土壤充分混合后移栽育苗。土壤和生物炭的理化性质见表1。
[0035]
表1土壤和生物炭的物理和化学性质
[0036][0037]
n=4,均值+se,tn:总氮;ap:有效磷;tp:总磷。
[0038]
1、2土壤和植物n2o排放量的测定
[0039]
采用密闭不透明静室(直径
×
高度=17cm
×
81cm)测定土壤和树木n2o通量。取样箱为pvc管制成的圆柱体,在圆柱的顶部设一个小孔,在小孔处放置一个带橡胶塞的温度计。然后在圆柱的中间插入橡胶软管,软管外面由三通阀连接。在5次取样过程中,圆柱外表面用泡沫铝覆盖以减少温度变化。收集气体前,用注射器将蒸馏水注入环形槽进行密封。在测量植物n2o排放时,用塑料袋将土壤包裹起来。在第0、5、10和15分钟时用60毫升注射器收集土壤排放n2o气体。同样在第0、10、20和30分钟时用60毫升注射器来收集植物排放n2o气体。收集气体样品立即带回实验室进行相关测定。使用带电子捕获检测器(ecd)的气相色谱仪(agilent7890b,santa clara,ca,usa)测定取样后24小时内n2o的浓度。土壤氧化亚氮通量(f,μg
·
m-2
·
h-1
)计算公式如下(zhang等,2016;zhang等,2018):
[0040][0041]
式中,p为标准大气压(pa);v、s分别为圆柱形腔体的体积(m3)和内底表面积(m2);δc/δt表示线性回归基础上的n2o(ppb)浓度随时间的变化速率(deng等,2019);r代表通用气体常数;t为气体样品吸入时的绝对空气温度(k)。
[0042]
由于植物n2o的排放量大多来自于叶片,因此以叶片面积为基础计算樟树n2o的排放量。在实验期间利用手持激光叶面仪(cid,ci-203,美国)定期测量叶面积。植物的n2o排放量表示为μg
·
m-2
叶
·
h-1
。
[0043]
土壤和植物累计的n2o排放量计算公式如下:
[0044][0045]
式中e代表土壤累计n2o排放量(μg
·
m-2
)或植物累计n2o排放量(μg
·
m-2
叶);f代表土壤n2o排放速率(μg
·
m-2
·
h-1
)或植物n2o排放速率(μg
·
m-2
叶
·
h-1
);i表示第i次气体收集;t
i+1-t
i
表示两次收集气体间隔的时间;n为收集气体的总次数。施氮前采集两次样品,施氮后的8天内采集三次。采集气体样品时同时测定各盆栽中的土壤湿度和土壤温度。
[0046]
1.3土壤特性和微生物功能基因的测定
[0047]
2018年11月采集土壤样品,分析土壤理化参数和微生物功能基因。去除土壤中细根后过2毫米筛。土壤nh
4+-n和no
3--
n的含量分别采用靛酚蓝法和双波长紫外分光光度计(中国上海,mapada,uv6300)测定。采用玻璃电极(梅特勒-托莱多,中国上海)测定土壤ph值,体积比为1:2.5(土壤:水)。有效磷的测定采用0.5mol
·
l-1
nahco3萃取法和钼锑电阻比色法(li等,2017)。采用熏蒸提取法测定土壤微生物生物量碳(mbc)和微生物生物量氮(mbn)(jiang等,2017)。可溶性有机碳(doc)、可溶性有机氮(don)、微生物生物量碳(mbc)和微生物生物量氮(mbn)用0.5mol
·
l-1
k2so4提取并过滤。滤液采用multi n/c 3100toc总有机碳/总氮分析仪(jena,德国)(deng等,2019)测定。
[0048]
土壤中的功能基因(aoa,aob,nirs,nirk,nosz)通过dna提取和定量pcr(pcr)检测进行定量,详见(liu等,2017)。按照制造商(中国武汉天益汇亿元生物技术有限公司)的使用说明使用试剂盒提取土壤中全基因组dna。用含有每个目标基因的一个代表性克隆的质粒dna序列稀释,建立标准曲线。计算各基因在每克干土中的微生物功能基因拷贝数。
[0049]
1.4统计分析
[0050]
采用混合模型方差分析(anova)研究了植物n2o排放速率、叶面积、土壤n2o排放速率、土壤温度、土壤水分与氮和生物炭处理的关联性,并以时间为随机效应。使用双向anova来研究累积土壤和植物氧化亚氮排放、微生物功能基因和土壤理化参数与氮、生物炭及其相互作用的关联性。使用事后检验(tukey
’
s hsd)来检验具有显著结果的方法之间的差异,使用jmp9.0(cary nc usa)进行数据分析。
[0051]
二、结果分析
[0052]
2.1、土壤微生物中aoa,aob,nirs,nirk和nosz基因的表达
[0053]
生物炭添加显著改变了aob,nosz和nirs的表达量(图1a,b,c)。相比于对照组,添加生物炭后aob和nosz的表达量更高,但nirs在生物炭添加后的表达量降低(图1a,b,c)。aoa基因丰度随着n的增加而增加,但随着生物炭的添加而减少(图1d)。氮和生物炭对土壤中nirk丰度的影响很大(图1e)。n3bc处理的nirk基因数量高于其他处理(图1e)。氮添加对aoa、aob、nirs和nirk均有显著影响,生物炭添加对各微生物功能基因均有显著影响(表2)。
[0054]
表2土壤微生物功能基因(aoa、aob、nirk、nirs和nosz)和土壤累计n2o排放随n和生物炭添加的变化及其在双向anovas中的变化
[0055][0056]
f和p值由*表示;aoa为氨氧化古生菌amoa基因(ammonia-oxidizing archaea amoa gene);aob为氨氧化细菌amoa基因(ammonia-oxidizing bacteria amoa gene);p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001。
[0057]
2.2土壤特性与氮和生物炭的添加有关
[0058]
与对照相比,n处理尤其是n3处理增加了nh
4+-n,但生物炭降低了nh
4+-n浓度(图2a)。氮的添加对nh
4+-n浓度有显著影响(表3)。生物炭添加升高了土壤ph和mbc,但降低了no
3--
n浓度(图2b、c、d)。生物炭添加对ap浓度有显著影响,n添加对don、mbn、doc和mbc浓度有显著影响(表3)。
[0059]
表3土壤理化特性与氮、生物炭的关联性及其在双向anovas中的相互作用
[0060][0061]
星号表示f和p值。ap,可用磷;doc,溶解有机碳;don,溶解有机氮;mbc,微生物生物量碳;mbn,微生物生物量氮。*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001。
[0062]
2.3氧化亚氮排放速率、土壤温度和湿度
[0063]
生物炭的添加降低了土壤n2o的排放速率(图3),土壤温度和水分均受生物炭添加量的影响,而土壤水分及温度受生物炭及其与n相互作用的影响(表4;图5和图6)。土壤温度与植物和土壤n2o排放显著相关(表5)。
[0064]
表4叶面积、土壤n2o排放速率、土壤温度和土壤水分对氮和生物炭的关联性
[0065][0066]
相互作用为固定效应,研究时间为随机效应。用星号表示f和p值。.*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001。
[0067]
表5土壤温度、土壤水分、叶面积、土壤n2o排放速率与植物n2o排放速率呈两两相关关系
[0068][0069][0070]
*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001。
[0071]
不同n处理条件下生物质碳添加对植株和土壤n2o累积排放量的影响如图6所示,方差分析结果如表6-表9所示。可见在n0和n1水平下植株n2o累积排放量与生物炭的添加与否显著相关,生物炭的添加能够显著降低低氮条件(n0、n1)下植株n2o的排放量。
[0072]
表6 n0水平下生物质炭添加对植株和土壤n2o累积排放量的影响方差分析。
[0073][0074]
表7 n1水平下生物质炭添加对植株和土壤n2o累积排放量的影响方差分析。
[0075][0076]
表8 n2水平下生物质炭添加对植株和土壤n2o累积排放量的影响方差分析。
[0077]
[0078]
表9 n3水平下生物质炭添加对植株和土壤n2o累积排放量的影响方差分析。
[0079][0080][0081]
三、讨论
[0082]
3.1生物炭和氮添加对植物和土壤n2o排放的影响
[0083]
生物炭的添加能够显著降低土壤n2o累积排放量和低氮条件下植物n2o累积排放量(图4)。尽管这里没有研究,但
15
n同位素标记研究表明,小麦叶片释放的n2o来源于小麦植株吸收的no
3-,而不是根际微生物(smart and bloom,2001),因此香樟幼苗产生n2o是可能的。植物的n2o排放已在农业、湿地和森林植物中被报道(pihlatie等,2005)。土壤中产生的氧化亚氮也可以通过植物的蒸腾流输送到大气中(pihlatie等,2005)。在本研究中,生物炭减少了土壤n2o的排放以及低氮条件下叶片n2o的排放。土壤中产生的n2o和植物排放的n2o是香樟幼苗n2o排放的重要来源。氮的添加可以增加植物n2o的排放,因为它提供了更多的可供植物利用的氮基质,增加了植物根和叶对no
3-和no
2-的同化,这将直接导致植物n2o的排放增加(smart和bloom,2001;pihlatie等,2005)。低氮条件下的植株n2o累积排放量随着生物炭的添加降低,而添加生物炭显著降低了土壤n2o排放,表明动物源生物炭可以用于缓解香樟林氧化亚氮排放量。
[0084]
3.2微生物机制导致生物炭和氮对n2o排放的影响
[0085]
生物炭通常是碱性的,具有碳封存潜力(woolf等,2016)。添加生物炭可以提高土壤ph值和mbc(图2)。土壤ph值的提高能够促进反硝化过程和n2的形成来提高反硝化细菌的n2o还原酶活性(simek和cooper,2002)。事实上生物炭的添加显著提高了香樟土壤中nosz、aob和nirk的丰度(表2;图1)和累积的土壤n2o排放(图4)。已有研究表明,生物炭通过增加nosz丰度降低了土壤n2o的排放(xu等,2014),说明生物炭促进了n2o转化为n2的过程(cayuela等,2013)。
[0086]
然而,aob丰度的增加表明硝化速率提高,这可能是由于生物炭的碱性作用,因为硝化是酸化过程(bolan等,1991),添加生物炭可以创造良好的环境(prommer等,2014;ulyett等,2014)。而生物炭处理中nirk丰度的增加可能是由于nirs编码的亚硝酸盐还原酶不是本研究中反硝化的主要限制因素(xu等,2014)。
[0087]
n处理的aoa和nirk基因丰度均显著增加(图1),这与aoa通常在低nh
4+
时增加,而aob在高nh
4+
时增加的观点不一致(martens-habbena等,2009)。其他研究也发现,在所有nh
4+
浓度下aoa均增加,而aob仅在最高浓度下显著增加(v erhamme等,2011)。因此,aoa丰度可能同时随氮态和其他环境因素而变化。
[0088]
总的来说,本研究考察了病死猪制备的生物炭和氮添加对香樟种植中土壤和植物n2o排放的影响以及其微生物机制。这些结果将有利于在集中施肥管理的非木材人工林中利用动物源生物炭减轻植物和土壤的氧化亚氮排放。在未来对香樟人工林和其他森林生态系统的管理中,应同时考虑植物和土壤n2o的缓解。
[0089]
生物炭通过增加nosz基因的丰度,降低了香樟的土壤n2o排放。低氮条件下的植株n2o排放同样随生物炭的添加降低。作为大气氧化亚氮的重要来源,植物氧化亚氮的排放应引起重视。动物尸体制备的生物炭可被用于缓解森林生态系统中的氧化亚氮排放。今后应进一步研究氮和生物炭对植物n2o排放的影响机制。
[0090]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1