用于检测尼卡巴嗪的时间分辨荧光免疫层析方法和应用与流程
[0001]
本发明属于兽药残留检测技术领域,具体涉及到一种用于检测尼卡巴嗪的时间分辨荧光免疫层析方法和应用。
背景技术:
[0002]
鸡肉是我国除猪肉之外的第二大肉类产品,而球虫病是禽类养殖业常见且危害严重的一种寄生虫病。尼卡巴嗪(nicarbazin,nic)是一种良好的预防鸡球虫病的药物,广泛用于鸡和火鸡球虫病的防治,是由4,4
’-
二硝基苯脲(4,4-dinitrocarbanilide,dnc)和2-羟基-4,6-二甲基嘧啶(2-hydroxyl4,6-dimethylpyrimidine,hdp)组成的等分子复合物,其中,dnc为残留标志物。虽然其毒性较低,但也发现存在一定的毒性。目前,关于nic生理毒性的研究显示,当长期摄入正常剂量的80倍后,雄鼠精子畸变率明显增加。nic对产蛋母鸡的繁殖性能也有一定的影响,所以临床上禁止将尼卡巴嗪用于产蛋鸡。长期食用尼卡巴嗪残留超标的鸡肉,会对人体健康存在潜在的风险。近年来,我国农业部兽药残留监控检测数据表明,在所有必检药物中nic是唯一超标的抗球虫药,且其被检测到的阳性率逐年有上升趋势,因此对鸡肉及其它禽类副产品中nic残留检测十分有必要。
[0003]
目前针对nic残留检测的方法主要有仪器分析方法和免疫分析检测方法,仪器分析方法结果准确,具有高度选择性和快速高效等优点,但是仪器方法也有设备昂贵、耗时长,不适于基层现场监控及大规模快速筛查等不足。免疫分析方法是除仪器方法外最常见的检测方法,是以抗原、抗体特异性结合为基本特征的快速检测分析技术,因其特异性强、时间短、灵敏度高、成本低、通量高等特点可应用于饲料生产、养殖、畜禽产品流通及销售等各个环节,目前普遍应用于动物性食品中药物残留快速检测中。如受到国际广泛关注的β-兴奋剂类、磺胺类、氯霉素、氨基糖苷类、喹诺酮类等药物都已建立了免疫分析快速检测方法。然而,迄今为止,国内外采用免疫分析方法对nic在动物性食品中的残留分析方法报导很少,难以满足实际样本筛查nic的检测需求。
[0004]
目前,检测nic残留的主要免疫方法主要包括酶联免疫分析方法(elisa)、免疫测流层析方法、表面等离子体共振(spr)等。其中基于elisa检测方法的文献报道居多,elisa方法为固相的免疫分析方法,检测过程中需要多次分离和洗涤步骤,耗时较长,整个反应步骤需1.5h,甚至长达2h方可完成。
[0005]
因此,建立一种快速、灵敏、简便的nic残留检测方法,势在必行。对于我国实现nic在动物性食品中残留快速筛选检测以及在畜禽生产中的规范使用具有重要意义。
[0006]
时间分辨荧光免疫层析技术(trfia)是在传统的胶体金免疫层析技术上发展起来的,与传统荧光素标记相比,它使用的是具有独特荧光特征的镧系元素及其螯合物,具有灵敏度高、特异性好,无放射元素污染等优点。因此,建立检测nic残留的trfia方法,具有重要意义。
技术实现要素:
[0007]
本发明针对上述现有检测nic免疫技术操作复杂、耗时长等缺点,建立一种用于检测尼卡巴嗪的时间分辨荧光免疫层析方法,该方法操作简单、效率高、短时间即可完成检测,且准确度和精确度良好,可用于尼卡巴嗪的残留检测。
[0008]
基于上述目的,本发明提供一种用于检测尼卡巴嗪的时间分辨荧光免疫层析方法,步骤如下:
[0009]
(1)制备时间分辨荧光微球偶联抗体探针:采用表面有羧基修饰的铕-荧光纳米微球通过活泼酯法活化微球表面羧基,与尼卡巴嗪单克隆抗体表面的氨基反应形成共价结合的eu-纳米微球探针;
[0010]
(2)制备时间分辨免疫层析试纸条:将尼卡巴嗪抗原dnc-4-bsa和羊抗鸡igg用划膜仪依次喷涂nc膜上的检测线t线和质控线c线位置,间距依次是3mm,将划好的nc膜烘干,与样品垫、吸水垫依次粘在pvc底板上;样品垫和吸水垫在两端各压住nc膜2mm;切成宽度为4mm的试纸条,安装在塑料卡壳里组装成检测卡;
[0011]
(3)检测:在微孔中加入样品,再加入步骤1制备的eu-纳米微球探针,吹打混匀,室温孵育;吸取微孔中混合溶液,加入检测卡的点样孔,层析后,进行结果判定。
[0012]
所述结果判定包括,
[0013]
定性判定法:在紫外仪下观察,若t和c线均有颜色,则是不含有nic的阴性样本;若c线没颜色、t线有颜色,则是含有nic的阳性样本;
[0014]
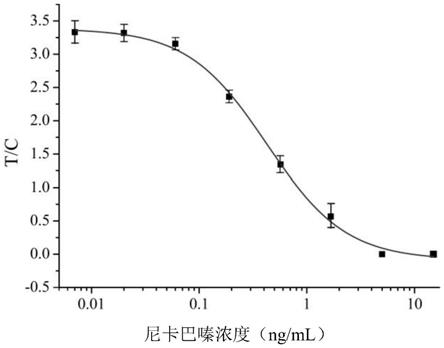
定量判定法:使用时间分辨免疫定量分析仪测定t和c线下的荧光强度,t/c为纵坐标,以添加nic标准品浓度为横坐标建立标准曲线,进行定量检测。
[0015]
所述步骤(1)制备时间分辨荧光微球偶联抗体探针具体方法是:采用一步偶联法,即将铕-荧光纳米微球用活化缓冲液清洗后,加入edc和nhs活化,活化后再加入尼卡巴嗪单克隆抗体进行偶联,封闭离心后复溶即得eu-纳米微球探针。所述铕-荧光纳米微球和尼卡巴嗪单克隆抗体的用量比为5:2
[0016]
所述标准曲线的建立:按0、0.07、0.19、0.56、1.67、1.37、5、15ng/ml的标准品梯度,建立标准曲线,每个梯度重复3次,取其平均值,以添加浓度为横坐标,以t/c荧光比值为纵坐标,拟合标准曲线,计算ic
50
值并确定线性范围,具体步骤:
[0017]
(1)吸取0.4μleu-纳米微球探针溶于120μl不同浓度的尼卡巴嗪标准品溶液中,反复吹打至微孔中白色固体全部溶解;
[0018]
(2)室温孵育1min;
[0019]
(3)吸取100μl微孔中液体,加到试纸条底端样品垫上,准确反应8min;
[0020]
(4)将试纸条插入时间分辨免疫荧光分析仪读数,计算样品中nic药物含量,建立标准曲线。
[0021]
本发明建立的标准曲线nic的ic
50
为0.43ng/ml,lod为0.07ng/ml,检测范围为0.13-1.37ng/ml。
[0022]
所述样品为鸡肉经过前处理后的溶液;所述鸡肉前处理方法:称取2.00
±
0.05g匀浆的鸡肉样品于10ml离心管中,加入2ml乙腈,涡动10min,8000rpm离心10min,取上清用硼酸盐缓冲液稀释5倍。
[0023]
所述用于检测尼卡巴嗪的时间分辨荧光免疫层析方法,所用尼卡巴嗪单克隆抗体
稀释10倍为工作浓度,所用尼卡巴嗪抗原dnc-4-bsa稀释2倍为工作浓度。
[0024]
本发明还提供所述的用于检测尼卡巴嗪的时间分辨荧光免疫层析方法在鸡肉尼卡巴嗪含量检测中的应用或在制备检测尼卡巴嗪的时间分辨荧光免疫试剂卡中的应用。
[0025]
本发明还提供一种尼卡巴嗪时间分辨荧光免疫检测试剂卡,包括底板和放置在其上的样品垫、硝酸纤维素膜和吸水垫,所述硝酸纤维素膜提前用尼卡巴嗪抗原dnc-4-bsa和羊抗鸡igg划好。所述划膜方法是:将尼卡巴嗪抗原dnc-4-bsa和羊抗鸡igg用划膜仪以0.7μl/cm的喷速依次喷涂nc膜上的检测线t线和质控线c线位置,间距依次是3mm,将划好的nc膜,放置在37℃烘箱中过夜。
[0026]
目前关于尼卡巴嗪残留免疫层析方法的报道较少,在2004年,hargen采用新型一步干化学法,建立了肝脏和鸡蛋中尼卡巴嗪残留trfia方法;但该方法基质效应较大,鸡蛋样本稀释100倍,肝脏样本稀释200倍,检测时间需要18min。2018年wu等建立了尼卡巴嗪残留胶体金免疫层析,检测样本为牛奶,稀释10倍即可消除基质效应,样本中检测限为8.6ng/ml,cutoff值为100ng/ml。与之相比,本发明建立的trfia方法,更简便,更灵敏。
[0027]
总之,本发明所建立的用于检测尼卡巴嗪的时间分辨荧光免疫层析方法与上述现有方法相比,具有如下有益效果:
[0028]
(1)本发明以eu-荧光纳米粒子为示踪物标记抗体,建立了尼卡巴嗪检测的trfia方法。经过一系列条件优化,建立了尼卡巴嗪标准曲线,方法的ic50为0.4ng/ml,线性检测范围为0.13-1.37ng/ml,且与其他抗球虫药无明显交叉,特异性好。
[0029]
(2)将本发明方法应用于鸡肉中尼卡巴嗪的检测,lod为1.4μg/kg,回收率为77.3%~92.7%,变异系数小于7.0%,说明本发明方法的准确度和精确度良好,可用于尼卡巴嗪的残留检测。
[0030]
(3)本发明建立的trfia方法,更简便,更灵敏。检测时间9min,灵敏度及精密度达到检测的要求,可用于尼卡巴嗪的残留检测。
附图说明
[0031]
图1为本发明尼卡巴嗪时间分辨荧光免疫检测试剂卡结构示意图及本发明尼卡巴嗪trfia层析过程;(a)阴性结果;(b)阳性结果。
[0032]
图2为本发明实施例2 trfia测定缓冲液中nic标准曲线层析结果图。
[0033]
图3为本发明实施例2 trfia测定缓冲液中nic标准曲线。
[0034]
图4为实施例2用于鸡肉检测的基质曲线。
具体实施方式
[0035]
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。下述实施例中所使用的实验方法如无特殊说明,均为常规方法;所用到的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
[0036]
实施例一、本发明用于检测尼卡巴嗪的时间分辨免疫分析方法的建立
[0037]
1.材料
[0038]
尼卡巴嗪、山羊抗鸡igg多克隆抗体、鸡igy、proclin 300、铕-荧光纳米微球(粒径210nm)、牛血清白蛋白(bsa,99.9%)、硝酸纤维素膜、pvc底板、吸水垫等均为商业购买获
得。
[0039]
dnc半抗原、dnc抗原和尼卡巴嗪单克隆抗体来自中国农业大学馈赠;该dnc半抗原(本发明中用dnc-4表示)、dnc抗原(本发明中用dnc-4-bsa表示)和尼卡巴嗪单克隆抗体(本发明中用nic特异性抗体3b4表示)记载在专利号zl201910536490.x,名称为4,4
’-
二硝基苯脲半抗原和人工抗原及其制备方法与应用的发明专利中。
[0040]
所述dnc半抗原dnc-4即4,4
’-
二硝基苯脲半抗原,结构式如下式(i)所示:
[0041][0042]
所述dnc抗原(dnc-4-bsa)为4,4
’-
二硝基苯脲半抗原与牛血清白蛋白偶联得到。所述尼卡巴嗪单克隆抗体通过dnc-bsa人工抗原免疫实验动物(小鼠)采用杂交瘤技术来制备。所用方法为本领域通用方法。
[0043]
溶液系统:
[0044]
(1)包被缓冲液
[0045][0046]
(2)活化缓冲液:0.05mol/l,ph 6.0 mes缓冲液
[0047]
吗啉乙磺酸0.975g去离子水定容至100ml
[0048]
(3)偶联缓冲液:0.04mol/l,ph 8.0硼酸硼砂缓冲液(bb)
[0049]
na2b4o70.457gh3bo30.692g去离子水定容至400ml
[0050]
(4)封闭缓冲液:20%bsa
[0051]
bsa10g去离子水定容至50ml
[0052]
(5)复溶液:
[0053][0054][0055]
(6)二抗稀释液:
[0056]
bsa1gprolin 30020μl0.01m pbs(ph7.4)定容至100ml
[0057]
2试验方法
[0058]
2.1时间分辨荧光微球偶联抗体探针的制备
[0059]
采用表面有羧基修饰的eu-时间分辨纳米微球(粒径210nm),通过活泼酯法活化微球表面羧基,与抗体表面的氨基反应形成共价结合的eu-纳米微球探针。具体步骤如下:
[0060]
(1)清洗微球:取20μl微球到1.5mlep管,加入180μl活化缓冲液,涡旋仪震动5s,离心机20000g,离心15min,弃上清。
[0061]
(2)活化:加入160μl活化缓冲液,使用超声仪超声2min,加入edc和nhs各20μl,水平摇床上室温活化15min;之后20000g离心15min,弃上清。
[0062]
(3)再次清洗微球:加入200μl偶联缓冲液(1x)复溶微球,使用超声仪超声2min,分装4个ep管中,每个50μl,离心机20000g,离心15min,弃上清。
[0063]
(4)偶联:加入200μl偶联缓冲液复溶微球,使用超声仪超声2min,分装4个ep管中,每个50μl,离心机20000g,离心15min,弃上清。加入25μl偶联缓冲液复溶微球,超声仪超声2min,离心5s,将复溶后的微球加到25μl稀释好的抗体里(2μg)吹打混匀,室温,水平摇床2h。离心机15000g,离心15min,弃上清。
[0064]
(5)封闭:使用100μl封闭缓冲液复溶微球,超声仪超声2min,掌上离心机离心2s,室温,水平摇床2h(或4℃,过夜封闭);15000g离心15min,弃上清。
[0065]
(6)复溶:加入50μl复溶缓冲液复溶微球,超声仪超声2min,离心机15000g,离心15min,弃上清;再次使用50μl复溶缓冲液复溶微球,超声仪超声2min,掌上离心机离心2s,4℃保存。
[0066]
2.2 nic时间分辨免疫分析方法的建立
[0067]
2.2.1时间分辨免疫层析试纸条的制备
[0068]
将dnc-4-bsa(1.5mg/ml)和羊抗鸡igg(0.2mg/ml)用划膜仪以0.7μl/cm的喷速依次喷涂nc膜上的检测线(t线)和质控线(c)线位置,间距依次是3mm,将划好的nc膜,放置在37℃烘箱中过夜。将烘干的nc膜,样品垫和吸水垫依次粘在pvc底板上。样品垫和吸水垫在两端各压住nc膜2mm。层析试纸条结构如图1所示。将处理好的大板用切条机切成宽度为4.0mm的试纸条,安装在塑料卡壳里组装成检测卡,再置于干燥封闭的铝箔袋里,备用。
[0069]
2.2.2时间分辨免疫层析试纸条的检测步骤
[0070]
在微孔中加入待检样本,用移液枪向样品中加入一定量的eu-纳米微球探针,吹打混匀,室温孵育后取混合溶液,加入检测卡的点样孔,层析,进行结果判定。
[0071]
定性判定法:在紫外仪下观察。若t和c线均有颜色,则是不含有nic的阴性样本;若c线没颜色、t线有颜色,则是含有nic的阳性样本,具体过程如图1所示。
[0072]
定量判定法:使用时间分辨免疫定量分析仪测定t和c线下的荧光强度,t/c为纵坐标,以添加nic标准品浓度为横坐标建立标准曲线,达到定量检测的目的。
[0073]
2.3 nic时间分辨免疫分析方法的优化
[0074]
利用对照和加标缓冲液的荧光强度以及抑制率选择最佳参数。抑制率通过以下公式计算:抑制率=(1-t/t0)
×
100%(t0和t分别为对照和加标缓冲液的荧光强度),加标缓冲液中nic的浓度为5ng/ml,抑制率越高越灵敏。
[0075]
2.3.1时间分辨荧光微球用量的选择
[0076]
分别取2.5、5、10和20μl的时间分辨荧光微球,偶联方法同前述。根据试纸条在紫外仪下的显色和抑制情况来选择最佳的时间分辨荧光微球的用量。
[0077]
时间分辨荧光微球的量从2.5μl到20μl逐渐增加时,t线的荧光强度也逐渐增加,当微球量增加至20μl时,荧光强度变低。使用20μl微球偶联抗体时,微球处于过量状态,荧光强度不仅低于10μl的微球偶联效果,而且层析不完全,背景值升高,且t线界限不明显。当选择10μl的微球偶联抗体时,荧光强度明显偏高,抑制效果也明显下降。当选择5μl的微球偶联抗体时,荧光强度和抑制率都高于2.5μl的微球偶联效果,所以选择使用5μl的微球进行后续的偶联。
[0078]
2.3.2edc/nhs用量的选择
[0079]
将edc和nhs配成1.0mg/ml的混合溶液,分别加入2.5、5、10和20μl活化eu-纳米微球,其余标记步骤同前述,与抗体偶联后,分别使用0和5ng/ml浓度的nic标准品进行检测,紫外灯下观察试纸条t线和c线荧光强度及抗体探针释放情况,测量荧光值并计算抑制率。
[0080]
edc和nhs主要是通过活化微球上的羧基,将其和抗体的氨基进行偶联,可以直接影响抗体和时间分辨荧光微球的偶联效率。结果表明加入20μl活化剂时,层析不完全。当edc的量过多时,则会使体系的抗体发生自偶联,造成聚集现象。加入10μl活化剂,虽然t线荧光强度提升了,偶联效率增加了,但是抑制率有所下降。加入2.5μl活化剂时抑制率显然更好一些,故选择加入edc/nhs的最佳用量为2.5μl。
[0081]
2.3.3抗体和抗原的正交试验
[0082]
将抗体分别稀释5、10、20和40倍按照前述方法和微球进行偶联制备探针。根据试纸条的显色强度和抑制率来进行筛选。然后将dnc-4-bsa分别稀释2、4、8和16倍后,分别用
划膜仪喷在nc膜上制备试纸条,再根据显色强度和抑制率选择最佳抗原包被浓度。
[0083]
结果如下表1和2所示,随着抗体和包被原的稀释倍数逐渐升高,t线的荧光强度逐渐下降,抑制率也逐渐升高。但是当抗体稀释倍数低于10倍,抗原稀释倍数小于2倍时,荧光强度大幅度下降。综合显色强度和抑制率两方面,选择抗体稀释10倍,抗原稀释2倍时为最佳条件。
[0084]
表1抗体的量对trfia的影响
[0085][0086]
表2抗原的量对trfia的影响
[0087][0088]
2.3.4探针用量的选择
[0089]
荧光探针用量分别取0.8μl、0.6μl、0.4μl和0.2μl,根据试纸条的显色强度和抑制率来进行筛选。
[0090]
结果表明随着eu-纳米微球探针用量的减少,t线荧光强度也逐渐降低,抑制率也逐渐上升,当eu-纳米微球探针的量小于0.6μl时,出现消线。将荧光强度控制在12000左右。所以最终选择每个样本加入0.4μleu-纳米微球探针进行后续试验。
[0091]
2.3.5包被液的选择
[0092]
将包被抗原dnc-4-bsa分别用0.02mpb(ph7.4)、cb(ph9.6)和0.02mpbs(ph7.4)按确定的最佳抗原包被浓度稀释,喷膜,检测荧光强度并计算抑制率,确定最佳包被液。
[0093]
结果表明用pbs包被荧光强度最差,包被液pbs和cb的荧光强度相差不大,但是pb作为包被液时,抑制率最佳,选择pb做最佳包被液。
[0094]
2.3.6 nc膜的选择
[0095]
选择常用的4中nc膜(sartorius 95、millipore 135、mdi 90和vivid 170),分别划膜组装试纸条,观察荧光强度和微球释放情况,并计算抑制率,确定最佳nc膜型号。nc膜主要通过膜孔隙和蛋白结合力影响试验的灵敏度。结果表明除millipore 135膜抑制最差,其他三种膜抑制率相差无异。但mdi 90膜荧光强度最低,v膜次之,sartorius 95膜荧光强度最好。因此选择sartorius 95膜。
[0096]
2.3.7样品垫材质的选择
[0097]
选择sb08、滤血膜和rb65三种材质,分别用上述确定的最佳样品垫处理液处理后,干燥组装试纸条,观察荧光强度和微球释放情况,并计算抑制率,确定最佳样品垫材质。样品垫主要通过层析速度和释放效果影响免疫层析结果。结果表明,滤血膜做样品垫时,样品垫整体偏红,释放不完全且层析速度很慢,导致荧光强度非常低。rb65释放效果次之,样品垫仍然发红,释放不完全;sb08最佳,释放效果最好,且荧光强度和抑制相比之下都最好。所以选择sb08作为样品垫。
[0098]
2.3.8探针复溶液的选择
[0099]
将复溶液的常用成分0.02 mpb(ph7.4)、0.05 mbb(ph8.0)、0.05m tris-hcl(ph9.0)、表面活性剂(tween-20、tritonx-100、pvp)、蔗糖、海藻糖和bsa等按不同成分组成3组配方,分别复溶微球探针,测试检测线的显色强度及灵敏度,确定最佳复溶液。结果表明,1#复溶液荧光强度最强,2#和3#复溶液荧光强度相当,但2#抑制率高,故选择2#复溶液为最佳复溶液。
[0100]
2.3.9样本稀释液的选择
[0101]
分别用0.01m pbs、样1和样2稀释nic标准品,检测不同稀释液对试纸条显色和灵敏度的影响,确定最佳稀释液组分。结果表明pbs会影响eu-纳米微球探针的释放,背景值偏高。
[0102]
2.3.10孵育时间
[0103]
将样本溶液和荧光探针加入微孔中混匀后,分别孵育0、1、2、3、4和5min后再进行免疫层析检测,根据抑制情况来确定最佳的孵育时间。在免疫层析上样前,标准品和eu-纳米微球探针进行充分反应,可以使得抑制更加充分,提高方法的灵敏度。研究结果表明,孵育时间对荧光强度和抑制情况无较大影响,最佳选择孵育1min。
[0104]
2.3.11显色时间
[0105]
加样后,从第2min开始,每隔1min测定一下试纸条的荧光比值(t/c),确定试纸条反应平衡所需时间作为试纸条的最佳反应时间。
[0106]
免疫层析时间对于方法的结果影响很大,当免疫层析时间较短时,溶液中的探针不足以和t线和c线充分反应,导致显色强度低;当反应时间过长时,溶液中的探针和t和c线充分接触,导致显色过深,反而影响抑制情况,进而降低方法的灵敏度。在本试验中,结果显示荧光强度随着时间增加逐渐加深,前8min抑制情况比较稳定,9min开始抑制情况逐渐下降。选择8min为层析时间,此时荧光强度比较高,且灵敏度好。
[0107]
实施例二、本发明用于检测尼卡巴嗪的时间分辨免疫分析方法性能的评价
[0108]
1缓冲液中标准曲线的建立
[0109]
采用上述优化好的条件,按0、0.07、0.19、0.56、1.67、1.37、5、15ng/ml的标准品梯度,建立标准曲线,每个梯度重复3次,取其平均值,以添加浓度为横坐标,以t/c荧光比值为纵坐标,拟合标准曲线,计算ic
50
值并确定线性范围。
[0110]
最终确定trfia的检测步骤如下:
[0111]
(1)吸取0.4μl eu-纳米微球标记抗体溶于120μl不同浓度的标准品溶液中,反复吹打至微孔中白色固体全部溶解;
[0112]
(2)室温孵育1min;
[0113]
(3)吸取100μl微孔中液体,加到试纸条底端样品垫上,准确反应8min;
[0114]
(4)将试纸条插入时间分辨免疫荧光分析仪读数,计算样品中nic药物含量,建立标准曲线。
[0115]
层析后通过肉眼观察如图2,cut-off值为5ng/ml。如图3显示方法对于nic的ic
50
为0.43ng/ml,lod为0.07ng/ml,检测范围分别为0.13-1.37ng/ml。
[0116]
2特异性
[0117]
在最终优化好的缓冲液体系中梯度添加nic及其结构类似物标准品,用试纸条检测,绘制标准曲线,测定ic
50
值并计算交叉反应率。结果见表3。方法与其他药物的交叉反应率分别小于0.1%,与其他结构类似物均无交叉反应。
[0118]
表3本发明trfia交叉反应率测定结果
[0119]
[0120][0121]
3鸡肉样本中的检测
[0122]
3.1样本前处理
[0123]
方法一:称取2.00
±
0.05g匀浆的鸡肉样品于50ml离心管内,加入8ml乙腈,迅速涡旋5min进行提取,超声10min,然后5000rpm离心10min。取上清液4ml于40-50℃条件下氮气吹干。残留物中加正己烷1ml,加75%的甲醇水溶液1ml,充分涡旋混合,然后2000rpm离心10min,取下层含基质溶液用缓冲液稀释不同倍数5倍,并采用建立的trfia方法进行检测,测定后与缓冲溶液中建立的标准曲线进行对比。
[0124]
方法二:称取2.00
±
0.05g匀浆的鸡肉样品于10ml离心管中,加入2ml乙腈,涡动10min,8000rpm离心10min,取上清用bb缓冲液稀释5倍用于trfia检测。
[0125]
在空白鸡肉样本中添加nic浓度分别为1.5、4、10μg/kg和6、16、30μg/kg,每个样本分别重复测定5次,计算方法的添加回收率、批内变异和批间变异。
[0126]
首先选用了常用于处理鸡肉样本的几种有机试剂,对样本处理进行了初步的摸索。样本处理后,统一对基质进行5倍稀释,进行检测读数。表4结果表明除乙腈外,其他有机溶剂对样本进行处理后,荧光强度锐减。初步选取乙腈进行后续的处理,单用乙腈处理后的基质稀释5倍仍存在一定的基质效应,所以后续用乙腈进行了两种前处理方法。方法一,用
乙腈提取,氮吹后经正己烷除脂,得到的基质溶液经5倍稀释;方法二用乙腈直接提取,基质稀释20倍。两种得出的基质曲线如图4,基本与缓冲液中的标曲相吻合,能有效的降低基质效应,可以应用于实际检测,基质曲线中ic
50
分别为0.714μg/kg和0.523μg/kg。两种方法对鸡肉中nic的lod分别为0.4μg/kg和1.4μg/kg,检测范围分别为0.9-13.9μg/kg和2.96-37.06μg/kg。
[0127]
表4不同方法处理鸡肉样本
[0128][0129]
3.2添加回收测定
[0130]
在鸡肉中添加不同浓度的目标物,确定准确度和精确度。结果如下表5,方法一nic的添加回收率在77.7%-93.9%之间,变异系数小于14.9%;方法二nic的添加回收率在77.3%-92.7%之间,变异系数小于7.0%。说明该方法的准确度和精确度良好。考虑到快速检测中时间的重要性,最终选择方法二,用乙腈直接提取。
[0131]
表5鸡肉中nic添加回收率
[0132]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1