一种筛选方法
1.本发明涉及生物技术领域,具体而言,涉及一种筛选方法。
背景技术:
2.自从kohler和milstein于1975年建立杂交瘤技术以来,已经产生了成千上万种不同的单克隆抗体,他们有的被用于科研检测,有的被用于临床诊断,还有一些被用于治疗各种疾病,如肿瘤,免疫系统疾病,心脑血管疾病等。单克隆抗体具有极高的商业价值。2019年十大最畅销药物中,治疗性单克隆抗体贡献了总销售额的73%,达到870亿美元。预计到2025年,全球治疗性单克隆抗体市场将达到3000亿美元。针对一个药物靶点,需要筛选很多抗体,才有可能优选到一个能用到临床研究的候选抗体药物,所以一个高效可靠的抗体发现平台是必不可少的。
3.到目前为止,主要的单克隆抗体发现技术分为杂交瘤技术、表面展示技术以及单b细胞技术。
4.杂交瘤技术是由细胞融合技术发展而来的。将脾脏b淋巴细胞和骨髓瘤细胞融合,形成b淋巴细胞-骨髓瘤细胞杂合体,有且只有这种杂合体才能在hat培养基中无限快速增殖且存活,又能分泌抗体。虽然该技术可以筛选到特异性的抗体,但是该方法的缺点也很明显:
5.(1):需要人工操作,操作及重复的步骤太多;
6.(2):速度慢,效率低,对于高通量筛选来说,不能满足要求;
7.(3):不能保证单克隆,需要亚克隆3-4次,人工和耗时都较多;
8.(4):有限稀释在elisa检测前,并不知道哪一个克隆满足抗原特异性的要求。
9.所以,需要对所有克隆都最少做一次elisa鉴定。经过45年的发展,产生了一些能够减少杂交瘤筛选的人力操作的设备,如clonepix系统。该系统使用半固体培养的方法,使细胞在培养基上生长成单个独立分散的单克隆,在半固体培养基中加入荧光标记克隆检测试剂,随着克隆生长时间延长,在克隆周围会聚集更多荧光蛋白复合体,再通过挑头将需要选择的克隆一个个地挑选出来。该技术虽然减少了杂交瘤筛选的人工操作,但是其也存在一些缺点。比如,首先杂交瘤要能在半固体培养基上生长良好,所以还需要开发合适的培养基。其次,克隆的大小和密度对于自动化挑取克隆的精确性有很大影响。克隆太小,会影响识别和挑取。克隆太密,容易影响挑到克隆的单克隆性。最后,机械臂对于挑选精度要求比较高,所以,需要对设备进行细致的日常维护。
10.另一种主要的抗体发现方法是表面展示技术。应用最广泛的是噬菌体展示和酵母展示技术。其原理为将b淋巴细胞的抗体重链可变区(vh)和轻链可变区(vl)采用pcr方法进行扩增,将扩增的片段插入到载体中,将抗体分子以fab片段或者单链抗体(scfv)与单链噬菌体外壳蛋白或酵母表面的蛋白进行融合表达,从而将抗体展示在噬菌体或酵母表面。利用抗原筛选的方法经过亲和吸附-洗脱-扩增等步骤后可获得靶抗原特异性的单克隆抗体。但是该方法中可变区的重抗体链和轻抗体链是随机组合的,这使很大一部分配对没有意
义。而且从这些展示文库中筛选的大多数抗体需要进一步成熟以满足亲和力要求。
11.单b细胞技术是近几年发展起来的,该技术可以从哺乳动物或人的单个b淋巴细胞直接分离表达出抗体,可以节省大量的筛选时间。目前主要的单b细胞技术针对的是记忆b细胞,因为该细胞表面表达有相应的igg,可以通过和带标记的抗原(荧光或磁性)偶联后进行分选(流式分选,或磁分选,或微流控分选),从而实现高通量的筛选。lotta von boehmer等人通过流式分选,将能和抗原结合的记忆b细胞分选到96孔pcr板中,进行重链和轻链的可变区的扩增,然后进行表达筛选特异性的抗体。但是该类方法只能针对细胞表面表达有igg的记忆b细胞,浆细胞表达的抗体由于是分泌形式的,所以无法用此类方法进行检测。alison m clargo等人建立了原位荧光方法(fluorescent foci method),通过显微操作的方法将分泌特异性抗体的细胞取出后进行重链和轻链的可变区的扩增和抗体的表达。但是该方法都需要显微操作才能取出目的细胞,耗时费力且无法进行高通量。
12.鉴于此,特提出本发明。
技术实现要素:
13.本发明的目的在于提供一种筛选方法,更具体而言,本发明提供一种抗体及其分泌细胞的筛选方法。
14.本发明是这样实现的:
15.一方面,本发明提供一种筛选分泌目标抗体的细胞的方法,其包括如下步骤:
16.步骤(a):使候选细胞被第一荧光分子标记;
17.步骤(b):将标记有所述第一荧光分子的候选细胞和抗所述目标抗体的标记抗体加入至固定有捕获抗原的容器中,混合并进行孵育,获得细胞液;其中,所述捕获抗原能够与所述目标抗体特异性结合;所述标记抗体标记有第二荧光分子;
18.所述第一荧光分子具有如下性质:所述第一荧光分子受第一激发光激发后发射的荧光与所述第二荧光分子受所述第一激发光激发后发射的荧光不同;所述第一荧光分子经第二激发光激发后处于光激活或光转化状态,在其处于光激活或光转化状态下再经第三激发光激发后发射第一荧光;且所述第一荧光分子未经第二激发光激发直接经第三激发光激发后发射第二荧光;所述第一荧光的波长与所述第二荧光的波长不同,或者所述第一荧光的波长与所述第二荧光的波长相同但荧光强度不同;其中,所述第一激发光的波长和所述第二激发光的波长不同;
19.所述第二荧光分子受所述第一激发光激发后所发射的荧光的波长与所述第二激发光的波长不同;
20.步骤(c):利用高内涵细胞成像仪观察所述细胞液,采用所述第一激发光激发所述第二荧光分子发射荧光并筛选出被所述第二荧光分子的荧光包围的候选细胞,将其标记为目标候选细胞;然后用所述第二激发光照射所述目标候选细胞以使其标记的第一荧光分子处于光激活或光转化状态;
21.步骤(d):利用流式细胞仪对所述细胞液中的候选细胞进行分选,分选过程中,采用所述第三激发光照射经步骤(c)处理后的候选细胞并分选出发射所述第一荧光的目标候选细胞,即为所述分泌目标抗体的细胞。
22.本发明提供的筛选方法能够高通量地筛选分泌抗体的细胞,其筛选原理如下:
23.由于目标抗体是分泌型的,目标抗体都被分泌到胞外分布在候选细胞周围,因此,当采用第一激发光照射候选细胞时,可以激发第二荧光分子发射荧光,此时能够分泌目标抗体的候选细胞周围会呈现出荧光包围的现象,而不能够分泌目标抗体的候选细胞则没有荧光包围;据此现象,可以将能够分泌抗体的候选细胞初步确定;再用第二激发光针对性地对其进行激发,使其标记的第一荧光分子处于光激活或光转化状态;进而使得在使用流式细胞仪的筛选步骤中,用第三激发光进行激发时,处于光激活或光转化状态的第一荧光分子则会发射第一荧光,而没有经过第二激发光激发的荧光分子则发射第二荧光;据此,可以根据第一荧光和第二荧光的不同,将能够分泌目标抗体的候选细胞和不能够分泌目标抗体的候选细胞给区分筛选出来。
24.从筛选原理可以看出,针对分泌型抗体的细胞筛选,本发明提供的筛选方法通过荧光分子的标记并结合高内涵细胞成像仪和流式细胞仪,能够高通量自动化地完成目标候选细胞的标记和分选,为后续扩增得其抗体序列和筛选有亲和力的抗体提供足够数量的细胞基础,提高了筛选效率。
25.需要说明的是,前文所述的“所述第一荧光分子受第一激发光激发后发射的荧光与所述第二荧光分子受所述第一激发光激发后发射的荧光不同”中的“荧光不同”是指:两种荧光分子的荧光波长不同,或者第二荧光分子发生发射荧光但第一荧光分子不发射荧光。第二荧光分子的类型可以根据第一荧光分子的类型合理选择,只要在第一激发光的激发下,能够将第二荧光分子的荧光与第一荧光分子的荧光区别即可。根据前文内容,本领域技术人员容易理解到,第一激发光和第二激发光的波长不同,避免相互影响。
26.在可选的实施方式中,所述第一荧光分子选自光激活荧光蛋白和光转化荧光蛋白。
27.在可选的实施方式中,在步骤(d)中,当采用所述细胞液通过流式细胞仪进行分选时,所述第二荧光分子为在所述第三激发光激发下不发射荧光的荧光分子,或者为在所述第三激发光激发下所发射的荧光的波长细胞液中是否含有标记抗体有所不同。
28.当直接对所述细胞液进行分选时,其含有标记抗体,所述第二荧光分子的荧光性质应当满足如下条件(a):其在所述第三激发光激发下不发射荧光,或者其在所述第三激发光激发下所发射的荧光的波长与所述第一荧光的波长不同。满足该条件的前提下可避免第二荧光分子在分选中产生的荧光干扰。当分选所用的溶液中含有不含有标记抗体时,则第二荧光分子可以不满足上述条件(a)。
29.是否选用细胞液直接进行分选可以根据捕获抗原的固定方式选择。
30.例如,当捕获抗原是通过表达该抗原的细胞(例如贴壁细胞)固定在容器(例如细胞培养皿)中时,这种情况下,候选细胞比较难分离,那么可以将细胞液消化后形成细胞悬液后直接用于后续分选。这种情况下,分选所用的细胞液含有标记抗体。此种情况下,第二荧光分子需要满足如上条件(a)。
31.又例如,当捕获抗原是直接固定或通过其他介质(例如微球或磁珠等)包被在容器(例如细胞培养皿)中时,这种情况下,候选细胞很容易通过清洗的方式从细胞液中分离出。那么,这种情况就可以将候选细胞单独分离出来,再使用合适的稀释液对其进行稀释后用于到后续分析步骤。这种情况下,分选所用的细胞液不含有标记抗体,第二荧光分子可以不满足上述条件(a)。
32.在可选的实施方式中,所述容器中含有过表达所述捕获抗原的贴壁细胞。捕获抗原通过表达该抗原的贴壁细胞固定在容器中。通过固定的捕获抗原可以将候选细胞分泌的抗体集中在候选细胞周围,便于荧光观察。
33.在可选的实施方式中,在步骤(c)处理后,对细胞液进行消化,获得细胞悬液,将所述细胞悬液通过流式细胞仪进行分选。
34.在可选的实施方式中,所述光激活荧光蛋白为pa-gfp。
35.在可选的实施方式中,当所述第一荧光分子为pa-gfp蛋白时,所述第一激发光的波长范围不处于390nm-415nm范围内,所述第二激发光的波长为390nm-415nm,所述第三激发光的波长范围为450nm-550nm(最大激发光波长为504nm)。
36.当所述第一荧光分子为pa-gfp蛋白时,利用高内涵细胞成像仪,筛选出被所述第二荧光分子的荧光包围的候选细胞,再用强烈的紫色光即第二激发光(390nm-415nm)照射,这个变体产生的绿色荧光提高了100倍。通过流式细胞仪,用激发光波长范围为450nm-550nm(最大激发光为504nm)的第三激发光照射,候选细胞的发射光的波长范围在480nm-600nm(最大发射光为517nm),此时,未经第二激发光照射的非候选细胞在第三激发光照射时,发射较弱的绿色荧光,发射光的波长范围在480nm-600nm(最大发射光为515nm)。利用不同的发射光的荧光强度可以将光激活后的带有pa-gfp蛋白的能够分泌目标抗体的候选细胞分选出来。
37.在可选的实施方式中,所述光转化荧光蛋白选自ps-cfp2、ps-cfp、meosfp、tdeosfp、deosfp、wteosfp、kaede、dendra2和kikgr。
38.在可选的实施方式中,当所述第一荧光分子为ps-cfp2蛋白时,所述第一激发光的波长范围不处于390nm-415nm范围内,所述第二激发光的波长为390nm-415nm,所述第三激发光的波长范围为420nm-520nm(最大激发光波长为490nm);
39.当所述第一荧光分子为ps-cfp2蛋白时,利用高内涵细胞成像仪,筛选出被所述第二荧光分子的荧光包围的候选细胞,再用强烈的紫色光即第二激发光(390nm-415nm)照射,带有蓝绿色荧光的候选细胞实现光转化变为绿色荧光。通过流式细胞仪,经过第三激发光激发,波长范围为420nm-520nm(最大激发光波长为490nm),经第二激发光照射的候选细胞的发射光波长范围为450nm-600nm(最大发射光波长为511nm)。此时,未经第二激发光照射的候选细胞经过第三激发光照射时,不发射荧光。因此可以将分泌目标抗体的候选细胞分选出来。
40.在可选的实施方式中,当所述第一荧光分子为kaede蛋白时,所述第一激发光的波长范围不处于350nm-400nm范围内,所述第二激发光的波长为350nm-400nm,所述第三激发光的波长范围为500nm-600nm(最大激发光波长为572nm)。
41.当所述第一荧光分子为kaede蛋白时,利用高内涵细胞成像仪,筛选出被所述第二荧光分子的荧光包围的候选细胞,再用强烈的紫色光即第二激发光(350nm-400nm)照射,带有绿色荧光的候选细胞实现光转化变为红色荧光。通过流式细胞仪,经过第三激发光激发,波长范围为500nm-600nm(最大激发光波长为572nm),经第二激发光照射的候选细胞的发射光波长范围为550nm-650nm(最大发射光为580nm),此时,未经第二激发光照射的候选细胞在第三激发光照射时,不发射荧光。因此可以将分泌目标抗体的候选细胞分选出来。
42.在可选的实施方式中,所述第一荧光分子为kikgr蛋白,所述第一激发光的波长范
围不处于390nm-415nm范围内,所述第二激发光的波长为390nm-415nm,所述第三激发光的波长范围为500nm-600nm(最大激发光波长为583nm)。
43.当所述第一荧光分子为kikgr蛋白时,利用高内涵细胞成像仪,筛选出被所述第二荧光分子的荧光包围的候选细胞,再用强烈的紫色光即第二激发光(390nm-415nm)照射,带有绿色荧光的候选细胞实现光转化变为红色荧光。通过流式细胞仪,经过第三激发光激发,波长范围为500nm-600nm(最大激发光波长为583nm),经第二激发光照射的候选细胞的发射光波长范围为550nm-650nm(最大发射光波长为593nm)。此时,未经第二激发光照射的候选细胞经过第三激发光照射时,不发射荧光。因此可以将分泌目标抗体的候选细胞分选出来。
44.在可选的实施方式中,步骤(a)中的候选细胞选自b淋巴细胞、t细胞、nk细胞、hek细胞、cho细胞、细菌和酵母。
45.候选细胞的类型可以根据需要选择,只要是预期其可能分泌目标抗体的细胞均可以作为本发明的候选细胞。例如典型的属于分泌型的分泌抗体的细胞包括b淋巴细胞。在一些实施例中,也可以是来自受免疫后的宿主动物的脾脏细胞、骨髓细胞以及淋巴结细胞等。
46.但需要说明的是,根据发明的筛选原理可以理解到,本发明的方法不仅可以用于筛选分泌抗体的细胞,也可以用于筛选分泌任何蛋白的细胞。因此,将本发明的方法用于筛选其他分泌蛋白的细胞也是属于本发明的保护范围。
47.在可选的实施方式中,步骤(a)中,使所述候选细胞被所述第一荧光分子标记的方式选自如下(i)-(iv)任意一项所示的方法:
48.(i):将编码所述第一荧光分子的核苷酸导入所述候选细胞并使所述核苷酸在所述候选细胞中表达第一荧光分子;
49.(ii):将所述第一荧光分子通过电转染方式导入所述候选细胞内;(iii):将所述第一荧光分子与所述候选细胞的细胞膜表面特异性标志物的抗体进行融合表达,通过该抗体与所述特异性标志物的特异性结合使第一荧光分子连接于所述候选细胞的表面;
50.(iv):将所述第一荧光分子标记脂类物质,再将标记脂类物质后的第一荧光分子与所述候选细胞混合以使第一荧光分子连接于所述候选细胞的表面。
51.需要说明是,将第一荧光分子标记在候选细胞上的方法并不限于上述的(i)-(iv)所示的方法,本领域技术人员根据本领域的常规技术是容易实现第一荧光分子的标记。采用其他的方式将第一荧光分子标记在候选细胞上也是属于本发明的保护范围。此外,第一荧光分子可以标记在候选细胞的表面或细胞内,或表面和细胞内。
52.在可选的实施方式中,所述脂类物质选自dspe-nhs,dspe-polyethylene glycol(peg)2000-nhs,dspe-peg3400-nhs,oleyl-peg2000-nhs,oleyl-peg4000-nhs和dioleoylphosphatidylethanolamine(dope)-peg2000-nhs。
53.在可选的实施方式中,在步骤(c)中,在低倍镜下进行成像,筛选出所述目标候选细胞;然后切换至高倍镜下对所述目标候选细胞进行所述第二激发光的照射。
54.在可选的实施方式中,为了避免候选细胞悬浮和分泌的抗体分散,也可以在盛放孵育体系的培养容器中接种表达捕获抗原的细胞,或连了捕获抗原的珠子(例如磁珠)。这些细胞或珠子表面还可以表达或偶联一些捕获分子,如抗cd19的抗体,抗b淋巴细胞的抗体,抗cd19的scfv等其他一些捕获分子,可以将候选细胞捕获下来,而不让其处于悬浮状态。或者可以在孵育体系中加入明胶以减少细胞和抗体的流动性,这样的操作有利于检测
观察。
55.在可选的实施方式中,在进行步骤(d)之前,将步骤(c)得到的细胞液消化成单细胞悬液,将单细胞悬液进行分选。
56.在可选的实施方式中,步骤(d)中,也可以使用微控流芯片实现分选。
57.另一方面,本发明提供一种筛选目标抗体的方法,其包括如下步骤:
58.采用如上任一项所述的方法获得分泌目标抗体的细胞;
59.从得到的所述分泌目标抗体的细胞中获取编码所述目标抗体的核苷酸序列。
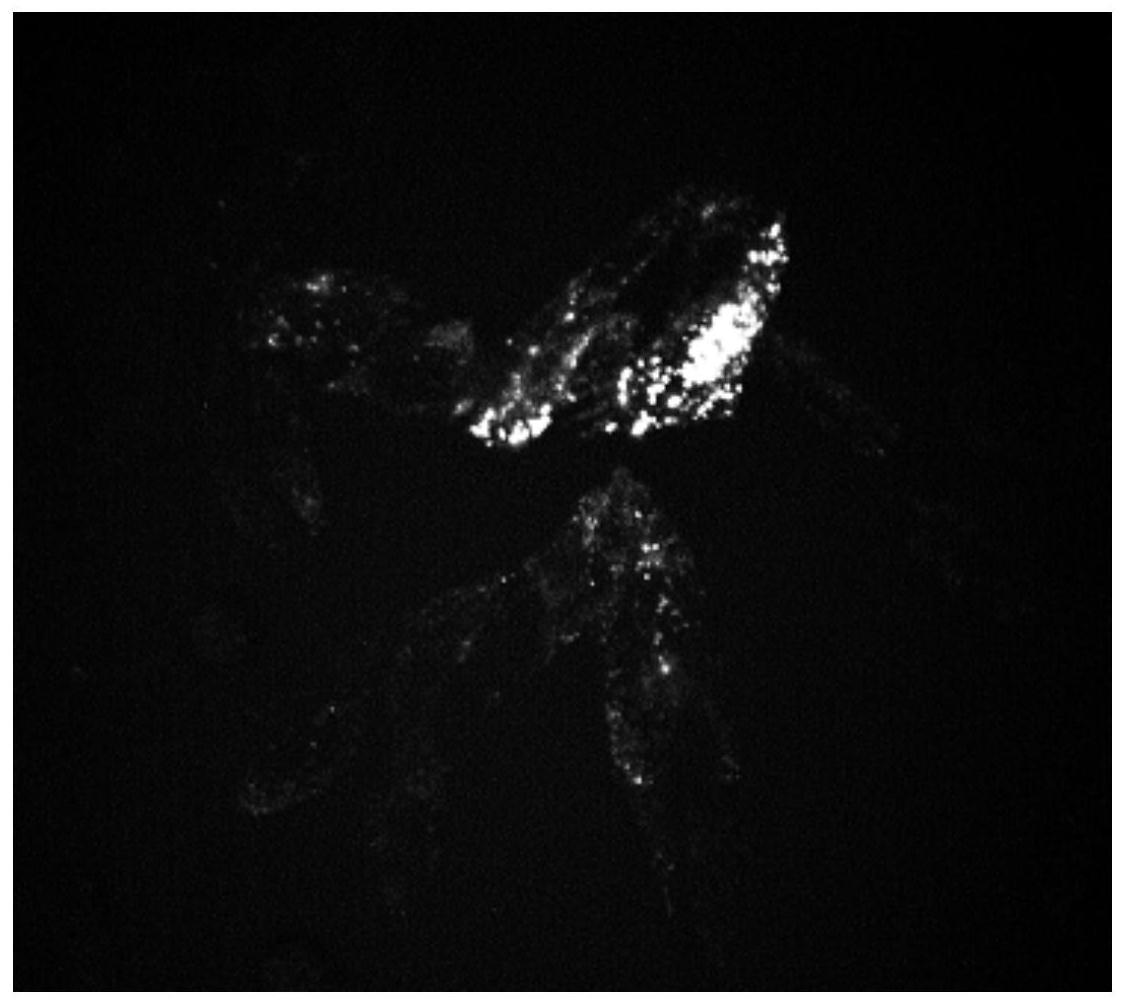
附图说明
60.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
61.图1:通过pcr获得抗体的重链可变区序列和轻链可变区序列,两者大小均在400bp左右。
62.图2:通过pcr获得构成全长抗体序列所需要的5’非翻译区,大小在400bp左右,重链抗体恒定区和3’非翻译区,大小在1200bp左右以及轻链抗体恒定区和3’非翻译区,大小在400bp左右。
63.图3:通过overlap pcr将抗体的轻重链可变区重构成完整的全长抗体序列。重链全长抗体序列大小在1900bp左右,轻链全长抗体序列大小在1000bp左右。
64.图4:使用高内涵进行的抗体亲和力检测,可见捕获抗原周围被带有第二荧光分子标记的标记抗体结合。
65.图5:分泌特异性抗pdl1的抗体的b淋巴细胞周围带有光晕。
具体实施方式
66.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
67.以下结合实施例对本发明的特征和性能作进一步的详细描述。
68.实施例1
69.本实施例以抗pdl1抗体和b淋巴细胞为例,对本实施例提供的筛选分泌抗pdl1抗体的b淋巴细胞的方法进行说明,其包括如下:
70.1使用pdl1蛋白作为抗原免疫小鼠。参考本领域常规方法进行。
71.2富集b淋巴细胞
72.1)小鼠取脾,放置于40μm滤膜,碾压脾脏通过滤网,获取单个脾细胞,置于50ml预冷的无血清的1640培养基中。
73.2)4℃,500g,离心5min。
74.3)弃上清,将细胞重悬至10ml 1
×
裂红液(bd bioscience,cat:555899)中,室温,
避光,静置5min。
75.4)加入无血清1640培养基40ml,4℃,500g,离心5min。
76.5)弃上清,将细胞沉淀重悬至10ml macs buffer(macs buffer:miltenyi biotec order no.130-091-221)中,吹匀,台盼蓝染色,计数。
77.6)取5
×
107细胞,4℃,500g,离心5min,弃上清。
78.7)加入175μl macs buffer,25μl fcr blocking reagent,50μl biotin-antibody cocktail(pan b cell isolation kit ii,mouse(order no:130-104-443)),混匀,4℃,孵育5min。
79.8)细胞悬液加入150μl macs buffer,100μl anti-biotin microbeads,混匀,4℃孵育10min。
80.9)用3ml buffer平衡ls柱子。
81.10)细胞悬液过柱子(500μl)收集滤液。
82.11)再加3ml buffer至ls柱子中,滤液收集至离心管。
83.12)所得滤液3.5ml,即为候选b淋巴细胞
84.3富集b淋巴细胞前包装慢病毒
85.1)取出生长密集的293t细胞,密度大约在80%-90%,并为其更换新鲜培养基(dmem+10%fbs),10ml/10cm细胞培养皿。
86.2)取2个2ml离心管,管1加入dmem培养基625μl,lipofectamine3000 18.75μl。管2中加入dmem培养基625μl,pspax2质粒7.5ug,pmd2g质粒2.5ug,plvx-kaede-ires-puro质粒10ug,p3000 25μl。
87.3)将管1中的溶液转移至管2中,用振荡器将管中溶液混匀,静置5min。
88.4)取出293t细胞,将混合物轻柔转入细胞中,放回培养箱中。
89.5)48h后第一次收集慢病毒上清,为细胞再重新加入10ml/皿新鲜培养基。
90.6)72h后第二次收集慢病毒,将病毒上清在4℃,60000g,离心2h,弃上清。使用适量pbs重悬沉淀,获得浓缩后的病毒,滴度在107u/ml。
91.4病毒感染b淋巴细胞,获得表达kaede蛋白(第一荧光分子)的b淋巴细胞
92.1)按照moi=50(10~100均可,优选50)感染分离的b淋巴细胞,转染6h(30min~48h均可,优选6h)后,将细胞悬液500g,离心5min,弃上清,获得表达kaede蛋白的b淋巴细胞。
93.5将转染后的b淋巴细胞铺板
94.1)转染前一天将过表达pdl1(捕获抗原)的cho-k1细胞接种到细胞培养皿中。
95.2)将转染后的b淋巴细胞铺到皿中,铺板细胞个数优选2
×
106(2
×
10
4-2
×
107均可)。培养6-48h后,轻柔吸弃培养基,加入用新鲜培养基配制的goat pab to ms lgg(aleax flour 647,abcam,cat:ab150115)染色液(含有第二荧光分子aleax flour 647标记的二抗),工作浓度为0.2μg/ml,避免扰动b细胞,37℃,5%co2孵育30min后,轻柔地吸弃染色液,换入新鲜培养基,换液过程避免扰动b细胞。
96.6将细胞培养皿放入高内涵细胞成像仪进行检测
97.1)利用高内涵细胞成像仪,在5倍镜下进行成像,用第一激发光(550nm-700nm)进行激发,aleax flour 647发射光波长范围为620nm-750nm,可以观察到分泌特异性抗pdl1
的抗体的b淋巴细胞周围的过表达pdl1的cho-k1细胞周围带有红光光晕(见图5),然后切换至60倍高倍镜下对该b淋巴细胞进行光激活,第二激发光波长(第二激发光)为365nm(350nm~400nm均可),曝光时间为500ms(50ms-5000ms均可),促使其发生光转化,没有发射光。
98.7流式分选分泌特异性抗体的单个b淋巴细胞
99.1)将步骤6的细胞消化成单细胞悬液,使用流式细胞仪进行分选,使用500nm-600nm激发光进行激发(最大激发波长572nm),在550nm~650nm区间得到发射光,(经过步骤6,使带有光晕的目标b细胞(能够分泌目标抗体)发生光转化,发射580nm波长的红色发射光,没有经过步骤6光转化的b淋巴细胞(不能分泌目标抗体)则不带有荧光),分选出红色发射光的被光转化过的b淋巴细胞(即为分泌抗pdl1抗体的b淋巴细胞)至装有细胞裂解液的pcr管中。
100.实施例2
101.本实施例以实施例1筛选得到的分泌抗pdl1抗体的b淋巴细胞为例,对筛选抗pdl1抗体的方法进行说明,该方法包括如下:
102.1逆转cdna第一链并通过5’race的方法扩增全长cdna。
103.1)第一链cdna合成(race 5’/3’kit,takara,cat:634858)
104.a:配制反应体系
105.mix1:
[0106][0107][0108]
使用移液器轻轻混合,短暂离心置于室温。
[0109]
mix2:
[0110]
组分体积rna6μlcap primer1μldeionized h2o4μltotal11μl
[0111]
cap primer:agcagtggtatcaacgcagagtacrgrgg;使用移液器轻轻混合,短暂离心。
[0112]
将mix2在以下条件下进行反应。
[0113]
温度时间72℃3min42℃2min14000g离心10s
[0114]
b:配制反应体系:
[0115]
mix3:
[0116]
组分体积mix15.5μlrnase inhibition0.5μlsmartscribe reverse transcriptase2μltotal8μl
[0117]
使用移液器轻轻混合,短暂离心。
[0118]
c:第一链cdna合成
[0119]
mix4:
[0120][0121][0122]
oligo-dt primer:
[0123]
agcagtggtatcaacgcagagtacttttttttttttttttttttttttttttttvn。使用移液器轻轻混合,短暂离心。
[0124]
反应条件:
[0125]
温度时间42℃90min70℃10min
[0126]
d:全长cdna扩增
[0127]
mix5:
[0128]
组分体积deionized h2o15.5μl2x seqamp buffer25μlseqamp dna polymerase1μltotal41.5μl
[0129]
使用移液器轻轻混合,短暂离心。
[0130]
mix6:
[0131]
组分体积mix42.5μlispcr primer5μloligo-dt primer1μl
mix 541.5μltotal50μl
[0132]
oligo-dt primer:
[0133]
agcagtggtatcaacgcagagtacttttttttttttttttttttttttttttttvn。
[0134]
ispcr primer:aagcagtggtatcaacgcagagt。
[0135]
pcr条件:
[0136][0137][0138]
2通过pcr获得抗体的重链可变区序列和轻链可变区序列。
[0139]
配制pcr反应体系:
[0140][0141]
pcr条件:
[0142][0143]
抗体重链可变区forward primer为fvh_mix(将九条10μm的引物fvh_i~ix各抽取
等量体积混合)。
[0144]
抗体重链可变区reward primer为rvh_mix(将四条10μm的引物rvh_i~iv各抽取等量体积混合)。抗体重链可变区forward primer和reward primer见下表:
[0145][0146][0147]
抗体轻链可变区forward primer为fvk_mix(将九条10μm的引物fvkfk_i~ix各抽取等量体积合)。
[0148]
抗体轻链可变区reward primer为rvk_mix(将三条10μm的引物rvk_i~iii各抽取等量体积混合)。
[0149]
抗体轻链可变区forward primer和reward primer见下表:
[0150][0151]
pcr实验结果如图1所示。
[0152]
3通过overlap pcr将抗体的轻重链可变区重构成完整的全长抗体序列,并进行体外无细胞表达。
[0153]
1)通过pcr获得overlap pcr所用的模板片段(5’utr,igg1fc-3’utr,igkc-3’utr)。
[0154]
pcr扩增5’utr片段体系如下:
[0155] 体系(50μl)5x q5 reaction buffer10μl10nm dntp1μlpd2p_up-f(20μm)1.25μl(终浓度0.5μm)tev-r(20μm)1.25μl(终浓度0.5μm)质粒pd2p-1.061μlgc enhancer10μlq5-high-fidelity dna polymerase0.5μlnuclease-free water25μl
[0156]
pd2p_up-f:atcggtgatgtcggcgatatag;
[0157]
tev-r:tccctggaaatataagttctcgcc。
[0158]
pcr条件:
[0159][0160]
pcr扩增igg1fc-3’utr片段体系如下:
[0161][0162][0163]
pcr条件:
[0164][0165]
igg1fc_f2:gccaaaaccacacctcct;
[0166]
pd2p-r:agcagccggatcgtcgagttcg。
[0167]
pcr扩增igkc-3’utr片段体系如下:
[0168]
组分体系(50μl)5x q5 reaction buffer10μl10nm dntp1μl
igkc-f2(20μm)1.25μl(终浓度0.5μm)pd2p-r(20μm)1.25μl(终浓度0.5μm)质粒pgm-igkc-3’utr1μlgc enhancer10μlq5-high-fidelity dna polymerase0.5μlnuclease-free water25μl
[0169]
igkc-f2:agagctgacgccgctcct;
[0170]
pd2p-r:agcagccggatcgtcgagttcg。
[0171]
pcr条件:
[0172][0173][0174]
pcr结果如图2所示。
[0175]
2)通过overlap pcr将抗体的轻重链可变区重构成完整的全长抗体序列。
[0176][0177]
pd2p_f:atcgagatctcgcgaaattaatacga;
[0178]
pd2p_r:agcagccggatcgtcgagttcg。
[0179]
overlap pcr条件:
[0180][0181]
pcr结果如图3所示。
[0182]
3)体外无细胞表达
[0183]
将overlap pcr获得的抗体的轻重链完整的全长抗体序列pcr产物各1μl加入60μl proteinfactory rxn(protein factory 1.0)反应体系。20-30℃静置3-20小时,即可完成蛋白质表达;得到抗pdl1的抗体。
[0184]
4获得表达的抗体后进行抗体的亲和力筛选
[0185]
1)提前一天,取过表达pdl1的cho-k1细胞(每孔一万)和过表达gfp的cho-k1细胞(每孔2000)细胞混匀于f-12培养基中,100μl/孔,种96孔板。37℃,5%co2过夜培养。
[0186]
2)吸弃培养板中培养基,并在每孔中加入40μl抗体蛋白,37℃,5%co2孵育30min。
[0187]
3)吸弃蛋白,取goat pab to ms lgg(aleax flour 647,cat:ab150115,abcam),工作浓度0.2μg/ml和hoechest 33342,工作浓度0.2μg/ml到f-12培养基中,每孔50μl。37℃,5%co2孵育30min。
[0188]
4)吸弃培养基,加入50μl f-12培养基。
[0189]
5)高内涵拍摄,分析平均荧光值(见图4)。分析方法如下:
[0190]
a)通过使用350nm激发光,找到由hoechest 33342染色的细胞核,调整荧光值,找到总细胞。
[0191]
b)在a)中输出的细胞中通过使用488nm激发光,找到带有绿色荧光的细胞,调整荧光值,输出为cho-k1-gfp。
[0192]
c)细胞总数扣减b)中的cho-k1-gfp,剩下的为cho-k1-pdl1。
[0193]
d)通过使用647nm激发光,检测细胞膜上红色荧光值,统计cho-k1-gfp膜上红色荧光平均值和cho-k1-pdl1膜上红色荧光平均值。
[0194]
e)通过统计cho-k1-pdl1膜上红色荧光平均值和cho-k1-gfp膜上红色荧光平均值的比值来进行抗体的亲和力筛选。选取比值较高的抗体,即得到具有高亲和力的抗pdl1的抗体。
[0195]
实施例3
[0196]
本实施例提供的筛选分泌抗pdl1抗体的b淋巴细胞的方法与实施例1基本相同,不同的是将转染后的b淋巴细胞铺板的步骤,本实施例的操作方法如下:
[0197]
1)转染前一天,使用无菌dpbs将poly-d-lysine solution(gibco,ref:a3890401)稀释到工作浓度50ug/ml。在其他实施例中,此步骤也可以选用半固体培养基或gelatin等。
[0198]
2)将稀释液加入六孔板中(此步骤可以增加细胞贴壁作用),每孔加入2ml。
[0199]
3)室温孵育1小时。
[0200]
4)弃去稀释液,使用无菌水将六孔板洗三遍,确保将残留的poly-d-lysine solution稀释液除去。
[0201]
5)将六孔板开盖放置于生物安全柜中。
[0202]
6)待六孔板全干后,将过表达pdl1的cho-k1细胞铺板于六孔板中。
[0203]
7)将转染后的b淋巴细胞铺到皿中。培养6-48h后,轻柔吸弃培养基,加入用新鲜培养基配制的goat pab to ms lgg(aleax flour 647,abcam,cat:ab150115)染色液,工作浓度为0.2μg/ml,避免扰动b细胞,37℃,5%co2孵育30min后,轻柔地吸弃染色液,换入新鲜培养基,换液过程避免扰动b细胞。
[0204]
其余步骤同实施例1。
[0205]
实施例4
[0206]
本实施例提供的筛选分泌抗pdl1抗体的b淋巴细胞的方法与实施例1基本相同,不同的是:第一荧光分子为pa-gfp蛋白;另外,在本实施例中,在高内涵细胞成像步骤中:利用强烈的紫色光(390-415nm)照射,候选细胞产生的绿色荧光(波长范围为480nm-600nm)提高了100倍;在流式细胞仪进行分选时,激发光波长范围为450nm-550nm(最大激发光为504nm),发射光的波长范围为480nm-600nm(最大发射光为517nm),可以将光激活后的带有pa-gfp蛋白的能够分泌目标抗体的标记b淋巴细胞分选出来。
[0207]
实施例5
[0208]
本实施例提供的筛选分泌抗pdl1抗体的b淋巴细胞的方法与实施例1基本相同,第一荧光分子为kaede蛋白;在高内涵细胞成像步骤中:利用强烈的紫色光(350-400nm)照射,带有绿色荧光(波长范围为500nm-600nm)的候选b淋巴细胞实现光转化变为红色荧光(波长范围为550nm-650nm);在流式细胞仪进行分选时,激发光波长范围为500nm-600nm(最大激发光波长为572nm),发射光波长范围为550nm-650nm(最大发射光为580nm),可以将光转化后的带有kaede蛋白标记的能够分泌抗体的b淋巴细胞分选出来。
[0209]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1