一种多荧光标记观察纤毛虫细胞立体结构的方法与流程
1.本发明属于纤毛虫细胞检测技术领域,尤其涉及一种多荧光标记观察纤毛虫细胞立体结构的方法。
背景技术:
2.目前,纤毛门原生动物是单细胞原生动物中种类最多,结构最复杂、最高等的一个门类,在生物界和自然环境中具有极为重要的作用。纤毛虫形态发生对于确立不同单元间的亲缘关系和系统学研究具有极为重要的意义。目前在纤毛虫的形态学研究中,对平面形态的研究主要利用蛋白银染色法和透射电镜。前者能显示其银线系统、纤毛、核器、皮膜结构,后者细胞内部亚显微结构,但都存在耗时多、过程复杂、掌握困难。显示三维形态主要利用扫描电镜和激光共聚焦显微镜,扫描电镜对技术要求高,激光共聚焦技术用直接及免疫荧光标记技术呈现纤毛虫细胞微管的分化和组成的模式,对口器、囊泡、皮膜和核器不能同时显示。
3.通过上述分析,现有技术存在的问题及缺陷为:
4.(1)在纤毛门原生动物的形态学研究中,通过利用蛋白银染色法和透射电镜对平面形态进行研究,两者都存在耗时多、过程复杂、掌握困难。
5.(2)显示三维形态利用扫描电镜和激光共聚焦显微镜,扫描电镜能显示皮膜、纤毛和伪足等外部结构,对技术要求高,但是无法显示内部囊泡和核器的三维结构,已报道的激光共聚焦技术用直接及免疫荧光标记技术呈现纤毛虫细胞微管的分化和组成的模式,但对口器、囊泡、皮膜和核器未能同时显示。
6.解决以上问题及缺陷的难度为:目前利用激光共聚焦显微镜观察纤毛虫形态多局限于单荧光标记分析微管胞器形态和空间定位的研究上,但是对口器、囊泡、皮膜和核器等其他胞器的研究多通过透射电镜和蛋白银染色法获得其二维结构,在立体构象上的研究尚不成熟。
7.荧光多标记显微观察技术是指利用荧光标记技术同时标记细胞内多种生物大分子的技术方法。荧光多标记显微观察技术在卵细胞骨架和细胞核方面的应用研究在哺乳动物方面较多,主要集中于鼠、猪、兔等。在果蝇和爪蟾(xenopus)方面也有相关报道。在原生动物细胞结构方面的应用研究较少。
8.解决以上问题及缺陷的意义为:纤毛虫微管结构特征能体现细胞运动胞器的功能,口器和囊泡的三维重建有助于揭示研究纤毛虫的摄食和消化过程,核器中的大核和小核的形态与其在营养和生殖中的作用相关,皮膜的质地和结构能体现纤毛虫的环境适应性。有必要发展一种简单的荧光多标记方法同时获得多种胞器的三维构象和对应空间位置关系的详细信息,对胞器的起源和演化、亲缘种廓清以及系统关系的重建等有重要意义。
技术实现要素:
9.针对现有技术存在的问题,本发明提供了一种多荧光标记观察纤毛虫细胞立体结
构的方法。
10.本发明是这样实现的,一种多荧光标记观察纤毛虫细胞立体结构的方法,所述多荧光标记观察纤毛虫细胞立体结构的方法,包括:
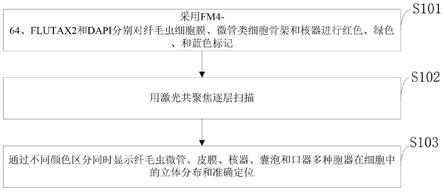
11.采用fm4-64、flutax2和dapi分别对纤毛虫细胞膜、微管类细胞骨架和核器进行红色、绿色、和蓝色标记;
12.用激光共聚焦逐层扫描;
13.通过不同颜色区分同时显示纤毛虫微管、皮膜、核器、囊泡和口器多种胞器在细胞中的立体分布和准确定位。
14.进一步,所述fm4-64染料是亲脂性、水溶性的苯乙烯类化合物,与质膜及内膜细胞器特异结合后发出高强度的红色荧光;
15.荧光紫杉醇flutax2对微管类细胞骨架进行绿色标记,荧光染料dapi穿透细胞膜与核酸特异性的结合,将细胞核进行蓝色标记。
16.进一步,所述多荧光标记观察纤毛虫细胞立体结构的方法包括:
17.(1)取材,实验用游仆虫、克鲁虫、四膜虫和全裂虫是采自福建沿岸的不同地区采取表层海水水样,带回实验室后镜检分离单个虫体;最初的培养液为原位海水,然后用细菌密度适中的大米水替换原池水,数日后待细胞分裂至较多数量时用于实验;
18.(2)样品准备,取生长状态良好的纤毛虫接种于6孔板中,适应2天,待虫体密度较高时,六孔板中放入多聚赖氨酸处理过的盖玻片,使纤毛虫吸附在玻片上,静置1个小时;
19.(3)细胞膜标记,取出玻片,1
×
phem清洗一次,加入20μlfm4-64,工作液浓度为5μg/ml,避光染15min;
20.(4)细胞固定,1
×
phem清洗一次后,用2.5%戊二醛固定15min;
21.(5)细胞膜通透,1
×
pbs清洗一次后,0.1%tritonx-100处理1min;
22.(6)细胞骨架标记,1
×
pbs清洗一次后,用0.01mm flutax2避光染15min;
23.(7)细胞核标记,1
×
pbs清洗一次后,用10μl 60%甘油和10μl dapi混合液封片;
24.(8)激光共聚焦显微镜观察拍照;使用激光共聚焦显微镜捕获纤毛虫细胞3d图像,可以在三维水平通过不同颜色区分同时显示纤毛虫微管、皮膜、核器、囊泡和口器多种胞器在细胞中的空间分布和准确占位。
25.进一步,所述多荧光标记观察纤毛虫细胞立体结构的方法还包括:用多聚赖氨酸处理过的盖玻片粘附纤毛虫;将纤毛虫吸附在盖玻片上,用戊二醛代替4%多聚甲醛固定纤毛虫,多聚甲醛在常温下溶解度较低,加热60℃数小时才能溶解;戊二醛固定液为高浓度50%戊二醛溶液稀释而成。
26.进一步,所述20μl fm4-64工作液浓度为5μg/ml。
27.进一步,所述激光扫描共聚焦显微镜观察纤毛虫细胞结构材料为:
28.(1)phem配方(2
×
):
[0029][0030]
(2)fm4-64 thermofisher t13320;
[0031]
(3)flutax2 tocris 6254。
[0032]
结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明操作简便,通过不同颜色的荧光显示不同胞器,识别便利,适合于不同纤毛虫的研究,突破了现有技术对电子显微镜观察细微结构的依赖,大大降低科研成本、技术要求和平台要求,可为其他原生生物细胞结构染色提供借鉴,并为大分子的亚细胞定位研究奠定基础,具有良好的应用前景。
附图说明
[0033]
为了更清楚地说明本申请实施例的技术方案,下面将对本申请实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
[0034]
图1是本发明实施例提供的多荧光标记观察纤毛虫细胞立体结构的方法流程图。
[0035]
图2是本发明实施例提供的激光扫描共聚焦显微镜观察游扑虫细胞结构示意图。
[0036]
图3是本发明实施例提供的激光扫描共聚焦显微镜观察克鲁虫细胞结构示意图。
[0037]
图4是本发明实施例提供的激光扫描共聚焦显微镜观察四膜虫细胞结构示意图。
[0038]
图5是本发明实施例提供的激光扫描共聚焦显微镜观察束状全列虫细胞结构示意图。
具体实施方式
[0039]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0040]
针对现有技术存在的问题,本发明提供了一种多荧光标记观察纤毛虫细胞立体结构的方法,下面结合附图对本发明作详细的描述。
[0041]
如图1所示,本发明提供的多荧光标记观察纤毛虫细胞立体结构的方法包括以下步骤:
[0042]
s101:采用fm4-64、flutax2和dapi分别对纤毛虫细胞膜、微管类细胞骨架和核器进行红色、绿色、和蓝色标记;
[0043]
s102:用激光共聚焦逐层扫描;
[0044]
s103:通过不同颜色区分同时显示纤毛虫微管、皮膜、核器、囊泡和口器多种胞器
在细胞中的立体分布和准确定位。
[0045]
本发明提供的s101中,fm4-64染料是亲脂性、水溶性的苯乙烯类化合物,对细胞无毒性作用,能与质膜及内膜细胞器特异结合后发出高强度的红色荧光。荧光紫杉醇flutax2能够对微管类细胞骨架进行绿色标记。荧光染料dapi可以穿透细胞膜与核酸特异性的结合,将细胞核进行蓝色标记。
[0046]
本发明提供的多荧光标记观察纤毛虫细胞立体结构的方法包括以下步骤:
[0047]
1.取材
[0048]
实验用游仆虫、克鲁虫、四膜虫和全裂虫是采自福建沿岸的不同地区采取表层海水水样,带回实验室后镜检分离单个虫体。最初的培养液为原位海水,然后用细菌密度适中的大米水替换原池水,数日后待细胞分裂至较多数量时用于实验。
[0049]
2.样品准备
[0050]
取生长状态良好的纤毛虫接种于6孔板中,适应2天,待虫体密度较高时,六孔板中放入多聚赖氨酸处理过的盖玻片,使纤毛虫吸附在玻片上,静置1个小时;
[0051]
3.细胞膜标记
[0052]
取出玻片,1
×
phem清洗一次,加入20μl fm4-64(工作液浓度为5ug/ml),避光染15min;
[0053]
4.细胞固定
[0054]1×
phem清洗一次后,用2.5%戊二醛固定15min;
[0055]
5.细胞膜通透
[0056]1×
pbs清洗一次后,0.1%tritonx-100处理1min;
[0057]
6.细胞骨架标记
[0058]1×
pbs清洗一次后,用0.01mm flutax2避光染15min;
[0059]
7.细胞核标记
[0060]1×
pbs清洗一次后,用10μl 60%甘油和10μl dapi混合液封片。
[0061]
8.激光共聚焦显微镜观察拍照;
[0062]
使用激光共聚焦显微镜捕获纤毛虫细胞3d图像,可以在三维水平通过不同颜色区分同时显示纤毛虫微管、皮膜、核器、囊泡和口器多种胞器在细胞中的空间分布和准确占位。
[0063]
以往研究应用激光扫描共聚焦显微技术由flutax单荧光标记纤毛虫微管。本发明的目的在于采用多荧光标记观察纤毛虫多种胞器,因此染色步骤在单荧光标记基础上进行了改进和调整。
[0064]
本发明提供的多荧光标记观察纤毛虫细胞立体结构的方法用多聚赖氨酸处理过的盖玻片粘附纤毛虫,代替文献中用微吸管收集纤毛虫。微吸管在显微镜下收集纤毛虫需要较高的实验操作技巧,而且收集到的虫体在后期的多次染色清洗过程中容易丢失。本发明的方法将纤毛虫吸附在盖玻片上,操作简便且易于进行原位染色和冲洗,有利于减少荧光染料的残留,降低观察样品中荧光背景干扰,获得清晰细胞图像。用戊二醛代替4%多聚甲醛固定纤毛虫。多聚甲醛在常温下溶解度较低,需要加热60℃数小时才能溶解,加入过程中释放刺激性气体,对操作者健康不利。戊二醛固定液为高浓度50%戊二醛溶液稀释而成,配制简便且易于根据不同纤毛虫的特性调制适合浓度的固定溶液,具有良好的实验效果。
[0065]
下面结合具体实施例对本发明的技术方案作进一步的描述。
[0066]
由于不同纤毛虫的大小与结构存在着差异,因此没有任何一种处理方法可以不加变更地适用于所有纤毛虫。本研究对游仆虫、克鲁虫、四膜虫和全裂虫四种不同纤毛虫固定、通透和染色方法进行了摸索,找到适合方法介绍于实施例1-实施例4。
[0067]
实施例1
[0068]
(1)phem配方(2
×
):
[0069][0070]
(2)fm4-64 thermofisher t13320
[0071]
(3)flutax2 tocris 6254
[0072]
激光扫描共聚焦显微镜观察克鲁虫细胞结构
[0073]
(5)游仆虫养在六孔板中,适应2天,尽量使虫子的浓度高一些;
[0074]
(6)将多聚赖氨酸处理过的盖玻片放入六孔板中,使游仆虫吸附在玻片上,静置1个小时;
[0075]
(7)取出玻片,1
×
phem清洗一次;
[0076]
(8)20μl fm4-64(工作液浓度为5μg/ml),避光染15min;
[0077]
(9)1
×
phem清洗一次;
[0078]
(10)2.5%戊二醛固定15min;
[0079]
(11)1
×
pbs清洗一次;
[0080]
(12)0.1%tritonx-100处理1min;
[0081]
(13)1
×
pbs清洗一次;
[0082]
(14)0.01mm flutax2避光染15min;
[0083]
(15)1
×
pbs清洗一次;
[0084]
(16)10μl 60%甘油和10μl dapi混合液封片。
[0085]
结果如图2所示,
[0086]
a:细胞核特异标记为蓝色荧光(图中转化为黑色);b:微管胞器标记为绿色荧光(图中转化为灰色,绿色荧光强度较高部分显示为白色);c:皮膜特异标记为红色荧光(图中转化为灰色);d:a、b和c图的叠加
[0087]
实施例2:多荧光标记观察克鲁虫的细胞结构
[0088]
1、将克鲁虫养在六孔板中,适应2天,尽量使虫子的浓度高一些;
[0089]
2、将多聚赖氨酸处理过的盖玻片放入六孔板中,使小虫子吸附在玻片上,静置1个小时;
[0090]
3、取出玻片,1
×
phem清洗一次;
[0091]
4、20μl fm4-64(工作液浓度为5μg/ml),避光染15min;
[0092]
5、1
×
phem清洗一次;
[0093]
6、2.5%戊二醛固定15min;
[0094]
7、1
×
pbs清洗一次
[0095]
8、0.1%tritonx-100处理5min
[0096]
9、1
×
pbs清洗一次
[0097]
10、0.01mm flutax2避光染15min;
[0098]
11、1
×
pbs清洗一次
[0099]
12、10μl 60%甘油和10μl dapi混合液封片
[0100]
结果如图2所示,a:细胞核特异标记为蓝色荧光(图中转化为黑色);b:微管胞器标记为绿色荧光(图中转化为灰色,绿色荧光强度较高部分显示为白色);c:皮膜特异标记为红色荧光(图中转化为灰色);d:a、b和c图的叠加。
[0101]
实施例3多荧光标记观察四膜虫的细胞结构
[0102]
将四膜虫养在六孔板中,适应2天,尽量使虫子的浓度高一些;
[0103]
将多聚赖氨酸处理过的盖玻片放入六孔板中,使小虫子吸附在玻片上,静置1个小时;
[0104]
取出玻片,1
×
phem清洗一次;
[0105]
20μl fm4-64(工作液浓度为5ug/ml),避光染15min;
[0106]1×
phem清洗一次;
[0107]
2%戊二醛固定15min;
[0108]1×
pbs清洗一次;
[0109]
0.1%tritonx-100处理1min;
[0110]1×
pbs清洗一次;
[0111]
0.01mm flutax2避光染15min;
[0112]1×
pbs清洗一次;
[0113]
10μl 60%甘油和10μl dapi混合液封片;
[0114]
结果如图3所示,a:细胞核特异标记为蓝色荧光(图中转化为黑色);b:微管胞器标记为绿色荧光(图中转化为灰色,绿色荧光强度较高部分显示为白色);c:皮膜特异标记为红色荧光(图中转化为灰色);d:a、b和c图的叠加。
[0115]
实施例4多荧光标记观察束状全列虫的细胞结构
[0116]
将束状全列虫养在六孔板中,适应2天,尽量使虫子的浓度高一些;
[0117]
将多聚赖氨酸处理过的盖玻片放入六孔板中,使小虫子吸附在玻片上,静置1个小时;
[0118]
取出玻片,1
×
phem清洗一次;
[0119]
20μl fm4-64(工作液浓度为5μg/ml),避光染15min;
[0120]1×
phem清洗一次;
[0121]
5%戊二醛固定15min;
[0122]1×
pbs清洗一次;
[0123]
0.1%tritonx-100处理20s;
[0124]1×
pbs清洗一次;
[0125]
0.01mm flutax2避光染15min;
[0126]1×
pbs清洗一次;
[0127]
10μl 60%甘油和10μl dapi混合液封片;
[0128]
图4激光扫描共聚焦显微镜观察束状全列虫细胞结构,a:细胞核特异标记为蓝色荧光(图中转化为黑色);b:微管胞器标记为绿色荧光(图中转化为灰色,绿色荧光强度较高部分显示为白色);c:皮膜特异标记为红色荧光(图中转化为灰色);d:a、b和c图的叠加。
[0129]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1