一种实体肿瘤靶向指标的检测方法及其试剂组合与流程
1.本发明涉及实体肺癌肿瘤细胞标志物及驱动基因的检测,具体的提供了一种肺癌肿瘤靶向指标的检测方法及方法中肿瘤及其微环境标志物检测的试剂组合。
背景技术:
2.肺癌是世界范围内发病率和死亡率最高的恶性肿瘤,其中绝大多数肺癌是非小细胞肺癌,约占 80%-85%。尽管随着居民健康意识的增强以及螺旋ct等早期筛查技术的应用,新增肺癌患者的首次确诊结果为中晚期肿瘤的占比有所降低,但是由于肿瘤异质性,晚期治疗效果不佳,预后不良,5年相对生存率仅有16.1%。如何更有效地延长肺癌患者的生存率,降低肺癌患者的死亡一直是肺癌治疗中关注点。不同组织亚型,不同驱动基因的同一分期的非小细胞肺癌(nsclc)患者对于相同的治疗方式会产生不同的治疗效果和预后。对于多数非小细胞肺癌患者,手术切除肿瘤的方式仍是首选的治疗方式。而晚期非小细胞肺癌患者,通常病灶已经发生转移,手术已无法达到预期的治疗效果。通过对晚期非小细胞肺癌进行准确分期、确定亚型、分析分子肺癌标记物以及检测驱动基因,选择合适的治疗手段和靶向药物,可以有效改善非小细胞肺癌患者的预后,提高生存率。
3.随着含铂化疗药物治疗nsclc的发展进入瓶颈期后,以表皮生长因子络氨酸激酶抑制剂为代表的大分子靶向治疗方式显著延长了驱动基因阳性的晚期nsclc的无进展生存期,但是与nsclc发生发展相关的驱动基因的不稳定性决定了靶向的药物难以治愈肿瘤。免疫治疗作为治疗肿瘤的新希望,将晚期nsclc 5年生存率呈倍数提升,尽管有部分患者出现预后不良。
4.免疫系统的t细胞的活化需要至少两个信号:第一个信号是抗原呈递细胞apc呈递的与主要组织相容性复合物(mhc)分子结合的特定肽被t细胞抗原受体tcr识别;第二个信号是共刺激分子(如cd28等) 与它在apc上的选择性配体b7连接。两种信号缺一不可,相互协作才能促使t细胞活化,分泌细胞因子,发挥免疫功能。t细胞活化并不是无限制的,当t细胞活化一定时间后,表达在活化的t细胞上的抑制性共刺激分子pd-1,抑制t细胞的活化,介导t细胞的凋亡。这种阳性和阴性的共刺激分子信号决定了免疫反应的强度和自由度,肿瘤的免疫治疗是指通过激发或调动机体的免疫系统,增强肿瘤微环境抗肿瘤免疫力,从而控制和杀伤肿瘤细胞。
5.表皮生长因子受体(epidermal growth factor receptor,egfr)是一种受体型络氨酸激酶,在细胞膜上表达。正常情况下,egfr胞外端与配体结合形成二聚体,胞内端与atp结合后发生磷酸化,然后激活多种下游信号通路,如pkc、jak、erk等信号通路,调节细胞生长、分化和发育等多种生理过程。egfr过表达和突变会造成egfr结构域的活化,异常激活下游信号通路,促使肿瘤细胞恶性增殖。egfr被认为是治疗癌症的有效靶标之一,目前已经开发和研究了许多抗egfr抑制剂药物,包括egfr单克隆抗体类西妥昔单抗、尼妥珠单抗、帕尼单抗和小分子酪氨酸激酶抑制剂(tki)类厄洛替尼、吉非替尼、埃克替尼等。
6.间变性淋巴瘤激酶(anaplastic lymphoma kinase,alk)基因被认为是强烈癌症
驱动基因,因为在血液学和实体恶性肿瘤包括间变性大细胞淋巴瘤,肌纤维支气管肿瘤及nsclc中均检测到alk基因的重排,参与肿瘤的发生和发展。alk基因主要在胚胎期表达,促进神经细胞增殖,在脑和外周神经系统的发育过程中起作用。当神经系统发育完善后,通常进入休眠状态,人体其他细胞基本不表达alk,alk的激活通常通过染色体重排进行。
7.肿瘤位于包括肿瘤,免疫细胞和间质在内的肿瘤微环境中,它们共同相互作用以决定特定癌症的命运。因此肿瘤的治疗需要精密医学来收集和评估与肿瘤有关的所有信息。目前肺癌治疗的重要分子靶标pd-l1, egfr,alk等的检测方法为免疫组化,测序,pcr,fish等。这些检测技术的拥有诸如检测所需要的步骤繁多,所需要的样本量大,检测成本高等缺点。传统的方法都是单一的检测,单次检测只能提供相对单一的检测信息,难以完成多种肿瘤生物标志物的检测。
8.流式细胞术是将待测标本制成单细胞悬液,经特异性荧光染料染色后放入样品管中上机后以单个细胞形式排出。染色的单个细胞经过激光聚焦区时被入射激光激发,产生特定波长的荧光。通过对仪器收集的荧光、光散射、光吸收或细胞电阻等信号的分析,可以区分细胞的状态、类型、dna含量等;流式细胞术与单克隆抗体结合可以对细胞细胞表面和细胞内抗原、癌基因蛋白及膜受体定量检测。临床上用流式检测机体的免疫状态、微小病灶残留,评估药物治疗效果及预后等。肿瘤在临床上有实体瘤和非实体瘤之分,实体瘤及有形瘤,可通过临床检查如x线摄片、ct扫描,b超、或触诊扪及到的有形肿块称实体瘤,非实体瘤、x线、ct扫描,b超及触诊无法看到或扪及到的肿瘤如血液病中的白血病就属于非实体瘤。在现有技术中,流式细胞术检测的样本多为血液样本,体外培养的细胞样本等,较少用于组织类型样本检测。实体瘤样本做流式检测,一般用物理研磨或者酶消化得到单细胞悬液,但是这些方法会破坏细胞表面结构,使其表面蛋白的组成和数量被破坏,不仅单细胞悬液得率低,而且影响检测的准确性及灵敏度,因此,流式细胞术很难用于临床实体肿瘤的检测。
技术实现要素:
9.为了克服上述缺陷,本发明提供了一种实体肿瘤靶向治疗的评价方法,包括实体肿瘤靶向治疗分子标志物的检测和实体肿瘤周围免疫细胞的检测,所述评价方法包括以下步骤:
10.步骤一:收集新鲜肿瘤组织样本;
11.步骤二:将待测的肿瘤组织样本制成单细胞悬液;
12.步骤三:建立流式细胞仪上机模型;
13.步骤四:利用流式细胞术检测实体肿瘤靶向治疗分子标志物;
14.步骤五:利用流式细胞术检测实体肿瘤周围免疫细胞;
15.其中,步骤四和步骤五的顺序不分先后。
16.在现有技术中,对于肿瘤的治疗评价仅仅局限于肿瘤细胞本身的检测,本技术所提供的评价方法不仅对肿瘤细胞本身的标志物进行了检测,同时对肿瘤细胞所处的微环境中免疫标志物进行了检测。从而对于肿瘤药物和/或治疗方案进行系统全面的评价。本技术所述实体肿瘤微环境指实体肿瘤细胞所处的免疫微环境,在实体肿瘤中既包括肿瘤细胞又包括非肿瘤细胞,所述非肿瘤细胞构成了肿瘤细胞的微环境。进一步的,本发明所述实体肿
瘤微环境是对手术中获得肿瘤组织周围的免疫细胞进行检测,旨在判断肿瘤在人体周围的微环境是怎样的。本发明对实体肿瘤微环境的检测进一步优选的是指对实体肿瘤周围免疫细胞的检测,本发明优选的对肿瘤周围免疫细胞进行检测,进一步优选为对cd4+、cd8+细胞百分比变化的检测,和/或相关免疫细胞上pd-1变化的检测。本发明所述的微环境与传统意义上的微环境不同,本发明所述的实体肿瘤微环境不是检测了整个外周血中的免疫细胞的变化,而是该肿瘤所在位置的免疫细胞的表达情况,更加精细的反应实体肿瘤的微环境。通过本技术提供的评价既可以检测到治疗前和/或后肿瘤细胞的变化也能检测到肿瘤细胞所处微环境的变化,包括但不限于微环境中免疫细胞的种类、各免疫细胞表达的细胞因子的种类及含表达量。本发明创新的用流式方法检测实体肿瘤的靶向治疗分子生物标志物。
17.优选的是,步骤四中,实体肿瘤靶向治疗分子标志物的分子组包括:cd45、pd-l1、egfr、alk、cellcycle dye,其中egfr、alk是肺癌发病的最普遍常见的驱动基因,占亚洲非小细胞肺癌患者的绝大多数。 pd-l1是免疫筛查点,用于判断患者用否适合免疫治疗及预后。
18.cell cycle dye可以检测细胞是否非整倍体或是二倍体,与cd45一起区分实体肿瘤细胞和非肿瘤细胞。本发明首次将整倍体检测结合cd分子方式应用于流式实体肿瘤检测,即cd45与cell cycle dye的结合应用区分肿瘤细胞和非肿瘤细胞。区别于流式血液肿瘤的检测方式,主要通过前向散射fsc、侧向散色ssc结合cd分子区分。
19.通过对肿瘤标志物pd-l1及驱动基因egfr、alk表达水平的检测,帮助临床医生判断肿瘤患者的疾病进展、选择用药及判断预后效果,实现辅助诊断的目的。现有技术中,临床通过pcr或一代测序及荧光原位杂交的方法可检测到肿瘤组织样本中egfr、alk这个两个基因是否存在致病突变,通过免疫组化方法可测得肿瘤组织中三个指标蛋白的表达量,进而判断患者的病情进展情况。以上这些方法单次样本实验只能获得单个指标的检测结果,即一份组织样本每次实验只能检测一个指标,而本发明中一份组织样本单次实验可同时得到上述三个指标的检测结果,相比现有的临床检测技术达到相同的检测效果,需要较少的组织样本、人力和工时。从检测方法上讲,流式检测的方法相比免疫组化检测方法更为精准,可以避免主观因素对实验阴阳性的判读,并且可以给出实验样本表达pd-l1、alk、egfr阳性的肿瘤细胞占比。通过本技术提供的方法,利用流式细胞术,实现了将pd-l1、egfr、alk三种标志物及cd45和cell cycle dye同时进行检测,并从检测结果反映出肿瘤样本中pd-l1、egfr、alk蛋白表达量。本发明采用流式细胞术进行检测,只用一个组织样本一次性检测肿瘤的上述分子生物标记物,具有准确度高,检测时间短,采用的组织样本少的优点。
20.cd45分子在所有白细胞上都有表达,称为白细胞共同抗原(leukocyte common antigen,lca)。cd45 由一类结构相似,分子量较大的跨膜蛋白组成,广泛存在于白细胞表面,其胞浆区段具有蛋白质酪氨酸磷酸酶的作用,能使底物p56lck和p59fyn上酪氨酸脱磷酸而激活,在细胞的信息传导中发挥重要作用。cd45 是细胞膜上信号传导的关键分子,在淋巴细胞的发育成熟,功能调节及信号传递中具有重要意义,cd45的分布可作为某些t细胞亚群的分类标志。本发明中利用cd45区分实体肿瘤中肿瘤细胞,即cd45阴性群细胞是肿瘤细胞群。
21.肿瘤标志物pd-l1是共抑制程序性死亡受体pd-1的配体,又叫程序性死亡配体(programmed celldeath 1ligand 1),在许多肿瘤细胞包括非小细胞肺癌上表达。而肿瘤
细胞表面大量表达的pd-l1与t 细胞上的pd1结合使得t细胞无法识别肿瘤细胞,逃脱t细胞的“捕杀”,免受强烈的免疫反应,从而维持生长增殖。基于此,肿瘤的免疫疗法,是通过靶向药物竞争结合肿瘤细胞上的pd-l1,或者t细胞上pd-1,阻止肿瘤细胞上的pd-l1与t细胞上的pd1的结合,保障肿瘤患者免疫应答的正常激活。nccn治疗指南已经将pd-l1列为非小细胞肺癌的生物标志物,作为晚期nslcc患者的必需评估的免疫筛查点,并且ihc检测肿瘤组织中pd-l1的表达水平应不低于50%。肿瘤组织低表达pd-l1是免疫治疗疗效不佳的预测标志之一。
22.egfr是非小细胞肺癌的驱动基因,egfr的过度表达被证明与多种癌症的预后和转移性扩散有关,大多数egfr过表达与淋巴结转移和更晚期的病理分期显着相关。肺癌中,egfr蛋白的过表达以及egfr基因扩增更常见于腺癌,70%的腺癌患者中过表达egfr,不同阶段的非小细胞肺癌患者中的egfr基因表达水平有显着差异。非小细胞肺癌研究发现egfr的表达与存活率降低有关,egfr在晚期nsclc患者中过度表达与癌细胞存活、转移、侵袭,化疗耐药性有关,通常意味着较差的存活率和预后不良。
23.alk也是非小细胞肺癌的驱动基因,大约1%-7%的非小细胞肺癌患者中会出现alk重排,目前临床上已经发现alk多种重排,其中alk-eml4重排是非小细胞肺癌中最常见的。检测alk重排的方法主要有荧光原位杂交(fish)、免疫组化(ihc)、和聚合酶链反应(pcr)等。fish能特异、灵敏地检测出alk重排,是目前临床检测alk融合基因的最常用方法,pcr能够灵敏地检测出已知类型的alk重排,ihc检测alk 重排的表达的准确度和灵敏度很大程度上依赖于抗体,通常用于alk基因重排的初筛。18年中国非小细胞肺癌治疗指南将ventana alk(d5f3)ihc检测试剂盒作为alk阳性nsclc的临床首选常规诊断方法,以区别于初筛的常规ihc方法,但采用常规ihc初筛后需要进行fish或者ventnana alk,pcr中任意一种进行确诊。
24.上述任一项优选的是,步骤五中检测实体肿瘤微环境的分子组合包括cd3、cd4、cd8、cd45、pd-1。免疫治疗靶点目前常规的检测技术是免疫组化染色或者pcr技术,cd3,cd4,cd8,cd45是血液肿瘤(也就是非实体肿瘤)免疫检测相关指标,本发明的优点在于创新的用流式细胞术检测实体肿瘤周围的免疫环境,免疫细胞的表达,尤其是通过标志物cd3,cd4,cd8,cd45,pd-1的检测,在治疗前预测肿瘤发展和指导用药,在治疗后评价治疗效果,指导后续治疗方案。
25.免疫细胞是白细胞的俗称,包括淋巴细胞和各种吞噬细胞等,也特指能识别抗原、产生特异性免疫应答的淋巴细胞等,淋巴细胞是免疫系统的基本成分。淋巴细胞包括t淋巴细胞(cd3+)、b淋巴细胞、nk 细胞,其中,t细胞是淋巴细胞的主要组成。cd3+的淋巴细胞代表全t淋巴细胞。cd4+t淋巴细胞是指 cd3+cd8+的细胞毒性的t淋巴细胞。其中cd8+t细胞浸润是肿瘤的相关标志物,cd8+t细胞浸润减少是预后不良预测标志之一。
26.上述任一项优选的是,步骤二通过涡流离心力使肿瘤组织样本分散成单细胞。本发明所述的涡流离心力包括通过仪器在肿瘤组织样本(或肿瘤细胞)所在的溶液中产生涡流,涡流带动溶液产生轴向流量以及剪切速率,肿瘤组织样本(或肿瘤细胞)在溶液液体剪切力的作用下克服细胞间连接力而分散成单细胞悬液。本发明所述产生涡流的仪器包括但是不限于涡轮震荡仪和磁力搅拌器,如vortex-genie2涡旋振荡器,所述磁力搅拌器优选微量高速磁力搅拌器,如amo系列高速磁力搅拌器,velp微量滴定磁力搅拌器,所选用的磁力
搅拌器转子可采用微量四氟磁力搅拌子(英国进口),长度*直径:8*1.5mm或7*2mm或与细胞处理所使用的容器体积相适应的微量转子。在现有技术中,用于流式细胞术的单细胞悬液多是通过胰蛋白酶等酶消化的方式获得的,在这一过程中,细胞膜受到破坏,细胞表面的蛋白的分布及数量被破坏,从而使检测结果不准确。肿瘤细胞相较与正常细胞,其细胞间连接力较弱,本发明通过涡流所产生的剪切力(机械力),就足以破坏肿瘤细胞间的胞间连接,从而在不破坏肿瘤细胞细胞膜及表面蛋白情况下,将肿瘤组织样本分散成单个的肿瘤细胞。优选的涡流离心力为2000-3000rpm。通过速度能够达到3000rpm的涡旋振荡器或微量磁力搅拌装置均可实现这一技术方案。
27.上述任一项优选的是,肿瘤组织样本为体积为10-20mm2的组织块。进一步在本发明优选实施例中,优选的组织块体积为4mmx4mm的肿瘤组织块。
28.上述任一项优选的是,步骤三中,将pd-l1阳性细胞、pd-l1阴性的细胞、egfr/alk阳性细胞及外周血单个核细胞pbmc按照1:1:1:1混合,制成对照体系细胞。实体肿瘤流式检测不同于血液肿瘤的检测,血液肿瘤检测中可以将部分阴性细胞作为内对照,帮助区分各群细胞,而实体肿瘤的流式方式检测无法通过内对照细胞及fsc ssc的方式分群,这也是实体肿瘤流式检测的难点。本发明中增加了外部细胞做为对照,解决了这一难点。将对照体系细胞分别加入单管对照管中,所述单管对照管分别命名为control、egfr、 alk、cd45、pd-l1、cell cycle;其中,control管为阴性对照未加入孵育抗体,egfr管、alk管、cd45 管、pd-l1管、cell cycle进行抗体孵育;建立上机模板,对阴性对照未孵育抗体io control细胞进行补偿计算;以fsc-a和ssc-a图上机未孵育抗体control管,调整电压使得细胞在fsc-a和ssc-a图形中间,各个通道的细胞在阴性位置;上机control管与各个单管的混合管,在fsc-a和ssc-a图选择细胞,调整各通道电压,使得各通道阴性峰和阳性峰分群明显,计算各个荧光通道补偿值。按照计算的补偿值上机。
29.其中,以fsc-a和ssc-a图上机未孵育抗体control管,调整电压使得细胞在fsc-a和ssc-a图形中间,各个通道的细胞在阴性位置。这一步调整电压的作用和目的是通过调整电压明确阴性细胞群在各个通道图的位置,使得各通道阴阳性细胞群分群明显,然后计算补偿值,固定阳性细胞群所在位置,使得整个实验对于阳性细胞分析可控,保证每一次实验分析的可靠性和可重复性。虽然调节电压是流式实验的常规操作,但在现有技术中调节电压的作用是使得细胞在保持在fsc-a和ssc-a图上适当的位置,避免细胞因为太高的电压冲出可收到集信号的边界或者电压太低,造成不同群细胞挤压在一起,难以区分,这种调节电压的方法多数凭借经验,阳性细胞群的位置并不固定,判断一群细胞是否为阳性细胞需要借助同一图中阴性细胞群的位置判断。现有技术中调节补偿值是通过带有不同荧光的微球模拟细胞进行上机实验调整或者凭借经验,以得到上机图中分群的阴阳性细胞群定补偿值,与本技术的方法不同。
30.上述任一项优选的是,制备对照细胞体系的细胞包括:pd-l1阳性细胞h441、pd-l1阴性的上皮细胞、 egfr/alk阳性细胞h2228及外周血单个核细胞pbmc。
31.上述任一项优选的是,按照上机模板中的电压和补偿值上机,在fsc-a/ssc-a图上选取活的细胞,在cell cycle图中除去黏连体,将分离出的非黏连体应用于细胞周期图中,区分二倍体细胞和非整倍体细胞;将非整倍体细胞应用在cd45/ssc图中,则cd45阴性的非整倍体细胞为肿瘤细胞。而在现有的肿瘤检测技术中,流式细胞术仅用于检测血液肿瘤,血
液肿瘤的检测仅用设门cd45/ssc即可。目前,pcr无法区分肿瘤和非肿瘤,免疫组化是通过染色之后看组织细胞样子判断是肿瘤组织还是正常组织,无法对活细胞进行检测。在本发明的分析方法中,没有采用传统的cd45/ssc设门的方法,而是设计了新的分析方法,本发明利用cd45和整倍体二倍体的方法设门,并且设计了肿瘤的阴阳性对照细胞,用来分析设门。传统的cd45/ssc设门多用于检测血液肿瘤,血液样本中包括碎片细胞、白细胞和少细胞红细胞。血液肿瘤的分析主要针对不同种类的白细胞,所有白细胞都表达cd45,所以可以用cd45/ssc设门来选取到白细胞。本实验所用的样本不同于血液样本,是肿瘤组织样本,里面包括组织细胞和血液细胞,组织细胞无法用cd45区分。
32.上述任一项优选的是,将肿瘤细胞群应用于各个通道中,得到egfr+、alk+、及pd-l1+的肿瘤细胞的占比。通过实验,将相同的组织样本的流式实验结果与ihc实验结果比较得到cutoff值,高于cutoff值的样本意味某一或某几个在检肿瘤标志物阳性有临床意义,可以用于肿瘤治疗药物或者治疗方案的评估。
33.本发明还提供了一种用于实体肿瘤靶向治疗评价的试剂盒,用于上述任一项的评价方法,包括如下所示的荧光标记抗体组合:由cd45-pc7、pd-l1-apc、egfr-fitc、alk-pe、cell cycle dye-bv421组成的荧光标记抗体组合或由egfr-af488、alk-pe、cd45-pc7、af647-pd-l1、cell cycle dye组成的荧光标记抗体组合;以及由cd45-percp、cd3-apc、cd4-pc7、cd8-ac7和pd-1-fitc组成的荧光标记抗体组合。不同荧光标记的抗体,不同克隆号的抗体在实际检测中灵敏度和特异性也不相同。不同的标志物与不同荧光抗体的组合对实验检测的灵敏度具有较大影响,甚至不当的组合使检测时细胞重叠而无法得到有效的检测和区分,本发明通过反复实验获得适合的荧光抗体和最佳的使用量可以使得细胞分群更加明显,结果分析更容易。
34.本发明具有检测所需样本少,检测时间短的优点,所需组织块可以仅为4mm
×
4mm,检测用时不超过 5h,并且同时可提供有关有助于预后和治疗的多种因素的信息,包括肿瘤浸润淋巴细胞的定量, pd-l1,egfr,alk的表达阳性的肿瘤细胞的比例和共表达阳性的肿瘤细胞的比例。
35.关于fsc和ssc的名词释义:光散射信号在前向小角度(0.5
°
~2.0
°
)进行检测,称为前向散射 (forward scatter,fsc),这种信号基本上反映了细胞体积的大小;90
°
散射光又称侧向散射(sidescatter,ssc),是指与激光束-液流平面垂直的散射光,其信号强度可反映细胞部分结构的信息。
附图说明
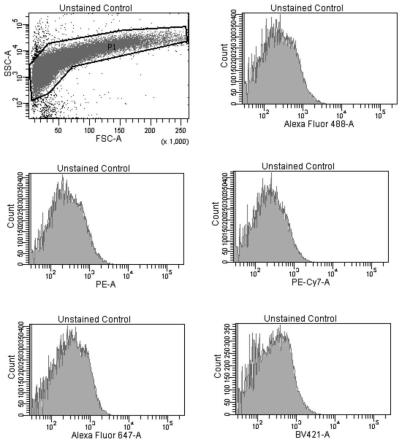
36.图1为本发明优选实施例1建立上机模板control管样品未标记检测结果。
37.图2为本发明优选实施例1建立上机模板control管样品alexa fluor 647标记结果。
38.图3为本发明优选实施例1建立上机模板control管样品bv421标记结果。
39.图4为本发明优选实施例1建立上机模板control管样品alexa fluor488标记结果。
40.图5为本发明优选实施例1建立上机模板control管样品pe标记结果。
41.图6为本发明优选实施例1建立上机模板control管样品pe-cy7标记结果。
facscanto ii软件)计算各个荧光通道补偿值。按照计算的补偿值上机。(电压值同一仪器在短时间内可以常规使用,较长时间再次检测需要再重复一遍本操作)
70.实施例2
71.新鲜组织肺癌样本检测步骤:
72.手术后的肺癌组织样本放置于ripm细胞保存液中,保存于2-8℃温度下。
73.新鲜肺癌组织样本悬液制备冰上操作
74.将ripm和新鲜的肺癌组织一起放入到干净的容器中,切成约4mm
×
4mm小块,放入到干净的1.5mlep 管中,用d-pbs或ripm吹打,将容器中残留的细胞尽量全部收集,放入到1.5ml ep管中,通过涡旋振荡器进行震荡或利用磁力搅拌器及微型转子进行搅拌,启动电源,振荡器或搅拌器的转速为3000rpm,利用培养液涡旋产生的离心力产生剪切力,使得肿瘤组织上的细胞脱落下来。将得到的细胞离心,弃上清后, d-pbs清洗一遍。用0.4%的台盼蓝染色,死细胞会被染成蓝色,显微镜下进行活细胞计数,4
×
4mm的组织块,至少可制备1
×
106个/ml单细胞悬液。
75.待测样本制备:
76.1、将待测的肺癌组织悬液制成单细胞悬液1.0
×
106个/ml;
77.2、取250μl上述细胞悬液和1ml d-pbs溶液与1.5ml离心管中,室温300g-800g离心5-10min;
78.3、吸弃上清液,留下50-100μl液体,注意不要吸到细胞沉淀;
79.4、加入100-350μl的细胞固定溶(可以保护细胞膜上的抗原完整性)轻轻吹打,重悬细胞,室温孵育1h。本发明所述固定液均为现有技术中商业化产品,优选为liquiprep利普细胞保存液。
80.对照体系制备:
81.将pd-l1阳性细胞h441 pd-l1阴性的上皮细胞、egfr/alk阳性细胞h2228及外周血单个核细胞pbmc 按照1:1混合,制成对照细胞体系。
82.抗体标记:
83.1、取200μl对照细胞加入1.5ml离心管中,在每个待测样品细胞悬液和对照细胞中分别加入1ml 2%-5%bsa溶液,室温下孵育5min;
84.2、室温下300-800g离心5-10min;
85.3、吸弃上清液,留下50-100μl液体,注意不要吸到细胞沉淀;
86.4、将抗体egfr-af488 alk-pe cd45-pc7 af647-pd-l1按照2-5ul的比例与2%-5%bsa混匀,制备成抗体混合物;
87.5、每个样品包括对照样体系中管中加入50-200μl制备好的抗体,轻轻吹打混匀;
88.6、室温下避光孵育20-30min。
89.细胞染色:
90.1、上述孵育好的每个样品和对照管中加入1ml2%-5%bsa,轻轻混匀,室温下孵育5-10min;
91.2、室温下300-800g-离心5-10min;
92.3、吸弃上清液,留下50-100μl液体,注意不要吸到细胞沉淀;
93.4、重复上述步骤1次;
94.5、每个样品和对照管中加入100μl的1μg/ml细胞染色工作液,轻轻吹打混匀,室温下避光孵育 30min;
95.将孵育好的样本流式上机:
96.按照实施例1中上机模板中的电压和补偿值上机,在fsc-a/ssc-a图上选取活的细胞,在cell cycle 图中除去黏连体,将分离出的非黏连体应用于细胞周期图中,区分二倍体细胞和非整倍体细胞。
97.将其应用在cd45/ssc图中,则cd45阴性的非整倍体细胞为肿瘤细胞(如图7,中左一绿色群细胞);
98.将肿瘤细胞群应用于各个通道中,可得到egfr+、alk+、及pd-l1+的肿瘤细胞的占比。
99.如图所示7。
100.将同一样本用流式检测到egfr+alk+pd-l1+肿瘤细胞的占比与常规方法免疫组化相比可以得到 cutoff值,高于cutoff值的样本结合临床其他试验可以帮助医生患者选择合适的药物或者治疗方案。
101.cutoff值的确定方法为:同一样本利用流式的方法与金标准的方法去比对,本发明通过20个左右的样本,分别用流式和金标准方法去检测,然后统计数据,发现在alk指标在流式结果中高于某个值的样本在金标准中判定都是阳性,低于这个值都是阴性,我们把这个值划定为cutoff值。同理其他指标的cutoff 值也一样。
102.实施例3
103.实施例3与实施例1或2的实验方法相同,不同的是,提供了一种本发明检测所使用的抗体组合的选择。如图8所示,为egfr抗体滴度实验结果,说明egfr抗体可以使用0.5ul到2ul的使用的量,都可以得到较好的实验结果。图9为pd-l1抗体滴度实验,说明pd-l1抗体可以使用0.5ul到2ul的使用的量,都可以得到较好的实验结果。图10抗体组合检测结果,可知,本发明所提供的抗体组合阴阳峰明显,可以很好的使细胞分群。
104.实施例4
105.实施例4与实施例1-3的实验方法相同,利用流式细胞术筛选对照细胞系,结果如图11所示,通过查阅文献选择a549、h1299、h2228三种细胞肺癌上皮细胞,通过实验发现h2228可同时表达egfr、 alk两种蛋白,最后选择h2228作为egfr/alk阳性细胞。
106.实施例5
107.实体肿瘤标志物的检测
108.对照细胞组成:pd-l1阳性对照细胞h4441,pd-l1阴性对照细胞beas-2b,egfr,alk阳性对照细胞 h2228,pbmc组成,每种细胞按照1.0
×
106个/ml 1:1混合制成。
109.1、低温保存在ripm(细胞培养液)不超过48h的新鲜肿瘤癌组织通过组织悬液制备器制备成组织悬液,操作中始终保持在冰上操作。取20ul组织悬液,用0.4%台盼蓝染色,活细胞计数。
110.2、将患者样本制成单细胞悬液至少1.0
×
106个/ml;
111.3、取250μl上述细胞悬液和1ml d-pbs溶液与1.5ml离心管中,室温300g离心5min;
112.4、吸弃上清液;
113.5、加入100-350μl的细胞固定液和破膜剂溶液轻轻吹打,重悬细胞,室温孵育1h。
114.抗体标记:
115.1、取200μl对照细胞加入1.5ml离心管中,在每个患者样品细胞悬液和对照细胞中加入1ml 2%bsa 溶液,室温下孵育5min;
116.2、室温下100-350g-离心5min;
117.3、吸弃上清液,留下50-100μl液体,注意不要吸到细胞沉淀;
118.4、按照下述体系制备抗体(现用现制备)
[0119][0120]
5、每个样品包括对照样管中加入100μl制备好的抗体,轻轻吹打混匀;
[0121]
6、室温下避光孵育30min。
[0122]
细胞染色:
[0123]
1、上述孵育好的每个样品和对照管中加入1ml 2-5%bsa,轻轻混匀,室温下孵育5-10min;
[0124]
2、室温下300-800g离心5-10min;
[0125]
3、吸弃上清液,留下50-100μl液体,注意不要吸到细胞沉淀;
[0126]
4、重复上述步骤1次;
[0127]
5、每个样品中的管1和对照管中加入100μl的1μg/ml cell cycle dye细胞染色工作液,轻轻吹打混匀,室温下避光孵育20-30min;
[0128]
6、上机以pd-l1 cutoff值5%,egfr cutoff值5%,alk cutoff值6%进行分析。
[0129]
如图12所示为活细胞检测结果,其中圈起来的部分外的黑色点表示的是死细胞及碎片。如图13所示,通过本发明提供的方法,肿瘤细胞团能够分散为单细胞。如图14所示,绿色区域为cd45-的组织细胞,蓝色区域为cd45+的非组织细胞,以此区分所得细胞悬液的组织细胞和非组织。如图15为整倍体和非整倍体的检测结果。如图16为egfr、alk、pd-l1的检测结果。本技术cutoff值定义为当表达某种标志物的肿瘤细胞占所有肿瘤细胞的比例超过一定的百分数之后,就认定为这个样本为所述标志物阳性的样本,所述一定的百分数即为cutoff值,cutoff值通过计算得到。具体到本实施例,通过计算得到pd-l1的 cutoff值,pd-l1的cutoff值是指表达pd-l1的肿瘤细胞占所有肿瘤细胞的比例超过5%之后,就认定这个样本是pd-l1阳性的样本。同理,egfr的cutoff值是指表达egfr的肿瘤细胞占所有肿瘤细胞的比例超过 5%之后,就认定这个样本是egfr阳性的样本;alk的cutoff值是指表达alk的肿瘤细胞占所有肿瘤细胞的比例超过6%之后,就认定这个样本是alk阳性的样本。cutoff值的计算方法如实施例2所述,在此不进行详述。
[0130]
实施例6
[0131]
肿瘤微环境检测
[0132]
低温保存在ripm(细胞培养液)不超过48h的新鲜肿瘤癌组织通过组织悬液制备器制备成组织悬液,操作中始终保持在冰上操作。
[0133]
1、组织悬液离心,用pbs洗一遍,然后0.4%台盼蓝染色,进行活细胞计数
[0134]
2、将患者样本制成单细胞悬液至少1.0
×
106个/ml;
[0135]
3、取250μl上述细胞悬液和1ml d-pbs溶液与1.5ml离心管中,室温300g-600g离心5-10min;
[0136]
4、吸弃上清液;
[0137]
5、加入250μl的细胞固定液溶液轻轻吹打,重悬细胞,室温孵育1h。
[0138]
6、加入1ml 2-5%bsa溶液,室温下孵育5-10min;
[0139]
7、室温下300-600g离心5-10min;
[0140]
8、吸弃上清液,留下50-100μl液体,注意不要吸到细胞沉淀;
[0141]
9、按照下述用量制备抗体(现用现制备)
[0142][0143]
10、加入100μl制备好的抗体,轻轻吹打混匀;
[0144]
11、室温下避光孵育20-30min。
[0145]
12、加入1ml pbs,清洗一遍,上机
[0146]
13、对微环境中免疫细胞进行分析。
[0147]
如图17为实体肿瘤周围免疫细胞的分析结果,其中免疫细胞的分析没有cutoff值,图17显示了实体肿瘤周围免疫细胞中cd4+pd-1+,cd8+pd1+的表达状况。
[0148]
实施例7
[0149]
实施例7与实施例1-6的实验方法相同,实施例7提供了cutoff具体数据,如表1所示(表中%x 45neg 是指45阴性细胞群的比例)。
[0150]
将相同的组织样本的流式实验结果与ihc实验结果比较得到cutoff值,高于cutoff值的样本意味某一或某几个在检肿瘤标志物阳性有临床意义。流式检测结果高于cutoff值的标志物阳性具有临床意义,说明可以用于肿瘤治疗药物或者治疗方案的评估。
[0151]
表1
[0152]
[0153][0154]
由表中可知,流式检测结果与ihc检测结果相比,egfr、alk的总符合率为100%,pd-l1的总体符合率为89%。利用本技术所提供的流式方法与疫组化方法相比较,对同一个实验检测结果比较一致性。 100%、89%的高符合率说明本发明所提供的流式检测方法能够替代传统的免疫组化并获得准确的检测结果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1