用于心肌肌钙蛋白I检测的组合物及应用和磁微球电化学发光免疫检测试剂盒与检测方法与流程
用于心肌肌钙蛋白i检测的组合物及应用和磁微球电化学发光免疫检测试剂盒与检测方法
技术领域
1.本发明涉及电化学检测领域,特别涉及用于心肌肌钙蛋白i(troponin i) 检测的组合物,该组合物的应用,包含该组合物的磁微球电化学发光免疫检测试剂盒,以及基于该组合物或试剂盒的磁微球电化学发光免疫检测方法。
背景技术:
2.肌钙蛋白i(tni)是横纹肌的一种关键调节蛋白。由于组织特异性高,心肌肌钙蛋白i(ctni)是心肌损伤的高敏感性标志物。ctni还可用于鉴别骨骼肌损伤(如横纹肌溶解、多发性损伤)和心肌损伤。
3.ctni升高可见于急性心肌梗死(ami)、不稳定性心绞痛(uap)和充血性心力衰竭(chf)。ctni已经明确是急性冠状动脉综合症(acs)患者的预后标志物,可以预测近期、中期甚至长期预后。ctni和ctnt已确定是预测acs后果的最佳独立标志物,也是acc/aha(美国心脏病学会)对uap 和nstemi患者处理导则的一部分。
4.肌钙蛋白的升高可以说明心肌损伤,但并不能说明缺血的机制。mi这个术语应当用于有心脏损伤迹象,如心肌缺血同时也检测到了蛋白标志物。如果临床情况表明没有发生缺血,那么应当考虑其他原因导致心脏损伤。
5.到目前为止,用于检测人血清中ctni的方法主要有:酶联免疫法(elisa) 和酶促磁微粒化学发光;本发明采用方法为电化学发光法,采用吡啶钌作为化学发光标记物具有明显优势,主要表现在:灵敏度更好,稳定性更好,钌是金属离子,分子量小,不影响抗体的空间位阻。生产过程短,检测范围宽,重复性好。电化学发光反应可控,降低信号采集难度。
技术实现要素:
6.本发明提供了一种用于心肌肌钙蛋白i(troponin i)检测的组合物及应用和磁微球电化学发光免疫检测试剂盒与检测方法,具有生产效率高、检测时间短、适用于全自动检测,具有更高的灵敏度、线性范围宽等优点。
7.为了实现上述发明目的,本发明提供以下技术方案:
8.本发明提供了用于心肌肌钙蛋白i(troponin i)检测的组合物,包括 troponin i试剂ra、troponin i试剂rb、链霉亲和素超顺磁微球;
9.所述troponin i试剂ra包括含生物素标记的抗troponin i单克隆抗体;
10.所述troponin i试剂rb包括含三联吡啶钌标记的抗troponin i单克隆抗体;
11.所述链霉亲和素超顺磁微球包括表面包裹带有链霉亲和素的超顺磁微球。
12.在本发明的一些具体实施方案中,所述超顺磁微球的粒径在1.5~5.0μm。
13.在本发明的一些具体实施方案中,所述troponin i试剂ra中,每个抗体分子表面的生物素分子标记量为2~5个;所述troponin i试剂rb中,每个抗体分子表面的钌分子标记量为2~10个。
14.在本发明的一些具体实施方案中,所述troponin i试剂ra的制备方法为:在缓冲液存在的条件下,取抗troponin i单克隆抗体与生物素混合,制得所述 troponin i试剂ra;所述缓冲液包括ph=7.4~7.8、20mm~200mm的磷酸盐缓冲液或ph=7.4~7.8、20mm~200mm的三羟甲基氨基甲烷缓冲液。
15.在本发明的一些具体实施方案中,所述troponin i试剂ra的制备方法为:取2.0mg的用于标记生物素心肌肌钙蛋白i(troponin i)抗体,使用脱盐柱 pd10更换缓冲液为磷酸盐缓冲液(ph=7.8),使用超滤管浓缩后调整浓度为 2.0mg/ml,加入80μg的生物素(使用dmf溶解),混匀反应30分钟,使用脱盐柱pd10去除未标记的生物素。使用含1%的牛血清白蛋白的磷酸盐缓冲液(ph=7.4)稀释标记生物素的心肌肌钙蛋白i(troponin i)抗体到1mg/l,作为troponin i试剂ra。
16.在本发明的一些具体实施方案中,所述troponin i试剂rb的制备方法为:在缓冲液存在的条件下,取抗troponin i单克隆抗体与三联吡啶钌混合,制得所述troponin i试剂rb;所述缓冲液包括ph=7.4~7.8、20mm~200mm的磷酸盐缓冲液或ph=7.4~7.8、20mm~200mm的三羟甲基氨基甲烷缓冲液。
17.在本发明的一些具体实施方案中,所述troponin i试剂rb的制备方法为:取2.0mg的用于标记三联吡啶钌的心肌肌钙蛋白i(troponin i)抗体,使用脱盐柱pd10更换缓冲液为磷酸盐缓冲液(ph=7.8),使用超滤管浓缩后调整浓度为2.0mg/ml,加入80μg的琥珀酰胺三联吡啶钌(使用dmf溶解),混匀反应30分钟,使用脱盐柱pd10去除未标记的钌。使用含1%的牛血清白蛋白的磷酸盐缓冲液(ph=7.4)稀释标记钌的心肌肌钙蛋白i(troponin i)抗体到1mg/l,作为troponin i试剂rb。
18.在本发明的一些具体实施方案中,本发明提供的组合物还包括定标品和/ 或清洗液;所述清洗液包括浓度150~200mmol/l的三丙胺和浓度 200~400mmol/l的磷酸盐缓冲液;或浓度80~100mmol/l的二丁基乙醇胺和浓度200~400mmol/l的磷酸盐缓冲液。
19.在本发明的一些具体实施方案中,所述清洗液包括但不限于三丙胺清洗液、二丁基乙醇胺清洗液、管路清洗液。
20.在本发明的一些更具体的实施方案中,所述清洗液包括浓度180mmol/l 的三丙胺和浓度300mmol/l的磷酸盐缓冲液;或浓度90mmol/l的二丁基乙醇胺和浓度300mmol/l的磷酸盐缓冲液。
21.在本发明的一些具体实施方案中,所述troponin i试剂ra、所述troponini试剂rb与所述链霉亲和素超顺磁微球的体积比为(50~80):(50~80): (20~40)。
22.在上述研究的基础上,本发明还提供了所述的组合物在制备心肌肌钙蛋白i(troponin i)的磁微球电化学发光免疫检测试剂盒中的应用。
23.本发明还提供了心肌肌钙蛋白i(troponin i)的磁微球电化学发光免疫检测试剂盒,包括所述的组合物以及检测可接受的试剂。
24.本发明还提供了心肌肌钙蛋白i(troponin i)的磁微球电化学发光免疫检测方法,该方法基于所述的组合物或所述的试剂盒,包括如下步骤:
25.步骤1:取样本,依次加入troponin i试剂ra和troponin i试剂rb,于 37℃孵育8~12min,最后加入链霉亲和素超顺磁微球,于37℃孵育8~12min,获得反应液;其中,样本、troponin i试剂ra、troponin i试剂rb与链霉亲和素超顺磁微球的体积比为15:(50~80):
(50~80):(20~40);
26.步骤2:将所述反应液用磁铁吸附;
27.步骤3:取清洗液,清洗未结合到超顺磁微球上的标记钌的抗体和样本,通电,在所述清洗液存在的条件下三联吡啶钌发光;
28.步骤4:记录发光值,建立标准曲线,根据建立的标准曲线,获得样本中 troponin i的浓度。
29.在本发明的一些具体实施方案中,所述孵育为于37℃孵育9min。
30.在本发明的一些具体实施方案中,所述检测方法具体为:
31.步骤1:取样本50μl加入反应管中,再依次加入troponin i试剂ra 60μl 和troponin i试剂rb 60μl,于37℃孵育9min,最后加入链霉亲和素超顺磁微球30μl,于37℃孵育9min;
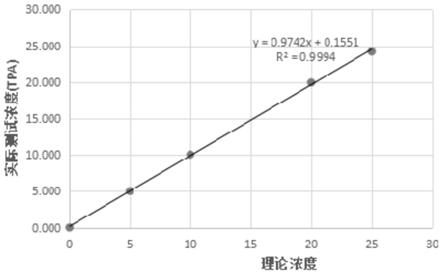
32.步骤2:将孵育反应完成的反应管通过吸液钢针吸入电化学流通池,并被流通池的磁铁吸附;
33.步骤3:吸液钢针吸取清洗液(三丙胺或dbae),未结合到超顺磁微球上的标记钌的抗体和样本被清洗后,流通池加电,在三丙胺或dbae存在的条件下三联吡啶钌发光。
34.步骤4:光电倍增管记录发光值,建立标准曲线,根据建立的标准曲线,计算样本中troponin i的浓度。
35.磁微粒可以作为生物大分子的载体,抗体包被的磁微粒称为免疫磁微粒,由于其既有结合抗原的特性又有磁性的特点,因此,在从复杂样品中分离、纯化与浓集目的微生物、细胞和生物大分子等方面具有较多优势,包括快速、特异性强、操作简便、使用范围广等。纳米材料是20世纪90年代后得到迅猛发展的新材料,纳米磁微粒(粒径小于10nm~100nm)在磁结构和磁性方面与一般磁微粒有很大区别:纳米磁性颗粒,单位体积颗粒数目更多,比表面积更大;具有超顺磁性,磁相互作用很弱;它可在外加磁场作用下定向运动,使得某些特殊成份得以分离、浓集或纯化等。本发明建立的磁微粒化学发光法灵敏度高、特异性强、准确快速、检测时间短、检测结果具有更高的准确性与重复性。
附图说明
36.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
37.图1示出实施例8
‑
(1)的反应方法中稀释浓度与实测浓度的直线拟合结果;
38.图2示出实施例8
‑
(2)的反应方法中稀释浓度与实测浓度的直线拟合结果。
具体实施方式
39.本发明公开了一种用于心肌肌钙蛋白i(troponin i)检测的磁微球电化学发光免疫检测试剂盒,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
40.本发明提供如下技术方案:一种troponin i磁微球电化学发光试剂盒,包括:troponin i试剂ra、troponin i试剂rb、链霉亲和素超顺磁微球、定标品、三丙胺清洗液、二丁基乙醇胺清洗液、管路清洗液。
41.上述一种troponin i磁微球电化学发光试剂盒,其中,troponin i试剂ra 为含生物素标记的抗troponin i单克隆抗体,每个抗体分子表面的生物素分子标记量在2~5个,所述的缓冲液为20mm~200mm磷酸盐缓冲液,ph=7.4~7.8 或20mm~200mm三羟甲基氨基甲烷缓冲液,ph=7.4~7.8。troponin i试剂rb 为含三联吡啶钌标记的抗troponin i单克隆抗体,每个抗体分子表面的钌分子标记量在2~10个,所述的缓冲液为20mm~200mm磷酸盐缓冲液,ph=7.4~7.8 或20mm~200mm三羟甲基氨基甲烷缓冲液,ph=7.4~7.8。
42.上述一种troponin i磁微球电化学发光试剂盒,其中,所述链霉亲和素超顺磁微球为表面包裹带有链霉亲和素的超顺磁微球,所述磁微球的粒径在 1.5~5.0微米,所述磁微粒包被物缓冲液为20mm~200mm磷酸盐缓冲液, ph=7.4~7.8或20mm~200mm三羟甲基氨基甲烷缓冲液,ph=7.4~7.8。
43.上述一种troponin i磁微球电化学发光试剂盒,其中,所述生物素标记的 troponin i抗体为单克隆抗体。
44.上述一种troponin i磁微球电化学发光试剂盒的检测方法,其中,所述清洗液为浓度180mmol/l的三丙胺,其中含浓度300mmol/l的磷酸盐缓冲液;或浓度90mmol/l的二丁基乙醇胺,其中含浓度300mmol/l的磷酸盐缓冲液。
45.本发明提供一种troponin i磁微球电化学发光试剂盒的检测方法,包括如下步骤:
46.1)取样本50μl加入反应管中,再依次加入troponin i试剂ra 60μl和 troponin i试剂rb 60μl,于37℃孵育9min,最后加入链霉亲和素超顺磁微球 30μl,于37℃孵育9min;
47.2)将孵育反应完成的反应管通过吸液钢针吸入电化学流通池,并被流通池的磁铁吸附;
48.3)吸液钢针吸取清洗液(三丙胺或dbae),未结合到超顺磁微球上的标记钌的抗体和样本被清洗后,流通池加电,在三丙胺或dbae存在的条件下三联吡啶钌发光。
49.4)光电倍增管记录发光值,根据建立的标准曲线,计算样本中troponini的浓度。
50.链霉亲和素与生物素具有高特异性的结合能力,链霉亲和素与生物素标记的高纯度抗体非共价键特异性结合,具有级联放大的作用,其反应呈高度专一性。因此,在提高灵敏度的同时,并不增加非特异性干扰,而且结合特性不会因反应试剂的高度稀释而受影响,使其在实际应用中可最大限度地降低反应试剂的非特异作用。
51.本发明将抗体
‑
抗原反应的高度特异性与三联吡啶钌发光的高度灵敏性结合起来,利用三联吡啶钌在三丙胺或dbae下产生的光子以检测产物浓度,具有灵敏度更高、反应时间短、操作简单、抗干扰性高的特点。
52.本发明提供的用于心肌肌钙蛋白i(troponin i)检测的磁微球电化学发光免疫检测试剂盒中所用原料及试剂均可由市场购得。
53.本发明检测试剂盒中的所有组分均能通过商业途径从生物试剂或化学试剂公司购买得到。使用的设备为北京联众泰克科技有限公司生产的全自动化学发光免疫分析仪(型号ud90dt)。
54.下面结合实施例,进一步阐述本发明:
55.实施例1:生物素标记心肌肌钙蛋白i(troponin i)抗体和试剂ra的制备
56.用于标记生物素的心肌肌钙蛋白i(troponin i)抗体购自北京缘田馨野科技有限公司,货号为yt
‑
troponin i
‑
002,克隆号为3a1。
57.取2.0mg的用于标记生物素心肌肌钙蛋白i(troponin i)抗体,使用脱盐柱pd10更换缓冲液为磷酸盐缓冲液(ph=7.8),使用超滤管浓缩后调整浓度为2.0mg/ml,加入80μg的生物素(使用dmf溶解),混匀反应30分钟,使用脱盐柱pd10去除未标记的生物素。使用含1%的牛血清白蛋白的磷酸盐缓冲液(ph=7.4)稀释标记生物素的心肌肌钙蛋白i(troponin i)抗体到1mg/l,作为troponin i试剂ra。每个抗体分子表面的生物素分子标记量为2~3个。
58.实施例2:钌标记心肌肌钙蛋白i(troponin i)抗体和试剂rb的制备
59.用于标记生物素的心肌肌钙蛋白i(troponin i)抗体购自北京缘田馨野科技有限公司,货号为yt
‑
troponin i
‑
003,克隆号为4f7。
60.取2.0mg的用于标记三联吡啶钌的心肌肌钙蛋白i(troponin i)抗体,使用脱盐柱pd10更换缓冲液为磷酸盐缓冲液(ph=7.8),使用超滤管浓缩后调整浓度为2.0mg/ml,加入80μg的琥珀酰胺三联吡啶钌(使用dmf溶解),混匀反应30分钟,使用脱盐柱pd10去除未标记的钌。使用含1%的牛血清白蛋白的磷酸盐缓冲液(ph=7.4)稀释标记钌的心肌肌钙蛋白i(troponin i) 抗体到1mg/l,作为troponin i试剂rb。每个抗体分子表面的钌分子标记量为5~6个。
61.实施例3:定标品的制备
62.用于定标品制备用的抗原购自北京缘田馨野科技有限公司,货号为 yt
‑
troponin i
‑
001。为重组表达蛋白。
63.使用含1%的牛血清白蛋白的磷酸盐缓冲液(ph=7.4)按照标识浓度稀释抗原到5.0pg/ml、150pg/ml。作为定标品使用,用于建立标准曲线。
64.实施例4:三丙胺清洗液、二丁基乙醇胺清洗液的制备
65.配制300mmol/l的磷酸盐缓冲液,添加三丙胺到180mmol/l,混匀溶解。作为三丙胺清洗液。
66.配制300mmol/l的磷酸盐缓冲液,添加二丁基乙醇胺到90mmol/l,混匀溶解。作为二丁基乙醇胺清洗液。
67.实施例5:
68.心肌肌钙蛋白i(troponin i)测定采用夹心法,其检测方法如下:
69.1)取样本50μl加入反应管中,再依次加入实施例1中制备的troponin i 试剂ra 60μl和实施例2中制备的troponin i试剂rb 60μl,于37℃孵育9min,最后加入链霉亲和素磁微球(粒径为3.0μm)30μl,于37℃孵育9min;
70.2)将孵育反应完成的反应管通过吸液钢针吸入电化学流通池,并被流通池的磁铁吸附;
71.3)吸液钢针吸取清洗液(三丙胺),未结合到超顺磁微球上的标记钌的抗体和样本被清洗后,流通池加电,在三丙胺存在的条件下三联吡啶钌发光。
72.4)光电倍增管记录发光值,根据企业提供的曲线使用定标品的发光值进行校正后
建立的标准曲线,计算样本中troponin i的浓度。
73.实施例6:
74.心肌肌钙蛋白i(troponin i)测定采用夹心法,其检测方法如下:
75.1)取样本50μl加入反应管中,再依次加入实施例1中制备的troponin i 试剂ra 60μl和实施例2中制备的troponin i试剂rb 60μl,于37℃孵育9min,最后加入链霉亲和素超顺磁微球(粒径为3.0μm)30μl,于37℃孵育9min;
76.2)加入包被链霉亲和素的超顺磁微球进行孵育,让上述形成的免疫复合物通过生物素与链霉亲和素间的相互作用结合到超顺磁微球上;
77.3)孵育结束后将反应混和液吸到测量池中,超顺磁微球通过磁铁吸附到电极上,吸液钢针吸取清洗液(二丁基乙醇胺),未结合到超顺磁微球上的标记ru(bpy)
32+
的抗体和样本被清洗后,流通池加电,在二丁基乙醇胺存在的条件下ru(bpy)
32+
发光。
78.4)光电倍增管记录发光值,根据企业提供的曲线使用定标品的发光值进行校正后建立的标准曲线,计算样本中troponin i的浓度。
79.实施例7:空白限测试
80.(1)以实施例5中反应方法,用零浓度稀释液作为样本,得到20次测量结果的rlu值(相对发光值),计算其平均值(m)和标准差(sd),得出m+2sd,同时相邻浓度的样品重复测试2次,根据零浓度稀释液和相邻低浓度样品之间的浓度
‑
rlu进行两点回归拟合得出一次方程,将m+2sd的 rlu值代入上述方程中,求出对应的浓度值即为空白限。
81.表1
[0082][0083]
(2)以实施例6中反应方法,用零浓度稀释液作为样本,得到20次测量结果的rlu值(相对发光值),计算其平均值(m)和标准差(sd),得出m+2sd,同时相邻浓度的样品重复测试2次,根据零浓度稀释液和相邻低浓度样品之间的浓度
‑
rlu进行两点回归拟合得出一次方程,将m+2sd的 rlu值代入上述方程中,求出对应的浓度值即为空白限。
[0084]
表2
[0085][0086]
实施例8:线性范围的验证
[0087]
(1)以实施例5中反应方法,将接近线性范围上限(25ng/ml)的高值样品按一定比例稀释为至少5种浓度,其中低值浓度的样品须接近0.50ng/ml。对每一浓度的样品均重复检测2次,计算其平均值,即为实测浓度,将稀释浓度和实测浓度用最小二乘法进行直线拟合,并计算线性相关系数r,r不小于0.99。稀释浓度与实测浓度的直线拟合结果如图1所示。
[0088]
表3
[0089]
项目样本1样本2样本3样本4样本5稀释浓度0.015102025实测浓度10.00105.1310.1219.7924.06实测浓度20.0104.939.9920.1024.35实测浓度0.0105.0310.0519.9424.21
[0090][0091]
(2)实施例6中反应方法,将接近线性范围(25ng/ml)上限的高值样品按一定比例稀释为至少5种浓度,其中低值浓度的样品须接近0.50ng/ml。按试剂盒说明书进行操作,对每一浓度的样品均重复检测2次,计算其平均值,即为实测浓度,将稀释浓度和实测浓度用最小二乘法进行直线拟合,并计算线性相关系数r,r不小于0.99。稀释浓度与实测浓度的直线拟合结果如图2 所示。
[0092]
表4
[0093]
项目样本1样本2样本3样本4样本5稀释浓度0.015102025实测浓度10.0105.2310.2221.0525.13实测浓度20.0115.0710.0920.3124.85
实测浓度0.0115.1510.1520.6824.99
[0094][0095]
汇总对比的试剂盒的情况:
[0096]
表5
[0097] 实施例7
‑
8对比例1对比例2方法学电化学发光夹心法酶促化学发光法酶联免疫吸附试验灵敏度0.01ng/ml0.25ng/ml0.3ng/ml线性范围0.01
‑
25ng/ml0.25
‑
20ng/ml0.3
‑
20ng/ml检测时间18分钟20分钟120分钟抗体处理60分钟大于10小时大于10小时
[0098]
电化学发光免疫分析技术具有灵敏度高、快速、准确、重复性好并安全无毒无污染等优点。鲁米诺、异鲁米诺及其衍生物是最早使用的一类化学发光物质,但其应用于化学发光免疫分析,需要使用催化剂和增强剂,这将导致背景发光增强,从而限制了这一技术的灵敏度和它的应用及发展。吖啶酯发光体系简单,不需要催化剂,置于h2o2溶液中即可发光,无需催化过程、增强剂,所以降低了背景发光,提高了灵敏度且干扰作用小,但是由于吖啶酯容易水解,同时吖啶酯的发光释放迅速。发光峰值在0.4s,所以需要原位进样,对设备要求高。而三联吡啶钌易与蛋白质联结,分子量小,对联结后抗体构象影响小,标记物是金属离子,稳定性好,发光需要在加电条件下,所以发光可控。因此在troponin i的检测上应用电化学的方法可以提高产品的灵敏度、缩短工艺标记时间、提高线性范围、缩短试验时间,为临床及时应对脑外伤处理提供依据。
[0099]
电化学发光标记物吡啶钌性质非常稳定,其发光效率不受温度、ph、离子强度等因素的影响。电化学发光试剂信号值与新鲜试剂相比信号值下降在 3%以内。开瓶效期为三个月,2
‑
8℃可稳定15个月以上。
[0100]
表6
[0101]
发光体系辣根酶
‑
鲁米诺吖啶酯碱性磷酸酶电化学发光标记时间大于24小时1小时大于24小时30分钟试验时间60分钟20分钟30分钟18分钟试剂有效期12个月12个月12个月大于15个月
[0102]
电化学标记反应迅速,整个反应只需半小时。标记效率达到70%。标记的比例可以通过投料比进行控制,提高产能50%以上。钌的分子量小(800d) 空间位阻小,抗体活性好。455nm的吸收峰,可以控制投料比来控制批间差。
[0103]
上述步骤表明,本发明采用的夹心法的反应模式,利用磁微球电化学的原理,定量检测人血清或血浆样品中的心肌肌钙蛋白i(troponin i)含量,确保了检测的灵敏度。并适合用于全自动设备使用。加大了检测速度和检测通量,提高了检测效率,同时避免了人为操作导致的误差。
[0104]
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本发明的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1