使用FACS分离胎儿细胞的制作方法
使用facs分离胎儿细胞
技术领域
1.本发明涉及用于从来自孕妇的血液样品中分离胎儿细胞的自动化方法。分离的胎儿细胞可用于识别胎儿dna中的遗传异常。
背景技术:
2.在妊娠期间,来自胎盘的胎儿细胞会侵入母体血液循环。这些胎儿细胞大多起源于胎盘,是滋养层细胞、血管内滋养层细胞或绒毛外滋养层细胞(evt)。这些侵入母体循环的胎儿细胞显示出内皮和上皮特征。上皮滋养层细胞改变特征并侵入母体循环的过程称为上皮-间充质转化(emt)。
3.emt是上皮细胞逐渐失去其上皮特征并获得间充质样表型的过程。emt在早期胚胎形成中已有描述,其中胚胎上皮细胞的迁移和瞬时去分化是形成神经管等所必需的。
4.通过利用中胚层标记物(即内皮标记物)作为阳性选择标记物,母体血液样品中存在的极少量的胎儿细胞与一些母体细胞一起被富集。随后通过使富集的细胞与上皮标记物接触从而利用emt现象来对胎儿细胞进行阳性识别。血液样品中存在的正常母细胞均未表达任何上皮标记物。
5.在图2a所示的现有技术方法中,母体血液样品经过处理,然后进行富集,以去除大部分母体细胞。随后,用荧光标记的母体和胎儿标记物对细胞进行染色,并在载玻片上进行扫描。考虑到母体血液样品中胎儿细胞的出现率极低,后一个过程既繁琐又耗时。
技术实现要素:
6.在一个方面,本发明涉及一种从孕妇的生物样品中分离胎儿细胞的方法,所述方法包括步骤:
7.a.提供来自所述孕妇的生物样品,该生物样品包含细胞组分,
8.b.使所述细胞组分中包含的细胞与针对至少一种胎儿细胞上皮标记物和/或内皮标记物的一种或多种荧光标记剂接触,
9.c.基于与细胞结合的所述一种或多种荧光标记剂的检测,通过荧光激活细胞分选法(facs)分选所述细胞,和
10.d.在所述分选细胞中识别胎儿细胞,包括将胎儿来源分类器分配给各个分选细胞的步骤。
11.本发明人做出了令人惊讶的观察,即可以使用facs进行单细胞分选,随后通过简单地分析facs输出,结合大量参数(例如散射和来自一个或多个荧光标记抗体的信号)来识别具有高胎儿概率的细胞。该输出可以组合到分类器中,其可以是数字分数或二元的。使用本发明的方法,发明人开发了一种以很高的可能性在分选细胞中识别胎儿细胞的方法。
12.与现有技术方法相比的优点如图1中所示,主要优点在于该过程可以完全自动化并且不需要拾取被识别为可能的胎儿细胞的细胞。
13.被识别的细胞可通过遗传分析确认为胎儿细胞,并可进一步用于识别细胞中的遗
传异常。
14.在另一方面,本发明涉及一种确定胎儿遗传异常的方法,所述方法包括步骤:
15.a.获得通过本发明的方法分离的一种或多种胎儿细胞,和
16.b.检测与所述胎儿细胞基因组中的所述遗传异常相关的一种或多种遗传标记物。
附图说明
17.图1
18.使用facs富集和分离胎儿细胞的基本原理。a)=此步骤后的胎儿细胞访问很费力且使过程通量低。b)=此步骤后的胎儿细胞访问速度较快,母体细胞污染风险更低。不过仍然需要人为干预。c)=没有对胎儿细胞的物理拾取。每96孔板1个细胞,然后进行单细胞分析。
19.图2
20.不使用facs(a)和使用facs(b)的胎儿细胞富集
21.a.1和b.1=采样,a.2和b.2=血液处理,a.3和b.3=选择、富集和染色,a4和b.5=扫描、和“拾取”胎儿细胞,b.4=facs。
22.图3
23.alexa fluor 488(x轴)(ck抗体)和pe(y轴)(cd14+cd45)的facs图上门1(gate 1)的x和y坐标。五个坐标中连接对角线的两个不是固定的,而是在x和y轴上有一个范围。
24.图4
25.使用facs进行单细胞分选并使用str分析法对它们进行分析。a)=采样,b)=血液处理,c=选择、富集和染色,d)=facs和e)=abi 3500(str分析)
26.图5
27.alexa fluor 488(x轴)(ck抗体)和pe(y轴)(cd14+cd45)的facs图上门g7的x和y坐标。门g7用于在各个管中各自分选单细胞。
28.图6
29.对单分选的细胞进行str分析的编译数据。图中的百分比是每个样品的各自百分比的平均值。a)=母体细胞,b)=胎儿细胞,c)=胎儿+母体细胞,d)=空,e)=其他污染
30.图7
31.使用facs进行单分选细胞之后,对胎儿细胞进行富集、识别和分析的完整实施流程。a)=采样,b)=血液处理,c=选择、富集和染色,d)=facs,e)=全基因组扩增(wga),f)=abi 3500(str分析)和g)=阵列比较基因组杂交。
32.图8
33.门控策略。a)所有事件,fsc-a(x轴)和ssc-a(y轴)。排除了具有高ssc值的事件(碎片)。b)低ssc事件,fsc-a(x轴)和hoechst(y轴)。然后对剩余的细胞进行门控以获得hoechst
+
细胞。c)hoechst事件,af488(x轴)和af555(y轴)。从hoechst
+
组分中,对ck+cd45-cd14-细胞进行单细胞分选。
34.图9
35.第一次分选的门控策略。a)所有事件,fsc-a(x轴)和ssc-a(y轴)。排除了具有高ssc值的事件(碎片)。b)低ssc事件,fsc-a(x轴)和hoechst(y轴)。然后对剩余的细胞进行门
控以获得hoechst
+
细胞。c)hoechst事件,af488(x轴)和af555(y轴)。从hoechst
+
组分中,ck
中-至-高
cd45-cd14-细胞被批量分选作为富集步骤。
36.图10
37.第二次分选的门控策略。a)所有事件,fsc-a(x轴)和ssc-a(y轴)。排除了具有高ssc值的事件(碎片)。b)低ssc事件,fsc-a(x轴)和hoechst(y轴)。然后将剩余的细胞门控以获得hoechst
+
细胞。c)hoechst事件,af488(x轴)和af555(y轴)。从hoechst
+
组分中,对ck
高
cd45-cd14-细胞进行单细胞分选。
38.图11
39.样品3091-b的第一次分选的门控策略。a)所有事件,fsc-a(x轴)和ssc-a(y轴)。排除了具有高ssc值的事件(碎片)。b)低ssc事件,fsc-a(x轴)和hoechst(y轴)。然后将剩余的细胞门控以获得hoechst
+
细胞。c)hoechst事件,af488(x轴)和af555(y轴)。从hoechst
+
组分中,对cd141+cd105
中至高
cd45-cd14-细胞进行批量分选作为富集步骤。
40.图12
41.样品3091-b的第二次分选的门控策略。a)所有事件,fsc-a(x轴)和ssc-a(y轴)。排除了具有高ssc值的事件(碎片)。b)低ssc事件,fsc-a(x轴)和hoechst(y轴)。然后将剩余的细胞门控以获得hoechst
+
细胞。c)hoechst事件,af488(x轴)和af555(y轴)。从hoechst
+
组分中,对cd141+cd105
高
cd45-cd14-细胞进行单细胞分选。
42.图13
43.第二次分选的门控策略。a)低ssc事件、af488(x轴)和af555(y轴)。样品aal302-b的第二次分选。没有添加hoechst、cd45或cd14。b)低ssc和hoechst事件,af488(x轴)和af555(y轴)。样品aal302-a的第二次分选。添加了hoechst,但没有添加cd45或cd14。
44.图14
45.第二次分选的门控策略。a)低ssc和hoechst事件、af488(x轴)和af555(y轴)。样品ko381的第二次分选,其中未添加cd45。b)低ssc和hoechst事件,af488(x轴)和af555(y轴)。样品ko380的第二次分选,其中未添加cd14。
具体实施方式
46.图1说明了从母体血液样品中分离胎儿细胞的相关挑战。通常,30ml的血液样品在红细胞裂解后包含大约1.5亿个细胞。这些可以使用如本文所述的富集方法富集以获得胎儿细胞。这样可能会得到包含大约250,000个细胞的样品,其中胎儿细胞极少,因此人工筛选胎儿细胞或从载玻片中拾取细胞是一种非常费力的方法。
47.图2a的流程图中说明了这种方法的一个实例,其中血液样品经采集,处理样品并进行富集。剩余的细胞被点在载玻片上,并使用手动和半自动程序相结合在显微镜中扫描和拾取。
48.我们的一个实施例表明,荧光激活细胞分选法(facs)可用于进一步富集该细胞群以获得胎儿细胞,使仍需单个检查的细胞数降至数千个细胞。在图2b中可以找到说明这种方法的流程图。
49.发明人做出了令人惊讶的发现,即可以从富集的母体血液样本中单分选胎儿细胞,因此本发明还涉及一种产前诊断方法,包括步骤:
50.1.提供来自怀有胎儿的妇女的血液样品,所述血液样品包含细胞组分,
51.2.富集所述样品以获得胎儿细胞,
52.3.使所述样品与选自以下各组的至少一种荧光标记剂接触:
53.i.针对细胞核的荧光标记剂,
54.ii.针对母体细胞标记物的荧光标记剂,和
55.iii.针对胎儿细胞标记物的荧光标记剂
56.4.在荧光激活细胞分选仪(facs)上从所述富集的样品中单细胞分选至少一个胎儿细胞,基于:
57.i.所述针对胎儿细胞标记物的荧光标记剂的阳性选择,
58.ii.所述针对细胞核的荧光标记剂的阳性选择,和
59.iii.所述针对母体细胞标记物的荧光标记剂的阴性选择
60.5.在所述分选细胞中识别所述至少一个胎儿滋养层细胞,包括通过从所述胎儿滋养层细胞获得基因型,将胎儿来源分类器分配给各个分选细胞的步骤,以及
61.6.诊断胎儿的表型。
62.用macs富集的目的是减少加载到facs仪器中的细胞数量(参见图1,显示富集将细胞数量从约1.5亿减少到约250,000)。如实施例中所示,进行macs富集不是必需的,该实施例证明了从未富集的样品中识别胎儿细胞也是可能的。这仅会导致facs机器中出现更多的事件。更具体地,实施例3显示facs可用于富集样品以获得胎儿细胞。
63.磁激活细胞分选法(macs)是一种根据细胞表面抗原(cd分子)分离各种细胞群的方法。
64.在其他实施方式中,macs用于细胞内靶点,例如带有针对上皮标记物的微珠,例如细胞角蛋白微珠。
65.miltenyi biotec的macs系统使用超顺磁性纳米颗粒和柱子。超顺磁性纳米颗粒的数量级为100nm。它们用于标记目标细胞,以便将它们捕获在柱子内。柱子置于永磁体之间,使得当磁性颗粒-细胞复合物通过它时,可以捕获标记的细胞。柱子由钢丝绒组成,当柱子置于永磁体之间时,它会增加磁场梯度以最大限度地提高分离效率。
66.磁激活细胞分选法是一种常用的方法,通常与微珠结合使用,微珠是与抗体偶联的磁性纳米颗粒,可用于靶向特定细胞。磁激活细胞分选法可用于富集细胞群以获得所需细胞。磁性纳米颗粒可以直接与标记剂偶联。磁性纳米颗粒还可以与能够结合标记剂的另一种试剂偶联(二次标记)。
67.如果选择macs作为富集步骤,则优选在该步骤之前的步骤为:使细胞组分中包含的细胞与至少一种针对胎儿细胞标记物的磁性标记试剂接触。
68.在本说明书的一种实施方式中,通过选择被标记剂标记的细胞,将样品富集以获得胎儿细胞,该标记剂对一种或多种内皮标记物具有特异性。内皮标记物的实例在下文进一步描述。
69.在本说明书的一种实施方式中,通过选择被标记剂标记的细胞,将样品富集以获得胎儿细胞,该标记剂对一种或多种上皮标记物具有特异性。上皮标记物的实例在下文进一步描述。
70.上皮标记物可用于富集样品中的胎儿细胞。富集可通过将抗体固定在固体表面来
完成。
71.细胞分选法是一种根据特定物理特征的存在与否来纯化细胞群的方法。在具有分选功能的流式细胞仪中,该仪器利用包括细胞大小、形态和蛋白质表达在内的参数来检测细胞,然后使用液滴技术分选细胞并回收子集以供实验后使用。
72.与流式细胞分析仪不同,流式细胞仪细胞分选仪具有收集系统。当样品被注入鞘液流时,鞘液流经过流通池,激光拦截,则收集过程开始。然后该液流携带细胞通过振动喷嘴。液流中的扰动使其断裂成理想情况下包含一个细胞的液滴。充电环放置于液流断裂成液滴的位置。在测量荧光强度之前,一种电荷被置于环上,当液滴从液流中断裂时,相反的电荷被捕获在该液滴上。然后带电的液滴通过静电偏转系统落下,该系统根据液滴的电荷将它们转移到容器中。在一些系统中,电荷直接施加到液流上,而断开的液滴保留了与液流相同符号的电荷。然后,在液滴断开后,液流恢复到中性。
73.如果是在无菌条件下收集,则分选的细胞可以被进一步培养、操作和研究。
74.这种facs上的分选可以是单细胞分选和批量分选,被丢弃且未显示给定阈值的细胞是
……
75.设置门控以定义facs仪器如何分选细胞。落在设置范围内的细胞被分选,落在门控范围外的细胞或者被分选用于之后的研究,或者被丢弃。根据用户如何设置facs仪器,分选可以是批量分选或单细胞分选。批量分选会使落在给定门控设置范围内的细胞被收集在同一管中。单细胞分选使落在给定设置范围内的细胞被各自分选到收集管中。单细胞分选通常比批量分选更耗时,如实施例5中所示。
76.由于facs仪器能够每秒分选几千个细胞,因此根据实验,不同的设置可能变化很大。当分拣到单细胞区室时,需要具有低输出,例如96孔板。相反,当使用批量分选时,可以分选数千个细胞/管。
77.在本发明的一种实施方式中,用批量分选富集样品。在另一种实施方式中,用单细胞分选来单个分选细胞,例如分入单细胞区室。
78.根据实验的门控策略,可以通过首先用批量分选然后用单分选,减少需要应用于样品的试剂数量以及实验所用的时间。这些参数适宜地可包括量化前向散射、侧向散射以及由流式细胞仪内的激光激发的荧光团发射的荧光。
79.前向散射被理解为物体引起的光路方向上的干扰,通常与细胞的大小相关。
80.侧向散射被理解为从光路方向反射的光,通常与光路中的颗粒数量相关。
81.当光源(例如激光)激发存在于样品上的荧光团,并穿过本领域技术人员知晓的与给定的激光和荧光团相配合的滤波器时,发射的荧光就被量化。给定一个具有特定激发波长和发射波长的荧光团,技术人员能够选择具有适宜波长的光源以及适宜的激发和发射滤波器。
82.当流式细胞仪测量了参数后,可以对细胞进行分选。适宜地,它是通过将每个细胞分选到单独的区室中来完成的。分选的细胞优选地是表达至少一种上皮标记物和/或内皮标记物并且不表达至少一种对血细胞具有特异性的细胞标记物的细胞。如何选择细胞进行分选的实例可以在选择特定门控(gate)进行分选的实例中找到。选择门控使分选胎儿细胞的可能性最大化,同时保持所分选细胞的数量相对较低。剩余的—未分选的—细胞被丢弃,因为预计它们不包含任何胎儿细胞。
83.在另一种优选的实施方式中,使用facs富集,其中优选地,在当前被富集的样品于facs上进行单细胞分选之前,将分选的细胞收集在一个管中。
84.在一种实施方式中,基于来自上皮标记物的信号,样品在facs上被富集。
85.在另一种实施方式中,基于来自内皮标记物的信号,样品在facs上被富集。
86.因此,如果选择facs作为富集步骤,则优选该步骤之前的步骤为:使细胞组分中包含的细胞与至少一种针对胎儿细胞标记物的荧光标记剂接触。
87.在富集步骤之后,通过facs进行单细胞分选。在一种优选的实施方式中,对至少一种上皮标记物呈阳性并且对所述至少一种血细胞标记物呈阴性或低的细胞被分选到单细胞区室中。这在图8,c)中有例证。
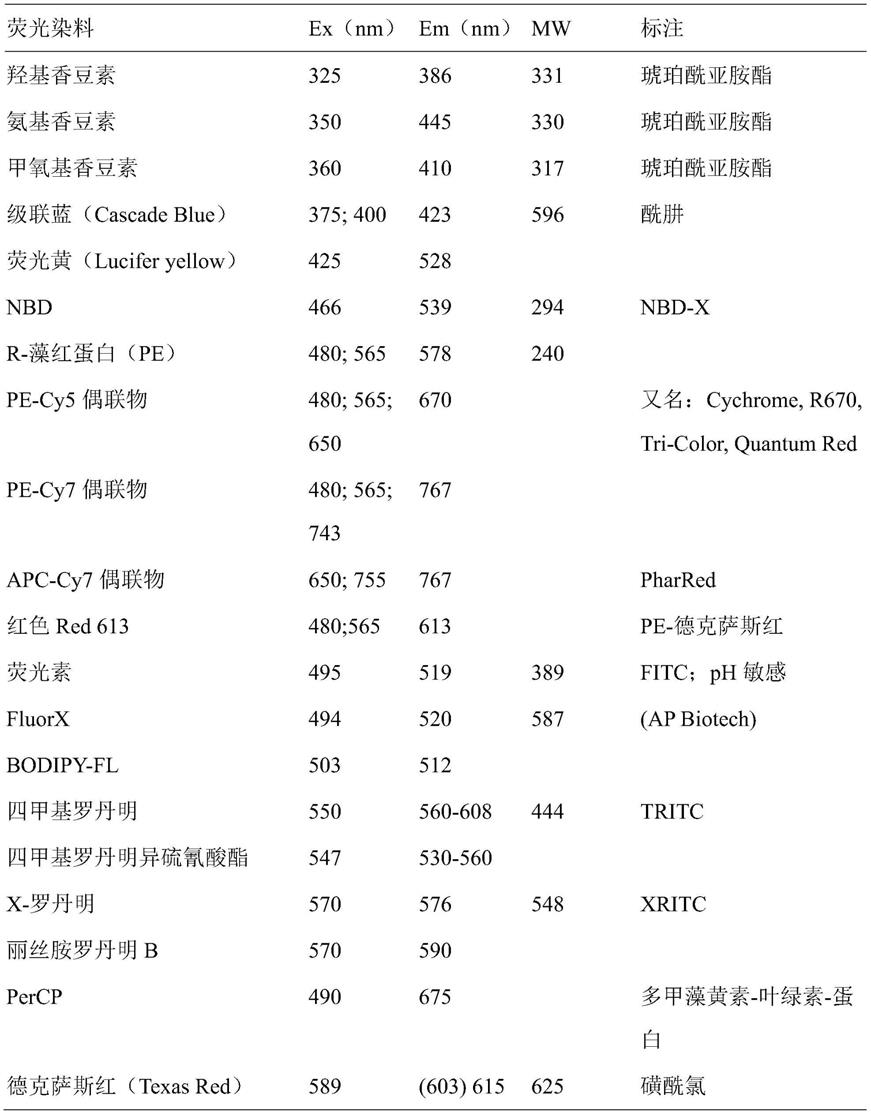
88.在另一种优选的实施方式中,基于对胎儿标记物、细胞核标记物的阳性信号和对母体标记物的阴性信号,将细胞分选到单细胞区室中。这在图8,b)和c)中有例证。
89.在一种优选的实施方式中,通过将相同的门控策略用于富集和单细胞分选,对样品进行分选。
90.在另一种实施方式中,通过将相同的门控策略用于富集和单细胞分选,对样品进行分选,不同之处在于富集和单细胞分选的门控的大小不同。
91.本文公开的分离方法优选使用荧光标记剂来选择性标记胎儿和母体细胞。在一种实施方式中,该方法依赖于使用内皮细胞、上皮细胞和血细胞标记物来区分胎儿细胞和母体细胞,并且可以进一步使用细胞核染色剂来区分细胞和碎片。
92.在其他实施方式中,标记剂是磁性标记剂,例如它们可以被固定在本发明使用的方法中,例如macs。
93.胎儿标记物可以是一种或多种上皮标记物,例如一种或多种细胞角蛋白(ck)。细胞角蛋白是在上皮组织的胞质内细胞骨架中发现的角蛋白。细胞角蛋白的大小从40-68kda不等。它们是中间丝的重要组成部分,可帮助细胞抵抗机械应力。这些细胞角蛋白在上皮细胞内的表达在很大程度上对特定器官或组织具有特异性。细胞角蛋白选自人细胞角蛋白1 ck1、人细胞角蛋白2 ck2、人细胞角蛋白3 ck3、人细胞角蛋白4 ck4、人细胞角蛋白5 ck5、人细胞角蛋白6 ck6、人细胞角蛋白7 ck7、人细胞角蛋白8 ck8、人细胞角蛋白9 ck9,人细胞角蛋白10 ck10,人细胞角蛋白13 ck13,人细胞角蛋白14 ck14,人细胞角蛋白15 ck15,人细胞角蛋白16 ck16,人细胞角蛋白17 ck17,人细胞角蛋白18 ck18,人细胞角蛋白19 ck19。
94.在优选的实施方式中,细胞角蛋白是ck7、ck8、ck18、ck19或其组合。
95.在一种实施方式中,针对上皮标记物的标记剂是广谱ck标记剂。广谱ck标记剂是一种同时靶向多种细胞角蛋白的标记剂。在一种实施方式中,广谱ck标记剂靶向分子量为58、56、52、60、51、48和68kda的细胞角蛋白。
96.在优选的实施方式中,标记剂是靶向ck7、ck8、ck18、ck19的试剂以及广谱ck标记剂的组合。
97.无需区分不同的细胞角蛋白标记物,因此,适宜地,靶向不同细胞角蛋白的荧光标记剂可以具有相同的荧光团。
98.内皮标记物可以用于如上所述的富集,也可以用于荧光标记,检测到的荧光可以用来计算分类器。
99.另一个参数可以是来自一种或多种荧光标记的内皮标记物的荧光。内皮标记物是在内皮细胞中/上优先表达的标记物。所述内皮标记物优选不在任何其他细胞类型中或上特别表达。
100.在一种优选的实施方式中,用来自内皮标记物的荧光对胎儿细胞进行单分选。
101.这种内皮标记物可以选自thy-1 cd90、血栓调节蛋白cd141、人内皮糖蛋白cd105、人波形蛋白vim、血管细胞粘附分子vcam、细胞间粘附分子1icam、血管内皮生长因子受体1(flt-1)vegfr-1、血管内皮生长因子受体2vegfr-2、血管内皮生长因子受体3vegfr-3、纤溶酶原激活抑制剂1pai-1、内皮蛋白c受体epcr、cd146、itga5、itgb5、cdh11、cdh3和cd59。
102.在优选的实施方式中,内皮标记物是cd105和/或cd141。
103.在另一种优选的实施方式中,内皮标记物是cd90、cd105和cd141。
104.针对内皮标记物的荧光标记剂是如本领域技术人员知晓的方式共价偶联的。在优选实施方式中与alexa fluor-488偶联。在另一种优选实施例中与fitc偶联。
105.在一种实施方式中,使用对母体血细胞具有特异性的标记物。对于母体细胞适宜的标记物是未在胎儿细胞上表达的标记物。优选的标记物是白细胞标记物。
106.在优选的实施方式中,母体标记物是血细胞标记物,例如cd14和/或cd45。
107.在另一种优选的实施方式中,血细胞标记物是针对cd3、cd14、cd15、cd16和cd19的标记物的组合。
108.本发明一个特别的特征是使用荧光标记剂对细胞进行特异性标记。这些试剂可以是能够特异性结合特定类型细胞的任何类型的分子,例如,通过与细胞表面或细胞内部的标记物结合。
109.一组优选的荧光标记剂是抗体。
110.根据本发明,标记剂可以是抗体,例如本领域已知的任何适宜的抗体,包括抗体或单链抗体的其他免疫活性片段。抗体分子通常是y形分子,其基本单元由四个多肽组成:两条相同的重链和两条相同的轻链,它们通过二硫键共价连接在一起。这些链中的每一个都在离散域中折叠。重链和轻链的c端区域在序列上都是保守的,称为恒定区,也称为c域。n端区域,也称为v域,序列是可变的,负责抗体特异性。该抗体主要通过位于其v域中的六个短互补决定区来特异性识别并结合抗原。
111.标记剂可以是单个基团(moiety),例如多肽或蛋白质,或者它可以包括两个或更多个基团,例如一对多肽,例如一对单链抗体结构域。产生抗体的方法是本领域技术人员熟知的,通过免疫策略产生单克隆或多克隆抗体,或体外方法产生可选择的结合成员(binding members)。多克隆抗体可以是绵羊、山羊、兔或大鼠等多克隆抗体。
112.此外,可以使用能够高亲和力结合的任何适宜的分子,包括抗体片段,例如单链抗体(scfv),特别是可以通过噬菌体展示(见下文)获得的fab和scfv抗体,或单域抗体(vhh)或嵌合抗体。标记剂可以来源于天然存在的蛋白质或多肽;它可以从头设计,也可以选自文库。例如,标记剂可来源于抗体、单链抗体(scfv)、单域抗体(vhh)、脂质运载蛋白、单链mhc分子、anticalin
tm
(pieris)、affibody
tm
、纳米抗体(ablynx)或trinectin
tm
(phylos)。因此,产生各种类型的结合成员的方法是本领域熟知的。
113.在本发明的一种实施方式中,标记剂是抗体的片段,优选抗原结合片段或可变区。可用于本发明的抗体片段的实例包括fab、fab’、f(ab’)2和fv片段。抗体的木瓜蛋白酶消化
产生两个相同的抗原结合片段,称为fab片段,每个片段都有一个单一的抗原结合位点,以及一个残留的“fc”片段,“fc”片段是因其易于结晶的能力而得名。胃蛋白酶处理产生一个f(ab’)2片段,该片段具有两个能够交联抗原的抗原结合片段和一个残留的其他片段(称为pfc’)。
114.另外的片段可以包括双抗体、线性抗体、单链抗体分子和由抗体片段形成的多特异性抗体。
115.在一种优选的实施方式中,本发明涉及来源于天然存在的蛋白质或多肽的标记剂;例如,所述蛋白质或多肽可从头设计,或者可选自文库。标记剂可以是单个基团,例如多肽或蛋白质结构域,或者它可包括两个或更多个基团,例如一对多肽。标记剂可以,例如但排他地,是脂质运载蛋白、单链mhc分子、anticalin
tm
(pieris)、affibody
tm
(affibody)或trinectin
tm
(phylos)、纳米抗体(ablynx)。可以通过本领域公知的重组方法来选择或设计标记剂。
116.在本发明的另一种实施方式中,标记剂是亲和体,例如本领域已知的任何适宜的亲和体,特别是本文定义的抗体,例如亲和体或亲和体的免疫学片段。亲和体是在体外从亲和体文库中选择的,该文库是通过蛋白a的igg结合域的组合变异构建的。蛋白a是一种来自金黄色葡萄球菌的表面蛋白。结合域由58个残基组成,其中13个被随机化以生成文库。因此,亲和体的尺寸远小于抗体的尺寸(www.affibody.com)。
117.最后,标记剂可以是直接或间接与荧光团相连的受体配体。
118.因此,本发明的一个目的是提供基于杂交技术,选择性标记母体生物样品中的胎儿细胞。可选择地,可使用探针,识别由胎儿细胞选择性表达的mrna。
119.胎儿细胞特异性rna,通常是信使rna(mrna)序列,可用作胎儿细胞标记物。这种mrna的存在表明胎儿蛋白质的基因正在被转录和表达。在含有胎儿和母体细胞的样品中,用于标记胎儿细胞的探针包括核酸分子,其包含的核苷酸序列与编码特异性蛋白质的rna分子的核苷酸序列互补。胎儿细胞包含在其他细胞类型中不存在的独特的mrna或rna种类。这些rna的检测可用于标记胎儿来源的细胞。
120.同样,可以使用对母体细胞mrna具有特异性的探针来标记母体细胞。
121.根据本发明,探针可以是本领域已知的用于检测rna或dna分子的任何类型的探针。本领域技术人员已知的常规探针包括使用商业合成器分别由核苷酸或脱氧核苷酸合成的rna和dna探针。探针可以由天然核苷酸碱基或天然核苷酸碱基的已知类似物组成。进一步认为,探针可以是包含一种或多种核苷酸类似物的寡聚物,所述核苷酸类似物包括肽核酸和能够进行沃森-克里克(watson-crick)碱基配对的其他合成分子。
122.为了检测染色体dna,经常采用荧光原位杂交(fish)。
123.在一种实施方式中,标记剂(例如抗体)或合成探针通过使荧光团与其共价连接而被直接标记。在另一种实施方式中,标记试剂(例如抗体)或合成探针通过结合到与荧光团共价连接的第二试剂而被间接标记。此类探针或标记剂与细胞中靶点的结合可在显微镜下观察为明亮的荧光或可通过facs检测。
124.通过使用组合的标记方法,可增强来自胎儿细胞的信号,从而促进其识别。
125.为了在母体细胞的背景下提高识别胎儿细胞的概率和/或选择性,可进行两个或更多个选择性标记。两个或更多个标记可以是上述用于单一标记的任意标记的组合。因此,
组合标记可通过使用两种或更多种不同的杂交探针来进行,例如dna探针和pna或lna探针的组合,用于与相同的胎儿rna或者更优选地与不同的胎儿rna杂交。此外,两种或更多种不同的dna探针(或pna探针,或能够进行特异性杂交的类似探针)也可用于与不同的胎儿rna杂交。同样地,可使用对相同的胎儿抗原具有特异性或对不同抗原具有特异性的不同标记剂的组合。在进一步的实施方式中,可使用核苷酸探针和标记剂的组合进行标记。
126.选择荧光团,以在检测装置的波长范围内发射,此外与任选的第二标记适宜地组合。具体地,荧光团可选自分别在495nm和520-530nm激发的fitc(荧光素-异硫氰酸酯)或tritc(罗丹明四甲基-异硫氰酸酯)。下表列出了可使用的其他荧光团以及各种荧光染料的激发和发射波长:
127.[0128][0129]
表1a:反应性的和偶联的探针
[0130][0131]
表1b:alexa fluor染料(分子探针)
[0132][0133][0134]
表1c:光谱染料(vysis)
[0135][0136]
表1d:cy染料(ap biotech)
[0137]
如本领域所知,可使用未标记的标记剂,例如使用针对未标记的一级抗体的二级抗体进行第二标记步骤,所述抗体按如上所述被标记,例如用荧光团标记。通过这两步骤,可能增强来自胎儿细胞的信号。如下文所述,使用间接标记可能包括进一步的检测步骤。
[0138]
荧光标记的抗体可被至少一个荧光团直接或间接标记。本领域技术人员能够选择适宜的荧光团,可以是任何荧光团,例如alexa fluor 488、alexa fluor555、荧光素异硫氰酸酯(fitc)、藻红蛋白(pe)、bv421。
[0139]
当使用一种以上的上皮标记物时,这些标记物可连接相同的荧光团。这是因为具有不同标记物的细胞之间通常不需要区分。这同样适用于使用一种以上内皮标记物和/或使用一种以上母细胞标记物的情况。
[0140]
荧光标记剂的间接标记可以通过将荧光团连接到二级抗体来完成,二级抗体使标记剂结合到标记物上。
[0141]
在优选的实施方式中,二级抗体可选自fitc(荧光素异硫氰酸酯)或tritc(罗丹明四甲基-异硫氰酸酯),激发波长分别为495nm和520-530nm。上表中列出了可使用的其他荧光团。
[0142]
在另一种优选实施方式中,二级抗体可选自alexa fluor 488或alexa fluor 555,激发波长分别为490nm和555nm。
[0143]
由于流式细胞仪会拾取较小的颗粒并量化这些颗粒的参数,因此优选使用真核细胞的标记物。对于本领域技术人员而言,此类染料通常为dna插入染料,可以是以下染料:例如任意hoechst染料、dapi、碘化丙啶、7-aad、vybrant dyecycle染色剂、sytox染色剂或syto染色剂。
[0144]
在另一种实施方式中,染料为vybrant dyecycle ruby染色剂。
[0145]
本发明的一个目的是通过使用一个或多个测量参数区分胎儿细胞与母体细胞和碎片,分析细胞分选器中所分选的细胞,提供分离单个胎儿细胞的半自动或全自动方法。测量的参数可用于计算胎儿来源分类器。由此可能识别出那些为胎儿细胞或极有可能为胎儿细胞的单分选细胞。分离的细胞可用于胎儿基因型的遗传分析。
[0146]
本发明的一个方面涉及一种从孕妇的生物样品中分离胎儿细胞的方法,所述方法包括步骤:
[0147]
a.提供来自所述孕妇的生物样品,所述生物样品包含细胞组分,
[0148]
b.将所述细胞组分中包含的的细胞与针对至少一种胎儿细胞上皮标记物和/或内
皮标记物的一种或多种荧光标记剂接触,
[0149]
c.基于所述结合到细胞上的一种或多种荧光标记剂的检测,通过荧光激活细胞分选法(facs)分选所述细胞,和
[0150]
d.识别所述分选细胞中的胎儿细胞,包括将胎儿来源分类器分配给各个分选细胞的步骤。
[0151]
在一种实施方式中,其中在facs之前,对细胞组分进行富集以获得胎儿细胞。
[0152]
富集可包括富集表达至少一种内皮标记物的细胞。本文进一步描述了内皮标记物的实例。
[0153]
在一种优选的实施方式中,使用胎儿来源分类器区分胎儿细胞和母体细胞。理想情况下,这可以以很高的确定性来完成,因此不需要按如下所述验证胎儿来源。
[0154]
在一种实施方式中,胎儿起源分类器是将细胞分类为胎儿或非胎儿的二元分类器。所述胎儿起源分类器可使用人工智能、神经网络、随机森林、机器学习、回归分析、或分类树来计算,其使用了包括经验证起源的胎儿和母体细胞的训练集。
[0155]
在一些实施方式中,胎儿起源分类器是二元的,即每个细胞被分类为可能是胎儿或不太可能是胎儿。在其他实施方式中,分类器将胎儿起源的概率分配给每个细胞。
[0156]
在一些实施方式中,基于经验证的胎儿细胞起源来计算胎儿起源分类器。例如,如下文所述,通过获得各分选的细胞的胎儿基因型来验证胎儿细胞的起源。
[0157]
胎儿起源分类器是根据facs中检测到的每个细胞的参数来计算的。因此,该方法将具体的胎儿起源分类器分配给每个分选的细胞。在对来自一个母体样品的细胞进行分选后,最终结果可能是一个具有相关胎儿来源分类器的细胞分选阵列。对数据进行组织,以便能够将每个分选细胞与其特定的胎儿来源分类器相关联。
[0158]
在下一步的细胞遗传分析中,可以从具有最高胎儿起源概率的细胞开始,如有必要,可以继续进行下一个最高值,等。对于胎儿细胞中的dna分析,只需要来自胎儿的一个细胞。为了更确定,可优选分析来自胎儿的多个细胞,例如来自相同胎儿的至少3个细胞。
[0159]
该概率可以使用从回归中获得的函数来计算,使用了包括经验证起源的胎儿和母体细胞的训练集。
[0160]
在优选的实施方式中,回归分析是逻辑回归。
[0161]
本领域技术人员知晓,逻辑回归是自然对数或公共对数。逻辑回归包括常数参数和针对参数的特定值,其是由荧光定量获得,用于计算概率。
[0162]
在一种实施方式中,生物样品是血液样品,例如外周血样品。
[0163]
血液样品的体积可以是5-30ml。样品可获取在任何适用于血液样品的试管中。
[0164]
在另一种优选的实施方式中,血液样品的体积可为2-100ml,例如3-70、5-50ml、5-30ml和10-30ml。
[0165]
在一种实施方式中,适当地通过使所述生物样品离心,从该生物样品中分离细胞组分。生物样品的离心优选地在0到25分钟之间,更优选在0到15分钟之间,最优选在5到10分钟之间。施加到样品上的离心力优选地在0和5000g之间,更优选在500和3000g之间,最优选在1000和2000g之间,例如1600g。
[0166]
本领域技术人员知晓,离心将血液样品分离成血浆组分和细胞组分。细胞组分包括红细胞、白细胞和胎儿滋养层细胞、胎儿绒毛外滋养层细胞和胎儿血管内滋养层细胞。
[0167]
在另一种实施方式中,生物样品为宫颈涂片。拭子中的粘液可首先用醋酸或ddt溶解。然后,该步骤后获得的细胞组分可固定在多聚甲醛中。宫颈涂片的细胞组分包括胎儿细胞(滋养层细胞,如细胞滋养层细胞、合胞滋养层细胞和/或间质滋养层细胞)和鳞状上皮细胞、柱状上皮细胞、白细胞和红细胞。随后,可使用hla-g和/或cd105/cd141富集胎儿细胞,并如本文所述对血液样品进行染色。
[0168]
在本发明的一种实施方式中,固定母体样品的细胞大大增加了母体样品中胎儿细胞的稳定性,同时允许富集和识别胎儿细胞,如上文所述。在一种实施方式中,可在取样后立即对未富集的样品进行固定程序(即,第一种实施方式中所述方法的步骤a),从而固定母体样品中的细胞成分。同时,这种固定非常温和,以便在随后的溶解步骤中,母体红细胞可以被选择性地溶解。
[0169]
固定时间优选在1到60分钟之间完成。更优选地,固定在5到30分钟之间完成,并且最优选地,固定在行5到15分钟之间完成,例如10分钟。
[0170]
固定溶液优选地包含0.5%到7.5%的多聚甲醛,更优选1%到6%,最优选1.5%到2%之间的多聚甲醛。
[0171]
除多聚甲醛外,固定溶液优选地包含浓度在0.05m到0.3m之间的盐。更优选地,盐浓度在0.1m到0.2m之间,最优选地,浓度在0.125m到0.175m之间。
[0172]
优选地,固定步骤之后可进行红细胞裂解步骤,包括使步骤a的固定样品与裂解缓冲液接触。
[0173]
裂解缓冲液通常包括非离子去污剂,优选triton-x-100。去污剂的优选浓度在0.01%(w/w)到0.5%之间,更优选在0.05%-0.3%之间,最优选0.1%。
[0174]
在一种优选的实施方式中,固定步骤之后立即进行溶解步骤。也就是说,在第一实施方式中描述的方法的步骤a之后和步骤b之前进行固定和溶解。即,例如在固定10分钟后,将溶解溶液直接添加到样品中。溶解通常在1分钟到120分钟完成,更优选5到60分钟,最优选6到10分钟。
[0175]
溶解缓冲液除了溶解红细胞外,还可在白细胞的细胞膜上形成小开口,从而允许标记剂穿透细胞膜并与其目标抗原结合。
[0176]
通过获得各分选细胞的胎儿基因型来验证胎儿细胞的起源。当基因型与母体基因型不同时,将会是胎儿起源的细胞。这种验证可以通过短串联重复序列分析(str分析)来完成。
[0177]
在另一种实施方式中,验证可通过首先扩增基因组并对部分物质进行短串联重复分析(str分析)来完成。
[0178]
在另一种实施方式中,验证是通过在全基因组扩增后分析单核苷酸多态性(snp)(即,在snp阵列上)来完成。
[0179]
在另一种实施方式中,如下文所述,通过任何适于检测遗传标记物的方法来验证胎儿起源。例如,下一代测序(ngs)。
[0180]
在第二方面中,本发明涉及一种确定胎儿遗传异常的方法,所述方法包括步骤:
[0181]
a.获得通过本文定义的方法分离的一个或多个胎儿细胞,以及
[0182]
b.在所述胎儿细胞的基因组中检测与所述遗传异常相关的一个或多个遗传标记物。
[0183]
遗传标记物是用选自如下的一种或多种方法来检测:rflp、southern印迹杂交分析、基于微阵列的比较基因组杂交(acgh)、短串联重复序列分析(str分析)、全基因组扩增、全基因组扫描、snp阵列、聚合酶克隆(polony)测序、鸟枪(shotgun)测序、大规模平行签名测序(mpss)、sanger测序、基于pcr的方法和下一代测序方法。
[0184]
下一代测序方法可选自illumina(solexa)测序、roche 454测序、离子激流:质子/pgm测序和/或solid测序。
[0185]
遗传异常包括非整倍体、单体、多体、三体、拷贝数变异(cnv)、单核苷酸变异(snv)或单基因疾病。
[0186]
在一些实施方式中,必须扩增来自单个胎儿细胞的dna含量,以便能够实施一些方法来检测和验证遗传标记物。
[0187]
目前已经发展了几种高保真全基因组扩增方法,包括多重置换扩增(mda)、简并寡核苷酸pcr(dop-pcr)和引物延伸预扩增(pep)。dop-pcr和pep是基于标准pcr技术,而mda可以通过等温反应装置实现。
[0188]
胎儿dna的检测/分析可通过以下方法进行:使用taqman引物/探针集的snp基因分型、基于qpcr和pcr的突变检测、下一代测序(ngs)、短串联重复序列/微卫星分析、sanger测序、rflp和southern印迹杂交分析及阵列技术,例如比较基因组杂交。
[0189]
基于本文中的方法和系统可确定的胎儿状况包括胎儿的存在和/或胎儿的状态,例如胎儿非整倍体。这种胎儿异常可以是:例如13三体、18三体、21三体(唐氏综合征)、克氏综合征(xxy)和其他不规则数量的性染色体或常染色体。
[0190]
使用本文方法可检测的其他胎儿状况包括节段非整倍体,例如ip36重复、dup(17)(pl l.2pl l.2)综合征、唐氏综合征、佩梅(pelizaeus-merzbacher)病、dup(22)(ql l.2ql l.2)综合征、猫眼综合征。
[0191]
在一种实施方式中,要检测的胎儿异常是由于性染色体或常染色体中的一个或多个缺失所致。这些异常包括猫叫(cri-du-chat)综合征、wolf-hirschhorn综合征、williams-beuren综合征、charcot-marie-toth病、易患压力性麻痹的遗传性神经病、smith-magenis综合征、神经纤维瘤病、alagille综合征、velocardiofacial综合征、digeorge综合征、类固醇硫酸酯酶缺乏症、kallmann综合征、伴有线性皮肤缺陷的小眼症、肾上腺发育不全、甘油激酶缺乏、pelizaeus-merzbacher病、睾丸y决定因子、无精子症(因子a)、无精子症(因子b)、无精子症(因子c)或ip36缺失。
[0192]
在某些情况下,胎儿异常是染色体数目的异常减少或增加,如xo综合征。
[0193]
实施例
[0194]
实施例部分中提到的抗体是下表中提到的特定抗体:
[0195]
表2.实施例中使用的抗体。用fitc或pe表示的抗体是直接偶联的抗体。
[0196]
33342)、488nm(alexa farror 488)和561nm(alexa fluor 555)激光进行分选。使用相应的带通滤波器收集荧光信号:450/50nm、530/30nm和585/42nm。未进行荧光补偿或双峰排除。光电倍增管电压设置为以下参数:fsc 300、ssc 390、af488 360、af555 236、hoechst 500,fsc-h阈值为5000。应用100μm喷嘴,由于循环胎儿细胞稀少,facs仪器设置为以产量模式(yield mode)分选。前向散射/侧向散射(fsc/ssc)图中包括所有细胞。从hoechst
+
组分中,在af488/af555荧光图中形成一个区域(门g1),以分选感兴趣的细胞。使用flowjo软件(flowjo,llc usa)对分选细胞进行分析。图3显示了具有x-y坐标的门g1的实例。平均来看分选了2244个细胞。将细胞涂抹在载玻片上,并使用cellcelector(荧光扫描仪-细胞拾取器)进行分选。在分选的细胞中有107个胎儿细胞,平均每个样品有7.9个胎儿细胞(表3)。
[0206]
表3:按照本文所述处理13名孕妇的血液样品,使用facs进一步富集胎儿细胞。平均来看每个样品有342.000个事件记录在facs上,每个样品分离出7.9个胎儿细胞。
[0207][0208][0209]
实施例2-使用macs富集和染色胎儿细胞,然后使用facs对胎儿细胞进行单细胞分选
[0210]
从13名孕龄10至14的孕妇采集30ml血液样品。对样品进行处理,并在磁珠上富集胎儿细胞,使用上述方法进行染色,并按照实施例1中所述的设置运行facs aria iii仪器。用alexa fluor 488和alexa fluor 555(pe)的facs图上的分选门(sorting gate,g7),将该门内的所有细胞收集在含有5μl te缓冲液的单个pcr管中,事件率为每秒约100-600个事件(图5)。分选的细胞在-80℃冷冻。使用该门,平均来看,从每个样品采集了17个细胞。然后对细胞进行短串联重复序列(str)分析,以破译它们的来源(胎儿或母体)(图4)。在str分析之前,根据制造商的说明,使用prepgem universal(zygem,new zealand)裂解胎儿细胞。使用abi 3500遗传分析仪,通过片段大小毛细管电泳生成str基因型谱。在genemapper id-x
片段大小分析软件(thermo fischer scientific,usa)中进行数据分析。表4和图6给出了单分选细胞的str分析结果。
[0211][0212]
表4:来自单细胞分选样品的数据。通过str分析破译细胞的起源(胎儿或母体)。13个连续样品使用macs用cd105和cd141微珠富集,随后使用细胞角蛋白、cd45、cd14和hoechst染色在facs aria iii上分选单细胞。4到47个细胞被分选,str分析显示分选细胞中有3到36个胎儿细胞,平均每个样品9.6个胎儿细胞。
[0213]
从13个连续样品中,4-47个细胞被分选,平均为17.5个细胞(表4)。str分析识别出3到36个胎儿细胞,平均为9.6个胎儿细胞。与实施例1(识别的7.9个胎儿细胞)相比,这表明在facs上分选macs富集的样品时,单细胞分离是可能的。
[0214]
在这一点上,所有单分选细胞的起源(胎儿或母体)是知悉的。此外,对于每个细胞,facs仪器上记录的5个不同参数的值是知悉的(前向散射(fsc-a)、侧向散射(ssc-a)、hoechst蓝-a(细胞核染色)、alexa fluor 488-a(针对胎儿细胞上的ck抗体)和alexa fluor 555(pe-a)(针对母体白细胞上的cd14和cd45)。鉴于所有这些信息,我们开发了一个模型,使用一种称为逻辑回归的数学方法,以预测无法获得str信息的未来样品中定位胎儿细胞的概率。
[0215]
模型:
[0216]
预测胎儿细胞的模型是基于一种称为逻辑回归的数学方法,对于每个样品,该方法将给出一个单分选细胞是否为胎儿的概率。
[0217]
逻辑函数如下:
[0218]
[0219]
其中x1、x2
…
xp是测量的各个单分选细胞的特定变量。如前所述,在我们的例子中,我们通过facs仪器测量五个变量(fsc-a、ssc-a、hoechst blue-a、alexa fluor 488-a和pe-a)。x1、x2、x3、x4和x5分别对应每个细胞的fsc-a、ssc-a、hoechst blue-a、alexa fluor 488-a和alexa fluor 555(pe-a)记录值。
[0220]
β0、β1、β2
…
βp是方程中的系数或常量。在我们的例子中,有六个系数,其中β0单独存在(反映所有五个变量为零时的概率),β1、β2、β3、β4和β5分别反映fsc-a、ssc-a、hoechst blue-a、alexa fluor 488-a和alexa fluor 555(pe-a)对细胞是胎儿或母体的概率的影响。然而,这种影响并不是通过它们的绝对值来体现。这六个系数是常数值,它们是从“训练”数据集计算得出,其中细胞的来源(胎儿或母体)和每个细胞的所有五个变量的值都是知悉的(在当前数据集中,它由121个胎儿细胞和90个母体细胞组成)。计算这些β值,使得对于“训练”数据集中的所有细胞,胎儿细胞获得尽可能高的概率(接近1),母体细胞获得尽可能低的概率(接近0)。表5中显示的这些β值(β0、β1、β2、β3、β4和β5)对于我们的数据来说是唯一的。
[0221][0222][0223]
表5:从121个胎儿细胞和90个母体细胞的数据集计算得到的系数,facs仪器中不同变量的值是知悉的。
[0224]
对样品中的每个单分选细胞运行此算法,p(x)将给出一个介于0和1之间的值。给定细胞的p(x)值越高,算法评估该细胞为胎儿细胞的概率越高。我们在三个单细胞分选样品上运行此模型,以测试我们是否可以通过仅关注50%的具有最高胎儿可能性的细胞来富集胎儿细胞的数量。在分选和聚焦于概率最高的细胞后,胎儿细胞量的差异在38-83%之间,显著增加。结果如表6所示。
[0225][0226]
表6:来自三个单细胞分选样品的数据,其中测试了使用逻辑回归预测胎儿细胞的模型。在所有三个样品中,在显示很高概率是胎儿细胞的第一半的样品中,胎儿细胞的数量增加。这将有助于提高产量,并减少cogs对单个胎儿细胞的下游遗传分析。
[0227]
本发明实现了使用上述方法,实施该模型以预测胎儿细胞在不同facs图上的定
位,工作流程如图7所示。对细胞进行单分选之后,使用全基因组扩增(wga)扩增所有细胞中的dna。然后用一部分wga产物进行str分析。然后使用acgh或任何其他相关的下游方法,对结果是胎儿的细胞的其余dna进行遗传分析。
[0228]
实施例3-使用facs富集胎儿细胞,然后使用cellcelector扫描和拾取胎儿细胞
[0229]
为了探索facs分离胎儿细胞而无需使用macs富集法富集胎儿细胞的可能性,从8名孕龄为10至14周的孕妇采集10ml的血液样品。如实施例1所述,处理血液样品并沉淀白血球。在血液处理后,将细胞染色,4份样品中用不同浓度的仅ck抗体的混合物,4份样品中用不同浓度的ck抗体加cd14和cd45抗体的混合物。按实施例1分选位于alexa fluor 488和alexa fluor 555(pe)的facs图上g1门内的细胞。平均来看,每个样品中记录了5,500万个事件,分选了22,140个细胞。将细胞涂抹在载玻片上并使用cellcelector(荧光扫描仪-细胞拾取器)进行分类。平均来看从10ml全血中回收4个胎儿细胞,表明可以仅使用facs进行富集(表7)。
[0230][0231]
表7:来自8个样品的数据,其中处理了10ml血液,细胞通过facs仪器运行,未事先富集胎儿细胞
[0232]
实施例4-使用macs富集和染色胎儿细胞,然后使用facs对胎儿细胞进行单细胞分选
[0233]
为了探索本发明在多台facs机器上的适用性,我们在facs melody(bd biosciences,usa)而非facs aria iii上进行了如实施例2所示的实例。在以下实例中,我们显示了可以从30ml血液中识别胎儿细胞。该血液经过血液处理,在macs平台上使用对内皮标记物(cd105和cd141)具有特异性的抗体进行富集,随后对上皮标记物(ck)进行染色,如实施例1中所述。使用细胞角蛋白、cd45、cd14和hoechst染色,在facs melody(bd biosciences,usa)上对经富集和染色的细胞进行单细胞分选。
[0234]
用facs进行单细胞分选
[0235]
在facs之前,将20μl的5μm hoechst 33342溶液添加到富集的细胞沉淀中,以使细胞核染色。
[0236]
经富集和染色的细胞在facs melody(bd biosciences,usa)上用405nm、488nm和561nm激光分选。使用各自的带通滤波器收集荧光信号:448/45nm(hoechst 33342)、527/
32nm(af488)和585/40nm(af555)。没有进行荧光补偿或双重排除。光电倍增管电压设置为以下参数:fsc:278,ssc:530,af488:336,af555:271,hoechst:470和fsc阈值:2939。应用100μm喷嘴,由于循环胎儿细胞稀少,facs仪器设置为以产量模式分选。
[0237]
首先,排除具有非常高侧向散射(ssc)的所有事件(碎片),并对剩余的细胞进行门控以获得hoechst
+
事件。随后,对hoechst
+
事件进行门控以获得ck
+
以及cd45-和cd14-的事件。门控策略的一个实例如图8所示。细胞被单个分选到含有5μl te缓冲液的200μl pcr管中,事件率为每秒约100-600个事件。分选的细胞在-80℃冷冻。然后对细胞进行短串联重复(str)分析以破译它们的来源(胎儿或母体),如实施例2中所述。
[0238]
实施例4的实验结果
[0239]
如表8所示,9个连续样品中分选了10到26个细胞,平均值为17.9。通过str分析,每个样品识别出0到16个胎儿细胞,平均7.0个胎儿细胞。与实施例1(识别了7.9个胎儿细胞)和实施例2(分离了9.6个胎儿细胞)比较,显示facs仪器的选择对本发明的结果没有影响。
[0240][0241][0242]
表8:使用macs法用cd105和cd141微珠富集9个连续样品,随后使用细胞角蛋白、cd45、cd14和hoechst染色在facs melody上进行单细胞分选。分选了10到26个细胞,str分析显示分选的细胞中有0-16个胎儿细胞,平均值为7.0。
[0243]
实施例5-使用facs富集胎儿细胞,然后使用facs对胎儿细胞进行单细胞分选
[0244]
为了探索是否可以避免使用macs富集,我们用facs富集代替了macs富集,然后在facs仪器上进行单细胞分选。换句话说,这些细胞正在经历“双重facs”。facs富集去除了大部分母体细胞和碎片,从而允许随后对胎儿细胞进行单细胞分选,而不会受到母体污染。两轮facs中胎儿细胞的识别仅基于细胞角蛋白、cd45、cd14和hoechst染色,无内皮标志物。
[0245]
我们从10名孕龄为10-14周的孕妇采集10ml血液样品。如实施例1所述进行血液处理。
[0246]
胎儿细胞染色
[0247]
血液处理后,将沉淀在管中的细胞用靶向ck7、ck8、ck18、ck19、ck广谱、cd14和cd45的一级抗体染色15分钟至1小时。然后用pbs洗涤细胞,550g离心10分钟,除去上清液。接着,加入用af488(靶向cks)和af555(靶向cd45+cd14)标记的二级抗体,并孵育15分钟至1小时。将细胞洗涤两次,并去除上清液至500μl。
[0248]
facs富集和单细胞分选
[0249]
在facs melody上进行分选之前,用500μl的20μm hoechst 33342溶液对细胞染色,并添加pbs,使最终体积为4ml。facs设置与实施例4中提到的设置相同。
[0250]
首先,排除所有具有极高侧向散射(ssc)的事件,然后对剩余的细胞进行门控以获得hoechst+事件。随后,对hoechst+事件进行门控,以获得表达中高水平的ck(ck
中-至-高
)和cd45-cd14-的事件。门控的实例如图9所示。将细胞批量分选到含有25μl pbs的1.5ml eppendorf管中,事件率为每秒约5,000-20,000个事件。将分选的细胞稀释至最终体积500μl,然后使用相同的门控策略再次分选,区别在于仅门控获得高表达ck(ck
高
)的细胞。门控的实例如图10所示。这些细胞是被分选到含有5μl te缓冲液的pcr管中的单细胞,事件率为每秒约100-600个事件。由于facs仪器设置为以产量模式分选,因此将事件率设置为如此低,以避免来自母体细胞的污染。在如上所述进行str分析之前,将分选的细胞冷冻在-80℃。
[0251]
实施例5的实验结果
[0252]
表9描述了来自第一次和第二次分选的分选细胞数以及通过str分析确定的胎儿细胞数。第一次分选,分选了约15,000到33,000个细胞,第二次分选中分选了5-32个细胞。然后通过str分析来自第二次分选的细胞,显示每10ml血液中有0到9个胎儿细胞,平均2.4个胎儿细胞。这显示胎儿细胞分离可以仅使用facs以及用cd45、cd14和hoechst染色上皮标记物来完成。
[0253][0254]
表9:在facs melody仪器上对10个连续样品进行“双重分选”。第一次分选产生了约15,000-32,000个细胞,然后将这些细胞再次加载到facs上进行单细胞分选。分选了5到32个细胞,str分析显示,经单细胞分选的细胞中存在0-9个胎儿细胞,平均为2.4个。
[0255]
实施例6-使用facs富集胎儿细胞,然后使用facs-胎儿内皮标记物对胎儿细胞进行单细胞分选
[0256]
在本实施例中,我们显示了“双重facs”只能基于内皮标记物染色(而非上皮标记物染色)识别胎儿细胞。
[0257]
我们从孕龄10-14周的孕妇采集了三份10ml的血液样品。如实施例1所述进行血液
处理。
[0258]
胎儿细胞染色
[0259]
血液处理后,用针对以下一种或多种抗体的抗体对细胞染色15分钟至1小时:cd105-fitc、cd141-fitc和cd90-fitc(见表10中的抗体组合)。此外,cd14和cd45的一级抗体和以af555标记的二级抗体用于染色母体细胞。然后在pbs中洗涤细胞,在550g离心10分钟,并去除上清液至500μl。
[0260]
facs富集和单细胞分选
[0261]
在进行facs之前,用500μl的20μm hoechst 33342溶液对细胞进行染色,并添加pbs至最终体积为4ml。facs设置与实施例4中提到的设置相同,不同的是af488的光电倍增管电压设置为461,为了直接偶联的cd105、cd141和cd90。
[0262]
首先,排除所有具有极高侧向散射(ssc)的事件,然后对低ssc组分进行门控以获得hoechst+事件。随后,对hoechst+事件进行门控,以获得表达中到高水平的cd105+cd141+cd90。门控的实例如图11所示。将细胞批量分选到含有25μl pbs的1.5ml eppendorf试管中,事件率为每秒约5,000-20,000个事件。将分选的细胞稀释至最终体积500μl,然后使用相同的门控策略再次分选,区别在于仅分选表达高水平cd105+cd141+cd90的细胞。门控的实例如图12所示。将细胞进行单细胞分选到5μl te缓冲液的pcr管中,事件率为每秒约100-600个事件。在如实施例2所述进行str分析之前,经单细胞分选的细胞被冷冻在-80℃。
[0263][0264]
表10:内皮标记物染色。样品ho107-a用针对cd105+cd141+cd90的抗体染色,并通过进行“双重facs”,识别出1个胎儿细胞。在样品3091-b中,仅cd105和cd141被染色,并且在“双重facs”后,也检测到1个胎儿细胞。
[0265]
实施例6的实验结果
[0266]
表10显示了用不同内皮标记物组合染色的2个样品。第一次分选产生约30,000-45,000个细胞,而第二次分选产生10-20个细胞。两种情况都发现了一个胎儿细胞。
[0267]
实施例7-使用facs富集胎儿细胞,然后使用facs-不同母体细胞特异性标记物对胎儿细胞进行单细胞分选
[0268]
在前面的实施例中,cd45和cd14的染色用于识别母体白细胞,而hoechst用于细胞核染色。这些染色的目的是增加细胞和碎片之间以及母细胞和胎儿细胞之间的分离。在本实施例中,我们研究了cd45、cd14和hoechst在胎儿单细胞分选中是否是必需的。
[0269]
从5名孕龄为10-14周的孕妇身上采集10ml血液样品。如实施例1所述进行血液处理。如实施例5所述,用ck抗体染色所有样品。此外,除非表11中另有说明,否则所有样品都如实施例5中所述用hoechst、cd45和cd14染色。在一个样品中,白细胞被靶向cd3、cd14、cd15、cd16和cd19的抗体——所有这些都与pe直接偶联,染色15分钟到1小时。使用ck染色连同白细胞和hoechst染色(如果这些包括在如实施例5中所述的样品中的话),将所有样品在facs上富集。最后,使用与富集facs相同的染色剂,在facs仪器上对细胞进行单细胞分
选。通过str分析经单细胞分选的细胞。
[0270][0271][0272]
表11:母体标记物和hoechst组合。
[0273]
实施例7的实验结果
[0274]
如图13a可见,样品aal302-b的facs图,其未经hoechst、cd45或cd14染色。细胞的分离大大降低。虽然对从主要群体中分离出来的少数事件进行了分选,但str分析揭示,所有分选事件均不含dna,即仅分选了碎片。这表明细胞核染色,例如hoechst染色是必要的,目的是从单细胞分选中去除碎片。
[0275]
hoechst:
[0276]
当添加hoechst,但未对母体细胞施加染色(样品aal302-a)时,未获得清晰分离(图13b)。str仅识别了母体细胞,说明母体标记物的染色大大增强胎儿细胞与母体细胞的分离。
[0277]
cd14和cd45:
[0278]
当母体细胞用cd14而非cd45染色时(样品ko381),虽然获得分离,但未识别出胎儿细胞(图14a)。然而,当仅进行cd45染色而不进行cd14染色时(样品ko380,图14b),识别出3个胎儿细胞,表明cd45染色是必要的。
[0279]
其他白细胞标记物:
[0280]
cd45也被称为常见的白细胞抗原,因为它在所有白细胞亚群(单核细胞、粒细胞、t细胞、b细胞和nk细胞)上均有表达。因此,为了研究cd45是否可以被代表所有白细胞亚群的标记物所取代,我们对cd3(t细胞)、cd14(单核细胞)、cd15(粒细胞)、cd16(nk细胞)和cd19(b细胞)进行染色,同时如前实施例5中所述进行ck和hoechst染色。这产生了3个胎儿细胞(表12),证明cd45可以被一组其他白细胞标记物替代。
[0281][0282]
表12:cd3、cd14、cd15、cd16和cd19靶向外周血中不同亚群的白细胞。通过对不同亚群染色,而非对靶向所有亚群的cd45染色,识别出3个胎儿细胞。
[0283]
项目
[0284]
1)一种分离胎儿细胞的方法,包括步骤:
[0285]
1.提供来自怀有胎儿的妇女的生物样品,
[0286]
2.富集所述样品以获得胎儿细胞,
[0287]
3.将所述样品与至少一种荧光标记剂接触,
[0288]
4.在荧光激活细胞分选仪(facs)上从所述富集样品中单细胞分选至少一个胎儿细胞。
[0289]
2)一种产前诊断方法,包括步骤:
[0290]
1.获得至少一个通过项目1所述方法分离的胎儿细胞
[0291]
2.获得所述胎儿细胞的基因型,和
[0292]
3.诊断胎儿的表型。
[0293]
3)一种产前诊断方法,包括步骤:
[0294]
1.提供来自怀有胎儿的妇女的生物样品,
[0295]
2.富集所述样品以获得胎儿细胞,
[0296]
3.使所述样品与至少一种荧光标记剂接触,
[0297]
4.在荧光激活细胞分选仪(facs)上从所述富集样品中单细胞分选至少一个胎儿细胞,
[0298]
5.获得所述胎儿细胞的基因型,和
[0299]
6.诊断胎儿的表型。
[0300]
4)根据前述任一项目所述的方法,其中所述荧光标记剂是针对细胞核、胎儿细胞标记物和/或母体细胞标记物。
[0301]
5)根据前述任一项目所述的方法,其中所述至少一种荧光标记剂选自以下各组:
[0302]
i.针对细胞核的荧光标记剂,
[0303]
ii.针对母体细胞标记物的荧光标记剂,和
[0304]
iii.针对胎儿细胞标记物的荧光标记剂。
[0305]
6)根据前述任一项目所述的方法,其中所述样品用磁激活细胞分选法(macs)富集。
[0306]
7)根据项目6所述的方法,其中所述富集步骤之前是使所述样品中包含的细胞与至少一种针对胎儿细胞标记物的磁性标记试剂接触的步骤。
[0307]
8)根据项目1-5任一项所述的方法,其中所述样品在荧光激活细胞分选仪(facs)上富集。
[0308]
9)根据项目8所述的方法,其中所述富集步骤之前是使所述生物样品中包含的细胞与至少一种选自以下各组的荧光标记剂接触的步骤:
[0309]
i.针对细胞核的荧光标记剂,
[0310]
ii.针对母体细胞标记物的荧光标记剂,和
[0311]
iii.针对胎儿细胞标记物的荧光标记剂。
[0312]
10)根据项目9所述的方法,其中所述在荧光激活细胞分选仪(facs)上富集是基于来自所述荧光标记剂的荧光。
[0313]
11)根据前述任一项目所述的方法,其中在荧光激活细胞分选仪(facs)上分选所述至少一个单细胞分选的胎儿细胞,基于:
[0314]
i.所述针对胎儿细胞标记物的荧光标记剂的阳性筛选,
33342。
[0333]
28)根据前述任一项目所述的方法,其中所述针对母体细胞标记物的荧光标记剂是针对白细胞的荧光标记剂。
[0334]
29)根据前述任一项目所述的方法,其中所述白细胞标记物选自cd45、cd3、cd14、cd15、cd16和/或cd19。
[0335]
30)根据前述任一项目所述的方法,其中所述白细胞标记物是cd45和cd14。
[0336]
31)根据前述任一项目所述的方法,其中所述白细胞标记物是cd45。
[0337]
32)根据前述任一项目所述的方法,其中所述基因型是通过str分析获得。
[0338]
33)根据前述任一项目所述的方法,其中所述基因型是通过snp分析获得。
[0339]
34)根据前述任一项目所述的方法,其中所述表型是通过检测与胎儿细胞基因组中的遗传异常相关的一个或多个标记物来诊断。
[0340]
35)根据前述任一项目所述的方法,其中所述遗传异常是通过选自如下的一种或多种方法来检测:基于微阵列的比较基因组杂交(acgh)、短串联重复序列分析(str分析)、全基因组扩增、全基因组扫描、snp阵列、polony测序、shotgun测序、大规模平行签名测序(mpss)、sanger测序、基于pcr的方法和下一代测序方法。
[0341]
36)根据前述任一项目所述的方法,其中所述下一代测序方法可选自illumina(solexa)测序、roche 454测序、离子激流:质子/pgm测序和/或solid测序。
[0342]
37)根据前述任一项目所述的方法,其中所述遗传异常是非整倍体、单体、多体、三体、拷贝数变异(cnv)、单核苷酸变异(snv)或单基因疾病。
[0343]
38)根据前述任一项目所述的方法,其中所述生物样品包括细胞组分。
[0344]
39)根据前述任一项目所述的方法,其中所述细胞组分包括母体细胞和胎儿细胞。
[0345]
40)根据前述任一项目所述的方法,其中所述生物样品是血液样品。
[0346]
41)根据前述任一项目所述的方法,其中所述血液样品在5-30ml之间。
[0347]
42)根据前述任一项目所述的方法,其中所述血液样品为30ml血液样品。
[0348]
43)根据前述任一项目所述的方法,其中所述血液样品为10ml血液样品。
[0349]
44)一种产前诊断方法,包括步骤:
[0350]
1.提供怀有胎儿的妇女的血液样品,
[0351]
2.使所述血液样品中包含的细胞与至少一种针对胎儿滋养层细胞标记物的标记剂接触,
[0352]
3.用微流体装置富集所述样品以获得胎儿滋养层细胞,
[0353]
4.使所述样品与选自以下各组的至少一种荧光标记剂接触:
[0354]
i.针对细胞核的荧光标记剂,
[0355]
ii.针对母体细胞标记物的荧光标记剂,以及
[0356]
iii.针对胎儿滋养层细胞标记物的荧光标记剂
[0357]
5.在荧光激活细胞分选仪(facs)上从所述富集的样品中单细胞分选至少一个胎儿滋养层细胞,基于:
[0358]
i.所述针对胎儿滋养层细胞标记物的荧光标记剂的阳性选择,
[0359]
ii.所述针对细胞核的荧光标记剂的阳性选择,以及
[0360]
iii.所述针对母体细胞标记物的荧光标记剂的阴性选择
[0361]
6.获得所述胎儿滋养层细胞的基因型,以及
[0362]
7.诊断胎儿的表型。
[0363]
要素
[0364]
1)一种从孕妇的生物样品中分离胎儿细胞的方法,所述方法包括步骤:
[0365]
a.提供来自所述孕妇的生物样品,该生物样品包含细胞组分,
[0366]
b.使所述细胞组分中包含的细胞与针对至少一种胎儿细胞上皮标记物和/或内皮标记物的一种或多种荧光标记剂接触,
[0367]
c.基于对结合到细胞的所述一种或多种荧光标记剂的检测,通过荧光激活细胞分选法(facs)分选所述细胞,和
[0368]
d.识别所述分选细胞中的胎儿细胞,包括将胎儿来源分类器分配给各个分选细胞的步骤。
[0369]
2)根据前述任一要素所述的方法,其中在facs之前所述细胞组分被富集以获得胎儿细胞。
[0370]
3)根据要素2所述的方法,其中所述富集包括富集以获得表达至少一种内皮标记物的细胞。
[0371]
4)根据要素2或3所述的方法,其中富集包括磁激活细胞分选。
[0372]
5)根据前述任一要素所述的方法,其中facs包括量化每个分选细胞的多个参数。
[0373]
6)根据要素5所述的方法,其中所述参数为散射,例如前向和侧向散射;来自核染料的荧光;来自与至少一种胎儿标记物结合的荧光标记剂的荧光;来自与至少一种母体标记物结合的荧光标记剂的荧光。
[0374]
7)根据要素6所述的方法,其中所述胎儿标记物是一种或多种上皮标记物,例如一种或多种细胞角蛋白,和/或其中所述母体标记物是血细胞标记物,例如cd14和/或cd45。
[0375]
8)根据前述任一要素所述的方法,其中另一参数是来自针对内皮标记物(例如cd105和/或cd141)的一种或多种荧光标记剂的荧光。
[0376]
9)根据前述任一要素所述的方法,其中胎儿来源分类器是将细胞分类为胎儿或非胎儿的二元分类器。
[0377]
10)根据前述任一要素所述的方法,其中胎儿起源分类器是胎儿起源的概率。
[0378]
11)根据前述任一要素所述的方法,其中所述胎儿来源分类器是使用人工智能、神经网络、随机森林、机器学习、回归分析或分类树,使用包含胎儿和母体细胞的训练集来计算。
[0379]
12)根据要素11所述的方法,其中回归分析是逻辑回归。
[0380]
13)根据要素12所述的方法,其中所述逻辑回归包括常数参数和检测参数的特定数值,用于计算概率。
[0381]
14)根据前述任一要素所述的方法,其中所述分选细胞是表达至少一种上皮标记物和/或内皮标记物并且不表达对血细胞具有特异性的至少一种细胞标记物的细胞。
[0382]
15)根据要素14所述的方法,其中对所述至少一种上皮标记物呈阳性并且对所述至少一种血细胞标记物呈阴性或低的细胞被分选到区室中,优选地其中每个区室仅包含一个细胞。
[0383]
16)根据前述任一要素所述的方法,其中所述生物样品是外周血样品或宫颈涂片。
[0384]
17)根据前述任一要素所述的方法,其中所述细胞组分与所述外周血样品的血浆相分离。
[0385]
18)根据前述任一要素所述的方法,其中所述细胞组分通过离心与所述血浆组分相分离。
[0386]
19)根据前述任一要素所述的方法,其中所述细胞组分包括红细胞、白细胞和胎儿滋养层细胞、胎儿绒毛外滋养层细胞和胎儿血管内滋养层细胞。
[0387]
20)根据前述任一要素所述的方法,所述方法进一步包括在与所述血浆组分分离之后,将血细胞固定的步骤,其中固定优选为多聚甲醛固定。
[0388]
21)根据前述任一要素所述的方法,所述方法进一步包括在所述细胞组分与所述血浆组分分离后,使用去污剂选择性裂解所述细胞组分的红细胞的步骤,其中所述裂解还使所述细胞组分中的剩余细胞透化。
[0389]
22)根据要素1所述的方法,其中生物样品是宫颈涂片。
[0390]
23)根据要素22所述的方法,其中将所述宫颈涂片用乙酸或ddt溶解粘液,然后固定,其中固定优选为多聚甲醛固定。
[0391]
24)根据要素22和23所述的方法,其中来自宫颈涂片的所述细胞组分包括胎儿细胞和鳞状上皮细胞、柱状上皮细胞、白细胞和红细胞。
[0392]
25)根据前述任一要素所述的方法,其中所述胎儿细胞是滋养层细胞,例如细胞滋养层细胞和/或合体滋养层细胞。
[0393]
26)根据前述任一要素所述的方法,其中通过其具有不同于母体基因型的胎儿基因型,所述分离的胎儿细胞被验证是胎儿细胞。
[0394]
27)根据前述任一要素所述的方法,其中对分离的胎儿细胞进行全基因组扩增。
[0395]
28)根据要素26或27所述的方法,其中通过检测短串联重复序列或单核苷酸多态性(snp)来进行所述验证。
[0396]
29)根据要素26或27所述的方法,其中具有胎儿起源的最高概率的20个细胞进行全基因组验证和/或验证为胎儿细胞,例如具有最高概率的15个细胞,例如具有最高概率的10个细胞,例如具有最高概率的7个细胞,例如具有最高概率的5个细胞,例如具有最高概率的3个细胞。
[0397]
30)根据前述任一要素所述的方法,其中该方法使得在来自一位怀孕母亲的一个生物样品中识别出至少1个胎儿细胞,其中该生物样品包含至少1.5亿个细胞,例如至少2个胎儿细胞,例如至少3个胎儿细胞。
[0398]
31)根据前述任一要素所述的方法,其中所述至少一种上皮标记物选自人细胞角蛋白1 ck1、人细胞角蛋白2 ck2、人细胞角蛋白3 ck3、人细胞角蛋白4 ck4、人细胞角蛋白5 ck5、人细胞角蛋白6 ck6、人细胞角蛋白7 ck7、人细胞角蛋白8 ck8、人细胞角蛋白10 ck10、人细胞角蛋白13 ck13、人细胞角蛋白14 ck14、人细胞角蛋白15 ck15、人细胞角蛋白16 ck16、人细胞角蛋白18 ck18、人细胞角蛋白19 ck19。
[0399]
32)根据前述任一要素所述的方法,其中所述至少一种上皮标记物是ck7、ck18或其组合。
[0400]
33)根据要素31和32任一项所述的方法,其中针对上皮标记物的抗体连接相同的荧光团。
[0401]
34)根据前述任一要素所述的方法,其中所述至少一种内皮标记物选自血栓调节蛋白cd141、人内皮糖蛋白cd105、人波形蛋白vim、血管细胞粘附分子vcam、细胞间粘附分子1icam、血管内皮生长因子受体1(flt-1)vegfr-1、血管内皮生长因子受体2vegfr-2、血管内皮生长因子受体3vegfr-3、纤溶酶原激活剂抑制剂1pai-1、内皮蛋白c受体epcr。
[0402]
35)根据前述任一要素所述的方法,其中所述至少一种内皮标记物是cd105、cd141或其组合。
[0403]
36)根据要素34和35任一项所述的方法,其中针对内皮标记物的抗体是用相同的荧光团标记。
[0404]
37)根据前述任一要素所述的方法,其中所述对血细胞具有特异性的至少一种细胞标记物是cd14和/或cd45,优选地其中针对不同血细胞标记物的抗体是用相同的荧光团标记。
[0405]
38)根据前述任一要素所述的方法,其中所述识别的胎儿细胞表达所述至少一种上皮标记物和/或内皮标记物,并且不表达所述对血细胞具有特异性的至少一种细胞标记物。
[0406]
39)根据前述任一要素所述的方法,其中所述至少一种荧光核染料是dna插入染料,例如任意hoechst染料、dapi、碘化丙啶、7-aad、vybrant dyecycle ruby染色剂。
[0407]
40)根据前述任一要素所述的方法,其中所述一种或多种荧光标记剂由至少一种荧光团直接或间接标记。
[0408]
41)根据要素40所述的方法,其中所述荧光团选自alexa fluor 488、alexa fluor 555、荧光素-异硫氰酸酯(fitc)、藻红蛋白(pe)和bv421。
[0409]
42)根据要素40所述的方法,其中所述荧光标记剂由二级标记剂间接标记。
[0410]
43)根据前述任一要素所述的方法,其中所述荧光标记剂是抗体、核苷酸探针、受体配体或其他特异性结合分子。
[0411]
44)根据要素43所述的方法,其中核苷酸探针是rna、dna或lna探针。
[0412]
45)根据前述任一要素所述的方法,其中所述方法进一步包括检测与所述分离的胎儿细胞基因组中的遗传异常相关的一个或多个遗传标记物的步骤。
[0413]
46)根据要素45所述的方法,其中所述一种或多种遗传标记物与非整倍、单体、多体、三体、拷贝数变异(cnv)、单核苷酸变异(snv)或单基因疾病相关。
[0414]
47)一种确定胎儿遗传异常的方法,所述方法包括步骤:
[0415]
a.获得通过前述要素1至46任一项定义的方法分离的一个或多个胎儿细胞,和
[0416]
b.检测与所述胎儿细胞基因组中的所述遗传异常相关的一种或多种遗传标记物。
[0417]
48)根据要素47所述的方法,其中所述一种或多种遗传标记物是使用选自如下的一种或多种方法来检测:基于微阵列的比较基因组杂交(acgh)、短串联重复序列分析(str分析)、全基因组扩增、全基因组扫描、polony测序、shotgun测序、大规模平行签名测序(mpss)、sanger测序、基于pcr的方法和下一代测序方法。
[0418]
49)根据要素48所述的方法,其中所述下一代测序方法可以选自illumina(solexa)测序、roche 454测序、离子激流:proton/pgm测序和/或solid测序。
[0419]
50)根据要素47所述的方法,其中所述遗传异常是非整倍体、单体、多体、三体、拷贝数变异(cnv)、单核苷酸变异(snv)或单基因疾病。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1